修回日期: 2007-07-22
接受日期: 2007-07-28
在线出版日期: 2007-08-08
目的: 表达二联体BO-E2重组融合蛋白, 以用于人原发性胆汁性肝硬化(PBC)的早期发现和临床诊断.
方法: 通过逆转录聚合酶链式反应(RT-PCR)方法扩增得到抗线粒体抗体二亚型(AMA-M2)的二个靶抗原侧链: 二氧酸脱氢酶复合体E2(BCOADC-E2)、2-氧戊二酸脱氢酶复合体E2(OGDC-E2)相应的基因片段, 经测定序列验证后插入表达载体pET28a(+), 构建重组表达载体pET28a(+)-BCOADC-E2, pET28a(+)-OGDC-E2, pET28a(+)-BO-E2, 转化大肠杆菌BL21(DE3)后诱导表达蛋白质. 表达蛋白经SDS-PAGE、Western blot等鉴定.
结果: 经核苷酸序列测定和酶切鉴定结果表明, 成功地构建了3种重组质粒. 异丙基-β-D-硫代半乳糖苷(IPTG)诱导表达后, 获得3种融合蛋白. 经免疫学鉴定, 重组抗原片段具有AMA-M2的免疫原性.
结论: 重组表达的BO-E2融合蛋白将有利于PBC的实验室诊断.
引文著录: 周晔, 姚定康, 陈燕, 蒋天舒, 陈波, 仲人前, 邓安梅. 人源M2二联体靶抗原BO-E2融合蛋白的克隆表达与鉴定. 世界华人消化杂志 2007; 15(22): 2465-2467
Revised: July 22, 2007
Accepted: July 28, 2007
Published online: August 8, 2007
AIM: To express BO-E2 recombinant fusion protein in Escherichia coli for use in early diagnosis of primary biliary cirrhosis (PBC).
METHODS: CDNA encoding BCOADC-E2 and OGDC-E2 were obtained by reverse transcription pdymerase chain reaction (RT-PCR), confirmed by DNA sequencing, subcloned non-directionally into the bacterial expression plasmid pET28a(+), and then transformed into E. coli BL21(DE3) to express the recombinant fusion protein, which was identified by SDS-PAGE and western blotting.
RESULTS: Results of nucleotide sequencing and restriction analysis showed that the recombinant plasmid successfully constructed three species. Three types of fusion protein were expressed by isopropyl-Beta-d-thiogalactopyranoside (IPTG) induction. The recombinant fusion protein exhibited the antigenicity of AMA-M2 by western blotting.
CONCLUSION: BO-E2 recombinant fusion protein can be used for in vitro diagnosis of PBC.
- Citation: Zhou Y, Yao DK, Chen Y, Jiang TS, Chen B, Zhong RQ, Deng AM. CDNA cloning and expression of autoantigen B0-E2. Shijie Huaren Xiaohua Zazhi 2007; 15(22): 2465-2467
- URL: https://www.wjgnet.com/1009-3079/full/v15/i22/2465.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i22.2465
原发性胆汁性肝硬化(primary biliary cirrhosis, PBC)是一种以肝内中小胆管的非化脓性进行性炎性损伤为特征、最终导致肝硬化和肝衰竭的典型自身免疫性疾病(AID)[1-4]. 在PBC患者体内可检出多种自身抗体, 如抗核抗体(ANA)、抗线粒体抗体(AMA)、抗平滑肌抗体(SMA)、抗肝肾微粒体抗体(LKM)等, 其中最主要的抗体是AMA[5-7]. AMA分为M1-M9共9个亚型, 而只有M2为PBC特异抗体. AMA-M2抗体对PBC检测的敏感性达93%以上, 特异性几乎达100%[8]. M2抗体的靶抗原为线粒体上的2-氧酸脱氢酶复合体(2-OADC)的一些组分: 丙酮酸脱氢酶复合体E2(PDC-E2)、2-氧酸脱氢酶复合体E2(BCOADC-E2)、2-氧戊二酸脱氢酶复合体E2(OGDC-E2)等. 我们用基因工程的方法表达BO-E2融合蛋白, 为PBC的早期发现和特异性诊断提供有效手段.
22例患者血清经德国Euroimmun公司免疫印迹试剂盒测定, M2抗体为阳性.反转录酶, PCR扩增试剂盒, RNA提取试剂盒为Qiagen公司产品. 各种限制性内切酶、T4DNA连接酶购自TaKaRa公司. pET-28a(+)质粒及大肠杆菌BL21(DE3)购自Novagen公司. 间接免疫荧光法测定AMA试剂盒购自Euroinmun公司. 参照人BCOADC-E2、OGDC-E2全序列, 设计引物.BCOADC-E2正向引物: 5'-ATCGCATCCGCACAGGTTGTTCAGTTCAT -3'; BCOADC-E2反向引物: 5'-TAATTTTTGCATGCACGGCGAACTGCAGGAGT-3'. OGDC-E2正向引物: 5'-CAGATTTAGAGCTCACAGCTGTATGCAAGGATGA -3'; OGDC-E2反向引物: 5'-ATCGCGTCGACAGGAGCAGCACCATGTTTCC-3'.
1.2.1 基因克隆操作: 用淋巴细胞分离液从健康人外周血中分离单个核细胞, 从白细胞中抽提RNA, 反转录得到cDNA. pET-28a(+)质粒分别用BamH1和Sph1、Sac1和Sal1、BamH1和Sal1双酶切后, 经T4DNA连接酶的作用将BCOADC-E2、OGDC-E2、BO-E2的cDNA对应定向插入其中. 送上海生工生物工程技术公司测定序列进行鉴定. PCR扩增反应条件为94℃变性1 min, 56℃退火1 min, 72℃延伸1 min, 35个循环后再进行72℃延伸5 min.
1.2.2 重组质粒的转化和鉴定: 将重组质粒用氯化钙转化法导入宿主菌BL21(DE3), 加入LB培养液37℃震荡培养45 min后涂布于LB平板上(含终浓度100 mg/L卡那霉素)培养过夜. 抽提质粒, 用10 g/L琼脂糖凝胶电泳观察重组质粒和酶切后的产物.
1.2.3 重组融合蛋白的收集和纯化: 次日挑取转化平皿上的菌落, 接种于含卡那霉素的LB培养液中, 37℃摇床培养扩增至A600为0.4左右加入终浓度为0.1 g/L的异丙基硫代-β-D-半乳糖苷(IPTG), 诱导表达4 h, 4℃离心收集菌液. 将菌液反复冻融4次, 经超声破碎仪以300 W, 15 s, 破碎4次, 以上操作在冰浴中进行. 而后在4℃, 10 000 g离心15 min, 收集沉淀, 以含5 g/L TritonX-100, 10 mmol/L EDTA的缓冲液洗涤后, 用100 µL裂解缓冲液(含0.1 mmol/L PMSF, 8 mol/L尿素, 10 mmol/L DTT)溶解包涵体, 室温放置1 h. 再加入900 µL氧化还原缓冲液, 最后离心取上清. 将上清液流经PBS平衡后的GST亲合层析柱, 经20 mL PBS洗涤后, 用5 mmol/L还原型谷胱甘肽溶液洗脱, 收集洗脱液进行150 g/L十二烷基磺酸钠-聚丙烯酰胺胶电泳(SDS-PAGE)分析.
1.2.4 重组蛋白抗原性的鉴定: BCOADC-E2、OGDC-E2、BO-E2重组蛋白经SDS-PAGE电泳后进行转印, 200 mA, 40 V, 2 h. 将转印后的NC膜剪成条带, 用含50 g/L BSA的PBS封闭1 h, 与1:1000稀释的人M2阳性血清反应2 h,充分洗涤后与1:1000稀释的HRP标记的兔抗人IgG二抗反应2 h, 再次洗涤后加入3, 3-二氨联苯胺底物及双氧水反应显色.
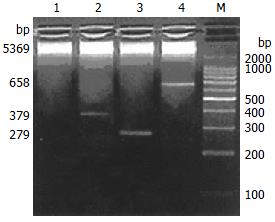
按上述条件扩增出379 bp和279 bp的片段, 经DNA测序表明他们是BCOADC-E2, OGDC-E2基因的精确拷贝.
通过反转录将PCR扩增的相应基因片段, 克隆入表达载体pET28a(+), 构建重组表达载体pET28a(+)-BCOADC-E2, pET28a(+)-OGDC-E2和pET28a(+)-BO-E2, 重组载体用限制性内切酶酶切鉴定, 结果(图1), 序列经测定完全正确.
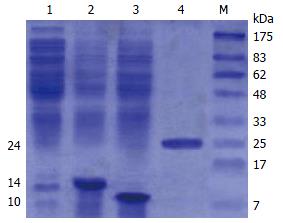
重组质粒的工程菌经IPTG诱导后进行120 g/L SDS-PAGE电泳, 在细菌裂解液(上清液)中可见有1条明显的额外蛋白带, 相对分子量为14×103 Da(BCOADC), 10×103 Da(OGDC)和24×103 Da(BO)(图2).
选取22例M2阳性的患者血清, 采用Western-blot方法进行检测, 抗BCOADC-E2抗体阳性19例, 阳性率为86.4%; 抗OGDC-E2抗体阳性18例, 阳性率为81.8%; 抗BO-E2抗体全部为阳性, 阳性率为100%.
PBC好发于中老年妇女, 男女发病比率约为1:10, 起病隐匿, 病程缓慢, 病程中可有瘙痒、黄疸、脂肪代谢紊乱、肝脾肿大和贫血, 晚期出现肝硬化和肝功能衰竭的各种临床表现. 肝功能检查ALP和γ-谷酰转肽酶显升高, 血清胆红素升高, 以直接胆红素升高为主[9-12]. 据国外研究报道, PBC发病率约为2-24人/10万, 年发病率为0.4-3.0人/10万, 且该数值有逐年递长趋势[13]. 近年来国内PBC发病率亦不断增加[14], 中国PBC人群的易感基因是HLA-DRB1*07[15]. 因此, 对PBC的早期发现和临床诊断显得尤为重要. AMA中只有M2抗体为PBC特异性抗体, 其他亚型可见于很多疾病如药物损害、心肌病、类风湿性关节炎及一些感染如结核、梅毒等. 间接免疫荧光法无法对AMA分型, 用于诊断PBC的特异性差. 本实验检测的22例M2阳性的患者血清中, 全部与BO-E2融合蛋白反应. M2抗原在细胞内含量较少, 传统生物化学方法提纯和制备抗原有很大的局限性, 操作复杂, 成本高, 很难获得纯化的线粒体抗原, 影响检测结果. 而利用本方法可大量获得所需抗原, 用于PBC的免疫学诊断, 为PBC的早期发现和临床诊断提供有力工具.
原发性胆汁性肝硬化(PBC)的主要特征为肝内中小胆管的非化脓性进行性炎性, 最终可以导致肝硬化和肝衰竭, 是一种自身免疫性疾病. 近年来, 该病的发病率不断增加, 对 PBC的早期发现和临床诊断显得尤为重要. 本文用基因工程的方法表达BO-E2融合蛋白, 为PBC的早期发现和特异性诊断提供了有效手段.
姜小华et al用人源M2三联体靶抗原检测抗体诊断原发性胆汁性肝硬化, 在20例原发性胆汁性肝硬化中均检出M2抗体,28例不明原因肝病6 例M2抗体阳性.
本文检测的22例M2阳性的患者血清中, 全部可以与BO-E2融合蛋白反应, M2抗原在细胞内含量较少. 传统生物化学方法提纯和制备抗原有很大的局限性, 而利用本方法可大量获得所需抗原, 用于PBC的免疫学诊断.
本文纯化得到的BO-E2融合蛋白可通过大量发酵而制备, 在临床上用来早期诊断原发性胆汁性肝硬化,并可申请专利, 用于开发PBC诊断试剂盒.
M2抗体: 抗线粒体抗体(AMA)是原发性胆汁性肝硬化患者体内的主要自身抗体, AMA分为M1-M99个亚型, 而只有M2为PBC特异抗体. AMA-M2 抗体对PBC检测的敏感性达93% 以上, 特异性几乎达100%.
本文论述了人源M2二联体把抗原BO-E2融合蛋白的克隆表达与鉴定的方法以及其将有利于原发性胆汁性肝硬化(PBC)的实验诊断, 立题新颖, 方法成熟, 图片清晰, 有一定的理论意义.
编辑: 程剑侠 电编:郭海丽
| 1. | Charatcharoenwitthaya P, Lindor KD. Current concepts in the pathogenesis of primary biliary cirrhosis. Ann Hepatol. 2005;4:161-175. [PubMed] |
| 2. | Yoneyama K, Yamazaki M, Kogo M, Kiuchi Y, Shibata M, Imawari M. Prognostic factors of primary biliary cirrhosis detected by health screening. Minerva Gastroenterol Dietol. 2006;52:97-105. [PubMed] |
| 3. | Yap I, Wee A, Tay HH, Guan R, Kang JY. Primary biliary cirrhosis--an uncommon disease in Singapore. Singapore Med J. 1996;37:48-50. [PubMed] |
| 4. | Speiciene D, Irnius A, Leuschner U, Liakina V, Semuchiniene T, Barakauskiene A. Primary biliary cirrhosis in Lithuania: diagnosis and clinical picture. Med Sci Monit. 2007;13:CR299-306. [PubMed] |
| 5. | Ishibashi H, Shimoda S, Gershwin ME. The immune response to mitochondrial autoantigens. Semin Liver Dis. 2005;25:337-346. [PubMed] |
| 6. | Abdul-Aziz K, Faizal AA. Serological diagnosis of autoimmune hepatobiliary diseases. Saudi Med J. 2005;26:1875-1881. [PubMed] |
| 7. | Rigopoulou EI, Bogdanos DP, Liaskos C, Koutsoumpas A, Baum H, Vergani D, Dalekos GN. Anti-mitochondrial antibody immunofluorescent titres correlate with the number and intensity of immunoblot-detected mitochondrial bands in patients with primary biliary cirrhosis. Clin Chim Acta. 2007;380:118-121. [PubMed] |
| 8. | Bargou I, Mankai A, Jamaa A, Ben Jazia I, Skandrani K, Sfar H, Baccouche A, Ajmi S, Letaief A, Fabien N. Detection of M2 antimitochondrial antibodies by dot blot assay is more specific than by enzyme linked immunosorbent assay. Pathol Biol (Paris). 2007;. [PubMed] |
| 9. | Chon CY, Park JY. Primary biliary cirrhosis. Korean J Hepatol. 2006;12:364-372. [PubMed] |
| 10. | Sarin SK, Monga R, Sandhu BS, Sharma BC, Sakhuja P, Malhotra V. Primary biliary cirrhosis in India. Hepatobiliary Pancreat Dis Int. 2006;5:105-109. [PubMed] |
| 11. | Giorgini A, Selmi C, Invernizzi P, Podda M, Zuin M, Gershwin ME. Primary biliary cirrhosis: solving the enigma. Ann N Y Acad Sci. 2005;1051:185-193. [PubMed] |
| 12. | Vierling JM. Primary biliary cirrhosis and autoimmune cholangiopathy. Clin Liver Dis. 2004;8:177-194. [PubMed] |
| 13. | Metcalf JV, Mitchison HC, Palmer JM, Jones DE, Bassendine MF, James OF. Natural history of early primary biliary cirrhosis. Lancet. 1996;348:1399-1402. [PubMed] |
| 14. | Jiang J, He M. Clinical features of primary biliary cirrhosis and treatment of it by integrated traditional Chinese and western medicine. Zhong Xi Yi Jie He Xue Bao. 2003;1:99-102. [PubMed] |
| 15. | Liu HY, Deng AM, Zhou Y, Yao DK, Xu DX, Zhong RQ. Analysis of HLA alleles polymorphism in Chinese patients with primary biliary cirrhosis. Hepatobiliary Pancreat Dis Int. 2006;5:129-132. [PubMed] |