修回日期: 2007-07-24
接受日期: 2007-07-28
在线出版日期: 2007-07-28
目的: 观察细胞角质素19(CK19)及消减基因P02在肝细胞癌, 肝硬化组织及卵圆细胞中的表达情况.
方法: 采用免疫组化SP法观察8例正常肝组织, 27例肝硬化组织和43例肝细胞癌组织中CK19的表达. 采用DIG-probe synthesis kit, 聚合酶链反应方法制备P02探针, 通过原位杂交方法检测P02在肝细胞癌, 肝硬化组织及卵圆细胞中的表达.
结果: CK19在肝硬化组与正常肝组织之间表达率无明显差异, 但在肝细胞癌组与肝硬化组之间差异有显著性(69.77% vs 25.93%, P<0.01). 肝硬化组织与肝细胞癌组织中CK19标记的卵圆细胞数量有显著性差异(5.74±1.05 vs 10.51±1.78, P<0.01). P02在肝硬化和肝细胞癌中的阳性表达率分别为26.7%和80%, 二者之间表达有显著性差异(P<0.01).
结论: CK19可能参与了肝硬化到肝细胞癌的癌变过程. 卵圆细胞与肝脏损伤后再生及癌变有关, 可能是P02通过促进卵圆细胞的增殖来介导肝细胞癌的发生.
引文著录: 李蔚, 李继昌, 段芳龄. 细胞角质素19及消减基因P02在肝细胞癌组织及卵圆细胞中的表达. 世界华人消化杂志 2007; 15(21): 2316-2321
Revised: July 24, 2007
Accepted: July 28, 2007
Published online: July 28, 2007
AIM: To observe the expression of cytokeratin 19 (CK19) and subtractive gene P02 in hepatocellular carcinoma (HCC), cirrhosis of the liver and oval cells.
METHODS: An immunohistochemical streptavidin-peroxidase method was used to examine the expression of CK19 in eight normal livers, 27 with cirrhosis, and 43 HCC samples. A DIG Probe Synthesis kit was used to prepare a P02 probe using a polymerase chain reaction, and in situ hybridization was used to detect the expressions of subtractive gene P02 in 15 pairs of specimens from HCC and liver cirrhosis, and in oval cells.
RESULTS: The positive rate for CK19 in cirrho sis of the liver was not significantly different to that for the control group. There were significant differences between HCC and cirrhosis of the liver (69.77 vs 25.93%, P < 0.01). Oval cells with strongly positive staining were seen in the portal area of cirrhosis, and at the brink of a carcinoma. There were significant differences (5.74 ± 1.05 vs 10.51 ± 1.78, P < 0.01) between the numbers of oval cells in cirrhosis of the liver and HCC. The positive rate for P02 in HCC and cirrhosis of the liver was 80 and 26.7%, respectively, and there was a significant difference (P < 0.01) between the two groups.
CONCLUSION: CK19 is associated with hepatocarcinogenesis. Oval cells are strongly positive for CK19 in cirrhosis of the liver and HCC. Oval cells are associated with regeneration of the liver, and are probably the original cells of HCC. P02 is overexpressed in HCC and plays an important role during hepatocarcinogenesis by promoting oval cell proliferation.
- Citation: Li W, Li JC, Duan FL. Expression of cytokeratin 19 and subtractive gene P02 in hepatocellular carcinoma and oval cells. Shijie Huaren Xiaohua Zazhi 2007; 15(21): 2316-2321
- URL: https://www.wjgnet.com/1009-3079/full/v15/i21/2316.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i21.2316
目前对肝细胞癌(hepatocellular carcinoma, HCC)发病机制的研究主要从两方面展开: 一是细胞学起源的探讨, 即肝细胞癌可能起源于肝内未分化的卵圆细胞的假说[1]; 并有不少学者从肝癌组织中发现了肝卵圆细胞的存在[2-4]. 卵圆细胞被证实是肝脏干细胞(stem cell)的子代细胞, 是肝干细胞的一种[5-6]. 二是HCC相关基因的研究, 如c-myc, c-met, N-ras, c-fos等. 而P02基因是肝细胞癌(HCC)消减cDNA文库中一个在肝细胞癌中高表达的基因[7], 他已作为表达序列标签(expression sequence tag, EST)登录到了GenBank/EMBL/DDBJ数据库, 登录号为GenBank Acc: BQ125043, GenBank Gi: 20178634, dbEST-1d: 12094454, 长度为479 bp.
我们通过免疫组化方法, 检测卵圆细胞标志物细胞角质素19(CK19)在正常肝组织, 肝硬化组织和肝细胞癌组织中的表达, 并观察卵圆细胞在不同组织中的增生状况, 以期了解卵圆细胞在肝细胞癌发生中的作用; 通过原位杂交方法, 观察P02基因在肝细胞癌中的表达定位, 检测其在卵圆细胞中是否表达, 将基因研究和肝细胞癌细胞源学说结合起来, 探讨肝细胞癌的发生机制.
免疫组化标本源于新乡医学院病理教研室, 郑州大学第一附属医院, 第二附属医院病理科, 河南省肿瘤医院共43例肝细胞癌, 27例肝硬化及8例肝囊肿, 血管瘤及肝硬化组织旁经病理证实为正常的蜡块或组织. 原位杂交组织标本来自郑州大学第一附属医院, 第二附属医院, 河南省肿瘤医院肝细胞癌及其对应的癌旁肝硬化组织15对(均经病理证实). 所有标本均经 1 mL/L DEPC处理的无RNA酶水冲洗, 液氮速冻, -80℃保存, 冰冻切片及HE染色. P02 EST序列 长度为479 bp, 见GenBank EST数据库(GenBank Acc: BQ125043, GenBank Gi: 20178634, dbEST-1d: 12094454); P02 EST PCR引物序列(使用软件Oligo6.44设计): 退火温度55℃产物长度281 bp: P02 5': 5'-AGA CCA GAA AGA GTA AAA CC-3', P02 3': 5'-TCC ACT CCA AAT AAA TCA CAG-3'.
1.2.1 免疫组化: 常规石蜡切片, HE染色. 免疫组化染色按试剂盒(北京中山公司)说明书进行: 二甲苯及梯度酒精脱蜡水化; 30 mL/L H2O2, 室温孵育10 min, 以消除内源性过氧化物酶的活性; 枸橼酸盐缓冲液抗原修复10 min; 正常山羊血清封闭, 室温孵育20 min; 倾去血清、勿洗、滴加一抗(CK19购自福建迈新公司)工作液, 4℃孵育过夜; 加二抗, 室温孵育20 min; SP室温孵育20 min; DAB镜下显色2 min-5 min; 苏木精复染, 酒精脱水, 二甲苯透明, 中性树胶封固. 设空白对照, 用PBS缓冲液代替一抗孵育已知阳性切片, 结果阴性.
1.2.2 P02的扩增: 采用PyrobestTM DNA polymerase (TaKaRa Biotechnology Co.Ltd) 反应体系10×Pyroest Buffer 2.5 μL, dNTP Mixture 1.5 μL, 上游引物1.4 μL, 下游引物1.6 μL, P02 cDNA模板(本所)0.5 μL, PCR级水17.375 μL, Taq酶0.125 μL, 总体积25 μL. 将PCR-Mix混匀后, 94℃ 2 min, 94℃ 30 s, 55℃ 30 s, 68℃ 45 s, 30个循环, 最后68℃延伸7 min.
1.2.3 P02探针制备: 采用DIG-probe Synthesis kit (Roche Molecular Biochemicals), PCR方法制备探针. 反应体系为10×Buffer 5 μL, PCR DIG Labeling Mix 5 μL, 上游引物2.8 μL, 下游引物3.2 μL, P02 cDNA模板1 μL, PCR级水32.25 μL, Enzyme Mix 0.75 μL, 总体积50 μL. 将PCR-Mix混匀后, 94℃ 2 min, 94℃ 30 s, 55℃ 30 s, 68℃ 40 s, 30个循环, 72℃ 延伸7 min. 探针制备后用High Pure PCR Product Purification kit (Roche Molecular Biochemicals)纯化并测其浓度.
1.2.4 原位组织杂交(武汉博士德敏感加强性原位杂交试剂盒): 切片取出后, 用新鲜配制的5 mL/L H2O2/甲醇室温处理30 min以灭活内源性过氧化物酶; 滴加3 mL/L柠檬酸新鲜稀释的胃蛋白酶, 37℃消化30-60 s, 以暴露mRNA核酸片段; 滴加预杂交液, 恒温箱41℃预杂交3 h; P02探针于PCR仪中94℃变性3 min后用杂交液稀释至1 μg/L并加至切片上, 将原位杂交专用盖玻片保护膜揭开后, 盖在切片上, 恒温箱41℃杂交12 h-16 h; 杂交后揭掉盖玻片, 依次用37℃水温的2×SSC, 0.5×SSC, 0.2×SSC洗涤; 用37℃封闭液孵育30 min并甩去多余液体, 不洗; 依次滴加生物素化鼠抗地高辛, 37℃ 60 min, SABC 37℃ 20 min, 生物素化过氧化物酶37℃ 20 min; 加新鲜配制的DAB; 显微镜下显色2-5 min, 棕黄色染色为阳性信号; 以PBS代替含探针杂交液为阴性对照.
1.2.5 结果判定: 根据阳性细胞所占的比例及显色程度, 将染色结果分为弱阳性(+), 阳性(++), 强阳性(+++)及阴性(-). 分别为25%-50%, 50%-70%, 70%以上及小于25%的细胞着色(参照1997年全国免疫组化技术诊断标准化专题研讨会意见).
统计学处理 应用SPSS10.0统计软件进行统计学处理, 计数资料采用χ2检验, 计量资料采用配对t检验, 以P<0.05认为有统计学意义.
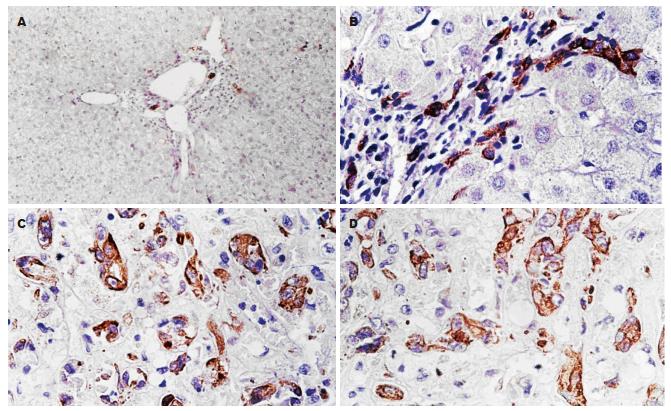
CK19在正常肝组织中, 胆管上皮细胞阳性表达, 肝细胞呈阴性表达, 在肝硬化组织中, 间质中胆管、假胆管呈阳性着色, 间质中可见强阳性着色的卵圆细胞, 肝细胞不着色, 在正常肝组织中和肝硬化组之中的阳性表达率分别为0%和25.93%, 二者之间无明显差异(P>0.05). 在HCC中, 癌细胞, 间质中假胆管中呈阳性表达, 相对正常肝细胞呈阴性表达, 并见卵圆细胞的阳性表达(图1). HCC的阳性表达率为69.77%, HCC和肝硬化组之间表达有显著差异(P<0.01, 表1)
在正常肝组织中未见到卵圆细胞, 在20/27例肝硬化组织中, 靠近肝小叶边缘汇管区周围可见到CK19染色较深的小细胞, 体积约为正常肝细胞的1/2-1/4, 胞核呈卵圆形, 胞质稀少, 即卵圆细胞. 在35/43例肝细胞癌组织中亦可见到卵圆细胞的增生, 他们位于癌巢周边, 成簇分布或散在分布. CK19标记的卵圆细胞在肝硬化组织和肝细胞癌组织中的数量分别为5.37±1.17和10.45±2.15, 两者比较有显著性差异(t = 9.75, P<0.01).
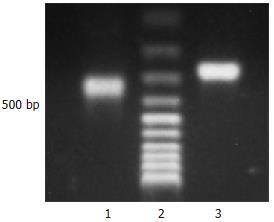
合成P02探针(图2). InGenius Bio imaging system凝胶成像系统扫描并经Gene snap form syngene图像分析软件分析得出2次合成的探针的量分别为140 ng和50 ng, 上样量均为5 μL, 计算探针浓度分别为28 mg/L和10 mg/L.
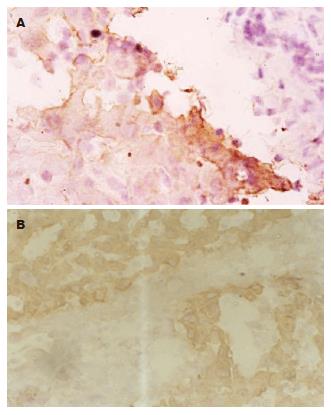
P02在肝硬化组织中主要定位于肝细胞中, 在肝细胞癌中主要定位于癌细胞中(图3). P02在肝硬化和肝细胞癌中的阳性表达率分别为26.7%(4/15)和80%(12/15), 二者之间表达有显著差异(χ2 = 8.571, P<0.01). 在13对肝硬化的汇管区和肝细胞癌癌巢周边可见到肝卵圆细胞的增殖且胞质呈强阳性染色, 所见到的肝卵圆细胞核呈卵圆形, 胞质较少, 细胞体积较小, 约相当于肝细胞体积的1/2-1/4(图3).
各标本均选取3个不重复且肝卵圆细胞比较多的区域, 400倍视野下对符合其形态特征且P02染色呈阳性的细胞进行计数, 取其均值作为该标本的卵圆细胞数P02标记的卵圆细胞在13例肝硬化组织和肝细胞癌组织中的数量分别为5.74±1.05, 10.51±1.78, 两者比较有显著性差异(t = 9.38, P = 0.000).
目前对于肝细胞癌的发病机制的研究主要从两方面展开, 一方面, 肝细胞癌的发生与基因的突变或异常表达有密切的关系. P02基因就是对肝癌组织和癌周肝硬化组织进行抑制性消减杂交(suppressed subtractive hybridization, SSH)时获得的在肝细胞癌中高表达的EST[7], 通过SMART(switching mechanism at 5' end of RNA transcript)、RACE(rapid amplification of cDNA ends)技术已获得了该基因的全长cDNA序列[8], 同源性分析表明, 该基因即TPT1. 从来源背景以及他的同源类似物的研究结果强烈提示:TPT1的的高表达与肿瘤有着密切的关系. 高天慧 et al[9-10]构建了TPT1真核表达载体并研究了其在肝癌细胞系SMMC-7721中的表达状况, 结果提示TPT1可在肝系细胞内高效表达, 并可增强肝癌细胞系SMMC-7721的恶性表型. 另一方面是肝细胞癌的细胞学起源问题, 认为癌变由肝内未分化的肝干细胞或卵圆细胞异常分化而来, 并根据卵圆细胞的形态, 表型特征, 癌基因表达及体外转化等大量间接证据[11-29], 认为肝细胞癌来源于卵圆细胞.
我们实验结果提示CK19在正常肝组织中, 胆管上皮细胞阳性着色, 肝细胞无阳性着色; 在肝硬化组织中, 间质中胆管, 假胆管呈阳性着色, 间质中可见阳性着色的卵圆细胞, 肝细胞不着色. 而在肝细胞癌组织中, 癌细胞和间质中假胆管呈阳性着色, 并可见卵圆细胞强阳性着色, 表明卵圆细胞具有向上皮分化的潜能, 当分化为正常肝细胞时, 表达CK19的表型被抑制, 而当细胞癌变时就表现干细胞的某些表型, 如表达CK19; CK19在肝硬化组与正常组中的表达率相比无明显差异, 而在肝细胞癌组与肝硬化组中的表达率相比有明显差异, 表明CK19主要参与了从肝硬化到肝细胞癌的癌变过程. 结合他们在卵圆细胞中的强阳性表达, 提示肝细胞癌可能起源于卵圆细胞.
在正常生理情况下及在半肝切除时, 肝脏干细胞并未激活及参与肝细胞的再生[30]. 据推测, 仅在各种内源或外源性毒素等的刺激下, 肝细胞自身的复制能力受到损害时, 肝脏的干细胞才被激活. 本实验中正常肝组织中未见到卵圆细胞, 但在肝硬化组织中和肝细胞癌组织中却有卵圆细胞的存在, 且其数量在两种组织中有显著性差异, 而90%的肝细胞癌由肝硬化发展而来, 肝硬化被认为是肝细胞癌的癌前病变, 验证了卵圆细胞在肝脏损伤后再生和癌变中的作用, 进一步支持肝细胞癌的卵圆细胞源学说.
我们实验从形态学的角度探讨了P02的表达状况, 结果显示P02的表达定位于肝硬化组织肝细胞和肝细胞癌细胞中. P02在肝硬化和肝细胞癌组织中的阳性表达率分别为26.7%和80%, 二者之间表达有显著性差异(P<0.01). 由于90%的肝细胞癌发生于肝硬化, 肝硬化已被认为是肝细胞癌的癌前病变. 消减基因P02在肝硬化和肝细胞癌组织中表达的显著差异性, 进一步确定其为肝细胞癌相关的差异表达基因的表达序列标签, 是一个在肝细胞癌发生发展中起重要作用的基因. 实验结果还显示: 在13对肝硬化的汇管区和肝细胞癌巢周边可见到肝卵圆细胞的增殖且胞质呈强阳性染色, 所见到的肝卵圆细胞核呈卵圆形, 胞质较少, 细胞体积较小, 约相当于肝细胞体积的1/2-1/4. 统计学结果显示二者的数量之间有显著性差异(P<0.01), 体现了肝细胞癌发生发展过程卵圆细胞的增殖情况, 有力的支持肝细胞癌的卵圆细胞源学说, 在卵圆细胞向肝细胞癌转化过程中, P02可能起着重要的作用. 由此我们得出初步结论, P02可能通过促进卵圆细胞的增殖来介导肝细胞癌的发生. 至于其具体机制还需要进一步的深入研究.
肝细胞癌(HCC)是严重危害人类健康的恶性肿瘤之一. 对于其发病机制的研究从两方面展开: (1)细胞学起源的探讨, 即肝细胞癌可能起源于肝内未分化的卵圆细胞的假说; 并有不少学者从肝癌组织中发现了肝卵圆细胞的存在. (2) 是HCC相关基因的研究,如c-myc, c-met, N-ras, c-fos等. 而 P02 基因是肝细胞癌消减 cDNA文库中一个在肝细胞癌中 高表达的基因, 他已作为表达序列标签(expressionsequencetag,EST) 登录到了 GenBank/EMBL/DDBJ数据库.
(1) 进一步研究卵圆细胞与肝坏死、再生、纤维化、硬化及癌变等病理生理过程的关系, 从而探讨对其进行定向诱导的可能; (2)以卵圆细胞作为种子细胞进行肝细胞移植, 应用于终末期肝衰竭的临床治疗
薛玲et al在体外诱导培养卵圆细胞向肝癌细胞转化, 并研究c-Ha-ras, c-myc及Ki-ras癌基因表达的动态变化, 认为卵圆细胞在致癌剂的作用下, 可能成为癌前细胞, 继而在癌基因及其产物的作用下分化为多种形态的恶性肿瘤. Huang et al研究Hoxa-13基因在乙型肝炎病毒/丙型肝炎病毒相关的肝癌病例中的表达情况时发现Hoxa-13基因在来源于肝干细胞的肝癌细胞系中表达, 而不在来源于肝细胞及胆管细胞的肝癌细胞系中表达, 因而推测其对于肝干细胞对肝癌的转化具有重要意义. Fang et al在大鼠肝癌模型中测得卵圆细胞贯穿于造模全过程, 其 c-myc的表达量随肝癌的进展增高, 由此推测c-myc作为致癌基因可能对卵圆细胞恶性转化起重要作用.
该论文利用肝细胞癌消减cDNA文库中已确定在肝细胞癌中高表达的P02基因并和肝细胞癌卵圆细胞源学说结合起来, 从独到的角度探讨肝细胞癌的发病机制, 揭示了卵圆细胞在肝细胞癌发生中的作用, 为卵圆细胞在临床的应用提供了理论依据.
1 干细胞: 干细胞是一类具有无限或较长的自我更新和增殖分化能力的细胞, 能产生表现型和基因型与其自身完全相同的子代细胞, 同时还能分化出定向祖细胞.2 表达序列标签(EST): 1991年, 美国公共卫生研究所(NIH)的Adams et al, 在用核苷酸自动测序仪每日分析96个模板的基础上, 开始了ESTs工作计划, 即开始运用表达序列标记法寻找新基因. 为了加快速度, 通常不读出基因的全部序列, 而是得到一部分序列, 称作表达序列标签(EST), EST要有足够长以至于能特异地标记基因. 通常他含有足够的结构信息指出这个基因与其他基因的关系.
本文论述了CK19 参与了肝硬化到肝细胞癌的癌变过程, P02是一个肝细胞癌高表达的基因, 可能通过促进卵圆细胞的增殖介导肝癌细胞的发生, 文章有一定的深度, 论证可信, 层次清楚, 对肝癌的基础研究有重要参考意义.
编辑:王晓瑜 电编:郭海丽
| 1. | Becker R, Luthgens B, Oesch F, Dienes HP, Steinberg P. Ha-rasVal12 but not p53Ser247 leads to a significant neoplastic transformation rate of the putative rat liver stem cells (oval cell). Carcinogenesis. 1996;17:2635-2640. [PubMed] |
| 2. | Ruck P, Xiao JC, Kaiserling E. Small epithelial cells and the histogenesis of hepatoblastoma. Electron microscopic, immunoelectron microscopic, and immunohistochemical findings. Am J Pathol. 1996;148:321-329. [PubMed] |
| 3. | Robrechts C, De Vos R, Van den Heuvel M, Van Cutsem E, Van Damme B, Desmet V, Roskams T. Primary liver tumour of intermediate (hepatocyte-bile duct cell) phenotype: a progenitor cell tumour? Liver. 1998;18:288-293. [PubMed] |
| 4. | Lowes KN, Brennan BA, Yeoh GC, Olynyk JK. Oval cell numbers in human chronic liver diseases are directly related to disease severity. Am J Pathol. 1999;154:537-541. [PubMed] |
| 6. | Petersen BE. Hepatic "stem" cells: coming full circle. Blood Cells Mol Dis. 2001;27:590-600. [PubMed] |
| 7. | 朱 武凌, 段 芳龄, 韩 有志, 刘 东亮, 张 玲, 马 军, 白 经修. 肝硬化患者发生的肝细胞癌差异表达基因文库的构建及初步筛选. 胃肠病学和肝病学杂志. 2000;9:252-254. |
| 8. | 高 天慧, 段 芳龄, 周 云, 朱 武凌, 韩 娜, 李 蔚. 肝细胞癌高表达基因片段P02的全长RACE扩增和序列分析. 胃肠病学和肝病学杂志. 2005;14:141-144. |
| 10. | 高 天慧, 段 芳龄, 周 云, 尚 佳, 孙 嫣, 孙 艳, 王 晓. TPT1基因转染对肝癌细胞系SMMC-7721生物学行为的影响. 中国误诊学杂志. 2005;5:3004-3007. |
| 11. | Shupe T, Petersen BE. Evidence regarding a stem cell origin of hepatocellular carcinoma. Stem Cell Rev. 2005;1:261-264. [PubMed] |
| 12. | Alison MR. Liver stem cells: implications for hepatocarcinogenesis. Stem Cell Rev. 2005;1:253-60. [PubMed] |
| 13. | Wu XZ, Chen D. Origin of hepatocellular carcinoma: role of stem cells. J Gastroenterol Hepatol. 2006;21:1093-1098. [PubMed] |
| 14. | Lee JS, Heo J, Libbrecht L, Chu IS, Kaposi-Novak P, Calvisi DF, Mikaelyan A, Roberts LR, Demetris AJ, Sun Z. A novel prognostic subtype of human hepatocellular carcinoma derived from hepatic progenitor cells. Nat Med. 2006;12:410-416. [PubMed] |
| 15. | Yamamoto T, Uenishi T, Ogawa M, Ichikawa T, Hai S, Sakabe K, Tanaka S, Kato H, Mikami S, Ikebe T. Immunohistologic attempt to find carcinogenesis from hepatic progenitor cell in hepatocellular carcinoma. Dig Surg. 2005;22:364-370. [PubMed] |
| 16. | Alison MR, Lovell MJ. Liver cancer: the role of stem cells. Cell Prolif. 2005;38:407-421. [PubMed] |
| 17. | Matthews VB, Yeoh GC. Liver stem cells. IUBMB Life. 2005;57:549-553. [PubMed] |
| 18. | Fang CH, Zhang GQ, Zhu XY, Gong JQ. Distribution of oval cells and c-myc mRNA expression in mouse hepatocarcinogenesis. Hepatobiliary Pancreat Dis Int. 2004;3:433-439. [PubMed] |
| 19. | Fang CH, Gong JQ, Zhang W. Function of oval cells in hepatocellular carcinoma in rats. World J Gastroenterol. 2004;10:2482-2487. [PubMed] |
| 20. | Fang CH, Zhang W, Zhu XY, Gong JQ, Zhang GQ. The expression of c-kit and proliferating cell nuclear antigen in oval cells of rats with hepatocellular carcinoma. Hepatobiliary Pancreat Dis Int. 2003;2:537-544. [PubMed] |
| 21. | Dumble ML, Croager EJ, Yeoh GC, Quail EA. Generation and characterization of p53 null transformed hepatic progenitor cells: oval cells give rise to hepatocellular carcinoma. Carcinogenesis. 2002;23:435-445. [PubMed] |
| 22. | 龚 加庆, 方 驰华. 大鼠肝癌发生发展过程中肝组织增殖细胞核抗原动态演变规律. 中国普外基础与临床杂志. 2007;14:11-14. |
| 25. | 龚 加庆, 方 驰华, 李 雅. 肝卵圆细胞在进行性肝损伤过程中分布及迁移的实验研究. 中国普外基础与临床杂志. 2004;11:389-392. |
| 27. | 肖 家诚, 金 晓龙, 曾 晓颖, Ruck P, Adam A, Kaiserling E. 肝细胞肝癌和肝硬化组织中的卵圆细胞: 电镜与免疫电镜研究. 检验医学. 2004;9:47-50. |
| 30. | Sell S. Comparison of liver progenitor cells in human atypical ductular reactions with those seen in experimental models of liver injury. Hepatology. 1998;27:317-331. [PubMed] |