修回日期: 2007-07-16
接受日期: 2007-07-28
在线出版日期: 2007-07-28
目的: 检测胃肠道间质瘤(GIST)中PDGFRα和C-kit基因突变及其蛋白表达的关系及在肿瘤形成中的作用.
方法: 采用单链象多态性聚合酶链式反应(PCR-SSCP), 免疫组化和蛋白印迹(Western blot)方法, 检测GIST 52例中PDGFRα和C-kit基因突变及蛋白表达情况.
结果: GIST 52例中PDGFRα基因突变5例(9.6%), 多见于梭形细胞型的胃源性GIST, C-kit基因突变28例(53.8%), 多发生于小肠, 并且这两种基因突变互相独立; PDGFRα蛋白表达率100%, C-kit蛋白的表达率为94.2%, 突变的5例GIST PDGFRα强于C-kit突变的GIST, 正常胃肠道组织和神经鞘瘤; 突变与C-kit蛋白表达之间没有显著相关性(P = 0.5332), 而突变与PDGFRα蛋白表达之间呈显著相关性(P<0.0001).
结论: GIST中PDGFRα和C-kit突变在部分GIST肿瘤发生过程中发挥了重要作用; 突变位点与起源部位和组织学类型有关; 大多GIST中蛋白表达与其基因突变关系密切.
引文著录: 王彦丽, 赵向荣, 白辰光, 杨蕾, 马大烈. 胃肠道间质瘤组织中PDGFRα和C-kit基因突变和蛋白表达的关系. 世界华人消化杂志 2007; 15(21): 2300-2305
Revised: July 16, 2007
Accepted: July 28, 2007
Published online: July 28, 2007
AIM: To detect platelet-derived growth factor receptor α (PDGFRα) and C-kit gene mutations and protein expression, and to discuss the relationship between the two genes. In addition, to discuss the important role of the PDGFRα mutation in the tumorigenesis of gastrointestinal stromal tumors (GISTs).
METHODS: PDGFRα and C-kit gene mutations and protein expression in 52 cases of GIST were detected by polymerase chain reaction single-strand conformation polymorphism, immunohistochemistry and Western blotting.
RESULTS: PDGFRα gene mutations were detected in five cases (9.6%) among the 52 GISTs. Most had spindle histology and were of gastric origin. The C-kit mutation was found in 28 cases (53.8%). Most were small intestinal origin; tumors with C-kit mutation were not examined for PDGFRα mutation. The rate of PDGFRα protein expression was 100%. In five cases of GIST with PDGFRα gene mutations, the corresponding protein expression was higher than that in cases with C-kit gene mutations, or in normal GI tissues and schwannomas. The rate of C-kit protein expression was 94.2% (49/52). Mutations were unrelated to C-kit protein expression (P = 0.5332). The presence of mutations correlated with PDGFRα protein expression (P < 0.0001).
CONCLUSION: Our results suggest that PDGFRα and C-kit mutations play an important role in the tumorigenesis of GIST. The location of mutations is associated with the site of origin and histological phenotype. Protein expression will not always be associated with a corresponding gene mutation and is only a diagnostic aid.
- Citation: Wang YL, Zhao XR, Bai CG, Yang L, Ma DL. Relationship of Platelet-derived growth factor receptor α and C-kit gene mutations and expression in gastrointestinal stromal tumors. Shijie Huaren Xiaohua Zazhi 2007; 15(21): 2300-2305
- URL: https://www.wjgnet.com/1009-3079/full/v15/i21/2300.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i21.2300
胃肠道间质瘤(GIST)是胃肠道最常见的间质肿瘤, 是完全不同于平滑肌瘤、平滑肌肉瘤、神经鞘瘤和其他间叶源性肿瘤的实体[1], GIST以C-kit的免疫组化表达为其典型特征. 1998年Hirota et al[2]首次报道在GIST中不仅可特异性的高表达C-kit蛋白, 还存在C-kit基因的功能获得性突变. 最近的研究发现在少部分GIST中, 还存在血小板衍生生长因子受体α(PDGFRα)基因的突变, 并发现大多数GIST中都能检测到PDGFRα在转录水平的表达[3-4]. PDGFRα为一种单链跨膜糖蛋白, 与C-kit同属Ⅲ型酪氨酸蛋白激酶家族. 关于PDGFRα在GIST中的表达情况研究较少, 并且GIST中PDGFRα和C-kit突变及与蛋白表达的关系仍不清楚. 为此, 我们对1组GIST进行PDGFRα和C-kit突变和蛋白的检测, 分析两者的关系, 探讨他们在GIST中的作用.
2002-2004年资料完整、诊断明确的GIST新鲜肿瘤标本52例. 男27例, 女25例; 发病年龄23-78(中位50.5)岁; 胃间质瘤34例, 肠间质瘤16例, 肠系膜间质瘤2例; 按照肿瘤最大径可分为0-5.0 cm组26例, 5.0-10 cm组19例, ≥10 cm 7例; 梭形细胞型37例, 上皮细胞型5例, 混合型10例. 均经手术切除治疗, 所有患者术前均未接受化疗和放疗. 同时收集神经鞘瘤、平滑肌瘤各3例作为阴性对照.
1.2.1 银染PCR-SSCP: GIST组织用蛋白酶K-酚-氯仿法抽提基因组DNA进行PCR. 引物序列、大小和退火温度见文献(插入的)[5]. 取PCR产物10 mL与950 g/L甲酰胺变性缓冲液10 mL和石蜡油30 mL混合后变性, 冷却后将水相全部上样于PAGE胶电泳至指示剂二甲苯青到达胶底部. 凝胶经固定、银染、显影后观察并照相. 与正常对照相比, 凡SSCP条带有单链条带泳动变位、缺失或多带提示该标本中存在突变. PCR产物50 mL经胶回收纯化后直接测序(上海英骏生物技术有限公司).
1.2.2 免疫组化: 石蜡切片进行Envision二步法免疫组化染色. 兔抗人PDGFRa和C-kit多克隆抗体(1:200, Santa Cruz公司; 1:100, Dako公司), Envision试剂盒(Dako公司). 每次实验设立阳性和阴性对照. 结果判定: 在组织结构良好和清晰的背景下, 阳性信号为定位于肿瘤细胞质和细胞膜上清晰的黄色或棕黄色、棕褐色颗粒状着色. <10%为阴性, 10%-50%为弱阳性, ≥80%为强阳性.
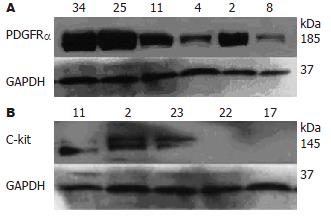
1.2.3 Western blot印迹: 裂解抽提组织总蛋白, BCA法蛋白定量. 以各泳道50 mg的蛋白样品电泳并转膜. 兔抗人PDGFRa一抗和羊抗人GAPDH一抗(1:500, Santa Cruz公司)孵育过夜后加入二抗, 洗膜后进行ECL(Santa Cruz公司)化学发光, X光片曝光并显影, 定影, 分析结果.
统计学处理 应用CMH(cochran-mantel-haenszel )χ2检验进行统计学分析.
所有检测标本的PDGFRα exon18, exon12和C-kit exon11, exon9的PCR产物在15 g/L琼脂糖凝胶电泳中均显示为一条带, 长度分别为212, 233, 223和310 bp. 在GIST 52例中共检测出PDGFRα基因突变5例(9.6%), exon18和exon12分别为4例(7.7%)和1例(1.9%). C-kit基因突变28例(53.8%), exon11 (46.2%)和exon9(7.7%)分别为24例和4例. 19例GIST、平滑肌瘤、神经鞘瘤和正常胃肠道组织中未检测到C-kit和PDGFRα基因突变.
5例PDGFRα突变经测序分析, 4例exon18突变, 2例为843位点突变异亮氨酸变为丝氨酸(I843S, ATC-TCC); 1例为839位点突变亮氨酸变为脯氨酸(L839P, CTG→CCG); 1例为点突变和插入突变共存, 点突变为851位, 插入突变为833和834位之间插入一个碱基G, 1例exon12突变, 585位R删除突变AGA→TGA终止密码子. C-kit exon11检测了10例, 突变均在密码子556-586之间, 其中仅点突变7例, 删除突变或删除突变和点突变都有的2例, 插入突变、删除突变和点突变都有的1例.
5例PDGFRα突变阳性的GIST中C-kit突变均为阴性, 28例C-kit突变阳性的GIST中PDGFRα突变均为阴性, 19例GIST中PDGFRα突变和C-kit突变均为阴性. 5例PDGFRα基因突变的肿瘤均为胃源性GIST; 其中梭形细胞型4例, 混合细胞型1例. C-kit突变的肿瘤胃源性17例, 肠源性11例, 其中4例C-kit exon9突变的肿瘤均为肠源性; 梭形细胞型21例, 上皮细胞型2例, 混合细胞型4例.
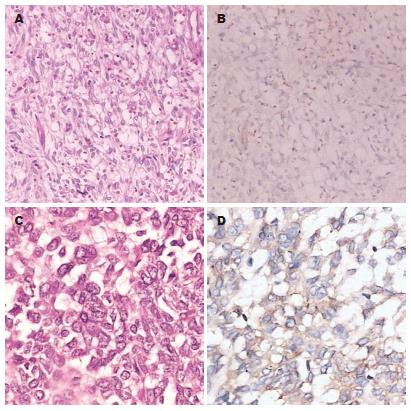
PDGFRα蛋白的表达率100%, GIST 52例, 平滑肌瘤、神经鞘瘤和正常胃肠道组织都表达PDGFRα, 但表达强弱不同. 存在PDGFRα基因突变的5例GIST呈强阳性表达, 无PDGFRα基因突变的47例GIST、平滑肌瘤、神经鞘瘤和正常胃肠道组织呈弱阳性表达. C-kit蛋白的表达率为94.2%, 但在平滑肌瘤和神经鞘瘤中不表达. 在PDGFRα基因突变的GIST 5例中C-kit蛋白强阳性表达4例, 阴性表达1例(图1A-B); 在C-kit基因突变的GIST 28例中C-kit蛋白强阳性表达24例(图1C-D), 弱阳性表达2例, 阴性表达2例. 突变与C-kit蛋白表达之间没有显著相关性(P = 0.5332), 而突变与PDGFRα蛋白表达之间呈显著相关性(P<0.0001, 表1).
| 突变 | n | C-kit | PDGFRα | |||||||
| 强阳性 | 弱阳性 | 阴性 | χ2 | P | 强阳性 | 弱阳性 | χ2 | P | ||
| C-kit | 28 | 24 | 2 | 2 | 0.3882 | 0.5332 | 0 | 28 | 32.0000 | <0.0001 |
| PDGFRα | 5 | 4 | 0 | 1 | 5 | 0 | ||||
| 合计 | 33 | 28 | 2 | 3 | 5 | 28 | ||||
PDGFRα蛋白普遍表达在各种组织中, 但表达水平高低不等, 5例PDGFRα突变的GIST均强于C-kit突变的GIST, 正常胃肠道组织和神经鞘瘤; C-kit突变的GIST, 其PDGFRα的表达水平强弱不等, 但均弱于PDGFRα突变的GIST(图2A). C-kit蛋白在C-kit突变的GIST中大多高表达, 但有2例C-kit突变的GIST却没有C-kit蛋白的表达; 5例PDGFRα突变的GIST中C-kit蛋白表达阴性或弱阳性(图2B).
PDGFRα基因定位与C-kit极为相近, 均位于人类4q12-13, 他的产物: PDGFRα为一种单链跨膜糖蛋白, 分子质量185 kDa, 与C-kit同属Ⅲ型酪氨酸蛋白激酶家族, 且结构相似. 当PDGFRα与配体PDGF结合后可激发酪氨酸残基磷酸化, 从而调节细胞的生长、增殖、黏附、转移、分化和凋亡[6]. 现在, 大多研究认为, 受体酪氨酸激酶C-kit的激活突变是大多数GIST发生、发展的重要分子事件[7]. 最近, 在少数病例中又发现存在PDGFRα功能获得性突变[3-4], 其突变方式与C-kit突变相似, 集中在近膜区和激酶区. 提示PDGFRα突变可能是产生GIST的另一个原因, 尤其是在C-kit突变阴性的GIST肿瘤形成过程中起重要作用.
PDGFRα的突变类型多样, 有功能获得性突变, 也有非功能性突变, 不仅在肿瘤组织中, 在正常组织中也可发生. Corless et al[8]研究并总结了1105例GIST的突变类型, 其中最多见的是exon18 D842V(约占62.6%); 其次为exon18 Del DIMH842-845和exon12 V561D(共占14.9%). 本组5例PDGFRα突变中2例为exon18的843位点突变, 由Ile→Ser; 1例exon12的585位删除突变, 文献中未报道过这两种类型, 其余均不在突变热点位置. 这可能与人种有关. 本组这5例突变是否为功能获得性突变, 现在还不清楚, 需体外的PDGFRα功能分析加以证实. 本组C-kit突变类型和情况与文献[9-10]报道基本一致, 检测的10例exon11突变均在密码子556-586之间. 目前, STI571是不能手术的GIST患者的一线治疗药物, 他选择性抑制原癌基因abl, Abl-Bcr, C-kit和PDGF受体酪氨酸激酶, 从而阻断信号的传导, 达到治疗的目的[11]. 研究发现检测突变位点对预测药物疗效可能是有用的[1], 如C-kit exon11和PDGFRα exon12突变的GIST比C-kit exon9和PDGFRα exon18对STI571的疗效好. 另外疗效与突变类型也有关, 如Debiec-Rychter et al[12]和Weisberg et al[13]发现PDGFRα-D842V突变体对STI571产生耐药性, 由此引出PKC412等新药的研究.
众多研究发现, C-kit基因外显子突变率达40%-90%, 其中exon11的突变率最高, 本组前期研究的C-kit exon11的突变率为40.4%[14]; PDGFRα主要有2个外显子突变, 突变率exon18 (5.6%), exon12(1.5%); 剩下约12%的GIST没有这两种突变[15]. 在本组的GIST中C-kit exon11, 9的突变率分别为46.2%和7.7%; PDGFRα的突变率9.6%, 其中exon18(7.7%)和exon12(1.9%); 剩下19例(36.5%)的GIST未检测到这两种突变. 说明这两种基因突变是GIST发生的重要分子机制, 但不是唯一的机制, 还存在其他机制. Miettinen et al[16]和Andersson et al[17]报道, 儿童、青少年和伴有神经纤维瘤Ⅰ型(NF1)的GIST中未检测到C-kit exon9, 11, 13, 17和PDGFRα exon12, 18突变, 说明有不同的发病机制. 但是, 关于这些GIST发病机制的更进一步研究还没有进行. 另外, 突变率的不同, 可能有2种原因, 一个是用于DNA抽提的组织不同, 另一个是研究方法不同.
我们发现, GIST有PDGFRα突变就没有C-kit突变, 与大多数研究结果相符[18]. Wasag et al[19]发现, PDGFRα的突变大多发生于胃, 且病理形态以上皮及混合型细胞为多; 而C-kit突变多发生于小肠, 病理形态以梭形细胞为主. 并且, 黏液上皮样GIST大多有PDGFRα的突变[20]. 本组5例PDGFRα突变的肿瘤均为胃源性, 但在上皮细胞型GIST中未检测到PDGFRα突变, 这与国外文献不太相符, 可能与人种有关, 因为有关华人GIST的研究报道中, 上皮细胞型GIST均较少见[21]. 相比更普通的C-kit原癌基因突变的GIST, 在PDGFRα突变的GIST中, 致瘤机制由PDGFRα代替C-kit, 因此C-kit表达减少而PDGFRα表达是增加的. 本组PDGFRα免疫组化结果提示其不是一种GIST特异性标记物, 但表达强度与PDGFRα基因突变相关(P<0.0001). Pauls et al[22]发现, 正常情况下PDGFRα表达在肌间神经从和施沃恩细胞的神经结体上, 但不表达在间质的卡哈尔细胞上, 当PDGFRα突变时其蛋白就会在间质表达. 另外, 与抗体特异性较差也有关, 目前众多学者[23]还没有找到有意义和可重复的商业化抗体, 因此, PDGFRα抗体仍未应用于临床. 本组病例C-kit蛋白免疫组化及突变与蛋白表达的关系(P = 0.5332)显示与以往文献[2,24]报道一致, 即C-kit基因突变一般不影响其蛋白产物的表达. 进一步分析2例无C-kit蛋白表达的GIST, 均发现有C-kit基因突变, 但突变方式未检测. 原因可从2个方面解释: (1)用免疫组化所检测的C-kit蛋白包括野生型和突变型; (2) C-kit基因突变会引起他的生物学功能发生改变, 但此时不影响他在免疫组化中的染色[25]. 进一步用免疫印迹发现这2例C-kit蛋白表达仍为阴性, 其生物学基础还不清楚, 有学者认为, 可能是突变片段太大导致的蛋白失表达[26]. 另外可能也有技术的原因.
本组蛋白表达的半定量分析结果与Hirota et al[4], Sokurai et al[20]和Kang et al[27]的文献报道相似, 这说明蛋白表达与相应基因的突变联系密切, 即PDGFRα的突变与PDGFRα的活性表达水平直接相关, 激活蛋白的不同表达水平也在Ⅲ型受体酪氨酸激酶家族的下游起重要作用, 这样我们可以根据蛋白表达水平预测突变情况来指导临床用药. 另外, 本组还发现, 有时基因突变和蛋白表达是不同步的, 在PDGFRα突变的GIST中C-kit蛋白也表达, 在2例C-kit突变的GIST中却没有C-kit蛋白的表达. 这与有些学者[6]的发现相符, 即虽然两种基因突变相对独立发生, 他们的蛋白表达与基因突变关系密切, 但他们的蛋白表达有时是相互重叠的. 所以蛋白的表达并不能完全代表基因突变, 只能作为诊断GIST的辅助手段.
总之, PDGFRα基因突变率为9.6%, 多见于梭形细胞型的胃源性GIST, 并且GIST中PDGFRα和C-kit突变是相互独立的. 大多GIST中PDGFRα的蛋白表达与其基因突变关系密切, 但是存在PDGFRα突变的肿瘤PDGFRα和C-kit蛋白大多同时表达. 所以蛋白的表达并不能完全代表基因突变, 只能作为诊断GIST的辅助手段.
2003年有学者在C-ki t突变阴性的GIST中检测到PDGFRα的表达及突变, 由于PDGFRα与C-kit的相似之处使得对于GIST中 PDGFRα的相关研究成为热点.
回顾国内外GIST的相关研究, 目前亟待研究解决的问题有: (1)GIST中PDGFRα表达量的高低和突变类型与各病理临床指标的相关性方面无明确资料; (2)GIST中 PDGFRα和C-kit突变和蛋白表达的关系尚不明了; (3)GIST的生物学行为难以预测.
Hirota et al发现大多数GIST中都能检测到PDGFRα在转录水平的表达. 并且在无C-kit突变的GISTPDGFRα的表达水平要比有 C-kit突变的GIST PDGFRα的表达水平强, 但也可能会在无C-kit突变的GIST中 PDGFRα的表达水平较弱. 他们之间的关系还需进一步研究.
关于PDGFRα在GIST中的表达情况研究较少, 并且GIST中PDGFRα和C-kit突变及与蛋白表达的关系仍不清楚.
本文提示PDG-FRα和C-kit蛋白的表达并不能完全代表基因突变, 只能作为诊断 GIST的辅助手段.这些问题的深入探讨必将为GIST在今后临床病理诊断及靶向治疗提供重要的科学依据.
血小板衍生生长因子受体 α(PDGFRα): 是一种单链跨膜糖蛋白, 分子质量185 kDa, 与C-kit同属Ⅲ型酪氨酸蛋白激酶家族, 且结构相似.
本文应用分子生物学技术检测了在52例GIST病理标本中PDGFRα和C-kit突变和蛋白表达的变化, 研究方法和技术较先进, 结果较客观, 对深入认识我国GIST患者的临床病例特点有一定的借鉴价值, 能较好地反映我国胃肠病学临床基础研究的先进水平.
编辑: 程剑侠 电编:张敏
| 1. | Debiec-Rychter M, Dumez H, Judson I, Wasag B, Verweij J, Brown M, Dimitrijevic S, Sciot R, Stul M, Vranck H. Use of c-KIT/PDGFRA mutational analysis to predict the clinical response to imatinib in patients with advanced gastrointestinal stromal tumours entered on phase I and II studies of the EORTC Soft Tissue and Bone Sarcoma Group. Eur J Cancer. 2004;40:689-695. [PubMed] |
| 2. | Hirota S, Isozaki K, Moriyama Y, Hashimoto K, Nishida T, Ishiguro S, Kawano K, Hanada M, Kurata A, Takeda M. Gain-of-function mutations of c-kit in human gastrointestinal stromal tumors. Science. 1998;279:577-580. [PubMed] |
| 3. | Heinrich MC, Corless CL, Duensing A, McGreevey L, Chen CJ, Joseph N, Singer S, Griffith DJ, Haley A, Town A. PDGFRA activating mutations in gastrointestinal stromal tumors. Science. 2003;299:708-710. [PubMed] |
| 4. | Hirota S, Ohashi A, Nishida T, Isozaki K, Kinoshita K, Shinomura Y, Kitamura Y. Gain-of-function mutations of platelet-derived growth factor receptor alpha gene in gastrointestinal stromal tumors. Gastroenterology. 2003;125:660-667. [PubMed] |
| 5. | Penzel R, Aulmann S, Moock M, Schwarzbach M, Rieker RJ, Mechtersheimer G. The location of KIT and PDGFRA gene mutations in gastrointestinal stromal tumours is site and phenotype associated. J Clin Pathol. 2005;58:634-639. [PubMed] |
| 6. | Heinrich MC, Rubin BP, Longley BJ, Fletcher JA. Biology and genetic aspects of gastrointestinal stromal tumors: KIT activation and cytogenetic alterations. Hum Pathol. 2002;33:484-495. [PubMed] |
| 7. | Duensing A, Heinrich MC, Fletcher CD, Fletcher JA. Biology of gastrointestinal stromal tumors: KIT mutations and beyond. Cancer Invest. 2004;22:106-116. [PubMed] |
| 8. | Corless CL, Schroeder A, Griffith D, Town A, McGreevey L, Harrell P, Shiraga S, Bainbridge T, Morich J, Heinrich MC. PDGFRA mutations in gastrointestinal stromal tumors: frequency, spectrum and in vitro sensitivity to imatinib. J Clin Oncol. 2005;23:5357-5364. [PubMed] |
| 9. | Sihto H, Sarlomo-Rikala M, Tynninen O, Tanner M, Andersson LC, Franssila K, Nupponen NN, Joensuu H. KIT and platelet-derived growth factor receptor alpha tyrosine kinase gene mutations and KIT amplifications in human solid tumors. J Clin Oncol. 2005;23:49-57. [PubMed] |
| 10. | Miettinen M, Sobin LH, Lasota J. Gastrointestinal stromal tumors of the stomach: a clinicopathologic, immunohistochemical, and molecular genetic study of 1765 cases with long-term follow-up. Am J Surg Pathol. 2005;29:52-68. [PubMed] |
| 11. | Roskoski R Jr. STI-571: an anticancer protein-tyrosine kinase inhibitor. Biochem Biophys Res Commun. 2003;309:709-717. [PubMed] |
| 12. | Debiec-Rychter M, Cools J, Dumez H, Sciot R, Stul M, Mentens N, Vranckx H, Wasag B, Prenen H, Roesel J. Mechanisms of resistance to imatinib mesylate in gastrointestinal stromal tumors and activity of the PKC412 inhibitor against imatinib-resistant mutants. Gastroenterology. 2005;128:270-279. [PubMed] |
| 13. | Weisberg E, Wright RD, Jiang J, Ray A, Moreno D, Manley PW, Fabbro D, Hall-Meyers E, Catley L, Podar K. Effects of PKC412, nilotinib, and imatinib against GIST-associated PDGFRA mutants with differential imatinib sensitivity. Gastroenterology. 2006;131:1734-1742. [PubMed] |
| 14. | Feng F, Liu XH, Xie Q, Liu WQ, Bai CG, Ma DL. Expression and mutation of c-kit gene in gastrointestinal stromal tumors. World J Gastroenterol. 2003;9:2548-2551. [PubMed] |
| 15. | Yamamoto H, Oda Y, Kawaguchi K, Nakamura N, Takahira T, Tamiya S, Saito T, Oshiro Y, Ohta M, Yao T. c-kit and PDGFRA mutations in extragastrointestinal stromal tumor (gastrointestinal stromal tumor of the soft tissue). Am J Surg Pathol. 2004;28:479-488. [PubMed] |
| 16. | Miettinen M, Lasota J, Sobin LH. Gastrointestinal stromal tumors of the stomach in children and young adults: a clinicopathologic, immunohisto-chemical, and molecular genetic study of 44 cases with long-term follow-up and review of the literature. Am J Surg Pathol. 2005;29:1373-1381. [PubMed] |
| 17. | Andersson J, Sihto H, Meis-Kindblom JM, Joensuu H, Nupponen N, Kindblom LG. NF1-associated gastrointestinal stromal tumors have unique clinical, phenotypic, and genotypic characteristics. Am J Surg Pathol. 2005;29:1170-1176. [PubMed] |
| 18. | Burger H, den Bakker MA, Kros JM, van Tol H, de Bruin AM, Oosterhuis W, van den Ingh HF, van der Harst E, de Schipper HP, Wiemer EA. Activating mutations in c-KIT and PDGFRalpha are exclusively found in gastrointestinal stromal tumors and not in other tumors overexpressing these imatinib mesylate target genes. Cancer Biol Ther. 2005;4:1270-1274. [PubMed] |
| 19. | Wasag B, Debiec-Rychter M, Pauwels P, Stul M, Vranckx H, Oosterom AV, Hagemeijer A, Sciot R. Differential expression of KIT/PDGFRA mutant isoforms in epithelioid and mixed variants of gastrointestinal stromal tumors depends predominantly on the tumor site. Mod Pathol. 2004;17:889-894. [PubMed] |
| 20. | Sakurai S, Hasegawa T, Sakuma Y, Takazawa Y, Motegi A, Nakajima T, Saito K, Fukayama M, Shimoda T. Myxoid epithelioid gastrointestinal stromal tumor (GIST) with mast cell infiltrations: a subtype of GIST with mutations of platelet-derived growth factor receptor alpha gene. Hum Pathol. 2004;35:1223-1230. [PubMed] |
| 21. | Li CF, Chuang SS, Lu CL, Lin CN. Gastrointestinal stromal tumor (GIST) in southern Taiwan: a clinicopathologic study of 93 resected cases. Pathol Res Pract. 2005;201:1-9. [PubMed] |
| 22. | Pauls K, Merkelbach-Bruse S, Thal D, Buttner R, Wardelmann E. PDGFRalpha- and c-kit-mutated gastrointestinal stromal tumours (GISTs) are characterized by distinctive histological and immunohistochemical features. Histopathology. 2005;46:166-175. [PubMed] |
| 23. | Medeiros F, Corless CL, Duensing A, Hornick JL, Oliveira AM, Heinrich MC, Fletcher JA, Fletcher CD. KIT-negative gastrointestinal stromal tumors: proof of concept and therapeutic implications. Am J Surg Pathol. 2004;28:889-894. [PubMed] |