修回日期: 2007-01-01
接受日期: 2007-01-01
在线出版日期: 2007-07-18
目的: 建立SYBR Green I实时荧光PCR定量检测人类SUZ12基因的方法.
方法: 将SUZ12 RT-PCR扩增片段克隆入载体pGEM-T后, 经测序鉴定正确后, 进行纯化和定量及系列稀释, 应用SYBR Green I实时荧光定量PCR检测SUZ12, 建立标准曲线, 熔解曲线分析产物的特异性.
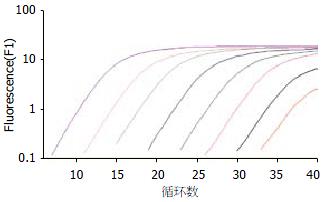
结果: 该法检测的最低拷贝数为14.2, 线性范围为1.42×101-1.42×108拷贝, 相关系数r为-1.00, 1.42×107拷贝/L标本的批内变异系数(CV)和日间CV分别为1.8%和2.8%. 熔解曲线分析显示单一的峰, 熔解温度(melting temperature, Tm)为(81.37±0.16)℃.
结论: 实时荧光定量PCR方法检测SUZ12基因, 快速有效、灵敏度高、特异性好.
引文著录: 陈凤花, 胡丽华, 王琳, 李一荣, 周志明. 人类SUZ12基因实时荧光定量PCR检测方法的建立. 世界华人消化杂志 2007; 15(20): 2220-2224
Revised: January 1, 2007
Accepted: January 1, 2007
Published online: July 18, 2007
AIM: To establish a real-time fluorescent polymerase chain reaction (PCR) for quantifying human SUZ12.
METHODS: The SUZ12 fragment in pure form from classical RT-PCR was cloned to pGEM-T vector, and recombinant plasmid pGEM-SUZ12 was purified and quantified by spectrophotometry. A standard curve was established using a serial dilution of quantified plasmids to measure SUZ12, using SYBR Green I real-time fluorescent PCR, and the characteristics of the specific SUZ12 amplicon were analyzed by the melting curve.
RESULTS: The method could detect as few as 14.2 copies. Good linearity was found from 14.2 to 1.42 × 108 copies/reaction, and the correlation coeffecient was -1.00. The intra- and interassay variation of 1.42 × 104 copies/reaction was 1.8% and 2.8%, respectively. Melting curve analysis showed a single peak, and melting temperature (Tm) was (81.37 ± 0.16)℃.
CONCLUSION: SYBR Green I real-time fluorescent quantitative PCR is rapid, specific, sensitive and accurate, and can be used for research on human SUZ12.
- Citation: Chen FH, Hu LH, Wang L, Li YR, Zhou ZM. Quantification of human SUZ12 with SYBR Green I real-time fluorescent polymerase chain reaction. Shijie Huaren Xiaohua Zazhi 2007; 15(20): 2220-2224
- URL: https://www.wjgnet.com/1009-3079/full/v15/i20/2220.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i20.2220
人类SUZ12(suppressor of zeste 12, SUZ12)是PcG(polycomb group, PcG)基因家族中的一员, 在胚胎发育、细胞周期、细胞增殖和分化的调控中起着极其重要的作用. PcG家族是在进化中高度保守的、防止细胞表型发生改变而记忆转录状态的细胞记忆系统的重要组成部分, 参与细胞一致性的保持、细胞周期的调节以及肿瘤发生、发展[1-10]. 最近的研究发现SUZ12在不同的人类肿瘤包括结肠癌、乳腺癌和肝癌中表达明显上调[9], 因此可能是一种新的肿瘤基因治疗的分子靶点. 在本研究中, 我们建立了SYBR Green I实时荧光定量PCR检测人类SUZ12基因的方法, 以期为SUZ12的进一步研究奠定基础.
大肠杆菌E.coli DH5α由本室保存, pGEM-T和T4 DNA连接酶购自Promega公司, 胶回收试剂盒和质粒小量抽提纯化试剂盒购自上海华舜公司, 氨苄青霉素为华北制药公司产品, 胰蛋白胨和酵母提取物购自英国Oxoid公司, dNTP购自MBI公司, Taq Gold为ABI公司产品, 20×SYBR Green I for Real-time PCR购自上海开放科技发展有限公司, 引物及测序由上海博亚公司完成, 上游引物: 5'-AAACGAAATCGTGAGGATGG-3'; 下游引物: 5'-CCATTTCCTGCATGGCTACT-3', 其他各种化学试剂均为国产分析纯产品. 荧光定量PCR仪LightCycler和毛细管均为Roche公司产品. 以人类乳腺癌细胞系MCF-7总RNA所逆转录合成的cDNA为模板, 以上述引物进行普通RT-PCR, 产物克隆入pGEM-T载体, 送上海博亚公司测序证实后, 小量抽提纯化质粒pGEM-SUZ12, 紫外分光光度计测定质粒浓度0.485 g/L, 根据公式[质粒浓度(g/µL)/(660×质粒长度bp)]×6.022×1026(copies/L)换算出质粒DNA浓度为1.42×1014 copies/L, 进行梯度稀释, 依次为1.42×1011-1.42×104 copies/L.
20 µL定量PCR反应体系包括: 10×PCR缓冲液2 µL、dNTP(10 mmol/L) 0.4 µL、20×SYBR Green I液 1 µL、Taq Gold (1000 U/L) 1 µL、上游引物(10 µmol/L) 0.4 µL、下游引物(10 µmol/L) 0.4 µL、质粒DNA模板1 µL、MgCl2 (20 mmol/L) 4 µL、牛血清白蛋白BSA (1 g/L) 2 µL. 阴性对照用1 µL灭菌蒸馏水代替质粒DNA模板. 定量PCR扩增条件则为: 先94℃预变性3 min; 接着进行40个循环, 包括94℃变性5 s, 53℃退火5 s, 72℃延伸10 s后进行荧光检测, 其检测温度为78℃; 然后进行熔解曲线分析, 由70℃以0.1℃/s上升至95℃; 最后冷却至40℃. 为了进一步确认PCR反应的特异性, 将SUZ12扩增产物在25 g/L的琼脂糖凝胶中进行电泳. 一旦PCR产物的长度确认是正确的, 就只应用SYBR Green I 实时荧光PCR的熔解曲线中Tm监测反应的特异性. 将1.42×107 copies/L的标准品平行操作8次或在8 d内分别测定, 获取其批内变异系数(CV) 和日间CV.
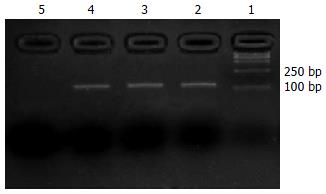
普通RT-PCR扩增SUZ12基因片段的产物长度为115 bp, 克隆入pGEM-T载体, 经测序证实, 与基因库序列一致.
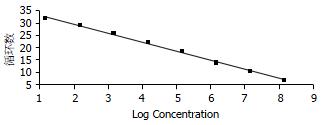
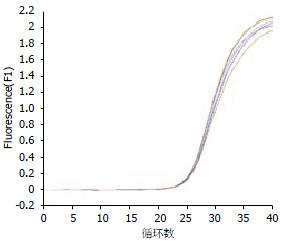
当质粒DNA浓度在1.42×104-1.42×1011 copies/L范围时, 曲线为一组典型的倒S型曲线(图1). 模板浓度越高, 可检测到荧光信号的循环数越少, 即其循环阈值(Ct)越小, Ct表示PCR循环过程中, 每个反应管内的荧光信号达到设定阈值时所经历的循环数; 随着循环数的增加, 荧光信号逐渐增强, 而当循环数达到一定程度时, 荧光强度达到平台. 标准曲线的横坐标为DNA浓度对应的Log值, 纵坐标为对应的Ct值. SUZ12的标准曲线为: CtSUZ12 = -3.68 log (DNA concentrate)+37.05, 其相关系数r为-1.00 (图2), 保证了Ct值和DNA浓度对应的Log值之间的线性相关, 即模板浓度与可检测的荧光信号的循环数之间呈负相关.
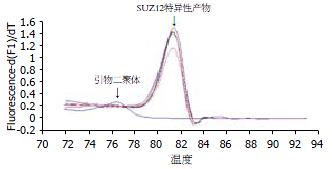
SUZ12特异性扩增产物对应的Tm为81.37±0.16℃, 而SUZ12引物二聚体的Tm为76.54±0.51℃, 因此我们将荧光检测温度定于两者之间为78℃, 以排除非特异性荧光的干扰. 熔解曲线分析(图3)和25 g/L琼脂糖凝胶电泳(图4)双重确认PCR产物的特异性, SUZ12扩增产物的Tm 81.37±0.16℃对应25 g/L琼脂糖凝胶电泳中的115 bp.
SYBR Green I实时定量PCR检测SUZ12, 1.42×107 copies/L标本的批内CV和日间CV分别为1.8%和2.8%(图5, 表1).
| 批内 | Ct1 | Ct2 | Ct3 | Ct4 | Ct5 | Ct6 | Ct7 | Ct8 | mean±SD | CV |
| 21.80 | 21.69 | 21.81 | 22.37 | 21.82 | 22.81 | 21.78 | 21.78 | 21.98±0.39 | 1.8% | |
| 日间 | Ct 1 d | Ct 2 d | Ct 3 d | Ct 4 d | Ct 5 d | Ct 6 d | Ct 7 d | Ct 8 d | mean±SD | CV |
| 21.8 | 22.3 | 23.2 | 22.3 | 21.8 | 22.6 | 21.9 | 23.4 | 22.47±0.60 | 2.8% |
SUZ12又称为KIAA0160, JJAZ1和ChET9, 是PcG基因家族中的EED-EZH2复合体中的一员, 后者参与HOX基因沉默、X染色体灭活和肿瘤转移等[1-10]. SUZ12是EED-SUZ12复合体发挥其内在的组蛋白甲基转移酶(histone methyltransferase, HMTase)活性所必需的成分之一[7,10]. 研究发现SUZ12基因是受双重启动子调控, 功能具有双向性; 其上游基因包括E2Fs, β-catenin等[9]. 在结肠癌、乳腺癌和肝癌的组织标本中SUZ12 mRNA的表达水平显著高于其对应的正常组织; 而在结肠癌细胞系中, 应用siRNA沉默SUZ12的表达, 发现一系列基因的表达发生改变[9], 提示SUZ12可能通过改变基因表达轮廓而调节肿瘤的表现型. 因此, SUZ12可能参与肿瘤的发生、发展, 而实时荧光定量PCR检测SUZ12方法的建立无疑为其在肿瘤中的进一步研究奠定基础.
目前最简单、经济、有效的实时荧光PCR方法就是通过嵌入双链DNA(dsDNAs)的荧光试剂如SYBR GreenⅠ等来检测PCR扩增产物[11-13]. 在游离状态下, SYBR GreenⅠ不发出荧光; 而在PCR的延伸阶段, SYBR GreenⅠ与dsDNAs相结合而发出荧光, 随着反应的进行, 荧光信号逐渐增强. 荧光信号的强度依赖于反应体系中现有的dsDNAs(包括特异性扩增产物和引物二聚体等)的量. 因此, 一旦PCR反应体系中出现非特异扩增, 就会影响到定量结果的可靠性与重复性. 在本研究中, 我们参考Ball et al[14]的建议, 在每一个PCR循环中延伸步骤后增加了一步, 即将温度提高后再检测反应体系中的荧光, 这个温度(78℃)大于引物二聚体的Tm 76.54±0.51℃而小于特异性扩增产物的Tm 81.37±0.16℃, 因而此时引物二聚体都变性成单链, 只检测到与特异性PCR产物结合的SYBR GreenⅠ所发出的荧光, 消除了引物二聚体的干扰, 降低了非特异性荧光, 有助于目标基因的准确定量. 另外, 为了进一步验证PCR反应的特异性, PCR产物同时进行熔解曲线分析和凝胶电泳双重确定. 在熔解曲线分析中, 温度由70℃缓慢上升(0.1℃/s)到95℃, 连续检测荧光; 在开始时, 所有DNA均退火结合成双链, 荧光信号最强; 而在产物Tm附近, 荧光信号则急剧下降. 不同序列或长度的PCR产物在不同的温度下熔解, 因此可观察到不同的峰值. 当只有特异性的PCR产物形成时, 在熔解曲线图中只可见单一的峰. Tm主要依赖于片段长度、序列组成、GC含量和反应中Mg2+浓度等因素. 在本研究中, SUZ12的PCR产物长115 bp, 其对应的Tm为81.37±0.16℃, 熔解温度均一, 峰的形状也较锐利; 而引物二聚体的Tm为76.54±0.51℃, 两者显著分开.
对于实时荧光PCR, 最为简单、准确的定量方法就是标准曲线法[15-16], 即用一系列已知浓度的标准品制作标准曲线, 在同等条件下目的基因测得的荧光信号量同标准曲线进行比较, 从而得到目的基因的量. 标准曲线是以起始拷贝数的对数为横坐标、Ct值为纵坐标; 理论上, 依次10倍稀释标准品所得的标准曲线, 其斜率应该接近-3.3. 在实际应用中, 当相关系数>0.95, 斜率在-3.0至-3.9之间的标准曲线都被认为是可行的[17]. 由于质粒大量制备方便、稳定、浓度高、定量准确, 还可应用于实验室内或不同实验室之间的定量分析, 故一般采用质粒作为标准品. 在本研究中, 我们应用重组质粒pGEM-SUZ12连续10倍稀释后得到的标准曲线为CtSUZ12 = -3.68 log(DNA Concentrate)+37.05, 相关系数r为-1.00, 都在公认的可接受范围内. 我们建立的SYBR GreenⅠ实时PCR检测SUZ12的方法, 能够检测低至14.2个拷贝的目的基因, 并最终产生可高达8个数量级(1.42×101-1.42×108)的动态检测范围; 在此范围内, 模板浓度与Ct之间的相关性良好. 重复性是判断实验结果优劣的另一种重要指标, 其主要判断指标之一为CV. SYBR Green I 实时定量PCR检测SUZ12, 1.42×107 copies/L标本的批内CV和日间CV分别为1.8%和2.8%, 均小于5%, 重复性较好.
因此, 本研究中所建立的SYBR GreenⅠ实时PCR定量检测SUZ12是一种快速有效、灵敏度高、特异性好、重复性佳、定量检测范围宽的方法, 用于研究SUZ12在肿瘤发生、发展、治疗以及预后中的作用具有重要的价值.
PcG基因首先作为同源盒基因(homobox, Hox)的抑制因子在果蝇中被发现, 迄今为止已发现30-40 种PcG基因, 统称为PcG基因家族. PcG家族蛋白不仅结构高度保守, 而且通过参与不同的信号通路, 调节不同的分子事件如自我更新/增殖、衰老/永生化等, 进而调节细胞的命运, 参与恶性肿瘤的发生、发展.
SUZ12参与胚胎发育、细胞周期调控、胚胎干细胞的分化等. SUZ12是PcG家族中的EED-SUZ12复合体发挥其内在的组蛋白甲基转移酶活性所必需的成分之一. SUZ12在不同的人类肿瘤包括结肠癌、乳腺癌和肝癌中表达明显上调, 可能是肿瘤基因治疗的分子靶点.
SYBR GreenⅠ实时PCR定量检测SUZ1 2, 快速有效、灵敏度高、特异性好、重复性佳、定量检测范围宽.
本研究中所建立的SYBR GreenⅠ实时PCR定量检测SUZ12的方法,用于研究SUZ12在肿瘤发生、发展、诊断、治疗以及预后中的作用具有重要的价值.
循环阈值(Ct)表示PCR循环过程中,每个反应管内的荧光信号达到设定阈值时所经历的循环数. Ct值越小, 表示PCR反应体系中的模板浓度越高.
本文建立了测定SUZ12的实时PCR方法, 是一篇较好的方法学研究文章, 具有潜在的临床应用前景. 研究方案设计合理、简明清晰, 研究方法可靠, 结果可信, 文字流畅, 表达简洁准确, 质量较高, 具有先进性和潜在的实用性.
编辑: 程剑侠 电编:张敏
| 1. | de la Cruz CC, Kirmizis A, Simon MD, Isono K, Koseki H, Panning B. The polycomb group protein SUZ12 regulates histone H3 lysine 9 methylation and HP1 alpha distribution. Chromosome Res. 2007;15:299-314. [PubMed] |
| 2. | Pasini D, Bracken AP, Hansen JB, Capillo M, Helin K. The polycomb group protein Suz12 is required for embryonic stem cell differentiation. Mol Cell Biol. 2007;27:3769-3779. [PubMed] |
| 3. | Squazzo SL, O'Geen H, Komashko VM, Krig SR, Jin VX, Jang SW, Margueron R, Reinberg D, Green R, Farnham PJ. Suz12 binds to silenced regions of the genome in a cell-type-specific manner. Genome Res. 2006;16:890-900. [PubMed] |
| 4. | Lee TI, Jenner RG, Boyer LA, Guenther MG, Levine SS, Kumar RM, Chevalier B, Johnstone SE, Cole MF, Isono K. Control of developmental regulators by Polycomb in human embryonic stem cells. Cell. 2006;125:301-313. [PubMed] |
| 5. | de la Cruz CC, Fang J, Plath K, Worringer KA, Nusinow DA, Zhang Y, Panning B. Developmental regulation of Suz 12 localization. Chromosoma. 2005;114:183-192. [PubMed] |
| 6. | Bracken AP, Dietrich N, Pasini D, Hansen KH, Helin K. Genome-wide mapping of Polycomb target genes unravels their roles in cell fate transitions. Genes Dev. 2006;20:1123-1136. [PubMed] |
| 7. | Pasini D, Bracken AP, Jensen MR, Lazzerini Denchi E, Helin K. Suz12 is essential for mouse development and for EZH2 histone methyltrans-ferase activity. EMBO J. 2004;23:4061-4071. [PubMed] |
| 8. | Lessard J, Sauvageau G. Polycomb group genes as epigenetic regulators of normal and leukemic hemopoiesis. Exp Hematol. 2003;31:567-585. [PubMed] |
| 9. | Kirmizis A, Bartley SM, Farnham PJ. Identification of the polycomb group protein SU(Z)12 as a potential molecular target for human cancer therapy. Mol Cancer Ther. 2003;2:113-121. [PubMed] |
| 10. | Cao R, Zhang Y. SUZ12 is required for both the histone methyltransferase activity and the silencing function of the EED-EZH2 complex. Mol Cell. 2004;15:57-67. [PubMed] |
| 11. | Vandesompele J, De Paepe A, Speleman F. Elimination of primer-dimer artifacts and genomic coamplification using a two-step SYBR green I real-time RT-PCR. Anal Biochem. 2002;303:95-98. [PubMed] |
| 12. | Schrader AJ, Lauber J, Lechner O, Heidenreich A, Hofmann R, Buer J. Application of real-time reverse transcriptase-polymerase chain reaction in urological oncology. J Urol. 2003;169:1858-1864. [PubMed] |
| 13. | Lekanne Deprez RH, Fijnvandraat AC, Ruijter JM, Moorman AF. Sensitivity and accuracy of quantitative real-time polymerase chain reaction using SYBR green I depends on cDNA synthesis conditions. Anal Biochem. 2002;307:63-69. [PubMed] |
| 14. | Ball TB, Plummer FA, HayGlass KT. Improved mRNA quantitation in LightCycler RT-PCR. Int Arch Allergy Immunol. 2003;130:82-86. [PubMed] |
| 15. | Ke LD, Chen Z, Yung WK. A reliability test of standard-based quantitative PCR: exogenous vs endogenous standards. Mol Cell Probes. 2000;14:127-135. [PubMed] |
| 16. | Vandenbroucke II, Vandesompele J, Paepe AD, Messiaen L. Quantification of splice variants using real-time PCR. Nucleic Acids Res. 2001;29:E68-68. [PubMed] |