修回日期: 2007-04-01
接受日期: 2007-04-13
在线出版日期: 2007-07-18
目的: 观察大鼠酒精性肝病组织病理形态学改变, 探讨细胞凋亡与细胞色素P4502E1的表达以及和氧化应激的关系.
方法: 用酒精灌胃法制备酒精性肝病大鼠模型, 模型组给予酒精8 g/kg, 每天分2次灌胃连续8 wk, 对照组给予等量的生理盐水灌胃. 实验8 wk末, 观察肝组织的病理形态学改变, 用原位末端标记法(TUNEL)检测肝细胞凋亡, 用免疫组化法检测肝组织中Caspase-3蛋白表达, 用全自动生化仪检测ALT和AST的含量, 用PCR法测定肝细胞色素P4502E1的基因表达, 分别用硫代巴比妥酸法(TBA法)和黄嘌呤氧化酶法测定肝组织丙二醛(MDA)的含量和超氧化物歧化酶(SOD)的活力.
结果: 模型组凋亡的肝细胞明显增多, 主要分布在中央静脉周围、点状和灶状坏死区; Caspase-3主要分布于中央静脉及肝细胞坏死灶周围细胞的胞质中. 模型组肝细胞凋亡指数(AI)和Caspase-3蛋白表达强度明显高于对照组(AI: 6.2%±1.7% vs 1.7%±0.8%; Caspase-3: 66.7% vs 9.5%, P<0.05, P<0.01). CYP2E1表达: 对照组c1基因频率为91.6%, c2基因频率为8.4%; 模型组c1基因频率为53.4%, c2基因频率为46.6%, 均有显著性差异(P<0.05). 长期酒精摄入大鼠血清MDA含量增加(41.53±7.43 μmol/L vs 15.72±2.06 μmol/L, P<0.05), SOD活力下降(353.12±61.02 kU/L vs 636.82±138.60 kU/L, P<0.05), 与酒精性肝病肝细胞凋亡程度有相关性(r = 0.644, r = -0.511).
结论: 长期酒精摄入可引起大鼠酒精性肝病及及肝功能损伤, 肝细胞凋亡明显增加. CYP2E1基因PstⅠ及RsaⅠRFLPs与酒精性肝病有关, 其中c2基因可能与大鼠酒精性肝病的发生有关. MDA含量和SOD活力在酒精性肝病的肝细胞凋亡过程及脂质过氧化反应中发挥重要作用.
引文著录: 金武丕, 权修权, 孟繁平, 崔香丹, 朴海今. 大鼠酒精性肝病细胞凋亡与细胞色素P4502E1和氧化应激的关系. 世界华人消化杂志 2007; 15(20): 2181-2185
Revised: April 1, 2007
Accepted: April 13, 2007
Published online: July 18, 2007
AIM: To observe the pathological changes and investigate the relationship between hepatocyte apoptosis, cytochrome P4502E1 (CYP2E1) and oxygen free radicals in alcoholic liver disease (ALD) in rats.
METHODS: Ethanol (400 mL/L) was administered at 8 g/kg body weight by gavage twice daily for 8 weeks in the ALD model group, and the control group received isovolumic saline by gavage. By the end of the eighth week, the serum activity of alanine aminotransferase and aspartate aminotransferase were detected by automatic biochemistry analyzer. The pathological changes in the liver were observed by light microscopy of HE-stained sections; hepatocyte apoptosis was detected by the TdT-mediated d-UTP nick end labeling (TUNEL) method; and expression of caspase-3 in the liver was detected by immunohistochemistry. Expression of serum CYP2E1 was determined by polymerase chain reaction, and maleic dialdehyde (MDA) level and superoxide dismutase (SOD) activity in serum were detected by the thiobarbituric acid (TBA) method.
RESULTS: TUNEL-positive cells were located around the central vein, spotty and focal necrosis area in the ALD group, and Caspase-3 was observed around the central vein and areas of hepatocellular necrosis. The apoptotic index (AI) and expression of caspase-3 in the ALD group were significantly higher than those in the control group (AI, 6.2% ± 1.7% vs 1.7% ± 0.8%; Caspase-3, 66.7% vs 9.5%, P < 0.05, P < 0.01). The allelic frequency of c1 and c2 subtypes of CYP2E1 gene in control group was 91.6% and 8.4%, respectively, and 53.4% and 46.6%, respectively, in the ALD group. There were significant differences between the two groups (both P < 0.05). The serum MDA content showed a positive correlation with hepatocyte AI (r = 0.644), and serum activity of SOD showed a negative correlation with AI (r = -0.511) in the ALD group.
CONCLUSION: Chronic alcohol administration induced ALD and liver dysfunction, and increased hepatocyte apoptosis. RsaⅠand Pst Ⅰrestriction fragment length polymorphisms (RFLPs) were related to ALD in rats, and the c2 gene might be related to development of ALD. The MDA content and SOD activity play an important role in the process of hepatocyte apoptosis and lipid peroxidation.
- Citation: Jin WP, Quan XQ, Meng FP, Cui XD, Piao HJ. Relationship between hepatocyte apoptosis, cytochome P4502E1 and oxidative stress in alcoholic liver disease in rats. Shijie Huaren Xiaohua Zazhi 2007; 15(20): 2181-2185
- URL: https://www.wjgnet.com/1009-3079/full/v15/i20/2181.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i20.2181
酒精性肝病(alcoholic liver disease, ALD)是由长期大量饮酒所致的慢性肝脏疾病, 近年来ALD的发病率呈逐年上升趋势, 酒精已成为继病毒性肝炎后导致肝损害的第2大病因[1]. 酒精及其代谢产物和代谢过程中产生的代谢混乱是导致酒精性肝病的重要原因. 酒精在肝内主要通过三酶系统被氧化[2]. CYP2E1是细胞色素P450的酒精诱导形式, 他在非乙醇脱氢酶氧化途径中起重要作用, 为酒精性肝病的主要发病机制[3]. 近年来, 氧化应激在酒精性肝病中的作用受到重视[4-5]. 我们通过酒精灌胃的方法建立动物模型, 进一步探讨肝细胞凋亡以及与之密切相关的CYP2E1, 氧化应激等因素在ALD的作用, 为今后的临床诊断及治疗提供基础资料.
♂Wistar大鼠由延边大学医学院动物科提供, 体质量为222.1±20.9 g. 原位细胞死亡检测试剂盒(北京中杉金桥生物技术有限公司), Caspase-3多克隆抗体、即用型SABC免疫组化染色试剂盒(武汉博士德生物工程有限公司), CYP2E1引物、PCR反应缓冲液、dNTP、Taq酶、PstⅠ和RsaⅠ内切酶(大连宝生物工程有限公司), 丙二醛(MDA)和超氧化物歧化酶(SOD)试剂盒(南京建成生物有限公司). 将70只大鼠随机分为2组: 对照组33只, 模型组37只. 模型组给予乙醇8 g/kg, 每天分2次灌胃连续8 wk, 对照组给予等量的生理盐水. 自由饮水, 饲以条杆状动物饲料. 实验8 wk末各组选30只麻醉后采血(分离血清冰冻待用)处死大鼠取肝(部分用40 g/L甲醛固定, 另一部分用液氮冰冻待用).
采用TUNEL法、免疫组化法(Caspase-3蛋白测定)检测肝凋亡细胞, 用PCR加酶切法测定细胞色素P4502E1基因型, 用硫代巴比妥酸(TBA)法测定血清MDA的含量及黄嘌呤氧化酶法测定SOD的活力.
统计学处理 采用SPSS软件, 数据以mean±SD表示, 进行单因素方差和χ2检验分析, P<0.05为两者之间有显著性差异.
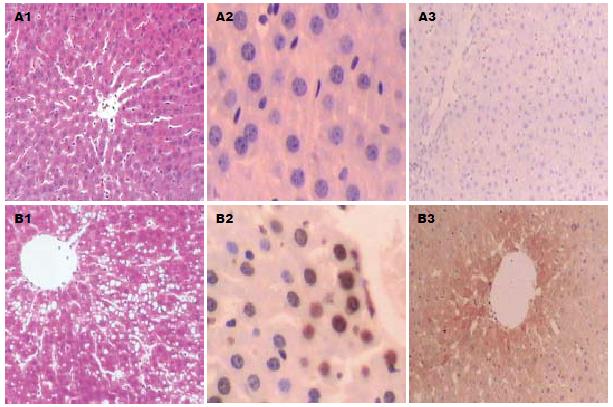
模型组肝窦结构不清, 肝细胞肿胀, 可见大小不等的脂肪空泡, 部分处可见点状、灶壮坏死, 对照组肝细胞以中央静脉为中心呈放射状排列, 肝窦结构清晰, 肝细胞无变性坏死(图1A1, 图1B1). 模型组凋亡的肝细胞散在分布于肝实质中, 小叶中居多, 主要位于小叶点状、灶状坏死区及其中央静脉周围, 对照组偶见肝细胞凋亡. Caspase-3蛋白主要分布于中央静脉及肝细胞坏死灶周围细胞的胞质中. 模型组凋亡指数高于对照组,差异有显著性(P<0.05, 表1, 图1A2, 图1B1); 模型组Caspase-3蛋白表达明显高于对照组, 差异有显著性(χ2 = 20.376, P<0.01, 表1, 图1A3, 图1B3).
| 指标 | 模型组 | 对照组 |
| AI(%) | 6.2±1.7a | 1.7±0.8 |
| ALT(U/L) | 107.4±16.6a | 48.4±10.5 |
| AST(U/L) | 232.1±52.9a | 102.9±14.1 |
| SOD(kU/L) | 353.12±61.02a | 636.82±138.60 |
| MDA(mmol/L) | 41.53±7.43a | 15.72±2.06 |
| Caspase-3 | ||
| (-) | 10 | 26 |
| (+) | 13 | 3 |
| (++) | 5 | 1 |
| (+++) | 2 | 0 |
| 表达率(%) | 66.7b | 9.5 |
| 基因情况 | ||
| A(c1/c1) | 8 | 25 |
| B(c1/c2) | 16 | 5 |
| C(c2/c2) | 6 | 0 |
| A(c1/c1%) | 26.7a | 83.3 |
| B(c1/c2%) | 53.3 | 16.7 |
| C(c2/c2%) | 20a | 0 |
| c1(%) | 53.4a | 91.6 |
| c2(%) | 46.6a | 8.4 |
酒精性肝病是指由于酒精摄入过量而导致的肝脏损害等一系列病变, 可分为轻型酒精性肝病、酒精性脂肪肝、酒精性肝炎、酒精性肝纤维化和酒精性肝硬化5种类型[6]. 近来研究表明酒精是肝细胞的一种凋亡诱导剂, 他在ALD的发生、发展过程中起着重要作用[7]. 细胞凋亡(apoptosis)是由体内外因素触发细胞内预存的死亡程序而导致的细胞死亡过程, 是细胞在生理或病理信号刺激下启动自身凋亡基因发生的主动自杀行为, 是保持组织自稳态的一个基本过程, 同时对于维持正常组织的细胞生长/死亡平衡至关重要. 凋亡细胞的清除与凋亡是保证肝脏功能的关键因素[8]. 我们通过灌胃的方法建立ALD大鼠模型, 并研究发现模型组大鼠肝细胞凋亡比例显著高于对照组, 多散在分布于肝实质中, 小叶中居多, 主要位于小叶点状、灶状坏死区及其中央静脉周围, 并且肝细胞凋亡程度与肝损伤的轻重密切相关, 与文献[9]报道一致. 因此可以认为肝细胞凋亡发生时常伴有肝细胞坏死, 两者均可引起肝损伤, 导致ALD的发生、发展.
Caspase-3是凋亡的重要执行者和哺乳动物细胞凋亡的关键蛋白酶[10-11]. 细胞凋亡是由各种凋亡刺激信号始动, 受细胞内源性基因、酶类和信号传导途径等调控的"瀑布式"激活过程. 其中蛋白酶与细胞凋亡密切相关, 凋亡的发生是一个复杂、由Caspase家族成员介导的蛋白酶级联反应过程. 在蛋白酶级联切割过程中, Caspase-3处于核心位置, 不同的蛋白酶分别切割Caspase-3酶原, 从而激活Caspase-3; 活化的Caspase-3又进一步切割不同的底物, 导致蛋白酶级联切割放大, 最终使细胞走向死亡[12]. 因此, Caspase-3称为死亡蛋白酶. 目前对于Caspase-3在酒精性肝病中表达的意义及其与其他凋亡基因在酒精性肝病发生、发展中的相互关系研究很少. 我们通过免疫组织化学检测发现酒精性肝病大鼠模型中Caspase-3蛋白表达增强.
细胞色素P450(cytochromeP450, CYP)是位于滑面内质网上的一组混合功能氧化酶系, 是肝脏代谢最主要的酶系之一, 其中细胞色素P4502E1(CYP2E1)与乙醇代谢密切相关. CYP2E1是一参与体内生理、病理和毒理过程, 有着广泛功能的代谢酶, 其表达水平往往与代谢活性相关且受体内外诸多因素的影响, 如饥饿、禁食及糖尿病均会导致体内CYP2E1水平增高, 其代谢底物可诱导该酶本身的表达等, 而人和大鼠的CYP2E1是由单基因调控[13], 并且所有CYP2E1的底物在人和动物中都是相同的[14], 因此, 研究动物的CYP2E1对人具有重要参考意义. 乙醇既为CYP2E1特异性代谢底物, 又对其表达具有诱导作用. 乙醇对CYP2E1的诱生有两种形式. 当血乙醇浓度低时, 通过增加mRNA翻译的效率或稳定翻译后蛋白而增加CYP2E1的活性, 当血乙醇浓度较高时, 则通过增强CYP2E1的基因转录使CYP2E1 mRNA翻译增加而使其活性增高[15]. CYP2E1具有基因多肽性, 可能与嗜酒者是否产生酒精性肝损伤有关. Tsutsumi et al[16]对日本的酒精性肝病患者的CYP2E1基因型进行研究, 发现84%酒精性肝病患者带有c2等位基因, 该基因频度比健康对照组或非乙醇性肝病组高2倍以上, 认为c2基因在酒精性肝病的发展中可能起决定作用. 本实验研究表明, 模型组中A基因型占26.7%, B基因型占53.3%, C基因型占20%, 即c1基因频率为53.4%, c2基因频率为46.6%. 对照组中A基因型占83.3%、B基因型占26.7%、即c1基因频率为91.6%、c2基因频率为8.4%. 模型组与对照组相比, c1基因频率明显降低, c2基因频率明显升高, 其差异有统计学意义(P<0.05). 因此, 考虑c2基因在乙醇性肝病的发病中起一定作用.
氧化应激(oxidative stress)是活性氧(ROS)产物增加和抗氧化剂屏障缺失引起的酒精性肝损伤的重要特征. 促氧物质增多和抗氧化物质减少的氧化应激可引起细胞内ATP衰竭和谷光甘肽(GSH)水平下降等一系列改变, 这种改变在中央静脉周围远较门脉周围严重, 最终导致肝细胞死亡. 正常情况下, 体内存在自由基的清除系统, 使自由基处于不断产生和不断被清除的动态平衡中. 一旦机体内保持平衡的因素被破坏, 自由基强大的生物活性就转变为对生物分子的损伤, 引起体内新陈代谢发生混乱及一系列自由基连锁反应加剧, 导致RNA、DNA、蛋白、酶、生物膜的氧化和过氧化损伤, 从而诱发疾病. 机体为避免受到内源性或外源性活性氧的损伤, 在进化过程中形成了一整套代谢ROS的抗氧化系统, 主要由酶和抗氧化剂组成. SOD是生物体内最为重要的抗氧化酶之一, 是清除ROS的第一道防线. 主要清除O2-及防止O2-直接或间接转变为其他形式的自由基, 防止生物膜脂质过氧化损伤. 我们采用400 mL/L乙醇灌胃8 wk后可以看出乙醇灌胃组血清中MDA明显升高, 则SOD明显降低, 且与正常对照组比较有差异显著性, 表明长期乙醇灌胃的动物体内脂质过氧化产物增多, 而且与细胞凋亡程度呈正相关; 长期灌酒后大鼠体内抗氧化产物明显减少, 与细胞凋亡程度呈负相关.
长期乙醇摄入可引起大鼠酒精性肝病及及肝功能损伤, 肝细胞凋亡明显增加. CYP2E1基因PstⅠ及RsaⅠ RFLPs与乙醇性肝病有关, 其中c2基因可能与大鼠酒精性肝病的发生有关. MDA含量和SOD活力在酒精性肝病的肝细胞凋亡过程及脂质过氧化反应中发挥重要作用.
酒精性肝病是由于长期大量饮酒所致的慢性肝脏疾病, 在欧美国家发病率较高, 是西方发达国家常见肝病之一. 近年来, 随着我国居民生活水平的提高, 嗜酒者增多, ALD的发病率呈逐年上升趋势, 酒精已成为继病毒性肝炎后导致肝损害的第2大病因. 吉林省延边地区酒精性肝病发病率较高.
酒精性肝病发病机制较复杂,尚未完全明了. CYP2E1是细胞色素P450的酒精诱导形式, 他在非乙醇脱氢酶氧化途径中起重要作用, 为酒精性肝病的主要发病机制. 近年来, 氧化应激在酒精性肝病中的作用受到重视.
本实验通过灌胃的方法建立ALD大鼠模型发现长期乙醇摄入肝细胞凋亡明显增加. CYP2E1基因Pst Ⅰ及Rsa Ⅰ RFLPs与酒精性肝病有关, 其中c 2基因可能与大鼠酒精性肝病的发生有关. MDA含量和SOD活力在酒精性肝病的肝细胞凋亡过程及脂质过氧化反应中发挥重要作用.
本文通过乙醇灌胃的方法建立动物模型, 进一步探讨肝细胞凋亡以及与之密切相关的CYP2E1, 氧化应激等因素在 ALD的作用, 为今后的临床诊断及治疗提供基础资料.
1 酒精性肝病(ALD): 是指由于乙醇摄入过量而导致的肝脏损害等一系列病变, 可分为轻型ALD、酒精性脂肪肝、酒精性肝炎、酒精性肝纤维化和酒精性肝硬化5种类型.2 CYP2E1: 是一参与体内生理、病理和毒理过程, 有着广泛功能的代谢酶, 其表达水平往往与代谢活性相关且受体内外诸多因素的影响. CYP2E1是细胞色素P450的乙醇诱导形式, 他在非乙醇脱氢酶氧化途径中起重要作用, 为酒精性肝病的主要发病机制.
本文研究了大鼠酒精性肝病细胞凋亡与细胞色素P4502E1 和氧化应激的关系, 选题较新颖, 研究内容较丰富, 文笔较好, 有一定的学术价值.
编辑: 何燕 电编:张敏
| 2. | 卿 笃信, 凌 奇荷. 酒精代谢酶与酒精性肝病的关系研究进展. 国外医学•生理、病理科学与临床分册. 2003;23:310-313. |
| 3. | Koop DR, Coon MJ. Ethanol oxidation and toxicity: role of alcohol P-450 oxygenase. Alcohol Clin Exp Res. 1986;10:44S-49S. [PubMed] |
| 4. | Hoek JB, Pastorino JG. Ethanol, oxidative stress, and cytokine-induced liver cell injury. Alcohol. 2002;27:63-68. [PubMed] |
| 5. | Arteel GE. Oxidants and antioxidants in alcohol-induced liver disease. Gastroenterology. 2003;124:778-790. [PubMed] |
| 7. | Stewart S, Jones D, Day CP. Alcoholic liver disease: new insights into mechanisms and preventative strategies. Trends Mol Med. 2001;7:408-413. [PubMed] |
| 8. | Neuman MG. Apoptosis in diseases of the liver. Crit Rev Clin Lab Sci. 2001;38:109-166. [PubMed] |
| 10. | Feldstein AE, Canbay A, Angulo P, Taniai M, Burgart LJ, Lindor KD, Gores GJ. Hepatocyte apoptosis and fas expression are prominent features of human nonalcoholic steatohepatitis. Gastroenterology. 2003;125:437-443. [PubMed] |
| 11. | Feldstein AE, Canbay A, Guicciardi ME, Higuchi H, Bronk SF, Gores GJ. Diet associated hepatic steatosis sensitizes to Fas mediated liver injury in mice. J Hepatol. 2003;39:978-983. [PubMed] |
| 12. | Srinivasula SM, Fernandes-Alnemri T, Zangrilli J, Robertson N, Armstrong RC, Wang L, Trapani JA, Tomaselli KJ, Litwack G, Alnemri ES. The Ced-3/interleukin 1beta converting enzyme-like homolog Mch6 and the lamin-cleaving enzyme Mch2alpha are substrates for the apoptotic mediator CPP32. J Biol Chem. 1996;271:27099-27106. [PubMed] |
| 13. | Naveau S, Emilie D, Balian A, Grangeot-Keros L, Borotto E, Portier A, Giraud V, Capron F, Galanaud P, Chaput JC. Plasma levels of soluble tumor necrosis factor receptors p55 and p75 in patients with alcoholic liver disease of increasing severity. J Hepatol. 1998;28:778-784. [PubMed] |
| 14. | Ziol M, Tepper M, Lohez M, Arcangeli G, Ganne N, Christidis C, Trinchet JC, Beaugrand M, Guillet JG, Guettier C. Clinical and biological relevance of hepatocyte apoptosis in alcoholic hepatitis. J Hepatol. 2001;34:254-260. [PubMed] |
| 15. | Oneta CM, Simanowski UA, Martinez M, Allali-Hassani A, Pares X, Homann N, Conradt C, Waldherr R, Fiehn W, Coutelle C. First pass metabolism of ethanol is strikingly influenced by the speed of gastric emptying. Gut. 1998;43:612-619. [PubMed] |
| 16. | Tsutsumi M, Takada A, Wang JS. Genetic polymorphisms of cytochrome P4502E1 related to the development of alcoholic liver disease. Gastroenterology. 1994;107:1430-1435. [PubMed] |