修回日期: 2007-04-11
接受日期: 2007-04-21
在线出版日期: 2007-07-08
目的: 探讨RNA干扰技术沉默STAT3基因表达对人肝癌细胞的抑制作用及对相关生长调控基因的调节.
方法: 构建pSilencer 3.0-H1-siRNA-STAT3重组质粒, 转染人肝癌细胞株SMMC 7721, 采用MTT法观察重组质粒对肝癌细胞的生长抑制, RT-PCR和Western blot及免疫组化法分别观察STAT3基因和蛋白水平的变化, 同时检测 survivin, c-myc, VEGF, p53, caspase3生长调控基因的mRNA, 并用流式细胞技术(FCM)及AO/EB染色方法观察细胞凋亡.
结果: pSilencer 3.0-H1-siRNA-STAT3重组质粒对肝癌细胞的生长有抑制作用, 实验组48 h和72 h抑制率分别为59.32%, 76.49%, 与空白组及阴性组细胞相比有显著性差异(P<0.01); 在重组质粒组, STAT3基因mRNA及蛋白水平表达降低, surviving, VEGF的mRNA表达下调, p53, caspase3的mRNA表达上调(P<0.01), c-myc的mRNA表达却无明显改变; 重组质粒可诱导SMMC 7721细胞凋亡, 凋亡率达21.6%(P<0.01), 细胞周期分析显示细胞阻滞于G2期.
结论: pSilencer 3.0-H1-STAT3-siRNA可能通过下调基因survivin和VEGF mRNA表达, 上调p53和caspase3 mRNA表达来抑制STAT3基因在人肝癌细胞中的表达.
引文著录: 李静, 朴云峰, 蒋政, 丁百静. siRNA沉默STAT3基因对人肝癌细胞的抑制及对相关生长调控基因的调节. 世界华人消化杂志 2007; 15(19): 2101-2107
Revised: April 11, 2007
Accepted: April 21, 2007
Published online: July 8, 2007
AIM: To explore the effect of silencing STAT3 expression by siRNA on the growth of human hepatocellular carcinoma cells and the regulation of genes related to growth control.
METHODS: We reconstructed the recombinant plasmid of pSilencer 3.0-H1-STAT3-siRNA-GFP, which was then transfected into SMMC 7721 cells. MTT assay was applied to investigate the proliferation of transfected SMMC 7721 cells, and the protein expression level of STAT3 was determined by Western blotting and immunohistochemical staining. The transcription of the STAT3 gene was detected by semi-quantitative reverse transcription-polymerase chain reaction (RT-PCR), mRNA expression for growth-control-related genes such as survivin, c-myc, VEGF, p53 and caspase3 was detected in transfected cells at the same time. Flow cytometry (FCM) and AO/EB double staining were used to observe apoptosis in transfected cells.
RESULTS: MTT assay demonstrated that cell growth was inhibited in transfected cells, and the 48-hour and 72-hour inhibition rates of the test group were 59.32% and 76.49%, respectively. There were significant differences compared to those of the mock-treated and negative groups (P < 0.01). The results of RT-PCR and Western blotting showed that mRNA and protein levels of STAT3 declined markedly in transfected cells. Genes related to growth control also changed at the mRNA level, and expression of survivin and VEGF in transfected cells was obviously reduced. The expression of p53 and caspase3 in transfected cells increased. The ratios of the above expression products in the test group were significantly different compared to those of the negative and mock-treated groups, while the expression of c-myc in transfected cells did not change. The results of FCM and AO/EB double staining indicated that there was apparent cell apoptosis in the test group; the apoptosis rate was 21.6% (P < 0.01). There were significant differences compared to those of the mock-treated and negative groups. Analysis of the cell cycle showed that cells were inhibited in the G2 stage.
CONCLUSION: The recombinant plasmid of pSilencer 3.0-H1-STAT3-siRNA-GFP can significantly inhibit the expression of the STAT3 gene in SMMC 7721 cells. The mechanism may be related to the down-regulation of survivin and VEGF mRNA expression and the up-regulation of p53 and caspase3 mRNA expression.
- Citation: Li J, Piao YF, Jiang Z, Ding BJ. Silencing of STAT3 expression by siRNA suppresses the growth of human hepatocellular carcinoma cells and regulates genes related to growth control. Shijie Huaren Xiaohua Zazhi 2007; 15(19): 2101-2107
- URL: https://www.wjgnet.com/1009-3079/full/v15/i19/2101.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i19.2101
原发性肝癌(绝大部分是肝细胞癌, HCC)在全球癌症死亡率中居第3位, 在我国为第2位癌症死因[1]. 肝癌的发生是一个多基因参与, 通过不同基因在不同时相的差异表达进行调控的复杂过程[2]. STAT3是转录信号传导子与激活子家族(signal transducers and activators of transcription: STAT)的重要成员, 其信号传导通路与细胞的增殖、分化及凋亡密切相关, 该通路持续激活可导致细胞异常增殖和恶性转化, 目前将其定义为癌基因[3]. 我们拟通过RNA干涉技术抑制STAT3基因在人肝癌细胞SMMC 7721中的表达, 观察其对肝癌细胞生长及凋亡的影响, 并通过对STAT3的相关基因survivin, c-myc, VEGF, p53, caspase3基因表达变化的分析揭示其作用机制, 为肝癌治疗提供新的靶点及技术.
Anti-P-STAT3兔抗人多克隆抗体, β-actin兔抗人多克隆抗体, 辣根过氧化物酶标记的羊抗兔二抗购自Santa Cruz公司, Anti-STAT3及SP组化试剂盒购自武汉博士德公司. 逆转录试剂盒, 转染试剂Lipofectamine 2000购于Invitrogen公司, Taq DNA聚合酶购于Genomy公司, IMDM, G418, PI, 胎牛血清购自Gibco公司, MTT购自Sigma公司, B型超纯质粒小样快速提取试剂盒(去内毒素)购于北京博大泰克公司, 常规试剂由吉林大学前列腺疾病防治研究中心提供. 人肝癌细胞SMMC 7721由吉林大学基础医学院病理生理教研室保存, 取处于生长对数期的细胞. pSilencer3.0-H1-STAT3-siRNA及pSiliencer1.0-U6-STAT3-siRNA-GFP均由吉林大学前列腺疾病防治研究中心构建并惠赠, STAT3-siRNA的序列为: 5'-GCAGCAGCTGAACAACATGTTCAAGAGACATGTTGTTCAGCTGCTGCTTTTT -3'(forward), 5'-AATTAAAAAGCAGCAGCTGAACAACATGTCTCTTGAACATGTTGTTCAGCTGCTGCTGCGGCC -3'(reverse). 经EcoRⅠ和Hind Ⅲ双酶切, 分别取pSilencer3.0-H1与STAT3-siRNA-GFP, 连接, 连接产物转化, 挑取阳性克隆, 测序鉴定, 构建重组质粒pSilencer3.0-H1-STAT3-siRNA-GFP. 将与人的任何基因序列均无同源关系的DNA序列(scrambled)按上述方法构建重组质粒作为阴性对照. 质粒提取按说明书进行, 经λDNA定量0.5 g/L者待用. 酶标仪、PCR仪(Sony, Japan), 荧光显微镜、倒置显微镜(Olympus, Japan), 电泳仪和蛋白质电泳装置及转移系统(Bio-Rad, America).
1.2.1 MTT法: 取对数生长期细胞, 0.25%胰酶消化后, 调制细胞浓度为8×103/孔接种于96孔平底培养板, 将其分为3组, 分别为空白组(未治疗组), 阴性对照组, 重组质粒实验组, 待细胞生长至80%-90%融合时进行转染, 剂量为质粒0.2 μg加Lipofectamine 2000 0.5 μL培养至68 h, 在相差显微镜下观察拍照后, 各孔加入浓度为5 g/L MTT(用PBS新鲜配制)20 μL, 温箱孵育4 h, 轻轻吸去上清, 每孔加入分析纯DMSO100 μL, 震荡10 min, 用酶标仪检测各孔的吸光度值(A570), 计算细胞的生长抑制率. 共重复3次. 细胞生长抑制率(%) = (1-实验组/对照组)×100%.
1.2.2 细胞转染: 取处于生长对数期的细胞按1×106个接种于100 mL培养瓶中. 细胞分为3组: 空白组, 阴性对照组, 重组质粒治疗组. 待细胞生长至90%-95%融合时, 分组进行转染, 将质粒6 mg溶于IMDM(17.7 g/L)500 μL, 轻轻混匀, 制成溶液A; 将Lipofectamine 2000 15 mL溶于终体积IMDM(17.7 g/L)500 μL中, 轻轻混匀, 室温5 min, 制成溶液B; 溶液A加入溶液B, 轻轻混匀, 制成溶液C, 置室温20 min以使DNA-Lipofectamine 2000复合物形成; 将贴壁细胞用IMDM洗3遍后, 加入C液, 37℃, 50 mL/LCO2培养箱培养, 4 h后换含100 mL/L胎牛血清的IMDM 5 mL继续培养. 转染后72 h, 相差显微镜观察细胞生长情况, 收集细胞备用.
1.2.3 RT-PCR: 收获的细胞按试剂说明书完成RNA的提取, 紫外分光光度计法定量后取总RNA10 µg逆转录为cDNA, PCR条件: 94℃, 5 min; 94℃, 30 s; 56℃, 30 s; 72℃, 45 s; 72℃, 7 min, 30循环, 25 µL体系. 同时检测c-myc, p53, survivin, VEGF, caspase3, 以β-actin为内参. PCR产物以20 g/L琼脂糖凝胶电泳, EB染色, 应用天能Gis凝胶成像系统分析, PCR产物量以光密度/面积表示, 以STAT3产物量/β-actin产物量的比值为最终结果. 实验共重复3次. 引物序列: STAT3: Sense 5'-TTGCCAGTTGTGGTGATC-3', Antisence 5'-AGACCCAGAAGGAGCCGC-3'; β-actin: Sense 5'-AAGTACTCCGTGTGGATCGG-3', Antisence 5'-ATGCTATCACCTCCCCTGTG-3', 引物均由上海生工公司合成.
1.2.4 Western blot法: 收获的细胞, 加入超声裂解缓(50 mmol/LNaH2PO4, 100 mmol/LTris-HCl, 250 mmol/LNaCl, 100 mg/L, PMSF1 mg/L, Aprotitin, pH8.0), 200-300W超声裂解, 每次10 s, 间隔10s, 共10次. 12 000 r/min 4℃离心, 40 min, 上清即为总蛋白粗提液. 应用Bio-rad标准曲线蛋白定量, 总蛋白40 μg加入等体积2×上样缓冲夜混匀后煮沸变性5 min, 蛋白分离电泳采用120 g/L十二烷基磺酸钠-聚丙烯酰胺凝胶, 电泳后采用半干法转膜至PVDF膜, Anti-P-STAT3及β-actin兔抗人多克隆抗体浓度为1:200, 辣根过氧化物酶标记的羊抗兔二抗浓度为1:2000, 显色应用DAB. 应用天能Gis凝胶成像系统分析, 蛋白量以吸光度/面积表示, 以STAT3蛋白量/β-actin蛋白量的比值为最终结果. 实验共重复三次.
1.2.5 细胞免疫组化法: 石取处于生长对数期的细胞按1×105个/孔接种于铺有载玻片的24孔板, 细胞生长80%-90%融合时, 分组(空白组, 阴性对照组, 重组质粒治疗组)进行转染, 于48 h后取出盖玻片, 荧光显微镜下观察拍照后用40 g/L多聚甲醛固定30 min, PBS洗3次, 蒸馏水洗3次, Triton-X 100(0.25%)洗10 min, PBS洗5 min×3次; 其余步骤按免疫组织化学染色说明书操作. 阳性结果为细胞胞质或胞核棕黄着色, 随机选取5个高倍镜视野, 计数阳性细胞占所研究细胞的15%以上即为阳性.
1.2.6 流式细胞术(FCM): 取分别收集转染48 h后的细胞1×106个, 离心, 用冷PBS悬浮细胞, 1000 r/min离心10 min, 清洗2遍, 弃上清, 将细胞用1 mL注射器快速推入700 mL/L冷乙醇中, 4℃固定12 h以上. PBS洗2次, 调整细胞密度为1×109/L, 用RNase消化后, 加入50 mg/L 1.5 mL PI对DNA进行染色. 混匀后上流式细胞仪FCM做单参数分析, 实验数据用累积曲线分割法计算各期细胞所占比例. 实验共重复3次.
1.2.7 AO/EB双染色: 分别收集转染48 h后的细胞, 制备单细胞悬液, 调细胞密度为1×1010/L, 取细胞悬液25 μL, 加100 mg/LAO染液2 μL及100 mg/L EB染液2 μL, 滴于载玻片, 盖片封片后荧光显微镜直接观察, 于20 min内计数500个细胞. 正常细胞显绿色/黄绿色荧光, 早期凋亡细胞显黄色荧光, 晚期凋亡细胞显红色荧光, 细胞坏死呈不均匀的橙红色荧光.
统计学处理 数应用SPSS12.0软件行相关数据分析, 计量资料采用mean±SD表示; 两组均数的比较用t检验. 以P<0.05为显著性.
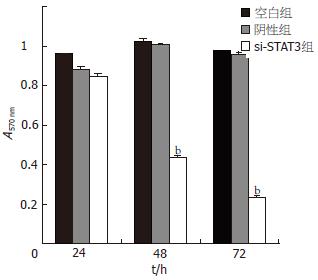
MTT结果显示, 阴性对照组细胞生长速度略低于空白组, 重组质粒治疗组细胞生长明显慢于空白组及阴性组, 生长抑制率24, 48, 72 h分别为11.69%, 59.32%, 76.49%, 经t test分析, 48 h及72 h组与空白组细胞相比均有显著性差异(t = 4.48E-09, t = 36E-05, bP<0.01, 图1).
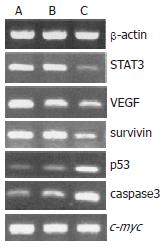
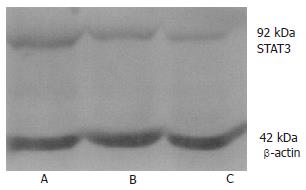
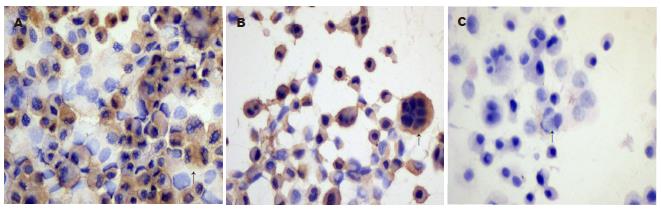
7721细胞STAT3表达 RT-PCR结果显示, 重组质粒治疗组STAT3, VEGF, survivin基因的mRNA表达明显降低, p53, caspase3基因的mRNA表达明显增高, c-myc基因的mRNA表达无明显变化. STAT3, VEGF, survivin, p53, caspase3, c-myc产物量/β-actin的比值经t检验, 除c-myc基因外, 治疗组与空白组、阴性组相比均有显著差异(STAT3: t = 8.25E-06, t = 1.41E-05; VEGF: t = 6.40E-07, t = 1.07E-06; survivin: t = 1.12E-08, t = 1.16E-05; p53: t = 1.98E-08, t = 7.70E-08; caspase3: t = 8.09E-07, t = 1.98E-06; P<0.01, 表1, 图2). Western blot结果显示, 重组质粒治疗组STAT3蛋白表达亦明显减弱, STAT3蛋白量/β-actin蛋白量的比值分别为0.784±0.01, 0.720±0.01, 0.334±0.01, 经t检验分析, 有显著性差异(t = 4.11E-08, t = 1.25E-07; P<0.01, 图3). 细胞免疫组化结果显示, 空白组及阴性组可见大量细胞呈强阳性, 而实验组仅见部分细胞呈弱阳性(图4).
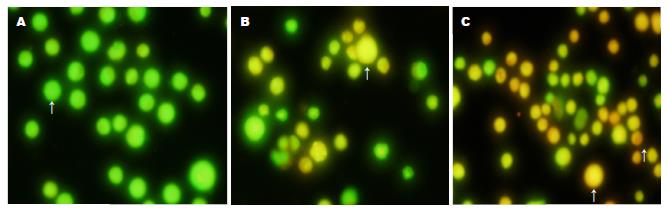
7721细胞凋亡 FCM结果显示重组质粒治疗组细胞出现明显的细胞凋亡峰, 凋亡率达21.6%, 经t检验与空白组及阴性组相比有显著差异(t = 4.11E-08, t = 1.25E-07, P<0.01). 细胞周期分析显示治疗组细胞出现G2期阻滞, 经t检验, 治疗组S期与G2期细胞数与空白组及阴性组相比有显著差异(S: t = 2.51E-06, t = 5.74E-05, G2: t = 4.6E-06, t = 6.06E-05, P<0.01, 表2). AO/EB双染色结果空白组及阴性组细胞呈绿色或黄绿色荧光, 实验组细胞可见较多黄色荧光, 偶见红色荧光, 提示实验组细胞较多呈早中期凋亡(图5).
STAT3是1994年作为白细胞介素-6(IL-6)信号传递中的急性反应因子被发现并被纯化[4], STAT3 mRNA广泛表达于不同类型的细胞和组织中, 其所参与的信号传导通路与细胞的增殖分化及凋亡密切相关, 越来越多的证据支持STATs在肿瘤形成过程中起重要作用, 尤其是STAT3和STAT5[5-7]. 目前国内外关于STAT3在人原发性肝癌中的研究尚不多见, 有报道在肝部分切除术后的再生肝脏中, STAT3转录复合物迅速激活[8-9]. 而对IL-6和TNFR-I缺乏的鼠实行肝部分切除术后, 检测不到STAT3激活, 这些鼠的肝脏不能再生. Yamada et al[10]据此推测, TNF-nuclear factor κB (NF κB)-IL-6-STAT3通路在肝细胞增殖中发挥重要的调节作用. 最早的有关STAT3与肝癌的研究见于Sánchez et al[11]的报道, 他们采用化学方法诱导大鼠产生肝癌, 检测STAT3的活性变化, 结论为STAT3信号转导通路的活化是肝癌生长所必需的, STAT3可成为肝癌治疗的潜在的新靶点. Pan et al[12]报道, 检测肝癌细胞系中345种转录因子, 发现7种活性异常因子, 其中5种活性增高, 包括c-myc, HIF-1a, STAT3, Sp1等. Miyoshi et al[13]报道, HCV病毒核心蛋白下调SOCS-1表达, 提高STAT3的活化, 从而改变细胞间信号传导通路, 在HCV感染导致肝癌发生的过程中可能起重要作用. Niwa et al[14]报道, 甲基化沉默SOCS-3可通过提高JAK/STAT和FAK信号传导促进肝癌细胞生长和迁移, 甲基化通常发生在CpG岛, 包含STAT3的DNA结合位点, 恢复SOCS-3表达可抑制STAT3磷酸化和细胞生长. 我们的前期研究证实, 在15例人原发性肝癌组织及癌旁组织中存在STAT3基因的高表达, 包括转录水平及蛋白表达水平的增高, 与正常肝组织有显著差异, 提示STAT3的异常激活可能发生在肝癌的早期, 同时检测的下游基因c-myc, survivin及VEGF基因在肝癌及癌旁组织中的表达亦增高, 而p53基因的表达在肝癌及癌旁组织中则降低, 提示在肝癌的发生发展过程中, STAT3的异常增高, 可启动其下游基因的持续活化, 并阻断了某些重要抑癌基因的活性, 因而STAT3基因可望成为肝癌治疗的新靶点.
siRNA(small interfering RNAs, siRNAs)是一种短片断双链RNA分子, 能够以同源互补序列的mRNA为靶目标降解特定的mRNA, 导致其相应的基因沉默, 这种转录后基因沉默机制(post-transcriptional gene silencing, PTGS)被称为RNA干扰(RNAi)[15]. 近年siRNA成功转入活体内的进展使得人们越来越期待siRNA药物能成为精力充沛的"魔术子弹", 应用于人类肿瘤、病毒感染、寄生虫感染等的治疗[16]. 国内已有应用RNAi技术成功抑制端粒逆转酶, c-myc, surviving等基因在肝癌细胞中表达的报道[17-19], 尚未见应用RNAi技术沉默STAT3基因对肝癌细胞的抑制作用及机制的报道, 我们应用针对人的STAT3基因的siRNA构建表达载体pSilencer3.0-H1-STAT3-siRNA-GFP, 转染人肝癌细胞株SMMC 7721, 结果表明重组质粒在mRNA及蛋白水平均可抑制STAT3基因表达, 并下调相关基因survivin, VEGF基因的mRNA表达, 上调p53, caspase3基因的mRNA表达, 对c-myc基因的mRNA表达无影响, 对肝癌细胞的增殖活性有抑制作用, 并可诱导肝癌细胞凋亡, 细胞阻滞于G2期. survivin为凋亡蛋白抑制因子, 在凋亡和细胞周期的基因调控中发挥重要作用[20], VEGF是强效力的促血管生成因子, 可促进肿瘤的血管生成, 与肿瘤的发生发展及转移关系密切[21], p53基因是重要的促凋亡因子, 有报道STAT3在体内及体外实验中均可与p53启动子结合, 其DNA结合位点的特异性突变可影响p53基因的活性[22]. 因而可以推断通过siRNA抑制STAT3基因在肝癌中的表达, 可相应抑制其下游基因的活化, 并恢复某些重要抑癌基因的活性, 使肿瘤细胞的增殖受限, 凋亡增加, 从而发挥其抗肿瘤作用. 本研究中c-myc基因作为STAT3基因的下游基因, 并未随其表达下降而下调, 而本研究室在应用同样序列的siRNA抑制STAT3基因在前列腺癌、黑色素瘤等肿瘤中的表达时[23], c-myc基因表达均下降, 这提示在肝癌细胞中c-myc基因表达的调控有所不同, 有待继续研究. 我们在研究中还注意到阴性组的细胞在转染后也会出现一些变化, 如部分细胞形态改变, 基因表达也有变化, 虽然与空白组相比无显著性差异, 但提示转染试剂及携有无关序列的表达载体对细胞还是存在一定的毒性作用, 另外, 尽管我们选用了效果很好的Lipofectamine 2000转染试剂, 转染率最高时也仅为22%, 而实验结果已达到实验组与空白组有显著差异的程度, 因此, 如能有效提高转染效率及降低毒性, 将使以siRNA为主的基因重组药物发挥更理想的治疗作用.
我们认为, 应用RNAi技术可抑制STAT3基因在肝癌细胞中的表达, 人工合成的STAT3-siRNA-GFP可通过抑制肝癌细胞的增殖、促进肝癌细胞的凋亡而发挥抗肿瘤作用, STAT3基因可成为肝癌治疗中重要的靶点.
STAT3基因是转录信号传导子与激活子家族的重要成员, 多项研究证实STAT3的酪氨酸磷酸化在多种肿瘤中普遍存在, 因此以STAT3为靶分子治疗可以从多途径攻击肿瘤.RNA干扰(RNAi)是通过短片断双链RNA(siRNA)引起同源mRNA降解, 致相应基因沉默, 广泛应用于抗肿瘤研究.
研究利用RNAi技术沉默STAT3基因在人肝癌细胞SMMC7721中的表达, 观察其对肝癌细胞生长及凋亡的影响, 并通过对相关调控基因表达变化的分析揭示其作用机制, 为肝癌治疗提供新的靶点及技术, 国内外尚未见相关报道.
目前原发性肝癌在我国癌症死因中占第2位. 而肝癌的发生是一个多基因参与的复杂过程中, 我们应用人工合成的STAT3-siRNA-GFP可抑制肝癌细胞的增殖. 促进肝癌细胞的凋亡而发挥抗肿瘤作用.
本文利用RNA干扰技术沉默STAT3基因表达, 研究STAT3表达下调对人肝癌细胞的抑制作用及分子机制. 立意创新, 设计合理, 数据可信, 有较强的可读性和科学性.
编辑: 程剑侠 电编:张强
| 2. | Ozturk M. Genetic aspects of hepatocellular carcinogenesis. Semin Liver Dis. 1999;19:235-242. [PubMed] |
| 3. | Bhatia M, Wong FL, Cao Y, Lau HY, Huang J, Puneet P, Chevali L. Pathophysiology of acute pancreatitis. Pancreatology. 2005;5:132-144. [PubMed] |
| 4. | Lutticken C, Wegenka UM, Yuan J, Buschmann J, Schindler C, Ziemiecki A, Harpur AG, Wilks AF, Yasukawa K, Taga T. Association of transcription factor APRF and protein kinase Jak1 with the interleukin-6 signal transducer gp130. Science. 1994;263:89-92. [PubMed] |
| 5. | Takeda K, Clausen BE, Kaisho T, Tsujimura T, Terada N, Forster I, Akira S. Enhanced Th1 activity and development of chronic enterocolitis in mice devoid of Stat3 in macrophages and neutrophils. Immunity. 1999;10:39-49. [PubMed] |
| 6. | Ni Z, Lou W, Leman ES, Gao AC. Inhibition of constitutively activated Stat3 signaling pathway suppresses growth of prostate cancer cells. Cancer Res. 2000;60:1225-1228. [PubMed] |
| 7. | Song JI, Grandis JR. STAT signaling in head and neck cancer. Oncogene. 2000;19:2489-2495. [PubMed] |
| 8. | Cressman DE, Diamond RH, Taub R. Rapid activation of the Stat3 transcription complex in liver regeneration. Hepatology. 1995;21:1443-1449. [PubMed] |
| 9. | Cressman DE, Greenbaum LE, DeAngelis RA, Ciliberto G, Furth EE, Poli V, Taub R. Liver failure and defective hepatocyte regeneration in interleukin-6-deficient mice. Science. 1996;274:1379-1383. [PubMed] |
| 10. | Yamada Y, Kirillova I, Peschon JJ, Fausto N. Initiation of liver growth by tumor necrosis factor: deficient liver regeneration in mice lacking type I tumor necrosis factor receptor. Proc Natl Acad Sci U S A. 1997;94:1441-1446. [PubMed] |
| 11. | Sanchez A, Nagy P, Thorgeirsson SS. STAT-3 activity in chemically-induced hepatocellular carcinoma. Eur J Cancer. 2003;39:2093-2098. [PubMed] |
| 12. | Pan Q, Wang L, Sun HC, Liu YK, Ye SL, Tang ZY. Transcription factor activity profile of human hepatocellular carcinoma cell lines with different metastatic potentials. Zhonghua Gan Zang Bing Za Zhi. 2006;14:37-40. [PubMed] |
| 13. | Miyoshi H, Fujie H, Shintani Y, Tsutsumi T, Shinzawa S, Makuuchi M, Kokudo N, Matsuura Y, Suzuki T, Miyamura T. Hepatitis C virus core protein exerts an inhibitory effect on suppressor of cytokine signaling (SOCS)-1 gene expression. J Hepatol. 2005;43:757-763. [PubMed] |
| 14. | Niwa Y, Kanda H, Shikauchi Y, Saiura A, Matsubara K, Kitagawa T, Yamamoto J, Kubo T, Yoshikawa H. Methylation silencing of SOCS-3 promotes cell growth and migration by enhancing JAK/STAT and FAK signalings in human hepatocellular carcinoma. Oncogene. 2005;24:6406-6417. [PubMed] |
| 15. | Kasschau KD, Carrington JC. A counterdefensive strategy of plant viruses: suppression of posttranscriptional gene silencing. Cell. 1998;95:461-470. [PubMed] |
| 16. | Cejka D, Losert D, Wacheck V. Short interfering RNA (siRNA): tool or therapeutic? Clin Sci (Lond). 2006;110:47-58. [PubMed] |
| 18. | 许 杨, 王 益华, 高 纪东, 叶 珏, 朱 红霞, 徐 宁志, 王 兴宇, 孙 宗棠. 干扰RNA对HepG2肝癌细胞内源性c-myc表达的抑制作用. 中华肿瘤杂志. 2004;26:458-460. |
| 19. | 闫 歌, 蒲 丹, 唐 霓, 高 小玲, 宋 文鑫, 卢 年芳, 吴 刚, 黄 爱龙. RNA干扰技术对肝癌细胞内源survivin基因表达的影响. 生物化学与生物物理进展. 2004;31:829-833. |
| 21. | 邱伟华, Bingsen Zhou, Dana Darwish, Peiguo G. Chu, Frank Luh, 陈皓, 杨卫平, 李宏为, Yun Yen. STAT3在SAMe抑制HepG2细胞VEGF表达中的作用. 上海交通大学学报(医学版). 2006;26:576-580. |
| 22. | Niu G, Wright KL, Ma Y, Wright GM, Huang M, Irby R, Briggs J, Karras J, Cress WD, Pardoll D. Role of Stat3 in regulating p53 expression and function. Mol Cell Biol. 2005;25:7432-7440. [PubMed] |
| 23. | Gao L, Zhang L, Hu J, Li F, Shao Y, Zhao D, Kalvakolanu DV, Kopecko DJ, Zhao X, Xu DQ. Down-regulation of signal transducer and activator of transcription 3 expression using vector-based small interfering RNAs suppresses growth of human prostate tumor in vivo. Clin Cancer Res. 2005;11:6333-6341. [PubMed] |