修回日期: 2007-03-01
接受日期: 2007-03-17
在线出版日期: 2007-07-08
目的: 探讨淫羊藿苷(ICA)诱导HepG2.2.15细胞分化凋亡的作用机制.
方法: MTT法检测细胞增殖; 流式细胞术(FACS)检测细胞周期分布; RT-PCR方法检测P27基因、FLIP基因mRNA表达水平的变化; AnnexinⅤ-FITC/PI双染法检测ICA处理后HepG2.2.15细胞凋亡的变化; 电化学发光法和速率散射比浊法分别检测ICA处理后HepG2.2.15细胞上清液中甲胎蛋白(AFP)和转铁蛋白(Tf)水平变化.
结果: ICA作用HepG2.2.15细胞增殖呈抑制作用, 具有时间依赖性. ICA处理后, HepG2.2.15细胞周期各时相分布与对照组相比发生变化, G0/G1期升高, S期减小, 与对照组相比有显著性差异(56.26±1.56% vs 49.68±1.34%, 19.95±1.24% vs 28.02±1.03%; P<0.01). ICA分别上调HepG2.2.15细胞P27和下调FLIP基因mRNA的表达水平(0.78 vs 0.27, 0.54 vs 0.90); HepG2.2.15细胞凋亡率增加, AFP下降, Tf水平升高, 与对照组相比均有显著性意义(7.09% vs 0.59%, 156±46 mg/L vs 285±58 mg/L, 152.1±26 mg/L vs 67.1±24 mg/L; P<0.05).
结论: ICA可能通过升高G0/G1期, 减少S期抑制HepG2.2.15细胞的增殖; 上调P27 mRNA和Tf水平, 下调FLIP mRNA的表达和AFP合成的水平来诱导细胞分化.
引文著录: 王谦, 张玲, 毛海婷, 顾洪涛, 温培娥, 李翠玲, 杨尚军, 夏武青. 中药淫羊藿苷逆转肝癌HepG2.2.15细胞恶性表型及诱导分化研究. 世界华人消化杂志 2007; 15(19): 2087-2092
Revised: March 1, 2007
Accepted: March 17, 2007
Published online: July 8, 2007
AIM: To investigate the mechanism of Icraiin (ICA) induction of tumor cell differentiation and apoptosis in HepG2.2.15 cells.
METHODS: MTT assay was used to explore the effects of ICA on the proliferation of HepG2.2.15 cells. Reverse transcriptase-polymerase chain reaction was used to examine mRNA levels of P27 and FLIP genes. Flow cytometry was used to detect apoptosis of HepG2.2.15 cells treated by Annexin V-FITC/PI. ABN ProSpec System nephelometer was used to examine alpha fetal protein (AFP), and the Elecsys System was used for immunoassay detection of transferrin (Tf).
RESULTS: Treatment with ICA reduced the rate of proliferation in the HepG2.2.15 cell line. The inhibition of cell proliferation was time dependent (P < 0.05). The distribution ratios of ICA-treated HepG2.2.15 cells were significantly different compared with those of the controls. The number of G0/G1-phase cells increased (56.26 ± 1.56% vs 49.68 ± 1.34%, P < 0.01), and S-phase cells decreased (19.95 ± 1.24% vs 28.02 ± 1.03%, P < 0.01). ICA increased the relative expression level of P27 mRNA from 0.27 to 0.78, and reduced that of FLIP mRNA from 0.90 to 0.54. ICA also decreased AFP expression level from 285 ± 58 to 156 ± 46 mg/L, while it increased that of Tf from 67.1 ± 24 to 152.1 ± 26 mg/L (P < 0.05).
CONCLUSION: ICA significantly inhibited HepG2.2.15 cell proliferation by affecting the cell cycle distribution ratios, and by reducing the number of S-phase cells and increasing G0/G1-phase cells. ICA could enhance the expression levels of P27 mRNA and Tf, while simultaneously inhibiting the tumor marker AFP and inducing HepG2.2.15 cell differentiation.
- Citation: Wang Q, Zhang L, Mao HT, Gu HT, Wen PE, Li CL, Yang SJ, Xia WQ. Chinese medicine Icraiin reverses expression of hepatocarcinoma cell line HepG2.2.15 and induces differentiation. Shijie Huaren Xiaohua Zazhi 2007; 15(19): 2087-2092
- URL: https://www.wjgnet.com/1009-3079/full/v15/i19/2087.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i19.2087
近年来的研究表明, 中药淫羊藿苷(ICA)对人外周血T、B、单核细胞均有调节作用, 可增强免疫效应细胞LAK、NK的杀伤活性和促进细胞因子IL-2、3、6等的产生[1-2]. 在我们前期研究中还证明, ICA抗肿瘤的核心作用是抑制肿瘤细胞增殖并诱导其分化、凋亡, 如: ICA可抑制人白血病HL-60、K562、U-937细胞增殖, 诱导HL-60细胞分化、凋亡, 抑制其端粒酶活性, 其中, 对HL-60细胞的诱导分化作用与全反式维甲酸相似[3]. 因此我们认为, ICA是一种新型的生物反应调节抗肿瘤药物, 具有良好的应用前景. 进一步研究其抗肿瘤机制, 提高抗肿瘤效果, 开发为新型抗癌药, 具有迫切性和重要性. 我们在前期研究的基础上, 围绕ICA诱导肿瘤细胞分化凋亡的作用核心, 针对人肝癌细胞HepG2.2.15从以下几方面进行了研究: (1)观察ICA作用前后对HepG2.2.15细胞增殖和细胞周期的影响; (2)观察ICA是否通过上调P27 mRNA表达水平影响细胞分化, 同时观察肿瘤细胞诱导分化后, 异位表达的肿瘤标志蛋白甲胎蛋白(AFP)水平是否下降, 合成正常生长所需的转铁蛋白(Tf)水平是否提高; (3)观察ICA是否下调HepG2.2.15细胞凋亡抑制蛋白(FLIP) mRNA表达. 通过探讨ICA诱导肿瘤细胞分化凋亡机制, 为ICA的开发应用提供新的理论和实验依据.
人肝癌细胞系HepG2.2.15细胞, 人T细胞白血病细胞系Jurkat细胞, 由本室常规培养. ICA: 淫羊藿苷, 淡黄色结晶, 从淫羊藿中提取, 纯度大于96%, 本课题组提纯. RPMI 1640、DMEM、胰蛋白酶为Gibco产品, MTT为Sigma公司产品. DMSO, 分析纯, 天津市广成化学试剂有限公司产品. PI染色液, Sigma公司产品. AnnexinV-FITC/PI试剂盒, 晶美生物工程有限公司. RT-PCR试剂均购自上海生工生物工程技术服务有限公司, FLIP基因上游引物5'-CTTCGAGACACCTTCACTTCC-3'下游引物5'-TGGCAGAAACTCTGCTGTTCC-3', 扩增产物为580 bp. β-actin上游引物5'-CACCTTCTACAATGAGCTGCG-3', 下游引物5'-TGCTTGCTGATCCACATCTGC-3', 扩增基因片段长度816 bp. P27基因上游引物: 5'-CCGACGATTCTTCTACTC-3', 下游引物: 5'-CTGATAAACAAGGAAACATA-3', 扩增产物为165 bp. β-actin上游引物5'-GTGGGGCGCCCCAGGCACCA-3', 下游引物 5'-CTCCTTAATGTCACGCACGATTTC-3', 扩增产物为506 bp, 均由上海生工生物工程技术服务有限公司合成. 甲胎蛋白(AFP)Elecsys试剂盒: 德国罗氏公司产品. 转铁蛋白(Tf)试剂盒: 德国德灵公司产品.
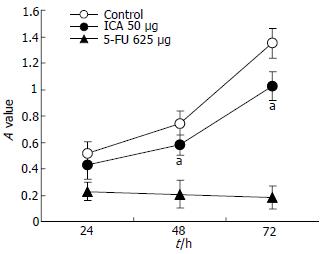
1.2.1 MTT法检测ICA对HepG2.2.15细胞增殖的影响[4]: 取对数生长期的HepG2.2.15细胞, 调细胞浓度为5×104/mL, 接种于96孔板, 每孔0.1 mL(5000个细胞), 37℃, 50 mL/L CO2孵箱孵育过夜后, 加入ICA 50 mg/L ,并设细胞对照及药物对照, 5-FU 625 mg/L为阳性对照组, 每组样本3个复孔, 作用24, 48, 72 h. 置酶标仪下测定A值, 按下式计算抑制百分率: 抑制率(%) = (对照组A值-实验组A值)/对照组A值×100%.
1.2.2 流式细胞术检测ICA处理后HepG2.2.15细胞周期变化[5]: 收集ICA50 mg/L处理48 h的HepG2.2.15细胞和对照组细胞(106), 细胞沉淀加700 mL/L乙醇500 μL固定, 4℃过夜. PBS洗2次, 加入PI染色液, 4℃避光放置30 min, PBS洗1次, FCM分析细胞周期变化.
1.2.3 RT-PCR检测ICA处理HepG2.2.15细胞后P27、FLIP: mRNA水平的变化[6-7]: 收集各处理组和对照组细胞, 按照TRIzol Rengent说明, 提取总RNA, 定量后进行RT-PCR DNA扩增产物以β-actin基因作内参照, 采用Gel Dosl000凝胶分析仪扫描分析并相对定量.
1.2.4 流式细胞术AnnexinⅤ-FITC/PI检测ICA处理后HepG2.2.15细胞凋亡的变化[8]: 常规消化HepG2.2.15细胞, 调整细胞浓度至4×105/mL, 接种于6孔培养板, 3 mL/孔, 培养过夜后, 吸出培液, 处理组加入ICA100 mg/L 3 mL/孔, 对照组加入DMEM全培3 mL/孔. 培养48 h后, 常规消化HepG2.2.15细胞, 分别离心, 弃上清. 用4℃预冷的PBS洗细胞1次, 分别用100 μL结合缓冲液(1:4稀释)重新悬浮细胞, 按试剂盒说明加入5 μL AnnexinⅤ-FITC/PI和10 μL 20 mg/L的碘化丙啶溶液, 混匀, 置于室温避光孵育15 min, FCM分析凋亡情况.
1.2.5 电化学发光法检测ICA处理后HepG2.2.15细胞产生AFP水平变化[9]: 常规消化HepG2.2.15细胞, 调整细胞浓度至4×105/mL, 接种于培养瓶中. 培养过夜后, 吸出培液, 处理组加入ICA 100 mg/L 10 mL, 对照组加入100 mL/L胎牛血清DMEM全培10 mL. 培养48 h后, 收集处理组和对照组细胞上清液, 用PBS1:100稀释, 按试剂盒说明加入检测试剂, 上机检测AFP水平变化.
1.2.6 速率散射比浊法检测ICA处理后HepG2.2.15细胞产生Tf水平变化[10-11]: 细胞处理同1.2.5. 处理组、对照组上清液分别吸入处理好的透析袋中扎紧. 用聚乙二醇6000包埋透析袋, 置4℃, 将上清液分别浓缩5倍、6倍, 按试剂盒说明加入检测试剂, 上机检测Tf水平变化.
统计学处理 采用SPSS12统计软件包进行t检验及χ2检验.
ICA50 mg/L作用于HepG2.2.15细胞, 48, 72 h可表现明显的抑制作用(P<0.05), 抑制率分别为22.04%, 29.68%, 并出现时间依赖效应(图1).
ICA50 mg/L处理HepG2.2.15细胞48 h, 细胞周期各时相分布中S期较对照组明显减小(P<0.01), 而G0/G1期较对照组升高(P<0.01, 表1).
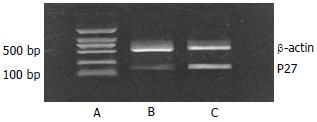
2.3.1 P27基因RT-PCR扩增片段的电泳分析结果: 在B, C泳道中可见位于506 bp处的β-actin 和165 bp处的P27片段(图2). ICA组与对照组相比, P27基因表达增高, 相对定量值由0.27增加到0.78.
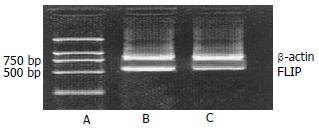
2.3.2 FLIP基因RT-PCR扩增片段的电泳分析结果: 如图3所见, 图中可见816 bp的β-actin和580 bp FLIP基因片段. ICA组与对照组相比, FLIP基因表达下降, 相对定量值由0.90降至0.54.
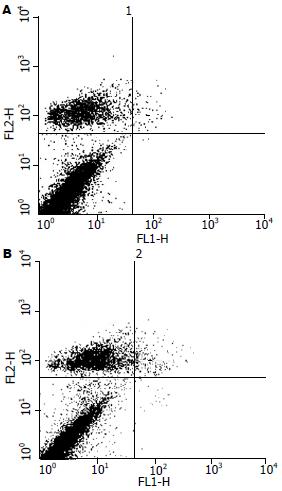
由图4可见, 用AnnexinⅤ结合PI染色进行双参数检测, 发现处理组部分细胞出现中晚期细胞凋亡, 凋亡率由对照组的0.59%提高到7.09%, χ2检验差异明显(P<0.05).
P27是调控细胞周期并与细胞分化密切相关的基因, 定位于人染色体12p13, 其DNA具有594 bp, 编码198个氨基酸,有高度保守性. N端区域的第28-87位的60个氨基酸中有两个丝氨酸磷酸化位点, 介导CDK激酶活性的抑制. P27作为广谱的细胞周期负性调控因子, 主要抑制cyclinE-CDK2和cyclinD-CDK4等激酶复合物活性, 使细胞停滞于G1期, 还具有启动细胞分化作用. 越来越多的研究表明, 几乎所有人类肿瘤均伴随P27下调或缺失[12-17]. 我们发现, ICA处理后, HepG2.2.15细胞增殖受到明显抑制, 作用48, 72 h的抑制率分别为22.04%和29.68%, 并出现时间依赖效应. 同时发现, HepG2.2.15细胞在增殖旺盛期, P27 mRNA表达下调, 相对表达值为0.27; ICA作用后, HepG2.2.15细胞增殖受到抑制, 同时P27 mRNA表达上调, 相对表达值为0.78. 因为P27是细胞分化相关基因, 他的高表达提示ICA可能诱导HepG2.2.15细胞分化, 从而抑制其增殖. 近年来的细胞周期调控研究表明, 细胞周期中的检查点的失调与肿瘤的发生发展有关[18-19], 在细胞周期中,检定点分3个阶段发挥作用: (1)G1/S期转换; (2)监督S期过程; (3)在G2/M期界点起作用[20]. 发生基因改变的肿瘤细胞不能像正常细胞一样在各检查点控制下趋向凋亡, 而是不断继续新的细胞周期, 表现出分裂相明显、增殖活性高. 有的抗癌药在影响基因表达的同时还能影响细胞周期时相分布的改变[21]. 本研究发现, ICA处理后, HepG2.2.15细胞周期时相分布改变, S期较对照组明显减小, 而G1期较对照组升高, 表明增殖状态细胞减少和静止细胞相对增多, 提示ICA对肿瘤细胞周期分布的影响, 可能是诱导肿瘤细胞分化的一个机制.
AFP是在胎儿早期由肝脏合成的一种糖蛋白, 出生后, AFP 的合成很快受到抑制, 当肝细胞或生殖腺胚胎组织发生恶性病变时, 有关基因重新被激活, 使原来已丧失合成AFP能力的细胞又重新开始合成, 以致血中AFP含量明显升高. AFP具有免疫抑制作用, 主要表现为抑制肿瘤患者对肿瘤的免疫应答, 是临床诊断肝癌最常用的肿瘤标志物之一[22]. 肝脏是人体合成和分解蛋白质的主要器官, 也是血浆蛋白质的重要来源, Tf是一种主要由肝脏合成、半衰期仅8 d的全身性内脏蛋白, 主要功能为转运铁[23]. 当肝脏出现病变时, 对蛋白质合成均会有一定程度影响, 并随病情加重而加大. 肝癌细胞与正常细胞相比, 其合成生长所需的Tf明显降低. 因此, 高表达AFP, 低合成Tf是肝癌细胞恶性表型表达的指标. 本研究发现, 肝癌HepG2.2.15细胞上清液中AFP水平显著增高, 而Tf水平显著降低. ICA作用后, HepG2.2.15细胞增殖受到抑制的同时, 其产生的AFP由285±58 mg/L下降至156±46 mg/L, Tf含量由67.1±24 mg/L上升为152.1±26 mg/L. 表明ICA逆转HepG2.2.15细胞恶性表型的表达, 其作用从基因的改变到细胞功能的改变, 也提示ICA在诱导肿瘤细胞分化的同时逆转其恶性表型的表达.
c-FLIP是近年来发现的一类含有死亡效应结构域(DED)的凋亡抑制蛋白. 人类FLIP基因含13个外显子, 位于染色体的2q33-34, 其N端含有与caspase-8相似的两个相互串联的DED. 两个DED与在体外能与死亡结构域FADD和caspase-8结合, 抑制caspase-8结合到死亡诱导信号复合物(DISC)上, 除阻断Fas、还阻断TNFR1、TRAIL、DR4等其他细胞表面死亡受体介导的凋亡信号的转导[24-25]. c-FLIP最早在人类黑色素瘤细胞系中发现[26], 继而在大肠癌、非小细胞肺癌、胆管癌等多种肿瘤中发现, 并与肿瘤的恶性程度、分期和淋巴结转移密切相关[27-30]. c-FLIP的过量表达可能是细胞癌变中的重要环节, 即细胞内染色体异常改变, 使c-FLIP基因激活并过度表达, 进一步促进细胞恶化. 本研究发现, HepG2.2.15细胞增殖旺盛时, FLIP mRNA水平上调, ICA作用后, HepG2.2.15细胞增殖受到抑制, 同时FLIP mRNA水平下调, 相对表达率从0.90分别下降到0.54. AnnexinⅤ-FITC/PI双染检测, HepG2.2.15部分细胞出现中晚期凋亡, 表明ICA可抑制肿瘤细胞FLIP基因的表达, 诱导部分肿瘤细胞凋亡. 进一步提示ICA抑制FLIP的表达, 也是逆转肿瘤细胞恶性表型表达的机制之一.
研究表明, 肿瘤的发生不仅与细胞恶性增殖有关, 而且与肿瘤细胞死亡受到抑制密切相关. 逆转肿瘤细胞恶性表型及诱导其分化、凋亡, 是一条有效的肿瘤治疗途径, 较杀伤肿瘤细胞的治疗有明显的生物学调节的优越性, 因此寻求高效低毒的诱导分化抗肿瘤药物已成为目前肿瘤治疗的研究热点
中草药堪称抗肿瘤新药开发的宝藏, 中草药及其活性成分的抗肿瘤研究开发, 符合我国中药创新的国策. 目前研究证实, 中药淫羊藿苷抗肿瘤的核心作用是抑制肿瘤细胞增殖及诱导细胞分化、凋亡, 但其对实体肿瘤的作用尚待探讨. 进一步探讨淫羊藿苷抗实体肿瘤的作用和机制, 提高抗肿瘤的效果, 开发为新型抗癌药, 具有重要的应用意义.
近赵勇etal研究报道, 淫羊藿苷促诱生细胞因子IL-2、3、6, 增强NK细胞的杀伤活性;张玲etal研究报道, 淫羊藿苷抑制白血病HL-60细胞增殖和端粒酶活性并诱导其向成熟粒细胞方向分化, 表明淫羊藿苷是一种新型生物反应调节抗肿瘤药物.
本文率先发现, 中药淫羊藿苷明显下调人肝癌HepG2.2.15细胞抗调亡因子FLIPmRNA的表达水平, 同时诱导部分肝癌细胞出现凋亡;在增强HepG2.2.15细胞分化相关基因P27mRNA的表达水平的同时, 下调肿瘤标志物AFP的产生, 上调合成转铁蛋白的水平, 在一定程度上对HepG2.2.15细胞诱导分化.
动物体内抑瘤实验表明, 淫羊藿苷不仅对小鼠移植肝癌具有明显的抑制作用, 同时未发现明显的毒副作用. 因此随着对淫羊藿苷抗癌机制的不断深入研究, 其将作为一种植物成分的新型抗癌药物进行开发, 具有良好的应用前景.
淫羊藿苷:中药淫羊藿为小檗科植物, 有"益精气坚筋骨、补腰膝、强心力"等功效记载, 但其药理学作用远远超出古人论述的范围. 其提取成分淫羊藿苷(Icariin, ICA)近年来的研究表明, 其不仅具有免疫调节功能, 而且对白血病和实体性肿瘤细胞具有逆转恶性表型和诱导分化作用, 我们认为ICA是新型生物反应调节抗肿瘤药物, 具有良好的开发前景.
本文较全面, 深入的研究了IAC对肝癌细胞珠的作用, 对于进一步阐明其作用机制, 开发有效的抗肿瘤中药具有一定的研究价值, 具有很强的实用性和可读性.
编辑: 王晓瑜 电编:张强
| 5. | Leong CM, Hibma MH. A flow cytometry-based assay for the measurement of protein regulation of E-cadherin-mediated adhesion. J Immunol Methods. 2005;302:116-124. [PubMed] |
| 6. | 罗 剑, 曹 治华, 刘 民锋, 左 石, 董 泾青, 邹 声泉. p27kip1基因在人胆管癌细胞化疗增敏效应中的作用. 华中科技大学学报(医学版). 2006;35:362-366. |
| 7. | XING Bao-cai, S. Wimmenaner, EH.Farthmann. EXPRESSION OF FLIP IN HUMAN COLON CARCINOMAS:A NEW MECHANISM OF IMMUNE EVASION. Chinese Journal of Cancer Research. 2005;17:193-198. |
| 13. | Sato H, Sato Y, Ichimura K, Oka T, Kondo E, Tanaka T, Kondo T, Ohara N, Takahashi K, Yoshino T. p27(Kip1) is detected on most gastric MALT lymphomas, but not large cell lymphomas. J Clin Exp Hematop. 2006;46:25-30. [PubMed] |
| 14. | Galizia G, Ferraraccio F, Lieto E, Orditura M, Castellano P, Imperatore V, La Manna G, Pinto M, Ciardiello F, La Mura A. p27 downregulation and metallothionein overexpression in gastric cancer patients are associated with a poor survival rate. J Surg Oncol. 2006;93:241-252. [PubMed] |
| 15. | Tan P, Cady B, Wanner M, Worland P, Cukor B, Magi-Galluzzi C, Lavin P, Draetta G, Pagano M, Loda M. The cell cycle inhibitor p27 is an independent prognostic marker in small (T1a,b) invasive breast carcinomas. Cancer Res. 1997;57:1259-1263. [PubMed] |
| 16. | Masciullo V, Sgambato A, Pacilio C, Pucci B, Ferrandina G, Palazzo J, Carbone A, Cittadini A, Mancuso S, Scambia G. Frequent loss of expression of the cyclin-dependent kinase inhibitor p27 in epithelial ovarian cancer. Cancer Res. 1999;59:3790-3794. [PubMed] |
| 17. | Cianga C, Cianga P, Cozma L, Diaconu C, Carasevici E. Low p27 (Kip1) expression is associated with poor prognostic factors in breast carcinomas. J BUON. 2002;7:117-120. [PubMed] |
| 18. | Golubnitschaja O. Cell cycle checkpoints: the role and evaluation for early diagnosis of senescence, cardiovascular, cancer, and neurodegenerative diseases. Amino Acids. 2007;32:359-371. [PubMed] |
| 19. | Dash BC, El-Deiry WS. Cell cycle checkpoint control mechanisms that can be disrupted in cancer. Methods Mol Biol. 2004;280:99-161. [PubMed] |
| 20. | 朱 应葆, 钱 鑫, 贾 廷珍. 肿瘤治疗的新靶点-细胞周期检定点. 中华放射医学与防护杂志. 2006;26:1-2. |
| 24. | Kim Y, Suh N, Sporn M, Reed JC. An inducible pathway for degradation of FLIP protein sensitizes tumor cells to TRAIL-induced apoptosis. J Biol Chem. 2002;277:22320-22329. [PubMed] |
| 25. | Bullani RR, Huard B, Viard-Leveugle I, Byers HR, Irmler M, Saurat JH, Tschopp J, French LE. Selective expression of FLIP in malignant melanocytic skin lesions. J Invest Dermatol. 2001;117:360-364. [PubMed] |
| 26. | Korkolopoulou P, Goudopoulou A, Voutsinas G, Thomas-Tsagli E, Kapralos P, Patsouris E, Saetta AA. c-FLIP expression in bladder urothelial carcinomas: its role in resistance to Fas-mediated apoptosis and clinicopathologic correlations. Urology. 2004;63:1198-1204. [PubMed] |
| 27. | Ryu BK, Lee MG, Chi SG, Kim YW, Park JH. Increased expression of cFLIP(L) in colonic adenocarcinoma. J Pathol. 2001;194:15-19. [PubMed] |
| 28. | 高 文超, 王 元和, 李 莉, 王 强, 张 玲珍, 曹 鲁宁, 丁 尔迅. c-FL IP mRNA在大肠癌细胞中的表达及其与Fas抗原表达的相关性. 第二军医大学学报. 2002;23:35-37. |
| 29. | Que FG, Phan VA, Phan VH, Celli A, Batts K, LaRusso NF, Gores GJ. Cholangiocarcinomas express Fas ligand and disable the Fas receptor. Hepatology. 1999;30:1398-1404. [PubMed] |
| 30. | Osaki M, Kase S, Kodani I, Watanabe M, Adachi H, Ito H. Expression of Fas and Fas ligand in human gastric adenomas and intestinal-type carcinomas: correlation with proliferation and apoptosis. Gastric Cancer. 2001;4:198-205. [PubMed] |