修回日期: 2007-05-01
接受日期: 2007-05-16
在线出版日期: 2007-07-08
目的: 观察去甲基化制剂--5-Aza-CdR对体外培养的胃癌细胞SGC7901 p16基因启动子区甲基化状态及表达的影响, 探讨胃癌细胞p16基因失活的机制及去甲基化制剂对p16基因表达的调控.
方法: 应用不同浓度的5-Aza-CdR(1×10-7, 5×10-7, 1×10-6, 5×10-6 mol/L)处理体外培养的胃癌细胞SGC7901后, MSP法检测用药前后细胞中p16基因的甲基化状态, RT-PCR及 Western-blot法检测用药前后细胞中p16基因mRNA及蛋白表达的变化.
结果: p16基因在胃癌细胞系SGC7901中启动子区呈异常甲基化状态, 在mRNA及蛋白水平低表达. 经过1×10-7, 5×10-7, 1×10-6, 5×10-6 mol/L 5-Aza-CdR处理后, p16基因启动子区呈去甲基化状态, 各组mRNA及蛋白表达相应的比值分别与处理前的比例为2.21±0.36, 2.01±0.31; 2.82±0.39, 2.22±0.33; 2.98±0.42, 3.15±0.43及3.35±0.55, 3.75±0.61.
结论: 5-Aza-CdR能逆转胃癌细胞p16基因甲基化状态, 调控p16基因表达.
引文著录: 沈文静, 戴冬秋, 滕玥, 刘洁. 5-Aza-CdR体外诱导胃癌细胞系p16基因去甲基化及表达增强. 世界华人消化杂志 2007; 15(19): 2082-2086
Revised: May 1, 2007
Accepted: May 16, 2007
Published online: July 8, 2007
AIM: To investigate the effects of 5-aza-2'-deoxycytidine (5-Aza-CdR) on methylation and expression of p16 gene in the human gastric cancer cell line SGC7901, and to discuss the mechanism of p16 gene silencing in human gastric cancer cells, as well as the regulating effect of the demethylating agent on p16 gene expression.
METHODS: SGC7901 cells were cultured in RPMI 1640 medium and were treated with different concentrations (1 × 10-7 mol/L, 5 × 10-7 mol/L, 1 × 10-6 mol/L, 5 × 10-6 mol/L) of DNA methyltransferase inhibitor 5-Aza-CdR. Methylation-specific polymerase chain reaction (MSP) was used to detect the promoter methylation state of the p16 gene. RT-PCR and Western blotting were used to detect expression of p16 mRNA and protein before and after treatment with 5-Aza-CdR, respectively.
RESULTS: Promoter hypermethylation of the p16 gene was detected in SGC7901 cells, and p16 was expressed at a low level before treatment. After treatment with 5-Aza-CdR, the promoter region of the p16 gene exhibited a demethylation state, and its expression was increased at the mRNA and protein levels.
CONCLUSION: Promoter hypermethylation is a major mechanism of p16 gene silencing in human gastric cancer cells, and can be reversed by the demethylating agent 5-Aza-CdR. Demethylating agents can regulate the expression of the p16 gene. The corresponding ratio of the group mRNA and protein expression prior to treatment when the concentration of 5-Aza-CdR is 1 × 10-7, 5 × 10-7, 1 × 10-6, 5 × 10-6 mol/L are 2.21 ± 0.36, 2.01 ± 0.31; 2.82 ± 0.39, 2.22 ± 0.33; 2.98 ± 0.42, 3.15 ± 0.43, 3.35 ± 0.55, and 3.75 ± 0.61 respectively.
- Citation: Shen WJ, Dai DQ, Teng Y, Liu J. 5-aza-2'-deoxycytidine induces demethylation of p16 gene in human gastric cancer cells and up-regulates its expression. Shijie Huaren Xiaohua Zazhi 2007; 15(19): 2082-2086
- URL: https://www.wjgnet.com/1009-3079/full/v15/i19/2082.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i19.2082
胃癌是一种严重威胁人类健康的恶性肿瘤, 国内外大量的资料显示, 胃癌的发生是遗传学和表观遗传学两大类机制共同作用的、多基因参与、多阶段变异累积形成的病理过程, 表观遗传学机制的DNA甲基化在胃癌的发生、发展中起重要作用[1-4]. 抑癌基因功能丧失可通过多种途径, 现已证实DNA甲基化是基因突变及缺失之外抑癌基因失活的第3种机制, 而且在某些情况下是其失活的唯一机制[5]. p16是公认的抑癌基因, 在细胞周期cyclin D-Rb调控途径中起决定性作用. 已有研究表明, p16基因启动子区发生甲基化可以引起表达缺失[6], 进而导致肿瘤的发生, 这在胃癌中已被证实[7-8]. 由于异常甲基化抑制抑癌基因表达的过程是可逆的, 有可能通过应用去甲基化制剂诱导因甲基化失活的基因重新表达[9]. 我们研究去甲基化制剂5-氮杂-2'-脱氧胞苷(5-aza-2'-deoxycytidine, 5-Aza-CdR)对体外培养的胃癌细胞系SGC7901 p16基因启动子区甲基化状态及表达的影响, 进一步探讨胃癌细胞p16基因失活的机制及去甲基化制剂对p16基因的表达调控作用.
SGC7901细胞系购自中国医科大学细胞生物教研室, 5-aza-2'-deoxycitydine(5-Aza-CdR)为Sigma产品, 总RNA抽提试剂TRIzol购自Invitrogen公司, RT-PCR试剂盒, Taq酶及dNTP购自TaKaRa公司, RPMI 1640培养基为Hyclone产品, P16鼠抗人mAb(Santa cruz产品), Wizard DNA Clean-up(Promega公司). SGC7901在含100 mL/L胎牛血清的RPMI 1640中, 37℃, 50 mL/L CO2条件下培养.
实验时细胞处于对数生长期, 活细胞数超过95%, 在含10 mL/L胎牛血清的RPMI 1640中饥饿培养24 h后, 于培养瓶中分别加入含不同浓度5-Aza-CdR(1×10-7, 5×10-7, 1×10-6, 5×10-6 mol/L)的培养液, 分别在d 1, 3换同样浓度的加药培养液, 于d 5收集细胞, 进行实验. 以未加5-Aza-CdR干预的细胞为对照组.
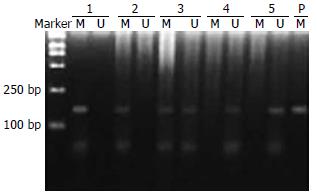
1.2.1 甲基化特异PCR法(MSP)法检测胃癌细胞中p16基因的甲基化状态: 收集5-Aza-CdR作用5 d不同处理组细胞, 细胞DNA提取及DNA修饰与纯化: 常规酚-氯仿-异戊醇法提取细胞DNA, 紫外分光光度法检测DNA浓度和纯度. 按文献方法进行DNA修饰及纯化[10]. 甲基化特异PCR反应体系25 μL, 包括样品DNA 2 μL, 10×PCR buffer 2.5 μL, 引物各0.5 μL, dNTP 2 μL, Taq酶0.2 μL, 双蒸水17.3 μL. 反应条件: 95℃预变性5 min; 94℃ 30 s, 63℃ 45 s, 72℃ 30 s, 40个循环; 72℃延伸10 min. 甲基化反应退火温度63℃, 非甲基化反应退火温度64℃. 以甲基转移酶SssⅠ处理和未处理的正常人外周血细胞DNA作为阳性和阴性对照, 以双蒸水作为空白对照. 1000 bp DL2000作为分子质量标记. 引物序列参照文献[10]设计: 甲基化引物: 上游引物5'-TTATTAGAGGGTGGGGCGGATCGC-3', 下游引物5'-GACCCCGAACCGCGACCGTAA-3', 扩增产物150 bp; 非甲基化引物: 上游引物5'-TTATTAGAGGGTGGGGTGGATTGT-3', 下游引物5'-CAACCCCAACCA CAACCATAA-3', 扩增产物151 bp. 应用20 g/L琼脂糖凝胶电泳, 电压100 V, 电泳时间40 min, 结果经激光密度扫描仪(Pharmacia LKB Ultroscan)照相进行分析. 实验重复3次.
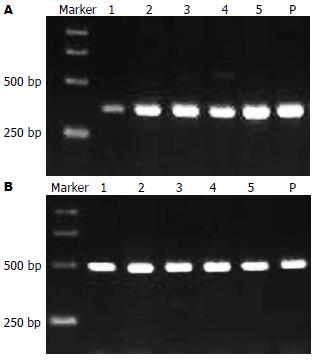
1.2.2 RT-PCR法检测p16基因mRNA的表达: 收集5-Aza-CdR作用5 d不同处理组细胞, 用TRIzol试剂提取各组SGC7901细胞总RNA. 用逆转录酶和Oliga(dT)20引物合成 cDNA. p16引物序列: 上游引物: 5'-CCCGCTTTGGTAGTTTTCAT-3', 下游引物: 5'-TTATTTGAGCTTTGGTTCTG-3', 扩增产物长度为355 bp. 以β-actin为内对照, 上游引物: 5'-GTGGGGCGCCCCAGGCACCA-3', 下游引物: 5'-CTCCTTAATGTCACGCACGATTTC-3', 扩增长度为498 bp. PCR反应条件为: 95℃预变性2 min, 94℃变性40 s, 58℃复性40 s, 72℃延伸60 s, 共35个循环, 72℃延伸6 min. RT-PCR产物经20 g/L琼脂糖胶分离, 用Alpha Image 2000自动成像仪摄影, 用Fluorchem V 2.0 Stand Alone软件分析RT-PCR产量. 实验重复3次.
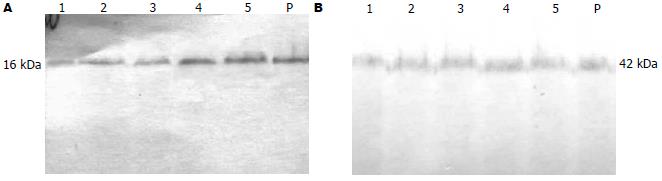
1.2.3 Western blot法检测P16蛋白表达情况: 收集5-Aza-CdR作用5 d不同处理组细胞, 将收集细胞按与细胞裂解液1:5加入200 μL裂解液, 提取总蛋白, 酚试剂法进行蛋白定量. 取100 μL总蛋白变性10 min后, 取20 μL加样, 100 g/L聚丙烯酰胺凝胶电泳, 蛋白电泳分离后移至PVDF膜. 50 g/L脱脂奶粉室温封闭1 h, PVDF膜置于1:250稀释的一抗(鼠抗人, Santa Cruz公司产品)稀释液中, 4℃过夜, 再置于1:4500稀释的碱性磷酸酶标记的二抗(抗鼠, IgG-, 北京中杉金桥生物公司产品)稀释液中, 37℃孵育2 h, 显色, 观察结果. 以β-actin蛋白表达为内参, 用ChemiImager 5500 AlPhaInn Ch下成像, 用Fluorchem V 2.0系统采集数据, 采用条带密度值与相应的β-actin密度值的比值作为指标进行结果分析. 实验重复3次.
p16基因在胃癌细胞系SGC7901中呈异常甲基化状态, 在经过不同浓度5-Aza-CdR处理5 d后, p16基因在1×10-7 mol/L组甲基化条带减弱, 5×10-7 mol/L组出现非甲基化条带, 呈部分甲基化阳性, 随着5-Aza-CdR浓度增高, 在1×10-6和5×10-6 mol/L组甲基化阴性, 呈现完全去甲基化状态(图1).
5-Aza-CdR处理前胃癌细胞系SGC7901中检测到p16基因mRNA低表达, 经1×10-7, 5×10-7, 1×10-6, 5×10-6 mol/L 5-Aza-CdR处理后, p16基因的mRNA表达增强(图2A, B). 以5-Aza-CdR处理前SGC7901中p16基因mRNA表达条带强度与相应的β-actin mRNA表达条带强度的比值设为基准值1, 1×10-7, 5×10-7, 1×10-6, 5×10-6 mol/L各组相应的比值与处理前的比例分别为2.21±0.36, 2.82±0.39, 2.98±0.42及3.35±0.55, 可以看出5-Aza-CdR处理后p16基因的mRNA表达较处理前增加2-3倍.
5-Aza-CdR处理前细胞系SGC7901中P16蛋白微弱表达, 用药后, P16蛋白表达增强, 1×10-6及5×10-6 mol/L组较明显(图3A, B). 以5-Aza-CdR处理前SGC7901中p16基因蛋白表达条带强度与相应的β-actin蛋白表达条带强度的比值设为基准值1, 1×10-7, 5×10-7, 1×10-6, 5×10-6 mol/L各组相应的比值与处理前的比例分别为2.01±0.31, 2.22±0.33, 3.15±0.43及3.75±0.61, 可以看出5-Aza-CdR处理后p16基因的蛋白表达较处理前增加2-3倍.
肿瘤的发生是遗传学和表观遗传学两大类机制共同作用的过程. 表观遗传学是研究没有DNA序列变化、可遗传的基因表达的改变[11]. 表观遗传学的分子机制包括DNA甲基化、组蛋白修饰、染色质改型和RNA干涉等[12], 他们在基因转录调控过程中起重要作用. 表观遗传学异常通过引起癌遗传学途径基因的失能与获能, 即抑癌基因失活、癌基因激活, 增加基因组的不稳定性以及基因印记丢失等途径参与肿瘤的形成. DNA甲基化是表观遗传学的重要内容, DNA低甲基化可促进基因表达, DNA高甲基化则抑制基因表达. 现已证明, DNA甲基化是基因突变及缺失之外肿瘤抑制基因失活的第3种机制, 而且在某些情况下是其失活的唯一机制. 目前已发现, 许多肿瘤相关基因启动子区CpG岛在人类肿瘤及癌细胞株中发生异常甲基化. 由于甲基化调节基因表达的过程是可逆的, 有可能通过应用去甲基化制剂诱导因甲基化失活的基因重新表达. 5-Aza-CdR是胞苷类似物, 作为去甲基化制剂, 他的作用机制是通过与DNA甲基转移酶共价结合, 降低DNA甲基转移酶的生物活性, 从而降低甲基化水平. 该药物目前已用于白血病的临床治疗[13-14].
作为多肿瘤抑制基因, p16基因是细胞周期G1期重要的负调节因子, 通过与Cyclin D/CDK4/CDK6结合, 抑制后者的作用, 使RB蛋白处于低磷酸化状态, 阻断细胞周期运行. p16基因失活与胃癌、卵巢癌、肺癌等多种肿瘤的发生密切相关, 在胃癌中已被证实p16基因启动子区异常甲基化是其失活的主要机制[7,15]. 我们检测胃癌细胞系SGC7901中存在p16基因启动子区异常甲基化, 表明胃癌细胞中p16基因可能主要因高甲基化而失表达. 经过5-Aza-CdR处理5 d后, p16基因在1×10-7 mol/L l组甲基化条带减弱, 5×10-7 mol/L组开始出现非甲基化条带, 呈部分甲基化阳性, 随着5-Aza-CdR浓度增高, 在1×10-6, 5×10-6 mol/L组呈现完全去甲基化状态. 表明启动子区异常甲基化是胃癌细胞p16基因失活的主要原因之一, 应用去甲基化制剂--5-Aza-CdR能逆转p16基因甲基化状态, Song et al[7], Merlo et al[16]的研究支持本观点. 我们在胃癌细胞系SGC7901检测到p16基因的mRNA及蛋白微弱表达, 经5-Aza-CdR处理后, SGC7901中p16基因的增强, 同时, P16蛋白表达增强, 胃癌细胞系SGC7901在5-Aza-CdR处理前后蛋白表达与mRNA表达改变相一致. 结合5-Aza-CdR处理前后p16基因甲基化状态改变的结果, 可以看出启动子区异常甲基化是胃癌细胞p16基因失活的主要原因之一, 去甲基化制剂--5-Aza-CdR通过逆转p16基因甲基化状态, 上调p16基因表达. 已有研究表明[17-20], 5-Aza-CdR可以逆转CpG岛甲基化, 恢复多个抑癌基因的表达, 支持上述观点. 随着实验技术的进步, 将为深入研究提供有力手段[21].
总之, 本研究表明启动子区异常甲基化是胃癌细胞p16基因失活的主要原因之一, 去甲基化制剂--5-Aza-CdR能逆转p16基因甲基化状态, 增强p16基因表达, 有可能用于胃癌的临床治疗.
表遗传学机制在胃癌的发生、发展中起重要作用, 肿瘤抑制基因启动子区异常甲基化与胃癌的发生及临床进展相关, 由于异常甲基化抑制基因表达的过程是可逆的, 有可能通过应用去甲基化制剂诱导因甲基化失活的基因重新表达, 进而用于临床治疗.
针对表遗传学机制与肿瘤发生的关系及可逆性的作用特点, 应用去甲基化制剂及组蛋白脱乙酰基酶抑制剂用于包括胃癌在内恶性肿瘤的临床治疗已成为研究热点. 去甲基化制剂5-Aza-CdR目前已用于白血病的临床治疗, 在实体瘤的治疗中处于研究阶段. 虽然存在非特异性、毒副作用等问题亟待解决, 这类药物仍具有重要的临床应用前景, 但其作用机制仍需深入探讨.
本研究表明5-Aza-CdR能使胃癌细胞中因高甲基化表达下调的p16基因呈去甲基化作用, 并使该基因的mRNA和蛋白表达水平均上调, 为胃癌的去甲基化治疗提供了一定的理论依据.
本研究提示去甲基化药物可能用于胃癌的临床治疗, 5-Aza-CdR可能通过去甲基化作用使包括p16基因在内的抑癌基因表达上调而发挥抗肿瘤作用, 为胃癌去甲基化治疗提供了一定的理论依据.
本文研究了5-Aza-CdR对胃癌细胞系p16基因去甲基化的影响, 科学性较好, 技术较先进, 基础研究有望应用于临床, 有很好的参考价值.
编辑: 潘伯荣 电编:何基才
| 6. | Honoki K, Tsujiuchi T, Mori T, Yoshitani K, Tsutsumi M, Takakura Y, Mii Y. Expression of the p16INK4a gene and methylation pattern of CpG sites in the promoter region in rat tumor cell lines. Mol Carcinog. 2004;39:10-14. [PubMed] |
| 7. | Song SH, Jong HS, Choi HH, Kang SH, Ryu MH, Kim NK, Kim WH, Bang YJ. Methylation of specific CpG sites in the promoter region could significantly down-regulate p16(INK4a) expression in gastric adenocarcinoma. Int J Cancer. 2000;87:236-240. [PubMed] |
| 8. | Kim H, Kim YH, Kim SE, Kim NG, Noh SH, Kim H. Concerted promoter hypermethylation of hMLH1, p16INK4A, and E-cadherin in gastric carcinomas with microsatellite instability. J Pathol. 2003;200:23-31. [PubMed] |
| 9. | Byun DS, Lee MG, Chae KS, Ryu BG, Chi SG. Frequent epigenetic inactivation of RASSF1A by aberrant promoter hypermethylation in human gastric adenocarcinoma. Cancer Res. 2001;61:7034-7038. [PubMed] |
| 10. | Herman JG, Graff JR, Myohanen S, Nelkin BD, Baylin SB. Methylation-specific PCR: a novel PCR assay for methylation status of CpG islands. Proc Natl Acad Sci U S A. 1996;93:9821-9826. [PubMed] |
| 11. | Herman JG. Epigenetic changes in cancer and preneoplasia. Cold Spring Harb Symp Quant Biol. 2005;70:329-333. [PubMed] |
| 13. | Wijermans PW, Krulder JW, Huijgens PC, Neve P. Continuous infusion of low-dose 5-Aza-2'-deoxycytidine in elderly patients with high-risk myelodysplastic syndrome. Leukemia. 1997;11:1-5. [PubMed] |
| 14. | Kantarjian H, Oki Y, Garcia-Manero G, Huang X, O'Brien S, Cortes J, Faderl S, Bueso-Ramos C, Ravandi F, Estrov Z. Results of a randomized study of 3 schedules of low-dose decitabine in higher-risk myelodysplastic syndrome and chronic myelomonocytic leukemia. Blood. 2007;109:52-57. [PubMed] |
| 15. | Shim YH, Kang GH, Ro JY. Correlation of p16 hypermethylation with p16 protein loss in sporadic gastric carcinomas. Lab Invest. 2000;80:689-695. [PubMed] |
| 16. | Merlo A, Herman JG, Mao L, Lee DJ, Gabrielson E, Burger PC, Baylin SB, Sidransky D. 5' CpG island methylation is associated with transcriptional silencing of the tumour suppressor p16/CDKN2/MTS1 in human cancers. Nat Med. 1995;1:686-692. [PubMed] |
| 17. | Segura-Pacheco B, Trejo-Becerril C, Perez-Cardenas E, Taja-Chayeb L, Mariscal I, Chavez A, Acuna C, Salazar AM, Lizano M, Duenas-Gonzalez A. Reactivation of tumor suppressor genes by the cardiovascular drugs hydralazine and procainamide and their potential use in cancer therapy. Clin Cancer Res. 2003;9:1596-1603. [PubMed] |
| 18. | Chuang JC, Yoo CB, Kwan JM, Li TW, Liang G, Yang AS, Jones PA. Comparison of biological effects of non-nucleoside DNA methylation inhibitors versus 5-aza-2'-deoxycytidine. Mol Cancer Ther. 2005;4:1515-1520. [PubMed] |
| 19. | Fang XM, Sun LF, Peng JP, Dong Q, Zheng S. The study of 5-Aza-2'-deoxycytidine on transcription regulation of p16/CDKN2 gene demethylation in RKO human colorectal cell line. Zhonghua Yi Xue Za Zhi. 2003;83:2077-2082. [PubMed] |
| 20. | Stresemann C, Brueckner B, Musch T, Stopper H, Lyko F. Functional diversity of DNA methyltransferase inhibitors in human cancer cell lines. Cancer Res. 2006;66:2794-2800. [PubMed] |
| 21. | Yegnasubramanian S, Lin X, Haffner MC, DeMarzo AM, Nelson WG. Combination of methylated-DNA precipitation and methylation-sensitive restriction enzymes (COMPARE-MS) for the rapid, sensitive and quantitative detection of DNA methylation. Nucleic Acids Res. 2006;34:e19. [PubMed] |