修回日期: 2007-03-01
接受日期: 2007-03-17
在线出版日期: 2007-06-28
目的: 探讨代谢综合征小鼠肝脏过氧化物增殖体受体γ共同作用因子-1(PGC-1)表达.
方法: 进正常食C57BL/6J小鼠10只、进高脂高糖食8 wk小鼠5只及16 wk小鼠10只. 测定血脂、血清胰岛素(INS)及空腹血糖、肝功、肝脏重质量、腹部瘦肉及瘦肉含量, 肝脏脂质含量及PGC-1蛋白表达采用Western blot免疫印迹, 并做肝脏病理.
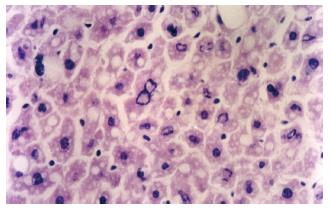
结果: 进高脂高糖食16 wk的小鼠腹部脂肪量、血清甘油三酯(TC)和空腹血糖(FBG)均明显高于正常小鼠(腹部脂肪量: 3.63±0.62 vs 2.99±0.31, P<0.01; TC: 2.31±0.16 mmol/L vs 2.04±0.15 mmol/L, P<0.01; FBG: 6.90±1.84 mmol/L vs 5.11±1.86 mmol/L, P<0.05). 高脂高糖食的动物血清TP、ALB及A/G低于正常动物, 其中进食16 wk的动物ALB及A/G有显著差异(ALB: 18.12±2.63 g/L vs 21.64±3.38 g/L, P<0.05; A/G: 0.89±0.15 vs 1.06±0.18, P<0.05). 血清ALT, ALP及AST高于正常动物, 其中进食16 wk的动物的ALP有显著差异(103.80±8.72 U/L vs 64.60±10.67 U/L, P<0.05). 高脂高糖食小鼠肝脏有明显脂肪变性, 16 wk重于8 wk的小鼠. 16 wk进高脂高糖食的小鼠肝脏的TC和TG含量显著高于正常动物, 达到正常的2倍以上(TC: 0.0582±0.0251 mmol/g干重 vs 0.0275±0.0114 mmol/g干重, P<0.01; TG: 0.1566±0.0166 mmol/g干重 vs 0.0631±0.0232 mmol/g干重, P<0.01). 高脂高糖食小鼠肝脏PGC-1表达高于正常动物, 16 wk强于8 wk的小鼠.
结论: 高脂高糖食C57BL/6J小鼠可作为代谢综合征动物模型, 其存在脂肪肝, 肝脏的PGC-1蛋白表达量高于正常食小鼠, 可能其参与脂肪肝的形成.
引文著录: 刘聪, 吴波, 李莉, 陈威, 李玲, 韩萍, 郑长青. 代谢综合征小鼠肝脏过氧化物增殖体受体γ共同作用因子-1的表达. 世界华人消化杂志 2007; 15(18): 1989-1994
Revised: March 1, 2007
Accepted: March 17, 2007
Published online: June 28, 2007
AIM: To investigate the expression of peroxisome proliferator-activated receptor-γ-coactivator-1 (PGC-1) in the liver of metabolic syndrome mice.
METHODS: Ten female C57BL/6J mice (control group) were fed a normal diet, Fifteen were fed a high fat and sugar diet (metabolic syndrome mice model), made up of 5 fed a high fat and sugar diet for 8 wk (experimental group: A subgroup) and 10 fed the same diet for 16 wk (experimental group: B subgroup). Abdominal fat mass, total cholesterol (TC), triglycerides (TG), high-density lipoprotein cholesterol (HDL-C), fasting blood glucose (FBG), insulin (INS), liver function and liver weight were measured. The lipid content and the protein expression of PGC-1 in liver were detected by Western blot.
RESULTS: In the B subgroup mice, abdominal fat mass, serum TC, and FBG were significantly higher than those of the control mice (abdominal fat mass: 3.63 ± 0.62 vs 2.99 ± 0.31, P < 0.01; TC: 2.31 ± 0.16 mmol/L vs 2.04 ± 0.15 mmol/L, P < 0.01; FBG: 6.90 ± 1.84 mmol/L vs 5.11 ± 1.86 mmol/L, P < 0.05). The B subgroup mice had lower levels of serum TP, ALB and A/G compared with the control animals (ALB: 18.12 ± 2.63 g/L vs 21.64 ± 3.38 g/L, P < 0.05; A/G: 0.89 ± 0.15 vs 1.06 ± 0.18, P < 0.05). The metabolic syndrome mice had higher levels of serum ALT, ALP and AST than normal controls, the ALP level was significantly differente from the controls (103.80 ± 8.72 U/L vs 64.60 ± 10.67 U/L, P < 0.05). The TG and TC contents in the liver of the metabolic syndrome mice were more than 2 times higher than the controls (TC: 0.0582 ± 0.0251 mmol/g dry weight vs 0.0275 ± 0.0114 mmol/g dry weight, P < 0.01; TG: 0.1566 ± 0.0166 mmol/g dry weight vs 0.0631 ± 0.0232 mmol/g dry weight, P < 0.01). The expression of PGC-1 protein in the liver was higher than in the normal controls, with the experimental B subgroup mice being higher than the experimental A subgroup.
CONCLUSION: The C57BL/6J mice, fed a high fat and sugar diet and showing dyslipidmia and fatty liver, presented a kind of metabolic syndrome mice model. The expression of PGC-1 protein in the liver of these metabolic syndrome mice was higher than that of normal mice and may have contributed to the formation of fatty liver.
- Citation: Liu C, Wu B, Li L, Chen W, Li L, Han P, Zheng CQ. Expression of peroxisome proliferator-activated receptor-γ-coactivator-1 in liver of metabolic syndrome mice. Shijie Huaren Xiaohua Zazhi 2007; 15(18): 1989-1994
- URL: https://www.wjgnet.com/1009-3079/full/v15/i18/1989.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i18.1989
代谢综合征是21世纪全球重大卫生问题, 日益引起世界各国的广泛关注. 代谢综合征的主要表现是肥胖、糖尿病、血脂异常及胰岛素抵抗, 他不但与糖尿病心血管病变和心血管事件密切相关, 也与非酒精性脂肪性肝炎(nonalcoholic steatohepatitis, NASH)密切相关. NASH是由于肥胖、糖尿病、血脂异常及胰岛素抵抗等导致肝脂肪变性和细胞损伤后出现的炎症和纤维化状态[1-4]. 其病因及发病机制比较复杂, 至今尚未完全阐明. 过氧化物增殖体受体g共同作用因子-1(peroxisome proliferator-activated receptor-g coactivator-1, PGC-1)是一种过氧化物增殖体受体g(peroxisome proliferator-activated receptor-γ, PPARγ)及其他核受体家族基因转录的共同作用因子. 他对机体的能量代谢起着关键的调节作用, 是调节能量代谢基因的辅转录激活物, 在肝脏表达丰富, 参与糖代谢[5-9]. 目前关于代谢综合征及脂肪肝的肝脏PGC-1表达情况报道较少. 本实验通过对代谢综合征小鼠血脂、肝脏变化及肝脏PGC-1表达的观察, 探讨代谢综合征血脂、脂肪肝及肝脏PGC-1间的关系.
♀6-8周龄的SPF级C57BL/6J小鼠, 购于北京维通利华实验动物技术有限公司. PGC-1多克隆抗体购自美国Chemicon生物工程公司. PGC-1表达采用GIS-700D数码凝胶图像处理系统扫描分析结果. 腹部瘦肉及脂肪应用美国NORLAND XR236双能X线骨密度仪测定.
1.2.1 造模及分组: 对照组C57BL/6J小鼠, 喂以正常饮食(每100 g食物中, 含4 g脂肪、24 g蛋白、4.5 g粗纤维), 共10只, 喂养16 wk. 实验组未经处理的小鼠, 其中5只喂以正常食8 wk, 之后喂以高糖高脂食8 wk, 为A亚组; 其中10只喂以高脂高糖食16 wk, 为B亚组. 高糖高脂食(每100 g食物中, 含35.5 g脂肪, 主要是猪油、36.6 g碳水化合物, 主要是蔗糖).
1.2.2 测如下各指标: (1)腹部瘦肉及脂肪测定; (2)测定血脂、血清胰岛素(INS)及空腹血糖(FBG). 禁食12 h后, ip水合氯醛(4 mL/kg体质量)麻醉动物, 眼眶取血法采血, 分离血清, 采用日本HITACHI日立7600-020全自动生化分析仪, 选择性遮蔽法测定血清总胆固醇(TC)、甘油三酯(TG)、高密度脂蛋白(HDL); 酶法测定FBG; 测定血清总蛋白(TP)、白蛋白(ALB)、白蛋白/总蛋白(A/G)、碱性磷酸酶(ALP)、谷草转氨酶(AST)、谷丙转氨酶(ALT); 放免法测定INS(试剂购于北京原子能研究所); (3)测定肝脏重质量和脂质含量. 将动物肝脏洗尽血迹, 测定肝脏质量. 取少量剪成小块, 置110℃烘至恒定重质量, 精确称取干燥后的肝脏. 磨成细粉, 加氯仿:甲醇(2:1, V/V), 再按上述测定血清脂质的方法测脂质含量; (4)肝脏病理检查: 取肝脏一部分40 g/L甲醛固定后, 做石蜡切片, HE染色; (5)Western blot方法测定肝脏SR-B1的表达. 取-70℃保存的各组动物肝组织100 mg, 提取细胞膜蛋白, 经SDS-聚丙酰胺凝胶电泳, 采用兔抗小鼠的PGC-1多克隆抗体(购自美国Chemicon生物工程公司), 测定小鼠肝脏的PGC-1蛋白水平.
统计学处理 所有数据以mean±SD表示, 采用t检验.
实验组体质量与对照组相似, 但腹部瘦肉量显著低于对照(P<0.01), 脂肪量显著高于对照(P<0.01), 脂肪与瘦肉量的比值显著高于对照组(P<0.01)(表1).
高脂高糖食小鼠血清TC高于正常小鼠, B亚组低于A亚组, B亚组与正常小鼠间有显著差异(P<0.01); 血清HDL-C及TG低于正常小鼠, A亚组与正常动物间有显著差异(P<0.01, P<0.05); 血清FBG及INS高于正常小鼠, B亚组高于A亚组, B亚组的FBG与正常小鼠间有显著差异(P<0.05)(表2).
高脂高糖食的动物血清TP, ALB及A/G有下降的趋势, 并且与对照组比较B亚组的ALB及A/G有显著差异(P<0.05). 血清ALT, ALP及AST有升高的趋势, 与对照组比较B亚组的ALP有显著差异(P<0.05)(表3).
高脂高糖食小鼠肝脏的TC和TG含量显著高于正常动物, B亚组高于A亚组(表4).
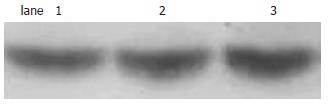
与对照组比较, 进高脂高糖食8 wk的小鼠肝脏PGC-1蛋白表达增加了1.78倍(P<0.05), 进高脂高糖食16 wk的小鼠肝脏PGC-1蛋白表达增加了2.13倍(P<0.01)(图2).
研究表明, 用高脂高糖食喂养C57BL/6J小鼠后, 可使其出现2型糖尿病[10]. 我们发现, 进高脂高糖食后C57BL/6J小鼠出现腹部脂肪增多、血清FBG及INS升高、血清HDL-C降低, 符合2001年ATP(adult treatment panel)报告Ⅲ中关于代谢综合征的诊断标准.
代谢综合征作为21世纪全球健康问题, 正日益引起世界的关注. 代谢综合征不但增加2型糖尿病大血管并发症, 心肌梗塞和中风的绝对风险, 也与脂肪性肝病相关. 代谢综合征的每一项指标如肥胖、糖耐量异常和糖尿病、血脂异常、高血压、高胰岛素血症和胰岛素抵抗(IR)均与脂肪性肝病密切相关. 研究表明, 代谢综合征指标每增加一项脂肪肝的危险性增加1-99倍. 糖尿病或糖耐量异常者肝纤维化的发生率增加7倍[11-15]. 同时, 非酒精性脂肪性肝病也增加了2型糖尿患者发生心血管并发症的风险[16].
本研究中, 与对照组比较, 进高脂高糖食的小鼠血清TC显著增高; 血清HDL-C及TG显著降低; 血清FBG显著增高. 提示在小鼠, 进食高脂高糖饮食可以导致代谢综合征. 高脂高糖食导致代谢综合征的机制可能是: (1)高脂高糖饮食可刺激鼠胰岛素的分泌和肝葡萄糖的输出, 从而导致肥胖和胰岛素抵抗; (2)高脂高糖饮食通过损害线粒体的呼吸导致胰岛素抵抗. 研究表明, 用高脂高糖饮食喂大鼠1 wk后, 可使♂Wistar大鼠肝糖原含量增高, 并通过损害线粒体的呼吸导致胰岛素抵抗. Schreyer et al[10]的研究也表明, 高脂高糖饮食可刺激鼠胰岛素的分泌和肝葡萄糖的输出, 从而导致肥胖和胰岛素抵抗. 本研究中进高脂高糖食小鼠血清TC显著高于正常小鼠. 其肝脏重质量高于正常小鼠, 进食16 wk的小鼠每克干燥的肝脏中TC和TG的含量显著高于正常鼠(P<0.01), 均大于正常小鼠的2倍; 病理检查亦显示实验组肝脏出现明显的脂肪肝表现; 血清A/G低于正常小鼠, 血清ALT, ALP及AST高于正常小鼠, 符合脂肪肝表现. 提示高脂高糖食在诱导小鼠出现IR的同时, 也能导致脂肪肝. 同时也提示, 脂肪性肝病与IR关系密切, 可能是IR的一部分.
脂肪性肝炎(steatohepatitis)是一种继发于肝脂肪变性和细胞损伤的炎症和纤维化状态. 按其病因分为非酒精性脂肪性肝炎(NASH)和酒精性肝炎(AH). 其病因及发病机制比较复杂, 至今尚未完全阐明. 流行病学研究显示, NASH与肥胖、糖耐量异常和糖尿病、血脂异常、高血压、高胰岛素血症和IR等密切相关. IR时, 肝摄取游离脂肪酸(FFA)增加, 肝细胞内FFA氧化或利用减少, 使细胞内酯化形成TG增多, 同时肝细胞将脂肪转运出肝脏的能力受损, 结果使肝细胞内脂质沉积, 形成脂肪肝. 此外, IR尚可诱导活性氧形成和TNF-α等表达增加, 进一步介导脂肪化的肝脏发生炎症、坏死和纤维化[17-19]. 反过来, NASH患者亦存在肝脏胰岛素的敏感性降低, 对葡萄糖和脂质的代谢作用降低、导致血脂异常、向心性肥胖、血糖升高等代谢综合征表现. 但代谢综合征时NASH产生的分子机制, 目前尚不清楚, 可能与多种因素有关[18-20], 其中PGC-1的作用受到人们的重视. PGC-1是由染色体4p15.1区域的基因编码的一种核受体家族基因转录的共同作用因子, 他参与葡萄糖, 脂肪的代谢, 因而也是能量代谢的因子, 在肝脏表达丰富[21-22]. 在亚洲印度人, PGC-1的Thr394Thr基因多型性与2型糖尿病相关[23]; 而在代谢综合征青少年中, PGC-1的Gly482 Ser基因多型性与高血压有关[24]. 我们研究中, 高脂高糖食小鼠在血TC, FBG增高, HDL-C降低及肝功能改变的同时, PGC-1蛋白表达量, 进高脂高糖食8和16 wk的小鼠约为正常小鼠的1.78及2.13倍, 此结果与培养的肝细胞对葡萄糖的反应一致, 提示PGC-1可能与代谢综合征及脂肪性肝炎的发生、发展有关. 代谢综合征小鼠肝脏PGC-1蛋白表达的增高的原因尚不清楚, 可能是对代谢紊乱的代偿, 并参与脂肪肝的形成. PGC-1表达增加可能与肝脏血糖及血清TC水平升高有关, 研究表明, PGC-1能通过HNF4α起始肝脏脂肪酸b氧化的限速酶肉毒碱棕榈酰基转移酶(L-CPTⅠ)基因的转录而影响脂代谢. 同时, PGC-1还可通过诱导胆固醇7α羟化酶基因的表达来调节体内胆固醇的平衡[25]. 在与脂肪细胞分化的关系中, PGC-1作为PPARg的辅激活因子可激活决定棕色脂肪细胞主要表型的基因, 如解偶联蛋白1、核受体因子等的表达, 提示PGC-1可促进棕色脂肪形成[26]. 另外, PGC-1与糖异生关系密切. PGC-1能诱导糖异生的基因, 磷酸烯醇丙酮酸激酶, G-6-P及1, 6二磷酸果糖酶的mRNA水平的增高, 从而使糖异生增强, 血糖增高. 血清中INS水平是否与PGC-1有关还需进一步研究[27]. 本实验中肝脏的脂质含量的改变比血清中TC和TG变化大, 可能肝脏的脂质含量受餐后脂质水平影响更大. 由于条件所限, 本研究仅测定了空腹血脂, 而未测定餐后血脂, 尚需进一步研究餐后血脂与肝脏脂质含量的关系. 另外2型糖尿病致肝脏的TG含量增高的机制已较清楚, 肝脏中胆固醇含量增高还未受到重视, 胆固醇性脂肪肝的形成机制还不清楚.
总之, 高脂高糖食C57BL/6J小鼠可作为代谢综合征动物模型, 高脂高糖食可致非酒精性脂肪肝, 肝脏的PGC-1蛋白表达量高于正常食小鼠, 并可能参与了代谢综合征和脂肪肝的形成. 本实验仅对进高脂高糖食所致的代谢综合征小鼠进行研究, 还需要进一步观察血脂正常后和/或血糖正常后肝脏PGC-1的表达改变, 并明确其主要影响因素.
非酒精性脂肪性肝炎与代谢综合征及糖尿病密切相关, 但其发生的机制尚不清楚. PGC-1是核受体家族基因转录的共同作用因子, 参与葡萄糖, 脂肪等能量的代谢, 在肝脏表达丰富, 因而其与糖尿病和胰岛素抵抗的关系受到人们的关注.
国内外研究表明, PGC-1位于染色体4p15.1, 在印第安比马人中, 该区域与人空腹胰岛素浓度相关. PGC-1基因多型性可能与糖尿病及代谢综合征有关. PGC-1对机体的能量代谢起着关键的调节作用. 在线粒体脂肪酸β-氧化酶基因的转录调控中, 他起着重要的作用. 同时, 他也是葡萄糖摄取和肝糖异生及葡萄糖转运的重要作用因子.
有关PGC-1与血糖及能量代谢关系虽有部分文献报道, 但PGC-1与高脂高糖食诱导的代谢综合征小鼠的非酒精性脂肪性肝炎相关性的研究, 国内外报道较少.
总结此文章在实际应用中的价值, 或对应用的指导、改进作用, 以及在将来应用中的前景. 对PGC-1的深入研究有利于进一步了解代谢综合征发生非酒精性脂肪性肝炎的分子机制, 为非酒精性脂肪性肝炎的治疗提供一定的理论依据.
非酒精性脂肪性肝炎:是由于肥胖、糖尿病、血脂异常及胰岛素抵抗等导致肝脂肪变性和细胞损伤后出现的炎症和纤维化状态.
本文作者采用生化、病理等方法观察了代谢综合征小鼠肝脏过氧化物增殖体受体g共同作用因子-1(PGC-1)的表达, 立题新颖, 思路清晰, 方法得当, 有较高的理论价值.
编辑: 王晓瑜 电编:张敏
| 1. | Parekh S, Anania FA. Abnormal lipid and glucose metabolism in obesity: implications for nonalcoholic fatty liver disease. Gastroenterology. 2007;132:2191-2207. [PubMed] |
| 2. | Shoelson SE, Herrero L, Naaz A. Obesity, inflamma-tion, and insulin resistance. Gastroenterology. 2007;132:2169-2180. [PubMed] |
| 3. | Ogden CL, Yanovski SZ, Carroll MD, Flegal KM. The epidemiology of obesity. Gastroenterology. 2007;132:2087-2102. [PubMed] |
| 4. | Forgione A, Miele L, Cefalo C, Gasbarrini G, Grieco A. Alcoholic and nonalcoholic forms of fatty liver disease. Minerva Gastroenterol Dietol. 2007;53:83-100. [PubMed] |
| 5. | Spiegelman BM, Puigserver P, Wu Z. Regulation of adipogenesis and energy balance by PPARgamma and PGC-1. Int J Obes Relat Metab Disord. 2000;24 Suppl 4:S8-10. [PubMed] |
| 6. | Rohas LM, St-Pierre J, Uldry M, Jager S, Handschin C, Spiegelman BM. A fundamental system of cellular energy homeostasis regulated by PGC-1alpha. Proc Natl Acad Sci U S A. 2007;104:7933-7938. [PubMed] |
| 7. | Sadana P, Park EA. Characterization of the transactivation domain in the peroxisome-proliferator-activated receptor gamma co-activator (PGC-1). Biochem J. 2007;403:511-518. [PubMed] |
| 8. | Handschin C, Spiegelman BM. Peroxisome proliferator-activated receptor gamma coactivator 1 coactivators, energy homeostasis, and metabolism. Endocr Rev. 2006;27:728-735. [PubMed] |
| 9. | Uldry M, Yang W, St-Pierre J, Lin J, Seale P, Spiegelman BM. Complementary action of the PGC-1 coactivators in mitochondrial biogenesis and brown fat differentiation. Cell Metab. 2006;3:333-341. [PubMed] |
| 10. | Schreyer SA, Wilson DL, LeBoeuf RC. C57BL/6 mice fed high fat diets as models for diabetes-accelerated atherosclerosis. Atherosclerosis. 1998;136:17-24. [PubMed] |
| 11. | 范 建高. 代谢综合征与脂肪肝. 国外医学内分泌学分册. 2002;22:273-275. |
| 12. | Neuschwander-Tetri BA. Fatty liver and the metabolic syndrome. Curr Opin Gastroenterol. 2007;23:193-198. [PubMed] |
| 13. | Gholam PM, Flancbaum L, Machan JT, Charney DA, Kotler DP. Nonalcoholic fatty liver disease in severely obese subjects. Am J Gastroenterol. 2007;102:399-408. [PubMed] |
| 14. | Marchesini G, Brizi M, Bianchi G, Tomassetti S, Bugianesi E, Lenzi M, McCullough AJ, Natale S, Forlani G, Melchionda N. Nonalcoholic fatty liver disease: a feature of the metabolic syndrome. Diabetes. 2001;50:1844-1850. [PubMed] |
| 15. | 范 建高, 朱 军, 李 新建, 李 锐, 戴 菲, 宋 晓敏, 陈 兰, 李 锋, 陈 世耀. 上海市成人脂肪肝患病率及其危险因素流行病学调查. 中华肝脏病杂志. 2005;13:83-88. |
| 16. | Targher G, Bertolini L, Padovani R, Rodella S, Tessari R, Zenari L, Day C, Arcaro G. Prevalence of nonalcoholic fatty liver disease and its association with cardiovascular disease among type 2 diabetic patients. Diabetes Care. 2007;30:1212-1218. [PubMed] |
| 17. | Baranova A, Randhawa M, Jarrar M, Younossi ZM. Adipokines and melanocortins in the hepatic manifestation of metabolic syndrome: nonalcoholic fatty liver disease. Expert Rev Mol Diagn. 2007;7:195-205. [PubMed] |
| 19. | 郭 津生, 沈 沪佳, 王 吉耀. 非酒精性脂肪性肝炎发病机制的研究进展. 国外医学消化系疾病分册. 2005;25:269-272. |
| 20. | Osterreicher CH, Brenner DA. The genetics of nonalcoholic fatty liver disease. Ann Hepatol. 2007;6:83-88. [PubMed] |
| 21. | Master SR, Hartman JL, D'Cruz CM, Moody SE, Keiper EA, Ha SI, Cox JD, Belka GK, Chodosh LA. Functional microarray analysis of mammary organogenesis reveals a developmental role in adaptive thermogenesis. Mol Endocrinol. 2002;16:1185-1203. [PubMed] |
| 22. | Finck BN, Kelly DP. PGC-1 coactivators: inducible regulators of energy metabolism in health and disease. J Clin Invest. 2006;116:615-622. [PubMed] |
| 23. | Vimaleswaran KS, Radha V, Ghosh S, Majumder PP, Deepa R, Babu HN, Rao MR, Mohan V. Peroxisome proliferator-activated receptor-gamma co-activator-1alpha (PGC-1alpha) gene polymor-phisms and their relationship to Type 2 diabetes in Asian Indians. Diabet Med. 2005;22:1516-1521. [PubMed] |
| 24. | Sookoian S, Garcia SI, Porto PI, Dieuzeide G, Gonzalez CD, Pirola CJ. Peroxisome proliferator-activated receptor gamma and its coactivator-1 alpha may be associated with features of the metabolic syndrome in adolescents. J Mol Endocrinol. 2005;35:373-380. [PubMed] |
| 25. | Shin DJ, Campos JA, Gil G, Osborne TF. PGC-1alpha activates CYP7A1 and bile acid biosynthesis. J Biol Chem. 2003;278:50047-50052. [PubMed] |
| 26. | Louet JF, Hayhurst G, Gonzalez FJ, Girard J, Decaux JF. The coactivator PGC-1 is involved in the regulation of the liver carnitine palmitoyltransferase I gene expression by cAMP in combination with HNF4 alpha and cAMP-response element-binding protein (CREB). J Biol Chem. 2002;277:37991-38000. [PubMed] |