修回日期: 2007-03-21
接受日期: 2007-03-31
在线出版日期: 2007-06-18
钙池操纵的Ca2+通道(store-operated Ca2+ channels, SOC)是非兴奋细胞Ca2+内流的主要通道之一, 参与多种病理和生理过程, 在钙信号通路的研究中, SOC的激活机制一直是人们关注的焦点之一, 迄今为止, 钙内流因子模型(Ca2+ influx factor model, CIF model)和构象耦联模型(conformational coupling model)受到广泛关注. 部分学者已经从很多不同类型的细胞中提取出CIF, 并证实钙非依赖性的磷脂酶A2(Ca2+-independent phospholipase A2, iPLA2)作为CIF的底物, 在某些类型细胞的SOC激活过程中发挥重要作用, 并进一步提出了ER-CIF-iPLA2-CaM-LysoPLs-SOC通路模型. 瞬时受体电位(transient receptor potential, TRP)通道蛋白与l, 4, 5-磷酸肌醇受体(inositol 1, 4, 5 trisphosphate receptor, IP3R)的结构连接作为构象耦联模型的基础已被广泛证实, 随着对IP3R, Ryanodine受体、肌动蛋白等在钙信号通路中所发挥作用的深入研究, 构象耦联模型将得到不断补充和完善. SOC激活机制的破解, 将对进一步完善非兴奋细胞的钙通道特性及其调节机制理论带来重大突破.
引文著录: 张子超, 张宗明. 钙池操纵的Ca2+通道的激活机制研究进展. 世界华人消化杂志 2007; 15(17): 1873-1880
Revised: March 21, 2007
Accepted: March 31, 2007
Published online: June 18, 2007
As one of the major Ca2+ channels for Ca2+ influx in non-excitable cells, the store-operated Ca2+ channel (SOC) is involved in a variety of pathological and physiological processes. The SOC has received much scientific attention regarding sub-types of the receptor-activated Ca2+ channel. The activation mechanisms of SOCs have always been an important focus of research on Ca2+ signal pathways. However, a generally accepted theory has yet to be established. The Ca2+ influx factor (CIF) model and the conformational coupling model are two widely researched models. CIF has been extracted from various types of cells, and it has been proven that Ca2+-independent phospholipase A2 is a substrate of CIF, playing a crucial role in activating the SOC in certain cells. These findings led to the ER-CIF-iPLA2-CaM-LysoPLs-SOC pathway model hypothesis. The structural junction between the TRP channel protein and the inositol-1, 4, 5-trisphosphate receptor is the foundation of the conformational coupling model, and has wide acceptance. Future research into the roles of the inositol-1, 4, 5-trisphosphate receptor, the ryanodine receptor and actin in the Ca2+ signal pathway should reinforce the conformational coupling model. Deciphering the mechanism of SOC activation will represent a breakthrough in our understanding of the characteristics of this Ca2+ channel and its regulative mechanism.
- Citation: Zhang ZC, Zhang ZM. Advances in understanding the activation mechanism of store-operated Ca2+ channels. Shijie Huaren Xiaohua Zazhi 2007; 15(17): 1873-1880
- URL: https://www.wjgnet.com/1009-3079/full/v15/i17/1873.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i17.1873
钙离子(Ca2+)作为重要的第二信使, 参与调节细胞众多的生理和病理过程[1-2]. 细胞内Ca2+时间和空间的分布受离子通道、结合蛋白、钙泵和转运体等的调节. 钙池操纵的Ca2+通道(SOC)存在于大多数非兴奋细胞和部分兴奋细胞上. SOC激活介导的Ca2+内流(SOCE)具有调节细胞多种重要功能的作用, 如细胞分泌、酶的活性(从而调控如葡萄糖代谢、一氧化氮和环磷酸腺苷合成等)、基因转导、细胞周期以及细胞凋亡[2]. 已知真核细胞内质网(endoplasmic reticulum, ER)等钙池释放及细胞膜上Ca2+通道的开放可使细胞内Ca2+浓度升高[3], 但SOC激活的确切机制迄今尚不清楚.
SOC是一类由钙池排空Ca2+后激活的、存在于细胞膜上的特殊Ca2+通道. 但细胞膜上有些Ca2+通道的开放并不依赖于钙池充分耗竭, 当钙池仅释放部分Ca2+或某一区域释放Ca2+时也能将其激活; 有些通道不仅对Ca2+, 对其他如Na+、Ba2+、Mg2+等阳离子一样具有通透性, 通道电导也存在明显差异. 部分学者根据通道电导、离子选择性等将SOC分为主要的两大类, 即: Ca2+-SOC(CRAC)和多种阳离子(cation)-SOC[4]. 随着orail、基质交感蛋白(stromal interaction protein, STIM)等相关分子的发现[3,5-7], 进一步的分型将通过对SOC家族各个通道分子特征的鉴定来确定.
1989年Montell et al[8]从果蝇复眼中分离出瞬时受体电位(transient receptor potential, TRP)基因及其表达蛋白, 至今人们已经在哺乳动物中发现了7种TRP类型. TRP蛋白在分子结构上与哺乳动物电压依赖性Ca2+通道(voltage-dependent Ca2+ channel, VDCC)非常类似, 但没有电压敏感性位点, 仅能构成非电压依赖的Ca2+通道. 由于TRP通道蛋白与SOC具有很多相似的通道特性和功能, 因此人们认为TRP基因很可能是编码SOC的基因, 或者TRP蛋白是SOC的主要组成部分, 甚至有学者将hTRP3通道(human TRP3 channel)当作典型的SOC[9-11]. 由于缺乏高度特异性的SOC配体, 也缺乏高度选择性的SOC抑制剂, 因此目前尚未能分离纯化出构成SOC通道的蛋白. 至今对于SOC分子组成的研究, 主要围绕TRP通道开展[12-15].
钙池耗竭是如何与细胞膜上的通道相联系的? 最初人们提出的4种假设模型是: (1)钙内流因子模型(Ca2+ influx factor model, CIF model); (2)构象耦联模型(conformational coupling model); (3)囊泡融合模型(vesicular fusion model); (4)Ca2+调节模型(Ca2+ regulation model). 其中, CIF模型和构象耦联模型至今得到最多的支持和完善. CIF模型的原始构想是由Takemura et al[16]于1989年首先提出, 该模型假设在钙池耗竭后会产生一种信使分子, 从钙池释放进入细胞质, 然后扩散至细胞膜激活SOC. Irvine et al[17]和Berridge et al[18]于1990年提出了构象耦联模型, 他们认为ER上的l, 4, 5-磷酸肌醇受体(inositol 1, 4, 5 trisphosphate receptor, IP3R)与细胞膜上的SOC之间存在结构上的连接, 当钙池释放Ca2+后, IP3R发生构象改变, 通过"蛋白-蛋白"的直接相互作用将信号传递到细胞膜上的SOC并将其激活.
CIF模型也被称为弥散信使模型(diffusible messenger model). Randriamampita et al[19]首先从钙池耗竭的Jurkat细胞中获得一种粗制提取物, 将其作用于靶细胞上会引起相应的Ca2+内流. 这种特殊因子被称为钙内流因子(Ca2+ influx factor, CIF).
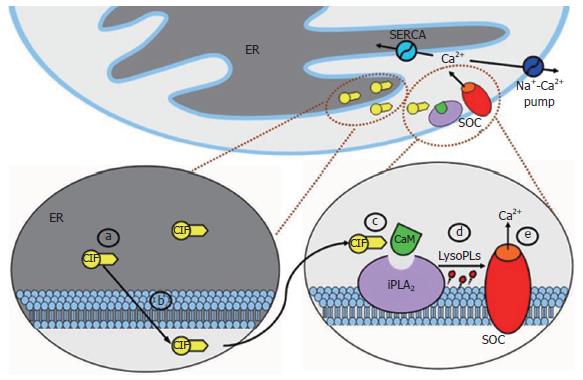
2.1.1 CIF及其活性鉴定: 诸多学者在不同细胞中应用不同方法分别获得了相似的CIF提取物, 并验证了CIF存在的真实性及其功能特征[20-25]. Thomas et al[20], Kim et al[21]运用新的提纯方法从上述提取物中获得一种特殊成分, 通过显微注射法将其注入靶细胞后激活了钙依赖性的氯离子电流(Ca2+-dependent Cl- current), 这种电流通常被认为是由Ca2+内流引发. Trepakova et al[23]分别从酵母及人类血小板中获得了具有相同特性的CIF. 部分学者将阴离子交换高效液相色谱分析技术(anion-exchange HPLC)引入到CIF的提纯方法中, 分离出的一种特殊片段能够在不引发钙池释放Ca2+的情况下激活Ca2+内流. Trepakova et al[23]首次验证了CIF对单个SOC的作用. 他们在膜片钳内面向外(inside-out)的单通道记录模式下证明CIF(包括上述粗制提取物和CIF片段)能够充分激活单个的SOC. 通过目前的研究结果, 部分学者认为CIF是一种分子大小约为600 Da的弥散信使, 能够抗热、抗碱, 不会被蛋白酶破坏, 但能被磷酸酶以及对糖和核苷酸起作用的化学处理破坏, 这些特性说明他可能是某种磷酸化的糖或核苷酸之类的相关分子.
2.1.2 iPLA2的相关作用: 有研究显示, SOC被激活后即使将CIF冲洗掉, 通道仍然处于开放状态[26]. 部分学者认为CIF是通过激活钙非依赖性的磷脂酶A2(Ca2+-independent phospholipase A2, iPLA2)影响SOC的. iPLA2的主要作用是水解和重塑细胞内磷脂, 其在不同类型细胞和组织中具有多种重要功能[27-30]. iPLA2的β亚型(iPLA2β)具有一种重要特性: 他的激活不依赖于Ca2+, 而是被钙调蛋白(calmodulin, CaM)所调节. 当iPLA2β与CaM结合, 其功能将被抑制, 移除CaM会激活iPLA2β, 并产生花生四烯酸(arachidonic acid, AA)和溶血磷脂(lysophospholipids, LysoPLs). Smani et al[31]的研究结果显示, 不同类型细胞SOC的激活过程必然会有iPLA2参与. Smani et al[24]进一步证明, 将CaM从iPLA2移除会激活单个SOC; 外源性的应用LysoPLs, 能够激活整个靶细胞的SOC. 更为重要的是, 实验证据显示CIF能够将CaM从iPLA2移除[24].
2.1.3 ER-CIF-iPLA2-CaM-LysoPLs-SOC通路模型: 根据这些重要发现, 一个更为细化的CIF模型被提出, 即ER-CIF-iPLA2-CaM-LysoPLs-SOC通路模型[24], 并于最近得到进一步验证[25]. 如图1所示, ER排空Ca2+后, 在耗竭的钙池中通过某种未知反应产生一种信使分子CIF, CIF释放入细胞质后扩散至细胞膜, 在细胞膜附近引发一系列级联反应: CIF从与细胞膜相结合的iPLA2上移除具有抑制作用的CaM, iPLA2被激活后产生LysoPLs, LysoPLs通过直接作用或者某种未知的间接过程激活SOC. 同时, 这个模型也能够解释SOCE是如何被终止的, 即Ca2+重填钙池后停止产生CIF, CaM与iPLA2重新结合, iPLA2失活后停止产生LysoPLs, SOC活性和Ca2+内流也相应被终止. iPLA2在SOC激活中的关键作用已经在血小板、平滑肌细胞、Jurkat细胞、RBL细胞和前列腺癌上皮细胞中得到证实[24,31].
虽然这种通路模型能够对之前的部分实验现象给出看似合理的解释, 但针对该通路中的未知部分, 很多学者又提出了新的问题: (1)SOC和CIF的分子组成究竟是怎样的? (2)CIF是在哪里、如何产生的? (3)CIF将CaM从iPLA2移除的分子机制是什么? (4)iPLA2在细胞膜附近是如何定位的, 与SOC存在何种关系? (5)LysoPLs激活SOC的分子机制是什么, 是否还存在某些中间反应? (6)Ca2+重填钙池后停止产生CIF, 在细胞质中的CIF以及后面产生的LysoPLs是如何代谢的? SOCE具体是怎样被终止的? (7)如果该通路中的某些环节出现异常, 细胞会出现怎样的病理状态? 该假设模型每个步骤的具体细节, 仍然需要进一步的研究来验证.
2.1.4 CIF和其他信使分子: CIF并不是唯一能够激活SOC的弥散信使, 有些分子如IP3、环二磷酸腺苷核糖(cADP- ribose)[32]、鞘氨醇-1-磷酸盐(sphingosine-1-phosphate, Sp1P)[33]、溶血磷脂酸(lysophosphatidic acid)[34]、5, 6-环氧二十碳三烯酸(5, 6-epoxyeicosatrienoic acid)[35]甚至LysoPLs等, 也能够通过其他机制或SOCE级联反应下游阶段激活SOC. 但不是所有激活SOC的信使分子都能被称为CIF. 根据诸多学者对"CIF"的定义, 这个术语应该是专指那些在钙池耗竭后产生、通过特异性地激活SOC而引发Ca2+内流的弥散信使. 虽然至今CIF的分子组成、所包含的亚型或究竟有多少种分子符合上述定义还不清楚, 但在之前的实验结果以及今后的研究中仍需对其严格加以区分, 谈及其他Ca2+内流通路时, "CIF"应该被慎重使用.
构象耦联模型是由Irvine et al[17]和Berridge et al[18]于1990年先后提出, 之后又根据新的发现被多次修改[36-37]. 最初的假设模型认为: ER上的IP3R与细胞膜上的SOC通过"蛋白-蛋白"的直接相互作用, 将信息传递给SOC, 从而将其激活并引发SOCE. 这种假设与骨骼肌细胞的兴奋收缩耦联(excitation-contraction coupling)机制非常类似.
2.2.1 IP3R的结构和功能: IP3R是一种分子量约为240-260 kDa的糖蛋白, 主要分布于粗面内质网和外层核膜, 同时具有结合IP3和Ca2+通道的特性, 因此有人将其称为IP3调控的Ca2+通道. 该受体朝向细胞质部分有一段较长的N末端和一段较短的靠近跨膜位点的C末端, N末端约有428-650个氨基酸残基高度保守, 是与IP3结合的关键序列. IP3R为同型四聚体结构, 每个亚单位有2734或2749个氨基酸, 均可结合一个IP3分子, 从功能上区分为IP3结合部位、调节部位和通道部分. 该受体作为细胞内最大的受体之一, 存在3种亚型, 即IP3R1、IP3R2、IP3R3, 因组织和细胞类型不同而分布不同.
2.2.2 IP3R与TRP通道的连接: 大量实验结果表明, IP3R确实能够和多种TRP通道结合[15,38-41], 而且在膜片钳单通道记录模式下, IP3R能够直接激活TRPC3通道[9,39,42]. Kiselyov et al[9,39]的研究显示, HEK293细胞中完整的IP3R与hTRP3通道存在连接但并未发生相互作用, 钙池耗竭后hTRP3通道能被IP3R激活, 在膜片钳实验中IP3可恢复结合区对通道的调控, 作者因此认为IP3R的N末端作为一个关键的调控区域能够充分激活SOC, IP3R中的感应和传导区对于维持SOC的失活状态是必需的. Boulay et al[38]利用免疫共沉淀等方法证明IP3R能够与TRP通道结合, 并鉴定出F2q和F2g作为IP3R分子中的两个区域, 能够与TRP通道产生相互作用, F2q抑制了细胞膜上两种形式的Ca2+内流, F2g的作用正好相反, 据此认为IP3R具有双重作用, 细胞内IP3水平升高时能够使钙池释放Ca2+, 钙池内Ca2+浓度下降时又能激活CaCa2+内流. Rosado et al[41]应用免疫共沉淀法, 证明人类血小板中内生性表达的hTRP1通道与IP3R2(而不是IP3R1或IP3R3)存在结构上的连接. Tang et al[40]证实, 当有Ca2+存在时, IP3R与TRP通道间的作用能够被CaM抑制, 认为CaM和IP3R对于调控TRP通道的活性都起着非常重要的作用, 但各种TRP通道对他们的敏感性存在差异.
2.2.3 构象耦联模型的补充和修改: 尽管如此, 仍然有很多实验结果与构象耦联模型存在矛盾, 由此部分学者对原始模型进行了相应地补充和和修改.
2.2.3.1 IP3激活两种形式的Ca2+内流 van et al[43]证实, 一种剪切了C末端的IP3R突变体在细胞内表达后, 虽然不能引起钙池释放Ca2+, 却可以在IP3的作用下发生构象改变激活Ca2+内流. 该研究结果符合Berridge et al[37]的另外一种假设: 与Ca2+内流通道连接的IP3R不能使钙池释放Ca2+, 即丧失了本身作为Ca2+通道的特性, 避免了从钙池释放出的大量Ca2+聚集在连接区附近反馈性地抑制通道开放. 而且Huser et al[44]在对内皮细胞的研究中证实, ER区域性地释放Ca2+, 能够激活100 mm远某处的Ca2+内流, 这体现了钙池与其调控的Ca2+内流之间具有自我平衡功能, 即钙池无论以怎样的方式和程度释放Ca2+都能够被重填.
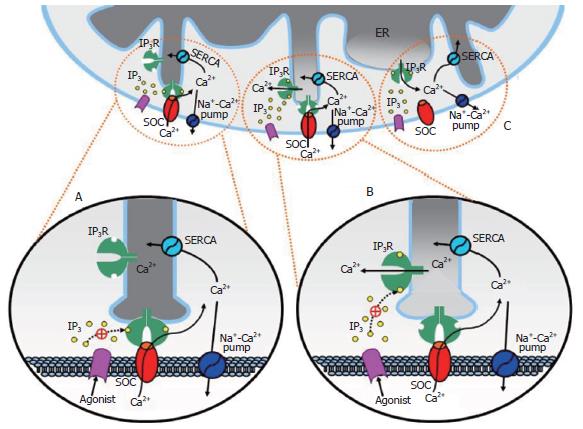
在总结上述相关研究后, Berridge对ER和IP3R的位置及结构做出了新的描述, 并提出IP3能够通过两种形式激活Ca2+内流的假设[37]. 如图2所示, 钙池ER靠近细胞膜区域形成周期性排列的指状突起, 突起上IP3R的顶部朝向细胞膜形成构象耦联的结构单位, 分隔ER和细胞膜之间的10 nm空间内显示出周期性的密度变化, 这里是IP3R传递信息的区域. 当激动剂激活膜表面受体后, 在细胞内相应的某片状区域产生IP3, 并通过两种形式激活Ca2+内流: 如果该片状区域覆盖IP3R与SOC的连接区(图2A), IP3直接激活IP3R, 后者发生构象改变, 将信息传递给与之连接的SOC引发Ca2+内流, 这种IP3R不具备Ca2+通道特性, 所以在该位点不会引发钙池释放Ca2+; 如果该片状区域在连接区附近(图2B), IP3激活未与SOC连接的IP3R并引起钙池区域性释放Ca2+, 这种区域性释放能够使与SOC连接的IP3R发生构象改变以激活SOC; 如果该片状区域更接近钙池其他部分(图2C), 只能引起钙池释放Ca2+而不会激活SOC. IP3的直接激活作用能够解释钙池耗竭前产生Ca2+内流的原因, 后一种激活作用解释了当钙池主体部分仍然含有大量Ca2+时, 钙池的区域性释放也能引发Ca2+内流. Berridge还指出, 两种激活方式可能同时存在于细胞中, 但他们的主要功能有所不同: 第一种方式主要引发受体激活的Ca2+内流, 后一种方式则体现了钙池的自我平衡功能.
2.2.3.2 SOC与IP3ROC 虽然很多TRP通道能够与IP3R结合, 其中有些也能与Ryanodine受体结合; 诸多旨在说明IP3R能够调控TRP通道的研究还牵涉到很多其他信号分子, 如SERCA、caveolin-1、磷脂酶C-β(phospholipase C-β, PLC-β)等, 人们怀疑IP3R与TRP通道的连接区对于调控SOC是否具有足够高的特异性. 此外TRP蛋白与SOC之间的关系仍有待进一步探讨. 部分学者认为, IP3R激活的Ca2+通道不同于SOC, 是一种新的阳离子通道家族, TRP蛋白可能属于这种通道之一. 有研究显示, 在人类前列腺癌上皮细胞[45-46]、肿瘤A431细胞[47]和HEK293细胞[48]中, 不同类型的Ca2+通道具有不同的激活方式和分子起源, 并可共存于同一细胞内. 在前列腺癌上皮细胞中[45], 一种阳离子通道能够在钙池耗竭后激活, 其开放依赖于iPLA2的调控; 另一种能够被IP3激活而对iPLA2不敏感, 中断IP3R和通道的连接能够使其失活. 前一种通道很可能是SOC, 依赖于TRP4的表达而不是TRP1, 后一种恰好相反.
Bolotina et al[4,49]认为不同类型的Ca2+通道能够对不同信号作出反应, 并可能共存于同一细胞的细胞膜上. 他们在ER-CIF-iPLA2-CaM-LysoPLs-SOC通路和构象耦联模型的基础上提出了新的假设. 两种类型的Ca2+通道可通过不同机制激活, 一种是由钙池操纵的, 即SOC, 另一种是由IP3R操纵的, 即IP3R操纵的Ca2+通道(IP3R-operated channel, IP3ROC). SOC能够通过ER-CIF-iPLA2-CaM-LysoPLs-SOC通路激活; IP3ROC与相应的IP3R连接, 钙池通过IP3R释放Ca2+使后者发生构象改变, 从而激活IP3ROC. 这两种Ca2+通道可能分别在不同类型细胞中起作用, 或在同一细胞的代谢过程中发挥不同作用. 这种模型与上述Berridge M的假设有相通之处.
2.2.3.3 分泌样耦联模型 构象耦联模型是基于"蛋白-蛋白"间的快速反应, 这与SOCE相对缓慢的激活过程不符, 为了解释这一矛盾, Patterson et al[36]提出了"分泌样耦联模型"(secretion-like coupling model): 钙池耗竭后, ER的外围部分在细胞骨架的作用下移向细胞膜, 使IP3R与SOC连接并调控SOCE, ER的迁移过程需要额外的时间, 这是SOCE激活过程相对缓慢的主要原因. 这个模型的主要依据是, 在部分细胞中稳定细胞骨架阻碍IP3R与SOC形成连接, 反之则能促进连接[36,50-51]. 但细胞骨架能够影响很多细胞膜上的离子通道致使细胞内外膜电位发生改变, 因此Ca2+内流很有可能是在电势驱动下产生. 在膜片钳全细胞(whole-cell)记录模式下钳制膜电位, RBL-1细胞中外围细胞骨架的状态变化并没有对SOC造成影响[50], 但在其他几种类型细胞中情况则相反[52]. 该模型成立的另外一个前提条件是IP3R的作用应该贯穿于整个Ca2+内流过程的始终. 在以前的研究中, 部分学者将2-aminoethoxydiphenyl borate (2-APB)作为IP3R的直接抑制剂应用于细胞, 抑制了thapsigargin激活的SOC[53]. 然而后面人们发现, 2-APB能够通过细胞外某一位点直接抑制SOC[50,54-55]. 应用IP3R的其他抑制剂, 如肝磷脂(heparin)等, SOC的激活不受影响[50-56]. 在DT40细胞中[54-55,57-58], 敲除3种表达IP3R的基因后, 细胞对IP3不再有反应, 但似乎仍然具有正常的SOCE. Kiselyov et al[59]认为, 在这种情况下Ryanodine受体可代替IP3R与SOC连接. 钌红(ruthenium red)作为Ryanodine受体的拮抗剂, 能够抑制上述DT40细胞的SOCE. 在RBL-1细胞中应用钌红和肝磷脂, SOCE也能正常激活[60].
该模型假设, 在静息状态下细胞膜上不存在SOC, 钙池耗竭后细胞通过一种分泌机制, 以囊泡融合的方式将SOC嵌入细胞膜. 其主要依据是, SNAP-25的突变体和能将其裂解的A型肉毒毒素(botulinum neurotoxin A)抑制了爪蟾卵母细胞的SOCE, B、E型肉毒毒素及破伤风毒素没有类似作用[61]. 在HEK293细胞中, A型肉毒毒素、布雷菲德菌素A(brefeldin A)和破伤风毒素也都能以相似的过程抑制SOCE[62]. 上述发现使部分学者产生了疑惑: 梭菌毒素的抑制作用是影响了细胞分泌还是仅仅阻碍了囊泡的迁移? 另外, 人们普遍认为非兴奋细胞不表达SNAP-25, 而是表达对肉毒毒素不敏感SNAP-23, 这在Scott et al[63]的实验中已得到证实. 更为重要的是, 过度表达的SNAP-23突变体、突变的NEM敏感型因子和重组的α-SNAP蛋白能够分别抑制转铁蛋白受体循环、ER迁移和钙依赖性的细胞分泌, 但都对SOCE没有影响[63-64]. 总之, 很多能够调节细胞分泌的因素都无法对SOC的激活造成影响, 至少在RBL细胞和HEK293细胞中, SOCE与细胞分泌没有必然联系.
经过近20 a的努力, 人们对SOC激活机制的研究已取得了实质性进展. 目前, 在最初的4种假设模型中, CIF模型和构象耦联模型得到最多的支持和完善. 不同实验小组证实了CIF的存在, 同时很多学者在构象耦联模型的基础上又提出很多新的观点. 虽然诸多学者在SOC激活机制的研究中取得了可喜进步, 但一些关键因素, 如CIF和SOC的分子组成等仍不清楚. 相信不久的将来, SOC激活机制研究的突破, 将对非兴奋细胞钙通道特性和调节的研究带来革命性变化, 进而促使与非兴奋细胞钙通道相关的生理学、病理生理学机制和临床防治研究取得重大进步.
钙池操纵的Ca2+通道(SOC)广泛存在于诸如肝细胞、Kupffer细胞等非兴奋细胞和部分兴奋细胞上, 是至今研究最多也最受重视的一个受体激活的Ca2+通道亚群, 但其具体的激活机制尚不清楚. 由于SOC具有调节细胞多种重要功能的作用, 因此其激活机制的深入研究对于基础医学和临床医学均具有重大意义.
在研究初期人们发现SOC与细胞内钙池耗竭存在密切联系, 但在后续实验中证实三磷酸肌醇及其受体、磷脂酶、钙调蛋白、肌动蛋白等多种细胞内分子均能对SOC的开放产生影响, 各国学者根据不同的研究结果分别提出了各自的假设模型, CIF模型和构象耦联模型如今得到了最多支持, 但也存在最多争论. 而且近1a来随着orail、基质交感蛋白等相关分子的发现, 人们在SOC激活机制的研究中得到了新的启示.
部分学者已从多种类型细胞中提取出具有相似特性的钙内流因子(CIF), ER-CIF-iPLA2-CaM-LysoPLs-SOC通路模型中的多数环节也已在近两年的实验中得到验证;支持构象耦联模型的学者证实了TRP通道蛋白与三磷酸肌醇受体(IP3R)确实存在结构连接, 并通过对内质网、Ryanodine受体、肌动蛋白等在钙信号通路中所发挥作用的分析, 解释了存在于该模型中的诸多问题.
国内针对SOC激活机制的综述尚未见报道, 本文较全面地总结了迄今关于SOC激活机制的观点及假设模型, 指出并分析了现存于各种观点中的问题及之间的矛盾.
由于SOC参与如细胞分泌、钙超载等诸多的生理和病理过程, 本文有助于加深并促进读者对部分与非兴奋细胞钙通道相关的生理学、病理生理学机制的了解.
本文具有较好的科学性, 创新性与可读性.
编辑: 王晓瑜 电编:何基才
| 1. | Jiang N, Zhang ZM, Liu L, Zhang C, Zhang YL, Zhang ZC. Effects of Ca2+ channel blockers on store-operated Ca2+ channel currents of Kupffer cells after hepatic ischemia/reperfusion injury in rats. World J Gastroenterol. 2006;12:4694-4698. [PubMed] |
| 2. | Parekh AB, Putney JW Jr. Store-operated calcium channels. Physiol Rev. 2005;85:757-810. [PubMed] |
| 3. | Gill DL, Spassova MA, Soboloff J. Signal transduction. Calcium entry signals--trickles and torrents. Science. 2006;313:183-184. [PubMed] |
| 4. | Bolotina VM, Csutora P. CIF and other mysteries of the store-operated Ca2+-entry pathway. Trends Biochem Sci. 2005;30:378-387. [PubMed] |
| 5. | Vig M, Peinelt C, Beck A, Koomoa DL, Rabah D, Koblan-Huberson M, Kraft S, Turner H, Fleig A, Penner R. CRACM1 is a plasma membrane protein essential for store-operated Ca2+ entry. Science. 2006;312:1220-1223. [PubMed] |
| 6. | Soboloff J, Spassova MA, Tang XD, Hewavitharana T, Xu W, Gill DL. Orai1 and STIM reconstitute store-operated calcium channel function. J Biol Chem. 2006;281:20661-20665. [PubMed] |
| 7. | Feske S, Gwack Y, Prakriya M, Srikanth S, Puppel SH, Tanasa B, Hogan PG, Lewis RS, Daly M, Rao A. A mutation in Orai1 causes immune deficiency by abrogating CRAC channel function. Nature. 2006;441:179-185. [PubMed] |
| 8. | Montell C, Rubin GM. Molecular characterization of the Drosophila trp locus: a putative integral membrane protein required for phototransduction. Neuron. 1989;2:1313-1323. [PubMed] |
| 9. | Kiselyov K, Xu X, Mozhayeva G, Kuo T, Pessah I, Mignery G, Zhu X, Birnbaumer L, Muallem S. Functional interaction between InsP3 receptors and store-operated Htrp3 channels. Nature. 1998;396:478-482. [PubMed] |
| 10. | Zhu X, Jiang M, Peyton M, Boulay G, Hurst R, Stefani E, Birnbaumer L. trp, a novel mammalian gene family essential for agonist-activated capacitative Ca2+ entry. Cell. 1996;85:661-671. [PubMed] |
| 11. | Hurst RS, Zhu X, Boulay G, Birnbaumer L, Stefani E. Ionic currents underlying HTRP3 mediated agonist-dependent Ca2+ influx in stably transfected HEK293 cells. FEBS Lett. 1998;422:333-338. [PubMed] |
| 12. | Woodard GE, Sage SO, Rosado JA. Transient receptor potential channels and intracellular signaling. Int Rev Cytol. 2007;256:35-67. [PubMed] |
| 13. | Kiselyov K, Shin DM, Kim JY, Yuan JP, Muallem S. TRPC channels: interacting proteins. Handb Exp Pharmacol. 2007;559-574. [PubMed] |
| 14. | Ambudkar IS, Bandyopadhyay BC, Liu X, Lockwich TP, Paria B, Ong HL. Functional organization of TRPC-Ca2+ channels and regulation of calcium microdomains. Cell Calcium. 2006;40:495-504. [PubMed] |
| 15. | Putney JW Jr. Inositol lipids and TRPC channel activation. Biochem Soc Symp. 2007;37-45. [PubMed] |
| 16. | Takemura H, Hughes AR, Thastrup O, Putney JW Jr. Activation of calcium entry by the tumor promoter thapsigargin in parotid acinar cells. Evidence that an intracellular calcium pool and not an inositol phosphate regulates calcium fluxes at the plasma membrane. J Biol Chem. 1989;264:12266-12271. [PubMed] |
| 17. | Irvine RF. 'Quantal' Ca2+ release and the control of Ca2+ entry by inositol phosphates--a possible mechanism. FEBS Lett. 1990;263:5-9. [PubMed] |
| 18. | Berridge MJ. Calcium oscillations. J Biol Chem. 1990;265:9583-9586. [PubMed] |
| 19. | Randriamampita C, Tsien RY. Emptying of intracellular Ca2+ stores releases a novel small messenger that stimulates Ca2+ influx. Nature. 1993;364:809-814. [PubMed] |
| 20. | Thomas D, Hanley MR. Evaluation of calcium influx factors from stimulated Jurkat T-lymphocytes by microinjection into Xenopus oocytes. J Biol Chem. 1995;270:6429-6432. [PubMed] |
| 21. | Kim HY, Thomas D, Hanley MR. Chromatographic resolution of an intracellular calcium influx factor from thapsigargin-activated Jurkat cells. Evidence for multiple activities influencing calcium elevation in Xenopus oocytes. J Biol Chem. 1995;270:9706-9708. [PubMed] |
| 22. | Csutora P, Su Z, Kim HY, Bugrim A, Cunningham KW, Nuccitelli R, Keizer JE, Hanley MR, Blalock JE, Marchase RB. Calcium influx factor is synthesized by yeast and mammalian cells depleted of organellar calcium stores. Proc Natl Acad Sci U S A. 1999;96:121-126. [PubMed] |
| 23. | Trepakova ES, Csutora P, Hunton DL, Marchase RB, Cohen RA, Bolotina VM. Calcium influx factor directly activates store-operated cation channels in vascular smooth muscle cells. J Biol Chem. 2000;275:26158-26163. [PubMed] |
| 24. | Smani T, Zakharov SI, Csutora P, Leno E, Trepakova ES, Bolotina VM. A novel mechanism for the store-operated calcium influx pathway. Nat Cell Biol. 2004;6:113-120. [PubMed] |
| 25. | Csutora P, Zarayskiy V, Peter K, Monje F, Smani T, Zakharov SI, Litvinov D, Bolotina VM. Activation mechanism for CRAC current and store-operated Ca2+ entry: calcium influx factor and Ca2+-independent phospholipase A2beta-mediated pathway. J Biol Chem. 2006;281:34926-34935. [PubMed] |
| 26. | Trepakova ES, Gericke M, Hirakawa Y, Weisbrod RM, Cohen RA, Bolotina VM. Properties of a native cation channel activated by Ca2+ store depletion in vascular smooth muscle cells. J Biol Chem. 2001;276:7782-7790. [PubMed] |
| 27. | Winstead MV, Balsinde J, Dennis EA. Calcium-independent phospholipase A(2): structure and function. Biochim Biophys Acta. 2000;1488:28-39. [PubMed] |
| 28. | Ramanadham S, Hsu FF, Zhang S, Jin C, Bohrer A, Song H, Bao S, Ma Z, Turk J. Apoptosis of insulin-secreting cells induced by endoplasmic reticulum stress is amplified by overexpression of group VIA calcium-independent phospholipase A2 (iPLA2 beta) and suppressed by inhibition of iPLA2 beta. Biochemistry. 2004;43:918-930. [PubMed] |
| 29. | Wang Z, Ramanadham S, Ma ZA, Bao S, Mancuso DJ, Gross RW, Turk J. Group VIA phospholipase A2 forms a signaling complex with the calcium/calmodulin-dependent protein kinase IIbeta expressed in pancreatic islet beta-cells. J Biol Chem. 2005;280:6840-6849. [PubMed] |
| 30. | Martinez J, Moreno JJ. Role of Ca2+-independent phospholipase A2 and cytochrome P-450 in store-operated calcium entry in 3T6 fibroblasts. Biochem Pharmacol. 2005;70:733-7339. [PubMed] |
| 31. | Smani T, Zakharov SI, Leno E, Csutora P, Trepakova ES, Bolotina VM. Ca2+-independent phospholipase A2 is a novel determinant of store-operated Ca2+ entry. J Biol Chem. 2003;278:11909-11915. [PubMed] |
| 32. | Thompson M, White T, Chini EN. Modulation of store-operated Ca2+ entry by cyclic-ADP-ribose. Braz J Med Biol Res. 2006;39:739-748. [PubMed] |
| 33. | Itagaki K, Hauser CJ. Sphingosine 1-phosphate, a diffusible calcium influx factor mediating store-operated calcium entry. J Biol Chem. 2003;278:27540-27547. [PubMed] |
| 34. | Itagaki K, Kannan KB, Hauser CJ. Lysophosphatidic acid triggers calcium entry through a non-store-operated pathway in human neutrophils. J Leukoc Biol. 2005;72:181-189. [PubMed] |
| 35. | Watanabe H, Vriens J, Prenen J, Droogmans G, Voets T, Nilius B. Anandamide and arachidonic acid use epoxyeicosatrienoic acids to activate TRPV4 channels. Nature. 2003;424:434-438. [PubMed] |
| 36. | Patterson RL, van Rossum DB, Gill DL. Store-operated Ca2+ entry: evidence for a secretion-like coupling model. Cell. 1999;98:487-499. [PubMed] |
| 37. | Berridge M. Conformational coupling: a physiological calcium entry mechanism. Sci STKE. 2004;pe33. [PubMed] |
| 38. | Boulay G, Brown DM, Qin N, Jiang M, Dietrich A, Zhu MX, Chen Z, Birnbaumer M, Mikoshiba K, Birnbaumer L. Modulation of Ca(2+) entry by polypeptides of the inositol 1,4,5-trisphosphate receptor (IP3R) that bind transient receptor potential (TRP): evidence for roles of TRP and IP3R in store depletion-activated Ca(2+) entry. Proc Natl Acad Sci U S A. 1999;96:14955-14960. [PubMed] |
| 39. | Kiselyov K, Mignery GA, Zhu MX, Muallem S. The N-terminal domain of the IP3 receptor gates store-operated hTrp3 channels. Mol Cell. 1999;4:423-429. [PubMed] |
| 40. | Tang J, Lin Y, Zhang Z, Tikunova S, Birnbaumer L, Zhu MX. Identification of common binding sites for calmodulin and inositol 1,4,5-trisphosphate receptors on the carboxyl termini of trp channels. J Biol Chem. 2001;276:21303-21310. [PubMed] |
| 41. | Rosado JA, Sage SO. Coupling between inositol 1,4,5-trisphosphate receptors and human transient receptor potential channel 1 when intracellular Ca2+ stores are depleted. Biochem J. 2000;350 Pt 3:631-635. [PubMed] |
| 42. | Kaznacheyeva E, Zubov A, Nikolaev A, Alexeenko V, Bezprozvanny I, Mozhayeva GN. Plasma membrane calcium channels in human carcinoma A431 cells are functionally coupled to inositol 1,4,5-trisphosphate receptor-phosphatidylinositol 4,5-bisphosphate complexes. J Biol Chem. 2000;275:4561-4564. [PubMed] |
| 43. | van Rossum DB, Patterson RL, Kiselyov K, Boehning D, Barrow RK, Gill DL, Snyder SH. Agonist-induced Ca2+ entry determined by inositol 1,4,5-trisphosphate recognition. Proc Natl Acad Sci U S A. 2004;101:2323-2327. [PubMed] |
| 44. | Huser J, Holda JR, Kockskamper J, Blatter LA. Focal agonist stimulation results in spatially restricted Ca2+ release and capacitative Ca2+ entry in bovine vascular endothelial cells. J Physiol. 1999;514:101-109. [PubMed] |
| 45. | Vanden Abeele F, Lemonnier L, Thebault S, Lepage G, Parys JB, Shuba Y, Skryma R, Prevarskaya N. Two types of store-operated Ca2+ channels with different activation modes and molecular origin in LNCaP human prostate cancer epithelial cells. J Biol Chem. 2004;279:30326-30337. [PubMed] |
| 46. | Pigozzi D, Ducret T, Tajeddine N, Gala JL, Tombal B, Gailly P. Calcium store contents control the expression of TRPC1, TRPC3 and TRPV6 proteins in LNCaP prostate cancer cell line. Cell Calcium. 2006;39:401-415. [PubMed] |
| 47. | Gusev K, Glouchankova L, Zubov A, Kaznacheyeva E, Wang Z, Bezprozvanny I, Mozhayeva GN. The store-operated calcium entry pathways in human carcinoma A431 cells: functional properties and activation mechanisms. J Gen Physiol. 2003;122:81-94. [PubMed] |
| 48. | Bugaj V, Alexeenko V, Zubov A, Glushankova L, Nikolaev A, Wang Z, Kaznacheyeva E, Bezprozvanny I, Mozhayeva GN. Functional properties of endogenous receptor- and store-operated calcium influx channels in HEK293 cells. J Biol Chem. 2005;280:16790-16797. [PubMed] |
| 49. | Bolotina VM. Store-operated channels: diversity and activation mechanisms. Sci STKE. 2004;2004:pe34. [PubMed] |
| 50. | Bakowski D, Glitsch MD, Parekh AB. An examination of the secretion-like coupling model for the activation of the Ca2+ release-activated Ca2+ current I(CRAC) in RBL-1 cells. J Physiol. 2001;532:55-71. [PubMed] |
| 51. | Rosado JA, Jenner S, Sage SO. A role for the actin cytoskeleton in the initiation and maintenance of store-mediated calcium entry in human platelets. Evidence for conformational coupling. J Biol Chem. 2000;275:7527-7533. [PubMed] |
| 52. | Venkatachalam K, van Rossum DB, Patterson RL, Ma HT, Gill DL. The cellular and molecular basis of store-operated calcium entry. Nat Cell Biol. 2002;4:E263-E272. [PubMed] |
| 53. | Ma HT, Patterson RL, van Rossum DB, Birnbaumer L, Mikoshiba K, Gill DL. Requirement of the inositol trisphosphate receptor for activation of store-operated Ca2+ channels. Science. 2000;287:1647-1651. [PubMed] |
| 54. | Prakriya M, Lewis RS. Potentiation and inhibition of Ca(2+) release-activated Ca(2+) channels by 2-aminoethyldiphenyl borate (2-APB) occurs independently of IP(3) receptors. J Physiol. 2001;536:3-19. [PubMed] |
| 55. | Broad LM, Braun FJ, Lievremont JP, Bird GS, Kurosaki T, Putney JW Jr. Role of the phospholipase C-inositol 1,4,5-trisphosphate pathway in calcium release-activated calcium current and capacitative calcium entry. J Biol Chem. 2001;276:15945-15952. [PubMed] |
| 56. | Hoth M, Penner R. Depletion of intracellular calcium stores activates a calcium current in mast cells. Nature. 1992;355:353-356. [PubMed] |
| 57. | Sugawara H, Kurosaki M, Takata M, Kurosaki T. Genetic evidence for involvement of type 1, type 2 and type 3 inositol 1,4,5-trisphosphate receptors in signal transduction through the B-cell antigen receptor. EMBO J. 1997;16:3078-3088. [PubMed] |
| 58. | Ma HT, Venkatachalam K, Li HS, Montell C, Kurosaki T, Patterson RL, Gill DL. Assessment of the role of the inositol 1,4,5-trisphosphate receptor in the activation of transient receptor potential channels and store-operated Ca2+ entry channels. J Biol Chem. 2001;276:18888-18896. [PubMed] |
| 59. | Kiselyov K, Shin DM, Shcheynikov N, Kurosaki T, Muallem S. Regulation of Ca2+-release-activated Ca2+ current (Icrac) by ryanodine receptors in inositol 1,4,5-trisphosphate-receptor-deficient DT40 cells. Biochem J. 2001;360:17-22. [PubMed] |
| 60. | Fierro L, Parekh AB. On the characterisation of the mechanism underlying passive activation of the Ca2+ release-activated Ca2+ current ICRAC in rat basophilic leukaemia cells. J Physiol. 1999;520 Pt 2:407-416. [PubMed] |
| 61. | Yao Y, Ferrer-Montiel AV, Montal M, Tsien RY. Activation of store-operated Ca2+ current in Xenopus oocytes requires SNAP-25 but not a diffusible messenger. Cell. 1999;98:475-485. [PubMed] |
| 62. | Alderton JM, Ahmed SA, Smith LA, Steinhardt RA. Evidence for a vesicle-mediated maintenance of store-operated calcium channels in a human embryonic kidney cell line. Cell Calcium. 2000;28:161-169. [PubMed] |
| 63. | Scott CC, Furuya W, Trimble WS, Grinstein S. Activation of store-operated calcium channels: assessment of the role of snare-mediated vesicular transport. J Biol Chem. 2003;278:30534-30539. [PubMed] |