修回日期: 2007-03-15
接受日期: 2007-04-02
在线出版日期: 2007-05-28
目的: 研究游离脂肪酸对3T3-L1脂肪细胞核因子NF-kBp65表达及转位的影响, 探讨游离脂肪酸诱导胰岛素抵抗的分子机制.
方法: 诱导成熟的3T3-L1脂肪细胞与0.3, 0.5, 1.0 mmol/L的软脂酸(PA)培养6-24 h, 用葡萄糖氧化酶法检测培液中的葡萄糖消耗量, 以2-脱氧-[3H]-D-葡萄糖摄入法观察葡萄糖的转运率, 用Western blot检测总NF-kBp65蛋白及核NF-kBp65蛋白的表达, 用激光扫描共聚焦(CLSM)对NF-kBp65进行定位显示.
结果: 0.3-1.0 mmol/L软脂酸作用6-24 h后, 3T3-L1脂肪细胞的葡萄糖消耗明显减少(3.03±0.34, 2.71±0.36, 2.64±0.25 mmol/L), 呈时间剂量依赖效应, 其作用不需要胰岛素的存在; 0.3-1.0 mmol/L软脂酸作用6-24 h显著减少3T3-L1脂肪细胞胰岛素刺激的葡萄糖转运率(64%, 33%, 32%), 呈时间剂量依赖效应; 核NF-kBp65蛋白表达明显增加, CLSM显示NF-kBp65核转位增加, 但软脂酸对3T3-L1脂肪细胞总NF-kBp65蛋白的表达无明显影响.
结论: 游离脂肪酸可以诱导胰岛素抵抗, 其分子机制可能与FFAs刺激NF-kB的活化转位调节相关基因的表达有关.
引文著录: 易屏, 陆付耳, 陈广, 徐丽君, 王开富. 游离脂肪酸刺激核因子NF-κBp65核转位诱导3T3-L1脂肪细胞胰岛素抵抗的分子机制. 世界华人消化杂志 2007; 15(15): 1706-1712
Revised: March 15, 2007
Accepted: April 2, 2007
Published online: May 28, 2007
AIM: To investigate the effect of free fatty acids (FFAs) on nuclear factor-kB p65 (NF-kBp65) expression and translocation in 3T3-L1 adipocytes and its possible molecular mechanism.
METHODS: 3T3-L1 adipocytes were treated for 6 to 24 hours with palmic acid (0.3, 0.5, 1.0 mmol/L) to induce insulin resistance. Glucose oxidase method was employed to measure the glucose consumption in the medium and 2-deoxy--[3H]-D-glucose method was used for the determination of glucose uptake. Western blot was used to determine the protein expression of total NF-kBp65 and nuclear NF-kBp65. The distribution of NF-kBp65 was investigated by confocal laser scanning microscopy (CLSM).
RESULTS: After the treatment with 0.3, 0.5 and 1.0 mmol/L of palmic acid for 6 to 24 hours, the glucose consumption (3.03 ± 0.34, 2.71 ± 0.36, 2.64 ± 0.25 mmol/L) and the insulin-stimulated glucose transport of 3T3-L1 adipose cells (64%, 33%, 32%) were decreased in a dose- and time-dependent manner. Both the expression of nuclear NF-kBp65 and nuclear translocation of NF-kBp65 were increased in a dose- and time-dependent manner. But the total NF-kBp65 protein expression had no marked changes during this study.
CONCLUSION: FFAs can induce insulin resistance, the molecular mechanism of which might be associated with the activation and translocation of NF-kBp65.
- Citation: Yi P, Lu FE, Chen G, Xu LJ, Wang KF. Molecular mechanism of insulin resistance induced by free fatty acids in 3T3-L1 adipocytes through targeting nuclear-kB p65. Shijie Huaren Xiaohua Zazhi 2007; 15(15): 1706-1712
- URL: https://www.wjgnet.com/1009-3079/full/v15/i15/1706.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i15.1706
游离脂肪酸(free fatty acids, FFAs)的代谢异常在胰岛素抵抗(IR)、高胰岛素血症、高血压病、2型糖尿病(type2diabetesmellitus, T2DM)等发病过程中起着非常重要的作用[1-2]. 近年来的研究显示, IKKb的活化与胰岛素抵抗的发生密切相关, 是治疗胰岛素抵抗的重要分子靶点[3-6], IKKb的主要功能之一是调节核因子NF-kB的转位活化, 游离脂肪酸是激活IKKb的重要因素之一[7-8], IKKb活化引起胰岛素抵抗可能是通过促进NF-kB的活化转位调节相关基因的表达而起作用[9-13]. 那么FFA是否通过促进NF-kB的活化转位而诱导胰岛素抵抗呢? 我们以游离脂肪酸诱导3T3-L1脂肪细胞产生胰岛素抵抗, 观察游离脂肪酸对核因子NF-kB表达和转位的影响, 探讨游离脂肪酸诱导胰岛素抵抗的分子机制.
3-异丁基-1-甲基黄嘌呤(IBMX)、地塞米松、胰岛素、软脂酸(PA)、乙酰水杨酸钠(阿司匹林)、不含游离脂肪酸的BSA(FAF BSA)、DMSO、细胞松弛素B和DAPI(Sigma公司), DMEM、胎牛血清(FBS)(Gibco BRL公司), 2-脱氧-[3H]-D-葡萄糖(北京原子高科股份有限公司), 3T3-L1前脂肪细胞(3T3-L1 preadipocyte)(中国医学科学院基础医学研究所细胞中心), NF-kBp65抗体(Neomarkers公司), 辣根酶标记山羊抗兔IgG、增强化学发光法(ECL)试剂盒(PIERCE公司), 蛋白Marker(Fermentas公司), BCA蛋白检测试剂盒, Cy-3标记的羊抗兔IgG(博士得公司), 其他化学试剂均为分析纯. 激光扫描共聚焦显微镜(FV500型)美国Olympus公司生产.
1.2.1 细胞培养及诱导分化: 在37℃、50 mL/L的CO2的条件下, 3T3-L1前脂肪细胞在含100 mL/L FBS的高糖DMEM中培养, 待细胞融合2 d后, 加入含0.5 mmol/L 3-异丁基-1-甲基黄嘌呤(IBMX)、1 μmol/L地塞米松、10 mg/L胰岛素和100 mL/L FBS的高糖DMEM培养48 h, 然后换上含10 mg/L胰岛素和100 mL/L FBS高糖DMEM再培养48 h, 随后以100 mL/L FBS的高糖DMEM 继续培养, 2 d换培养液一次, 诱导分化8-12 d的3T3-L1细胞90%-95%呈脂肪细胞表型, 可用于实验[14].
1.2.2 3T3-L1细胞的分组处理: 将诱导分化成熟的3T3-L1脂肪细胞换上含2 g/L FAF BSA的DMEM无血清培养液培养12 h后, 一组分别换上含0, 0.3, 0.5, 1.0 mmol/L软脂酸(PA) 10 g/L FAF BSA的DMEM培养24 h; 另一组换上含0.5 mmol/L软脂酸(PA) 10 g/L FAF BSA的DMEM分别培养0, 6, 12, 24 h.
1.2.3 葡萄糖消耗实验: 将96孔板中诱导分化成熟的3T3-L1脂肪细胞换入含2 g/L FAF BSA的DMEM培养液培养12 h后, 换以含2 g/L FAF BSA 的含药培养液, 分别孵育0, 6, 12, 24 h后, 用葡萄糖氧化酶法检测培养液中的葡萄糖含量, 以未接种细胞空白复孔的糖含量均值为基础值, 算出各孔细胞的葡萄糖消耗量[15]. 另用CCK-8 法监测细胞的数目和活力[16].
1.2.4 葡萄糖转运实验: 将24孔板中诱导分化成熟的3T3-L1脂肪细胞以含2 g/L FAF BSA的DMEM培养液培养12 h, 换以含2 g/L FAF BSA 的含药培养液孵育一定时间后, 移去培养液, 以KRP缓冲液(131.2 mmol/L NaCl, 4.71 mmol/L KCl, 2.47 mmol/L CaCl2, 1.24 mmol/L MgSO4, 2.48 mmol/L Na3PO4, 10 mmol/L HEPES, pH7.4)洗3次, 再以含或不含100 nmol/L胰岛素的KRP 缓冲液37℃孵育30 min, 加入1 mL含0.5 μCi/mL 2-脱氧-[3H]-D-葡萄糖的KRP缓冲液37℃孵育10 min, 以预冷含10 mmol/L葡萄糖的PBS快速洗3次中止反应, 加1 mL 0.1 mol/L NaOH作用2 h, 取细胞裂解液, 用液闪仪计数其每分钟衰变数. 另设一组加10 μmol/L细胞松弛素B作为2-脱氧-[3H]-D-葡萄糖的非特异摄取率, 所有数据减去此值, 作为各组细胞的葡萄糖摄取率[17]. 每次实验设3复孔, 共重复3次实验.
1.2.5 Western blot: 分化成熟经不同浓度(0, 0.3, 0.5, 1.0 mmol/L)软脂酸分别处理0, 6, 12, 24 h的3T3-L1脂肪细胞用细胞裂解液裂解后分别提取总蛋白和核蛋白, 用BCA试剂盒测定蛋白浓度. 取等量的蛋白样品50 μg用样品缓冲液处理, 蛋白变性、SDS-PAGE胶电泳分离蛋白、电转移法使蛋白转移至PVDF膜上, 用含50 g/L脱脂奶粉的TBST(Tris-HCl 50 mmol/L, NaCl 150 mmol/L, pH7.4和0.1% Tween-20)室温下封闭2 h以减少非特异性结合, 封膜后加入NF-kBp65抗体(1∶1000), 4℃过夜, TBST洗膜后以辣根过氧化物酶(HRP)标记的二抗(1∶3000)孵育, 室温下轻摇2 h, TBST洗膜后用ECL化学发光法曝光显影, 洗片后用Bio-Rad图像分析系统对Western blot目的条带进行扫描, 然后用Quantity One软件进行分析.
1.2.6 免疫荧光激光扫描共聚焦: 将6孔板中生长于盖玻片上分化成熟经不同浓度(0, 0.3, 0.5, 1.0 mmol/L)软脂酸分别处理0, 6, 12, 24 h的3T3-L1 脂肪细胞取出, 将盖玻片用1∶1无水乙醇∶丙酮固定液固定10 min; 10 mL/L tron X 100处理5 min, 充分水洗、PBS洗后滴加兔抗人NF-kBp65抗体(1∶100) 50 mL, 4℃过夜; 次日PBS洗后滴加Cy-3标记的羊抗兔IgG, 湿盒中避光孵育37℃, 30 min; PBS避光振洗后滴加DAPI溶液对核进行复染30 s(避光, 常温, 37℃左右); PBS避光振洗、蒸馏水洗涤后用500 mL/L缓冲甘油封片. 采用40×油镜观察样品, CY-3和DAPI两种染料分别由氩离子激光器552 nm, 358 nm激发, 分辨率为1024×1024, 发射波长分别为565 nm和460 nm.
统计学处理 所有数据采用SPSS13.0软件包进行分析, 实验数据用mean±SD表示, 组间数据的比较采用两样本均值的t检验, P<0.05为有统计学意义.
(1)FFA影响3T3-L1脂肪细胞葡萄糖消耗的量效关系. 3T3-L1脂肪细胞加入不同浓度的软脂酸作用24 h, 0.3, 0.5, 1.0 mmol/L软脂酸分别使3T3-L1脂肪细胞的葡萄糖消耗降低34%, 41%, 43%; 分别是空白对照组的66%, 59%, 57%(表1); (2)FFA影响3T3-L1脂肪细胞葡萄糖消耗的时效关系. 3T3-L1脂肪细胞加入0.5 mmol/L的软脂酸作用6 h即可使葡萄糖消耗降低23%、12 h时降低32%、24 h时降低41%, 分别是空白对照组的77%, 68%, 59%(表2); (3)FFA对3T3-L1脂肪细胞数目和活力的影响. CCK-8结果显示, 0.3, 0.5 mmol/L软脂酸孵育24 h, CCK-8值无影响; 当软脂酸浓度达到1.0 mmol/L时CCK-8值明显降低, 0.5 mmol/L软脂酸分别孵育6, 12, 24 h, CCK-8值均无影响(表1-2).
(1)FFA影响3T3-L1脂肪细胞葡萄糖转运的量效关系. 3T3-L1脂肪细胞加入不同浓度的软脂酸作用24 h, 0.3, 0.5, 1.0 mmol/L软脂酸分别使3T3-L1脂肪细胞胰岛素刺激的葡萄糖转运抑制36%, 67%, 68%; 分别是空白对照组的64%, 33%, 32%(表3); (2)FFA影响3T3-L1脂肪细胞葡萄糖转运的时效关系. 3T3-L1脂肪细胞加入0.5 mmol/L的软脂酸作用6 h即可使胰岛素刺激的葡萄糖转运抑制34%, 12 h时抑制50%, 24 h时抑制67%; 分别是空白对照组的66%, 50%, 33%(表4).
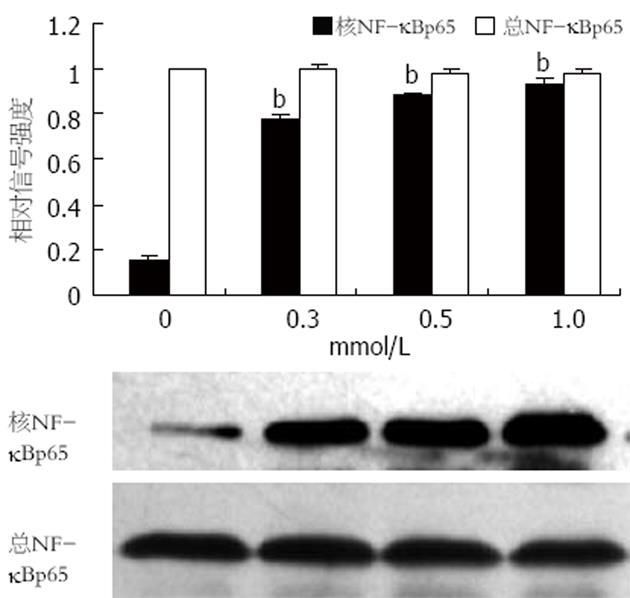
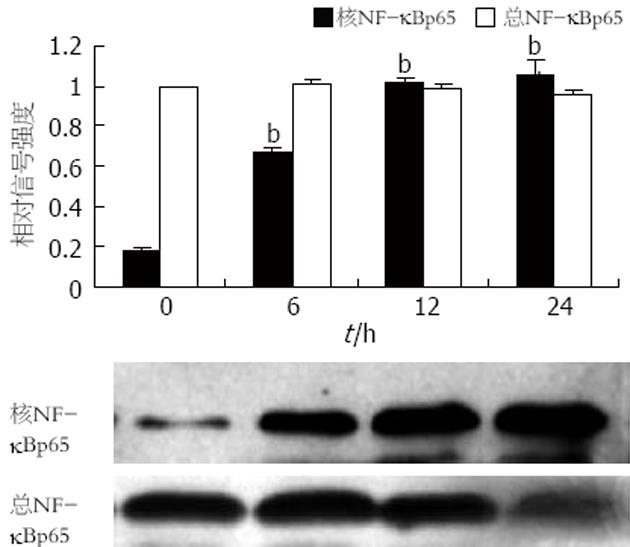
采用Western blot同时检测3T3-L1脂肪细胞总NF-kBp65与核NF-kBp65蛋白的表达, 结果显示, 加入不同浓度的软脂酸作用24 h, 0.3 mmol/L软脂酸即可刺激核NF-kBp65蛋白的表达, 随浓度增加(0.5 mmol/L, 1.0 mmol/L)其表达呈浓度依赖性增加(图1); 若加入同一浓度(0.5 mmol/L)的软脂酸作用6 h即可刺激核NF-kBp65蛋白的表达, 随作用时间的延长(12, 24 h)其表达呈时间依赖性增加. 但是, 不同浓度(0.3, 0.5, 1.0 mmol/L)的软脂酸作用不同时间(6, 12, 24 h)对3T3-L1脂肪细胞总NF-kBp65蛋白的表达均无明显影响(P>0.05, 图2).
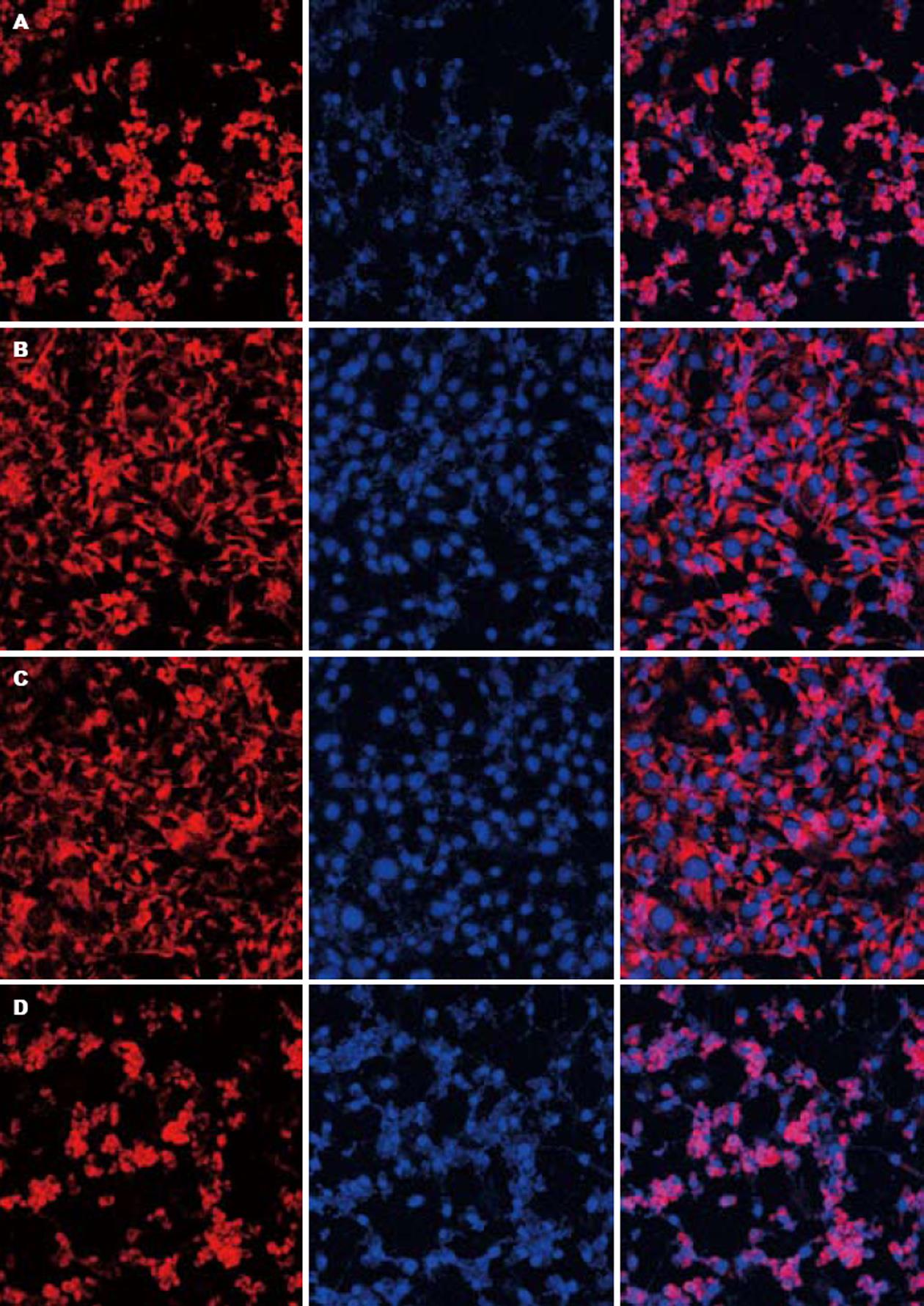
免疫荧光(Immunofluorescence)激光扫描共聚焦(CLSM)检测NF-kBp65显示: 蓝色为DAPI标记, 指示核区; 红色为CY-3标记, 指示NF-kBp65; 两种荧光共聚焦重合后为粉红色, 指示NF-kBp65转位到核内. 正常组(含0 mmol/L PA, 0 h) NF-kBp65均在胞质中表达, 呈红色(图3A); 低浓度组(0.3 mmol/L PA, 24 h)(图3B)或短时间组(0.5 mmol/L PA, 6 h)(图3C)即可见到NF-kBp65有少部分转移到核内, 图中既可见到红色又可见到少许粉红色; 模型组(0.5 mmol/L PA, 24 h)则见NF-kBp65大量转位到核内, 呈粉红色(图3D); 这说明FFAs可以刺激NF-kBp65的核转位, 此结果与Western blot的检测结果一致.
FFA的代谢异常在IR、高胰岛素血症、高血压病、T2DM等发病过程中起着非常重要的作用[1-2]. 大量体内、外研究表明, FFA能明显抑制肝脏、骨骼肌、脂肪等组织的胰岛素受体(InsR), 胰岛素受体底物-1(IRS-1)的酪氨酸残基磷酸化水平, 从而干扰胰岛素信号的正常传导, 参与IR的发生[18-19].
Rel/NF-kB/IkB/IKK信号转导途径广泛存在于真核细胞, 调控着炎症反应, 免疫反应等相关的一系列基因表达[20]. 近年来的研究显示, IKKb的活化与胰岛素抵抗的发生密切相关, 是治疗胰岛素抵抗的重要分子靶点[3-6], IKKb活化引起胰岛素抵抗的机制之一可能是通过促进核因子NF-kB的活化转位调节相关基因的表达而起作用的[9-13]. 游离脂肪酸是激活IKKb的重要因素之一[7-8], 那么FFA是否通过促进NF-kB的活化转位而诱导胰岛素抵抗呢? 我们用饱和脂肪酸--软脂酸孵育3T3-L1脂肪细胞作为细胞模型来研究FFAs诱导胰岛素抵抗的分子机制. 研究发现, 3T3-L1脂肪细胞加入0-1.0 mmol/L的软脂酸作用24 h, 0.3 mmol/L软脂酸即可使细胞的葡萄糖消耗降低34%, 使胰岛素刺激的葡萄糖转运抑制36%; 当软脂酸浓度达到1.0 mmol/L时, 葡萄糖消耗降低43%, 胰岛素刺激的葡萄糖转运抑制68%; 呈剂量依赖趋势. 若3T3-L1脂肪细胞加入0.5 mmol/L的软脂酸作用0-24 h, 6 h即可使葡萄糖消耗降低23%, 胰岛素刺激的葡萄糖转运抑制34%; 24 h使葡萄糖消耗降低41%, 胰岛素刺激的葡萄糖转运抑制67%; 呈时间依赖趋势. 胰岛素刺激的葡萄糖转运是衡量胰岛素敏感性、判断胰岛素抵抗的重要指标, 这说明软脂酸可以诱导3T3-L1脂肪细胞产生胰岛素抵抗, 这与国外报道FFAs可诱导IR是一致的[21-23]. 接下来我们用Western blot检测了3T3-L1脂肪细胞中总NF-kBp65蛋白和核NF-kBp65蛋白的表达. 加入不同浓度的软脂酸作用24 h, 0.3 mmol/L软脂酸即可刺激核NF-kBp65蛋白的表达, 随浓度增加(0.5 mmol/L, 1.0 mmol/L)其表达呈浓度依赖性增加; 若加入同一浓度(0.5 mmol/L)的软脂酸作用6 h即可刺激核NF-kBp65蛋白的表达, 随作用时间的延长(12, 24 h)其表达呈时间依赖性增加. 但是, 不同浓度(0.3, 0.5, 1.0 mmol/L)的软脂酸作用不同时间(6, 12, 24 h)对3T3-L1脂肪细胞总NF-kBp65蛋白的表达均无明显影响(P>0.05). 我们进一步用免疫荧光激光扫描共聚焦(CLSM)对NF-kBp65进行定位显示, 结果发现, 正常组(含0 mmol/L PA, 0 h) NF-kBp65均在胞质中表达, 呈红色; 低浓度组(0.3 mmol/L PA, 24 h)或短时间组(0.5 mmol/L PA, 6 h)即可见到NF-kBp65部分转移到核内, 图中既可见到红色又可见到粉红色; 模型组(0.5 mmol/L PA, 24 h)则见NF-kBp65大量转位到核内, 呈粉红色; 此结果与Western blot的检测结果一致.
因此, 我们推测FFA可能通过活化NF-kB, 使NF-kB进入核内调节相关基因的表达, 抑制葡萄糖的转运, 引起胰岛素抵抗. 当然, 至于FFA通过何种信号途径和机制促进NF-kB的活化转位, NF-kB又通过何种途径作用于胰岛素信号转导相关蛋白而导致胰岛素抵抗还需要我们进一步研究和探索.
近年来的研究显示, IKKβ的活化与胰岛素抵抗的发生密切相关, 是治疗胰岛素抵抗的重要分子靶点, IKKβ的主要功能之一是调节核因子NF-κB的转位活化, 游离脂肪酸是激活IKKβ的重要因素之一, IKKβ活化引起胰岛素抵抗可能是通过促进NF-κB的活化转位调节相关基因的表达而起作用. 那么FFA是否通过促进NF-κB的活化转位而诱导胰岛素抵抗呢?
胰岛素抵抗(IR)一直是人们研究的热点. 近年来, IR的发病机制, 尤其是其分子靶点及其信号转导机制受到极大关注. 最新研究表明, IKKβ的活化与胰岛素抵抗的发生密切相关, 是治疗胰岛素抵抗的重要分子靶点, 然而IKKβ活化引起胰岛素抵抗的机制尚不明确, 有研究提示IKKβ活化引起胰岛素抵抗可能是通过促进NF-κB的活化转位调节相关基因的表达而起作用的, 但其还未进一步证实.
目前IKKβ活化引起胰岛素抵抗的机制尚不明确, 有研究提示IKKβ活化引起胰岛素抵抗可能是通过促进NF-κB的活化转位调节相关基因的表达而起作用的. Itani et al发现输注脂质引起人血液中FFA水平升高, 导致骨骼肌胰岛素抵抗, 同时伴有骨骼肌二脂酰甘油含量增加、膜相关蛋白激酶C(PKC)-βII、-δ增加和IκB-α蛋白减少,这些发现提示FFA引起骨骼肌的胰岛素抵抗可能是通过活化特异的PKC异构体和IKKβ/IκB/NF-κB途径来实现的. IKKβ活化引起胰岛素抵抗是否是通过NF-κB起作用还有待于进一步证实.
本实验运用诱导成熟的3T3-L1脂肪细胞与0.3-1.0 mmol/L的软脂酸(PA)培养6-24 h诱导胰岛素抵抗的细胞模型, 用Western blot检测总NF-κBp65蛋白及核NF-κBp65蛋白的表达, 用激光扫描共聚焦(CLSM)对NF-κBp65进行定位显示, 研究发现游离脂肪酸可以诱导胰岛素抵抗, 其分子机制可能与FFAs刺激NF-κB的活化转位调节相关基因的表达有关.
本实验通过研究游离脂肪酸对3T3-L1脂肪细胞核因子NF-κBp65表达及转位的影响, 进一步探讨游离脂肪酸诱导胰岛素抵抗的分子机制, 为寻找新的改善胰岛素抵抗的分子靶点提供理论依据.
核转录因子κB(NF-κB): NF-κB是一种普遍存在的核转录因子, 调控着炎症反应, 免疫反应等相关的一系列基因表达. NF-κB由各种同源和异源的NF-κB/Rel蛋白二聚体构成, 主要发挥作用的是p50/p65异源二聚体. 正常情况下, NF-kB以无活性状态存在于胞质中. 细胞外信号可激活NF-κB, 活化的NF-κB通过核孔从胞质进入到细胞核, 结合到靶基因的启动子或增强子κB序列结合, 激活多种基因的转录, 进而引起广泛的生物学效应.
本文通过研究游离脂肪酸刺激NF-κB的活化转位调节相关基因的表达, 从而诱导IR的相关分子机制, 具有一定新意.
电编: 张敏 编辑:王晓瑜
| 1. | Boden G. Role of fatty acids in the pathogenesis of insulin resistance and NIDDM. Diabetes. 1997;46:3-10. [PubMed] [DOI] |
| 2. | Griffin ME, Marcucci MJ, Cline GW, Bell K, Barucci N, Lee D, Goodyear LJ, Kraegen EW, White MF, Shulman GI. Free fatty acid-induced insulin resistance is associated with activation of protein kinase C theta and alterations in the insulin signaling cascade. Diabetes. 1999;48:1270-1274. [PubMed] [DOI] |
| 3. | Yuan M, Konstantopoulos N, Lee J, Hansen L, Li ZW, Karin M, Shoelson SE. Reversal of obesity- and diet-induced insulin resistance with salicylates or targeted disruption of Ikkbeta. Science. 2001;293:1673-1677. [PubMed] [DOI] |
| 4. | Kim JK, Kim YJ, Fillmore JJ, Chen Y, Moore I, Lee J, Yuan M, Li ZW, Karin M, Perret P. Prevention of fat-induced insulin resistance by salicylate. J Clin Invest. 2001;108:437-446. [PubMed] [DOI] |
| 5. | Yin MJ, Yamamoto Y, Gaynor RB. The anti-inflammatory agents aspirin and salicylate inhibit the activity of I(kappa)B kinase-beta. Nature. 1998;396:77-80. [PubMed] [DOI] |
| 6. | Hundal RS, Petersen KF, Mayerson AB, Randhawa PS, Inzucchi S, Shoelson SE, Shulman GI. Mechanism by which high-dose aspirin improves glucose metabolism in type 2 diabetes. J Clin Invest. 2002;109:1321-1326. [PubMed] [DOI] |
| 7. | Rahman I. Regulation of nuclear factor-kappa B, activator protein-1, and glutathione levels by tumor necrosis factor-alpha and dexamethasone in alveolar epithelial cells. Biochem Pharmacol. 2000;60:1041-1049. [PubMed] [DOI] |
| 8. | Romashkova JA, Makarov SS. NF-kappaB is a target of AKT in anti-apoptotic PDGF signalling. Nature. 1999;401:86-90. [PubMed] [DOI] |
| 9. | Perreault M, Marette A. Targeted disruption of inducible nitric oxide synthase protects against obesity-linked insulin resistance in muscle. Nat Med. 2001;7:1138-1143. [PubMed] [DOI] |
| 10. | Ruan H, Hacohen N, Golub TR, Van Parijs L, Lodish HF. Tumor necrosis factor-alpha suppresses adipocyte-specific genes and activates expression of preadipocyte genes in 3T3-L1 adipocytes: nuclear factor-kappaB activation by TNF-alpha is obligatory. Diabetes. 2002;51:1319-1336. [PubMed] [DOI] |
| 11. | Itani SI, Ruderman NB, Schmieder F, Boden G. Lipid-induced insulin resistance in human muscle is associated with changes in diacylglycerol, protein kinase C, and IkappaB-alpha. Diabetes. 2002;51:2005-2011. [PubMed] [DOI] |
| 12. | Bedard S, Marcotte B, Marette A. Cytokines modulate glucose transport in skeletal muscle by inducing the expression of inducible nitric oxide synthase. Biochem J. 1997;325:487-493. [PubMed] [DOI] |
| 13. | Kapur S, Bedard S, Marcotte B, Cote CH, Marette A. Expression of nitric oxide synthase in skeletal muscle: a novel role for nitric oxide as a modulator of insulin action. Diabetes. 1997;46:1691-1700. [PubMed] [DOI] |
| 14. | Nelson BA, Robinson KA, Buse MG. High glucose and glucosamine induce insulin resistance via different mechanisms in 3T3-L1 adipocytes. Diabetes. 2000;49:981-991. [PubMed] [DOI] |
| 15. | Hansen MB, Nielsen SE, Berg K. Re-examination and further development of a precise and rapid dye method for measuring cell growth/cell kill. J Immunol Methods. 1989;119:203-210. [PubMed] [DOI] |
| 16. | Takeuchi A, Mishina Y, Miyaishi O, Kojima E, Hasegawa T, Isobe K. Heterozygosity with respect to Zfp148 causes complete loss of fetal germ cells during mouse embryogenesis. Nat Genet. 2003;33:172-176. [PubMed] [DOI] |
| 17. | Romero R, Casanova B, Pulido N, Suarez AI, Rodriguez E, Rovira A. Stimulation of glucose transport by thyroid hormone in 3T3-L1 adipocytes: increased abundance of GLUT1 and GLUT4 glucose transporter proteins. J Endocrinol. 2000;164:187-195. [PubMed] [DOI] |
| 18. | Boden G, Chen X, Ruiz J, White JV, Rossetti L. Mechanisms of fatty acid-induced inhibition of glucose uptake. J Clin Invest. 1994;93:2438-2446. [PubMed] [DOI] |
| 19. | Storz P, Doppler H, Wernig A, Pfizenmaier K, Muller G. Cross-talk mechanisms in the development of insulin resistance of skeletal muscle cells palmitate rather than tumour necrosis factor inhibits insulin-dependent protein kinase B (PKB)/Akt stimulation and glucose uptake. Eur J Biochem. 1999;266:17-25. [PubMed] [DOI] |
| 20. | Tak PP, Firestein GS. NF-kappaB: a key role in inflammatory diseases. J Clin Invest. 2001;107:7-11. [PubMed] [DOI] |
| 21. | Shi H, Kokoeva MV, Inouye K, Tzameli I, Yin H, Flier JS. TLR4 links innate immunity and fatty acid-induced insulin resistance. J Clin Invest. 2006;116:3015-3025. [PubMed] [DOI] |
| 22. | Dresner A, Laurent D, Marcucci M, Griffin ME, Dufour S, Cline GW, Slezak LA, Andersen DK, Hundal RS, Rothman DL. Effects of free fatty acids on glucose transport and IRS-1-associated phosphatidylinositol 3-kinase activity. J Clin Invest. 1999;103:253-259. [PubMed] [DOI] |
| 23. | Gao Z, Zhang X, Zuberi A, Hwang D, Quon MJ, Lefevre M, Ye J. Inhibition of insulin sensitivity by free fatty acids requires activation of multiple serine kinases in 3T3-L1 adipocytes. Mol Endocrinol. 2004;18:2024-2034. [PubMed] [DOI] |