修回日期: 2007-04-01
接受日期: 2007-04-02
在线出版日期: 2007-05-28
目的: 为了提高幽门螺杆菌DNA疫苗的免疫原性, 构建具有靶向作用于APC细胞的核酸疫苗.
方法: 利用基因工程技术, 将靶向基因片段和过氧化氢酶基因融合构建了核酸疫苗. 体外转染293T细胞, 间接免疫荧光和ELISA检测其基因表达情况. 用该核酸疫苗肌肉免疫注射BALB/c小鼠后, 测定其血清IgG、IgG1和IgG2a水平.
结果: 间接免疫荧光检测转染DNA疫苗的293T细胞, 表明该疫苗能在真核细胞中表达目的抗原, 通过ELISA方法测定表明其仍具有IgG抗体结合能力. BALB/c小鼠免疫后血清测定结果表明, 该靶向核酸疫苗诱导的抗体水平高于对照质粒pDNAkat, 抗体分型实验显示靶向核酸疫苗pcDNAkathIgz和pcDNAkat, 促进了免疫反应类型由Th2向Th1的部分偏转.
结论: 成功构建了靶向APC细胞的幽门螺杆菌核酸疫苗, 并在小鼠体内诱导了较高的抗体水平.
引文著录: 张瑞平, 刘纯杰, 陶好霞, 张兆山. 幽门螺杆菌靶向核酸疫苗的构建及免疫学评价. 世界华人消化杂志 2007; 15(15): 1682-1687
Revised: April 1, 2007
Accepted: April 2, 2007
Published online: May 28, 2007
AIM: To construct DNA vaccine targeted on antigen-presenting cells for the purpose of increasing the immunogenecity of Helicobacter pylori DNA vaccine.
METHODS: DNA vaccine was constructed by combining the targeted DNA sequence with katA. Whether or not the DNA vaccine could be expressed in the mammalian cells was detected by indirect immunofluorescence assay of 293T cells transfected with DNA vaccine. The IgG, IgG1 and IgG2a antibody titers of BALB/c mice immunized with DNA vaccine were also determined.
RESULTS: It was indicated in the immunofluorescence assay of 293T cells transfected with DNA vaccine that the KatA protein could be expressed in these cells. Enzyme-linked immunosorbent assay (ELISA) also showed that the transfected cells with pcDNAkathIgz had a higher affinity for IgG. The IgG antibody titer of BALB/c mice immunized with targeted DNA vaccine was significantly higher than that of mice immunized with pcDNAkatA, and a shift form (Th2 response to Th1 response) was achieved in the mice immunized with DNA vaccine.
CONCLUSION: DNA vaccine targeted on antigen-presenting cells is constructed successfully, which can evoke a higher IgG antibody titer than non-targeted DNA vaccine.
- Citation: Zhang RP, Liu CJ, Tao HX, Zhang ZS. Construction of targeted DNA vaccine of H pylori and immune test in BALB/c mice. Shijie Huaren Xiaohua Zazhi 2007; 15(15): 1682-1687
- URL: https://www.wjgnet.com/1009-3079/full/v15/i15/1682.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i15.1682
目前世界上约50%的人口感染了幽门螺杆菌, 发展中国家则高达80%, 感染者可诱发慢性胃炎、消化道溃疡、胃癌及胃黏膜相关性淋巴组织淋巴瘤等疾病. 目前最有效的治疗方法是化学疗法, 但存在着一定的副作用, 药物价格昂贵, 更令人担忧的是临床上出现了大量耐药菌株.
因此人们渴望通过疫苗技术来解决这个问题. 核酸疫苗作为一类新型疫苗, 易于设计构建、成本低廉、适于规模化生产, 化学性质稳定, 越来越受到人们的关注. 最近研究表明, 幽门螺杆菌DNA疫苗能激发机体产生免疫应答并提供保护作用[1-3]. 但与传统蛋白质疫苗相比, DNA疫苗免疫原性较差, 所以构建高效DNA疫苗势在必行, 而理性设计该类疫苗必须对参与免疫反应的分子和细胞事件加以调控. APC细胞在原初免疫反应和适应性免疫反应中起枢纽作用, 因此, APC捕获抗原效率, 加工效率, 提呈抗原肽对MHC分子的亲和力等因素均显著影响着机体免疫应答水平. 在众多提高抗原免疫原性的策略中, 本文将介绍和使用的是利用金黄色葡萄球菌(Staphylococcus aurous)蛋白A或其衍生片段和抗原融合的方法.
金黄色葡萄球菌蛋白A包括5个抗体结合域, 即EDABC. B区段经过基因突变命名为Z, 他和IgGs的Fc部分具有较强的亲和力[4]. 动物体内试验表明当抗原和两个Z基序融合时能显著提高免疫原性[5-7]. 研究认为这些基序能和APC细胞上的IgGs结合, 从而提高了目标抗原的提呈效率.
在幽门螺杆菌疫苗研究中, 候选抗原包括尿素酶(UreB)、过氧化氢酶(KatA)、空泡毒素(VacA)、细胞毒素相关蛋白(CagA)等. KatA一方面有利于幽门螺杆菌逃避巨噬细胞的吞噬作用, 另一方面则防止机体因氧化损伤带来的副作用, 因此KatA在幽门螺杆菌抗原中比较特殊而且重要. 为此本研究采用靶向免疫的手段, 将幽门螺杆菌的过氧化氢酶抗原和靶向分子融合表达, 以提高抗原免疫效率.
pcDNA3.1(-)为军事医学科学院微生物流行病研究所赵慧博士赠送. 293T细胞为军事医学科学院生物工程研究所田利园博士赠送. 大肠杆菌TOP10和幽门螺杆菌HPSS1均由本室保存. 限制性内切酶购自宝生物工程大连有限公司. T4DNA连接酶购自Biolab公司. 脂质体(Liporectamine 2000)购自Invitrogen公司. HPR酶标羊抗鼠lgG抗体、lgG1抗体和lgG2a抗体以及FITC标记羊抗鼠lgG抗体购自Sigma公司. ♀BALB/c(SPF)小鼠购于军事医学科学院实验动物中心.
1.2.1 人工合成靶向片段hIgZ及克隆: 靶向分子hIgZ由人IgG1重链绞链区基因和金黄色葡萄球菌蛋白A的Z基因组成. 该靶向分子连同两侧添加的酶切位点共计239 bp, 将其设计成6个连续DNA片段, 相邻片段之间有20 bp重复序列. P1: 5'CGGGATCCGTCTAGAGAGCCCAAATCTTGTGACAAAACTCACACATGCCCACCGTGCCCA3'; P2: 5'CATAGAACGCGTTTTGTTGTTCTTTGTTGAATTTGTTGTCTGGGCACGGTGGGCATGTGT3'; P3: 5'ACAACAAAACGCGTTCTATGAGATCTTACATTTACCTAACTTAAACGAAGAACAACGAAA3'; P4: 5'GCTTTGGCTTGGGTCATCTTTTAAACTTTGGATGAAGGCGTTTCGTTGTTCTTCGTTTAA3'; P5: 5'AAGATGACCCAAGCCAAAGCGCTAACCTTTTAGCAGAAGCTAAAAAGCTAAATGATGCTC3'; P6: 5'CCGATATCTTTCGGCGCCTGAGCATCATTTAGCTTTTTAG3'. 将引物对(P1, P2)、(P3, P4)、(P5, P6)分别放入PCR管中进行扩增. 从3管扩增产物中分别取1 μL混合后作为模版, 加入引物对(P7, P8) P7: 5'CGGGATCCGTCTAGAGAGCC3'; P8: 5'CCGATATCTTTCGGCGCCTG3'.再次进行扩增. 所得扩增产物经酶切, 克隆至载体pFS2.2上, 命名为pFShIgZ.
1.2.2 融合PCR拼接KatA和hIgZ及克隆: 以HPSS1基因组为模板, 加入引物pDNAkat(+)和pDNAkatlinker(-)进行扩增; 以质粒pFShIgZ为模板, 加入引物pDNAhIgz(+)和pDNAhIgz(-)进行扩增. 将上述PCR产物分别回收, 各取1 μL加入PCR管中混匀, 以pDNAkat(+)和pDNAhIgz(-)为引物进行扩增, 所得产物经酶切、克隆至载体pcDNA3.1(-), 将其命名为pcDNAkathIgZ. 以HPSS1基因组为模板, 加入引物pDNAkat(+)和pDNAkat(-)进行扩增, 扩增产物克隆至载体pcDNA3.1(-), 将其命名为pcDNAkat. pDNAkat(+): 5'GGGGTACCACCATGGTTAATAAAGATGTGAA3'; pDNAkatlinker(-): 5'CTTTTTCTTTTTTGTGTGGT3'; pDNAhIgz(+): 5'ACCACACAAAAAAGAAAAAGGAGCCCAAATCTTGTGAC3'; pDNAhIgz(-): 5'CGGAATTCTTATTTCGGCGCCTGAGCATC3'; pDNAkat(-): 5'CGGAATTCTTACTTTTTCTTTTTTGTGTGGT3'.
1.2.3 重组过氧化氢酶原核表达及抗体制备: 以HPSS1基因组为模板, 加入引物pKAT(+)和pKAT(-)进行扩增. 所得PCR产物克隆至载体pET32a上, 命名为pET32akatA. 大肠杆菌BL21(pET32akatA)经IPTG诱导表达, 培养物经超声破碎, 收集包涵体. 包涵体经尿素酶溶解、Ni柱亲和层析纯化后, 对小鼠进行免疫并收集血清. pKAT(+): 5'CGGAATTCGTTAATAAAGATGTGAAA3'; pKAT(-): 5'CCGCTCGAGTTACTTTTTCTTTTTTGT3'.
1.2.4 DNA疫苗体外转染和相关检测: 293T细胞在转染前12 h, 调整浓度至105个/mL, 将其接种到预先放置盖玻片中的6孔细胞培养板中. 用质粒pcDNA3.1(-)、pcDNAkathIgZ和pcDNAkat分别转染293T细胞. 48 h后进行间接免疫荧光检测以分析katA基因表达情况. 同时, 转染细胞经三去污剂裂解液裂解后, 离心收集上清, ELISA方法分别测定其和IgG抗体结合能力.
1.2.5 动物免疫及抗体检测: 6-8周龄BALB/c♀小鼠分成3组, 分别用质粒pcDNA3.1(-)、pcDNAkat和pcDNAkathIgZ免疫. 质粒DNA的免疫剂量为150 μg/只·次. 小鼠后腿多点im, 注射后立即用基因导入仪对注射部位肌肉进行电脉冲刺激, 参数为100 V/50 ms双向各6次脉冲. 每周免疫1次, 共免疫3次. 最后1次免疫1 wk后取血清, 进行抗体滴度测定.
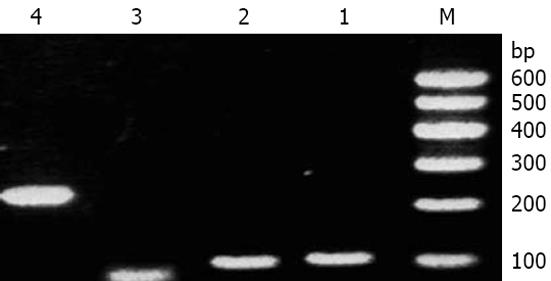
引物P1P2经过20个PCR循环可得到100 bp大小的片段, 引物P3P4可以得到100 bp大小的片段, 而P5P6则可以得到80 bp大小的片段. 将这些产物混合后, 加入引物P7P8通过融合PCR方法, 可以得到和目标基因大小基本一致的扩增产物(图1). 经限制性内切酶酶切鉴定, 该产物已克隆到载体pFS2.2上, 经测序验证, 与目标基因序列完全相同(图2).
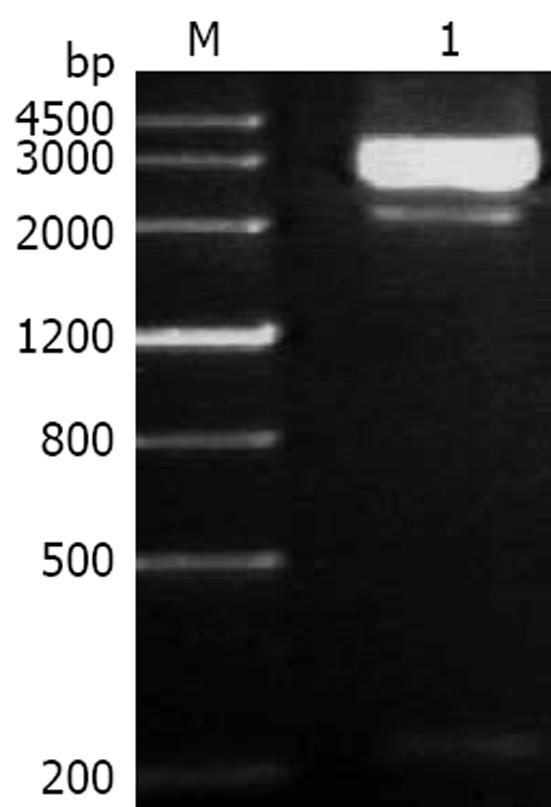
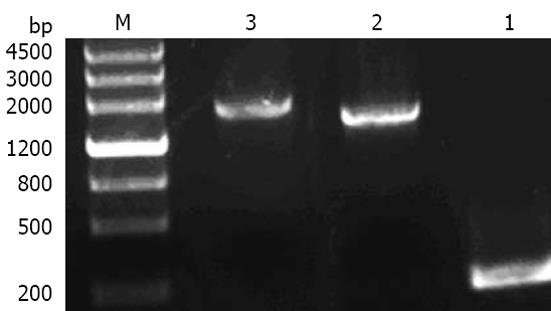
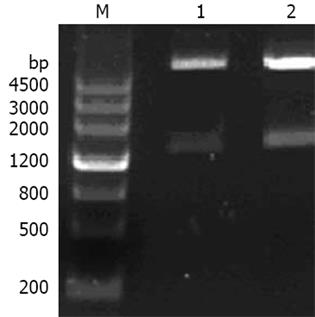
以质粒pFShIgZ为模板, 以pDNAhIgz(+)和pDNAhIgz(-)为引物进行扩增时, 可以得到1条专一性的扩增条带, 与预期分子大小相当. 以HPSS1基因组为模板, 加入引物pDNAkat(+)和pDNAkatlinker(-)进行扩增时, 可以得到1条约1500 bp的专一性扩增条带. 上述PCR产物经回收混合后, 加入引物pDNAkat(+)和pDNAhIgz(-)进行融合PCR, 融合成功(图3). 经限制性内切酶酶切鉴定, katAhIgZ和kat均克隆至载体pcDNA3.1(-)上(图4).
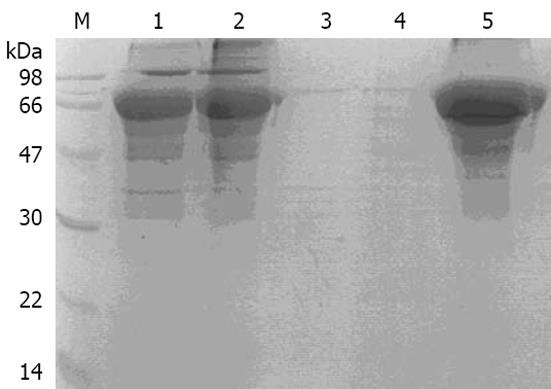
BL21 (pET32a/KAT)在IPTG诱导条件下, 可表达出一分子量约为70 kDa左右的蛋白质. 该蛋白质主要以包涵体形式存在. 包涵体经过洗涤, Ni柱亲和层析, 纯度可达90%以上(图5).
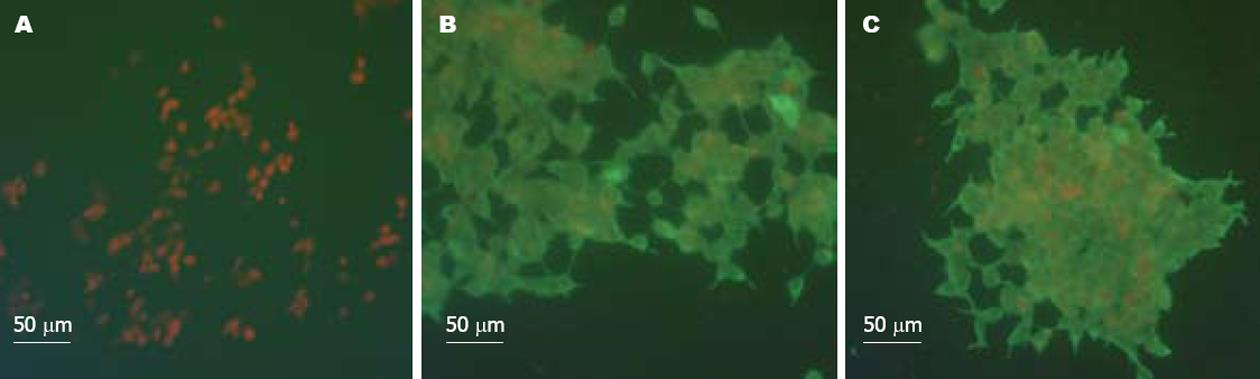
293T细胞经过不同质粒转染, 48 h后进行分析. 用含1 mL/L TritonX-100的20 g/L多聚甲醛固定细胞, 经封闭液封闭, 滴加一抗(1∶80稀释的KAT免疫血清), 清洗后加入含1 mL/L伊文氏蓝的FITC标记二抗, PBS清洗爬片后, 碱性甘油封片, 在荧光显微镜下观察(590 nm). 结果显示, 质粒pcDNAkatA和pcDNAkatAhIgZ均可以在293T细胞中表达过氧化氢酶(图6).
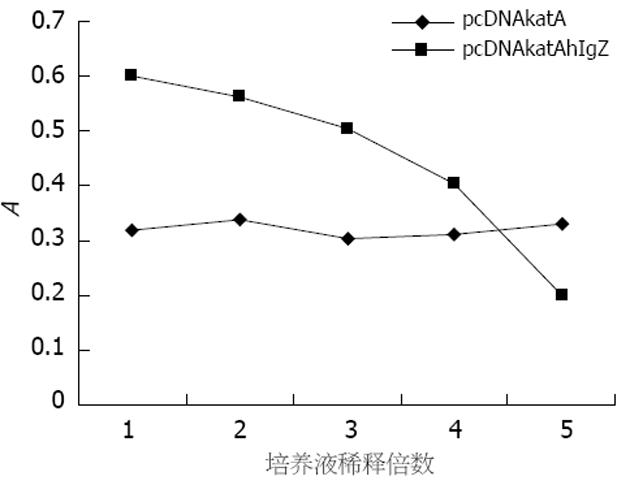
转染细胞经3去污剂裂解液裂解后, 离心收集上清, 经包被液不同倍数稀释后, 固定于ELISA板上, 洗涤后, 加入HPR酶标羊抗鼠lgG抗体, 加入底物显色后, 测定A值. 结果显示, 不同稀释倍数的pcDNAkatA转染细胞上清液, 其测定的A值变化不大, 而pcDNAkatAhIgZ的上清液则随着稀释倍数的增加A值降低(图7). 说明pcDNAkatAhIgZ的上清液和人IgG抗体的结合是特异的, 即靶向片段hIgZ和抗原融合后依然保留着和lgG抗体结合的能力.
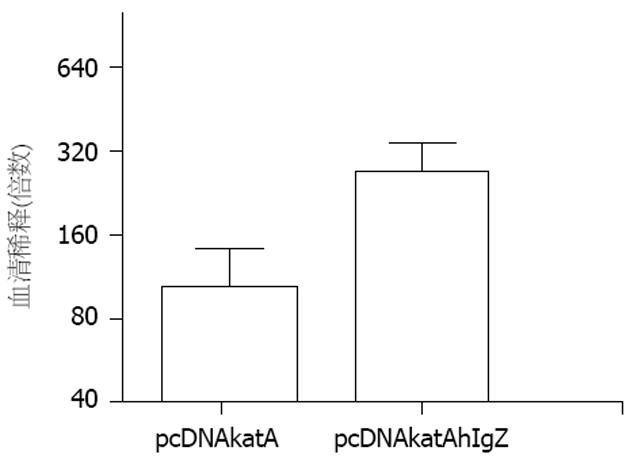
重组过氧化氢酶包被ELISA板, 经封闭液封闭, 加入系列稀释的一抗, 洗涤后加入二抗(1∶5000稀释), 显色后测定血清抗体滴度. 质粒pcDNAkatA和pcDNAkatAhIgZ免疫小鼠后均能产生过氧化氢酶抗体, 其中质粒pcDNAkatA诱导的抗体效价平均值为1∶106, pcDNAkatAhIgZ的抗体效价为1∶273(图8). 说明靶向质粒pcDNAkatAhIgZ诱导的抗体滴度高于非靶向质粒pcDNAkatA, 但差异不显著(P = 0.0667).
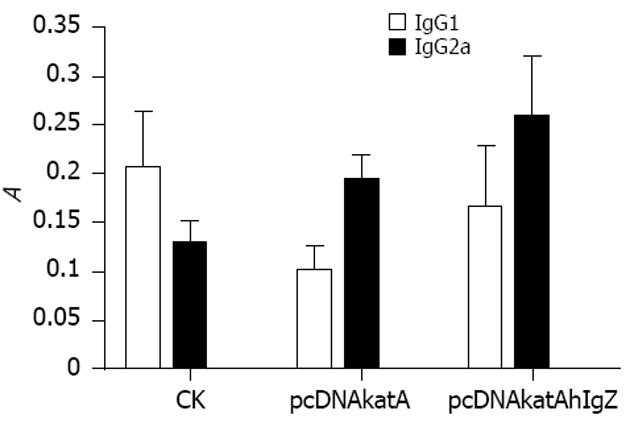
免疫后小鼠血清进行分型测定. 对IgG1类型抗体而言, 质粒pcDNAkatA和pcDNAkatAhIgZ诱导的抗体(1∶200)其A值均低于对照组(1∶100)A值. 对IgG2a类型抗体而言, 质粒pcDNAkatA诱导的抗体(1∶200) A值高于空白组(1∶100), 但差异不显著, P/N值<2; 质粒pcDNAkatAhIgZ诱导的抗体A值显著高于空白组, P/N值>2(图9). 对比IgG1和IgG2a抗体水平, 质粒pcDNAkatA和pcDNAkatAhIgZ诱导的抗体均以IgG2a类型为主, 即其诱导的免疫反应类型倾向于Th1类. 质粒pcDNAkatAhIgZ诱导的抗体水平, 无论IgG1还是IgG2a , 均高于质粒pcDNAkatA.
提高核酸疫苗免疫原性的策略较多, 大概可分为两类. 利用脂质体、微型胶囊或其他颗粒状物质包裹DNA疫苗, 从而达到缓释、延长疫苗半衰期等目的[8-9]; 另外, 将抗原和特殊的生物分子偶联实现靶向免疫的目的, 如将抗原和靶向M细胞的抗体或短肽偶联以激发黏膜免疫[10-11]. 本文采用了抗原和突变的金黄色葡萄球菌蛋白A部分区段(Z区段)偶联的方法来提高抗原免疫原性. 以往大多是将抗原和两个串联在一起的Z区段融合, 本实验中, 我们将抗原和一个Z区段偶联, 中间加入一个抗体绞链区, 一方面该柔性分子避免了抗原和靶向分子的可能存在的互相干扰, 另一方面, 促进了抗原靶向分子的二聚体化. 动物实验表明该靶向片段确实提高了核酸疫苗的免疫原性, 基本达到了预期目的.
本试验中, 无论是质粒pcDNAkatA还是质粒pcDNAkatAhIgZ免疫后激发的抗体水平均以IgG2a为主, 即激发的免疫反应以Th1类型为主. 与文献报道的DNA疫苗倾向于激发Th1型免疫反应一致.
人们最初认为, 设计幽门螺杆菌疫苗时, 其激发的免疫反应类型应该由Th1向Th2转变才能获取保护作用. 然而在IL-4, IL-5基因缺失和双缺失的小鼠中, 仍然能获得保护性免疫[12], IL-12敲除的小鼠却更容易被幽门螺杆菌侵染[13]. 在另外的一项独立研究中, IL-4, IL-10, IL-12, IL-18基因敲除的小鼠中, 其对幽门螺杆菌的易感性均有所降低, 特别是IL-10敲除的小鼠几乎对幽门螺杆菌具有完全抗性[14]. 这些证据都较好地说明了Th1型免疫反应也具有一定的保护作用. 因此人们认为Th1和Th2免疫反应间的平衡将更有利于获得保护性免疫.
在本实验中, 质粒pcDNAkatAhIgZ诱导的抗体IgG水平高于质粒pcDNAkat, 在分型试验中, pcDNAkat和pcDNAkatAhIgZ诱导的免疫反应类型向Th1发生了偏移, 这为获取保护性免疫反应提供了基础.
尽管最近有文献报道, 幽门螺杆菌DNA疫苗能激发机体产生免疫应答并提供保护作用, 但与传统蛋白质和全菌灭活疫苗相比, 其免疫原性和保护性均较低. 为此, 构建高效幽门螺杆菌DNA疫苗势在必行.
目前针对幽门螺杆菌感染最有效的治疗方法是化学疗法, 但存在着一定的副作用及菌株耐药性问题. 因此人们渴望通过疫苗技术来解决这个问题. 核酸疫苗作为一类新型疫苗, 越来越受到人们的关注.
本研究首次报道了幽门螺杆菌靶向DNA疫苗的构建和免疫评价, 为幽门螺杆菌疫苗研究提供了新思路.
幽门螺杆菌靶向DNA疫苗的构建和免疫评价, 为进一步理解幽门螺杆菌保护性免疫机制和开发人用核酸疫苗奠定了一定基础.
本文利用基因工程技术将靶向基因片段和过氧化氢酶基因融合构建了具有靶向作用的核酸疫苗, 提高了幽门螺杆菌DNA疫苗的免疫原性, 对于临床应用有很好的指导意义.
电编: 张敏 编辑:王晓瑜
| 1. | Todoroki I, Joh T, Watanabe K, Miyashita M, Seno K, Nomura T, Ohara H, Yokoyama Y, Tochikubo K, Itoh M. Suppressive effects of DNA vaccines encoding heat shock protein on Helicobacter pylori-induced gastritis in mice. Biochem Biophys Res Commun. 2000;277:159-163. [PubMed] [DOI] |
| 2. | Miyashita M, Joh T, Watanabe K, Todoroki I, Seno K, Ohara H, Nomura T, Miyata M, Kasugai K, Tochikubo K. Immune responses in mice to intranasal and intracutaneous adminis-tration of a DNA vaccine encoding Helicobacter pylori-catalase. Vaccine. 2002;20:2336-2342. [PubMed] [DOI] |
| 3. | Hatzifoti C, Bajaj-Elliott M, Dorrell N, Anyim M, Prentice MB, Nye KE, Wren B, Morrow WJ. A plasmid immunization construct encoding urease B of Helicobacter pylori induces an antigen-specific antibody response and upregulates the expression of beta-defensins and IL-10 in the stomachs of immunized mice. Vaccine. 2004;22:2651-2659. [PubMed] [DOI] |
| 4. | Cedergren L, Andersson R, Jansson B, Uhlen M, Nilsson B. Mutational analysis of the interaction between staphylococcal protein A and human IgG1. Protein Eng. 1993;6:441-448. [PubMed] [DOI] |
| 5. | Leonetti M, Thai R, Cotton J, Leroy S, Drevet P, Ducancel F, Boulain JC, Menez A. Increasing immunogenicity of antigens fused to Ig-binding proteins by cell surface targeting. J Immunol. 1998;160:3820-3827. [PubMed] |
| 6. | Nizard P, Chenal A, Beaumelle B, Fourcade A, Gillet D. Prolonged display or rapid internalization of the IgG-binding protein ZZ anchored to the surface of cells using the diphtheria toxin T domain. Protein Eng. 2001;14:439-446. [PubMed] [DOI] |
| 7. | Volpers C, Thirion C, Biermann V, Hussmann S, Kewes H, Dunant P, von der Mark H, Herrmann A, Kochanek S, Lochmuller H. Antibody-mediated targeting of an adenovirus vector modified to contain a synthetic immunoglobulin g-binding domain in the capsid. J Virol. 2003;77:2093-2104. [PubMed] [DOI] |
| 8. | Gregoriadis G, Bacon A, Caparros-Wanderley W, McCormack B. A role for liposomes in genetic vaccination. Vaccine. 2002;20 Suppl 5:B1-9. [PubMed] [DOI] |
| 9. | Paukner S, Kudela P, Kohl G, Schlapp T, Friedrichs S, Lubitz W. DNA-loaded bacterial ghosts efficiently mediate reporter gene transfer and expression in macrophages. Mol Ther. 2005;11:215-223. [PubMed] [DOI] |
| 10. | Wu Y, Wang X, Csencsits KL, Haddad A, Walters N, Pascual DW. M cell-targeted DNA vaccination. Proc Natl Acad Sci U S A. 2001;98:9318-9323. [PubMed] [DOI] |
| 11. | Stevceva L, Abimiku AG, Franchini G. Targeting the mucosa: genetically engineered vaccines and mucosal immune responses. Genes Immun. 2000;1:308-315. [PubMed] [DOI] |
| 12. | Lucas B, Bumann D, Walduck A, Koesling J, Develioglu L, Meyer TF, Aebischer T. Adoptive transfer of CD4+ T cells specific for subunit A of Helicobacter pylori urease reduces H. pylori stomach colonization in mice in the absence of interleukin-4 (IL-4)/IL-13 receptor signaling. Infect Immun. 2001;69:1714-1721. [PubMed] [DOI] |
| 13. | Hoffman PS, Vats N, Hutchison D, Butler J, Chisholm K, Sisson G, Raudonikiene A, Marshall JS, Veldhuyzen van Zanten SJ. Development of an interleukin-12-deficient mouse model that is permissive for colonization by a motile KE26695 strain of Helicobacter pylori. Infect Immun. 2003;71:2534-2541. [PubMed] [DOI] |
| 14. | Panthel K, Faller G, Haas R. Colonization of C57BL/6J and BALB/c wild-type and knockout mice with Helicobacter pylori: effect of vaccination and implications for innate and acquired immunity. Infect Immun. 2003;71:794-800. [PubMed] [DOI] |