修回日期: 2007-02-04
接受日期: 2007-03-07
在线出版日期: 2007-05-08
目的: 探讨胃癌癌变过程中Smad4蛋白的表达变化及其与临床病理特征的关系.
方法: 利用组织病理学和免疫组织化学的方法, 对103例胃癌患者(早期16例, 进展期87例)的石蜡标本进行了病理学分类, 并检测各级病变中Smad4蛋白的表达情况.
结果: 其中在28例标本中同时检出肠上皮化生, 在13例标本中检出不典型增生, 有2例标本同时检出肠上皮化生和不典型增生. 癌旁的正常胃黏膜细胞均有Smad4蛋白表达, 在肠上皮化生和不典型增生中表达阳性率分别为89.3%和76.9%. 在癌细胞中则为54.4%, 其中早期癌为62.5%, 进展期癌为52.9%. 随着恶变程度的增加, Smad4蛋白表达下降的频率显著升高(P<0.05). Smad4蛋白表达与癌细胞的分化程度密切相关(P<0.01), 低分化癌细胞中Smad4蛋白表达下降的频率更高, 为63.0%, 而高分化癌细胞中Smad4蛋白表达下降的频率仅为31.6%. 贲门部癌Smad4蛋白的表达阳性率明显高于其他部位(P<0.05), 为75%. 胃底、胃体和胃窦部癌的表达阳性率基本相似, 分别为50%, 53.6%和46.7%. Smad4蛋白表达与患者年龄、性别、肿瘤大小、淋巴结转移、浸润深度未见明显相关性.
结论: Smad4蛋白表达下降是胃癌癌变过程中频发的分子事件, 并且与细胞恶变的进展程度和分化程度密切相关, 但在贲门部癌中表达下降的频率较低.
引文著录: 徐岩, 陈亚男, 王振宁, 罗阳, 徐惠绵. 胃癌癌变过程中Smad4表达的变化及其与临床病理特征的关系. 世界华人消化杂志 2007; 15(13): 1510-1515
Revised: February 4, 2007
Accepted: March 7, 2007
Published online: May 8, 2007
AIM: To characterize the changes of Smad4 expression in the multistage carcinogenesis of gastric cancer and investigate the correlations between these changes and the clinicopatholo-gical features.
METHODS: The expression of Smad4 was detected by immunohistochemisty in the paraffin-embedded samples from 103 patients with gastric carcinoma (16 cases in early stage, 87 cases in progressive stage). The result was comparatively analyzed with the histopathology.
RESULTS: Among 103 gastric carcinoma samples, 28 cases with intestinal metaplasia and 13 cases with atypical hyperplasia were determined. In 2 cases, intestinal metaplasia and atypical hyperplasia were simultaneously determined in the same tissue. Normal gastric mucosa showed positive Smad4 expression. Smad4 expression decreased in different degrees of lesions, and the reduced rate increased with the lesion progression (P < 0.05). The positive rates of Smad4 expression in intestinal metaplasia and atypical hyperplasia were 89.3% and 76.9% respectively, while it was 54.4% in carcinoma cells. Positive expression of Smad4 was found in 10 (62.5%) of early carcinoma and 46 (52.9%) of advanced one. The expression of Smad4 in gastric carcinoma showed a significant correlation with the differentiation of carcinoma (P < 0.01). The reduced rate of Smad4 expression in poorly-differentiated carcinoma was higher than that in well-differentiated one (63.0% vs 31.6%, P < 0.01). Positive expression of Smad4 was found in 15 of 20 gastric cardia carcinoma (75%), which was significantly higher than that in the other positional carcinoma (P < 0.05). The positive rates of Smad4 expression in gastric carcinoma of fundus, corpus and antrum were 50%, 53.6% and 46.7% respectively. Smad4 expression had no marked correlations with the age of patients, gender, tumor size, lymph node metastasis and the depth of tumor invasion (P > 0.05).
CONCLUSION: Reduced expression of Smad4 is a frequent molecular event in gastric carcinogenesis, and closely correlated with the progression of lesions and differentiation of carcinoma.
- Citation: Xu Y, Chen YN, Wang ZN, Luo Y, Xu HM. Change of Smad4 expression in gastric carcinogenesis and its clinicopathological significance. Shijie Huaren Xiaohua Zazhi 2007; 15(13): 1510-1515
- URL: https://www.wjgnet.com/1009-3079/full/v15/i13/1510.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i13.1510
胃癌的发生、发展是一个包含癌基因激活和抑癌基因失活, 并伴有端粒酶活化及遗传不稳定性的多因素、多阶段过程. 在这个过程中, 基因的异常改变是以不断累加的形式发挥着合力作用. 目前认为, 正常胃黏膜细胞是在各种致癌因素的作用下, 通过肠上皮化生、不典型增生等癌前病变, 逐渐演变为胃癌[1-3]. 了解各阶段内所发生的分子事件, 将有助于阐明胃癌的发生机制, 从而为阻断癌变过程提供理论依据和分子靶点. Smad4基因通过转化生长因子-β(TGF-β)信号传导通路来抑制上皮细胞的生长, 最初被发现在胰腺癌中存在着高频率的失活[4-5]. 为了解Smad4在胃癌癌变过程中的变化情况, 我们利用免疫组化技术对正常胃黏膜上皮、癌前病变以及胃癌细胞中Smad4的蛋白表达变化情况进行了考察.
石蜡标本来自中国医科大学附属第一医院肿瘤外科于2003-03/2005-03经手术治疗的胃癌患者103例, 其中男78例, 女25例, 年龄26-80(平均61.0±1.6)岁, 术前均未经化、放疗. 免疫组化一抗为鼠抗人Smad4 mAb (sc-7966, 美国Santa Cruz Biotechnology, Inc.), 稀释倍数1:150, 抗小鼠生物素化二抗和SP检测试剂盒(Histostain-Plus Kit)购自晶美生物工程有限公司.
1.2.1 病理组织学检查: 选择癌灶和距癌灶5 cm以外黏膜部分的蜡块, 行连续切片, 厚4 µm, 一张用于HE染色, 进行病理学诊断. 其余用于免疫组化染色. 根据细胞形态和组织结构, 将胃黏膜上皮细胞分为癌旁正常、肠上皮化生、不典型增生、早期癌和进展期癌. 按照日本胃癌处理规约的标准判定病灶的分化程度、组织分型等, 浸润深度和肿瘤分期依据1997年TNM分期系统.
1.2.2 免疫组化染色: 采用过氧化物酶标记的链霉素卵白素(SP)法, 染色步骤按说明书进行. 石蜡切片置于0.01 mol/L (pH6.0)柠檬酸盐缓冲液中行高温高压抗原修复. 用PBS代替一抗, 作为空白对照. 正常的胃黏膜腺体(尤其是壁细胞)均为Smad4蛋白阳性表达, 所以将其作为阳性对照. 通过与相邻的正常胃腺体细胞相比较, 来确定各级病变细胞中的表达情况. 以胞质和(或)胞核出现棕黄或棕褐色颗粒为阳性细胞, 每例随机观察10个高倍视野, 每个视野计数100个细胞. 若超过50%的细胞为阳性, 则判为Smad4蛋白正常表达; 相反, 若阳性的细胞少于50%, 则判为Smad4蛋白表达下降[6-7].
统计学处理 采用SPSS11.0软件包进行分析. 正常细胞与各级病变之间、不同临床病理特征之间Smad4蛋白表达比较均采用χ2分析, P<0.05认为统计学上有显著意义.
103例标本中包括早期胃癌16例和进展期胃癌87例. 其中, 在28例标本中检出肠上皮化生, 在13例标本中检出不典型增生. 有2例标本同时检出肠上皮化生和不典型增生(表1).
| Smad4 | |||
| n | 正常表达(%) | 表达下降(%) | |
| 性别 | |||
| 男 | 78 | 41(52.6) | 37(47.4) |
| 女 | 25 | 15(60) | 10(40) |
| 部位 | |||
| 贲门 | 20 | 15(75) | 5(25) |
| 胃底 | 10 | 5(50)a | 5(50)a |
| 胃体 | 28 | 15(53.6)a | 13(46.4)a |
| 胃窦 | 45 | 21(46.7)a | 24(53.3)a |
| 淋巴结转移 | |||
| 阴性 | 38 | 22(57.9) | 16(42.1) |
| 阳性 | 65 | 34(52.3) | 31(47.7) |
| TNM分期 | |||
| Ⅰ | 35 | 22(62.9) | 13(37.1) |
| Ⅱ | 30 | 16(53.3) | 14(46.7) |
| Ⅲ | 19 | 10(52.6) | 9(47.4) |
| Ⅳ | 19 | 8(42.1) | 11(57.9) |
| 分化程度 | |||
| 高中分化 | 57 | 39(68.4)b | 18(31.6)b |
| 低分化 | 46 | 17(37.0) | 29(63.0) |
| 浸润深度 | |||
| T1 | 16 | 10(62.5) | 6(37.5) |
| T2 | 61 | 34(55.7) | 27(44.3) |
| T3 | 16 | 8(50) | 8(50) |
| T4 | 10 | 4(40) | 6(60) |
| 肿瘤大小 | |||
| ≤5 | 68 | 38(55.9) | 30(44.1) |
| >5 | 35 | 18(51.4) | 17(48.6) |
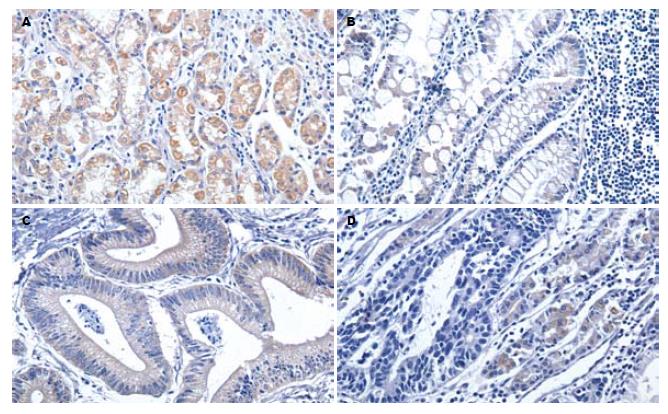
正常胃黏膜细胞中均有Smad4蛋白表达, 尤其在腺体颈部和底部的壁细胞中, 呈强阳性表达(图1A). 在肠上皮化生和不典型增生中表达阳性率稍有下降, 分别为89.3%和76.9%. 在癌细胞中则为54.4%, 其中早期癌为62.5%, 进展期癌为52.9%. 随着细胞恶变程度的增加, Smad4蛋白表达阳性率显著下降(P<0.05, 表2). 在同时存在肠上皮化生和不典型增生的2例标本中, 69号标本为中分化管状腺癌, H47号标本为印戒细胞癌, 两者的癌细胞为阴性表达, 而肠上皮化生和不典型增生则均为阳性表达(图1).
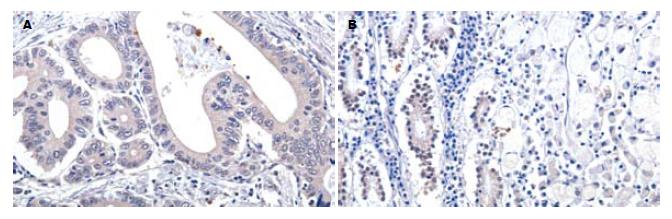
Smad4蛋白表达与癌细胞的分化程度密切相关(P<0.01, 图2). 随着分化程度的降低, 蛋白阳性表达的比率也显著下降. 虽然从总体上看各个部位的肿瘤在蛋白表达上没有显著差异, 但贲门部癌的表达阳性率明显高于其他部位(P<0.05). Smad4蛋白表达与患者年龄、性别、肿瘤大小、淋巴结转移、浸润深度未见明显相关性.
TGF-β是一种具有多种生理功能的细胞因子, 在调节细胞生长、分化、凋亡等方面起重要的作用, 其信号传导需要TGF-β受体和Smads蛋白的参与[8]. Smad4是Smads蛋白家族的成员之一, 是转导TGF-β信号的重要胞质内信号级联分子. TGF-β通路中的Smad2/Smad3复合物只有与Smad4结合后才能进入细胞核, 从而调节目的基因的转录, 发挥抑制细胞生长的作用. 一旦Smad4功能失活或表达低下可使这一信号通路中断, 癌细胞丧失了对TGF-β信号的调节反应. Ijichi et al[9]检测了多个大肠癌、胰腺癌和胃癌细胞株中TGF-β受体Ⅱ(TβRⅡ)和Smad4的表达情况, 结果在91%的大肠癌、61%的胰腺癌和40%的胃癌细胞株中出现了TGF-β信号通路的异常. 而与大肠癌和胰腺癌不同的是, 在胃癌细胞内这种TGF-β信号通路的异常并不能通过转染TβRⅠ和Smad2, 3而得到恢复, 这说明TGF-β信号通路在胃癌中的失活机制, 是与大肠癌和胰腺癌不同的.
本研究中, 癌旁的正常胃黏膜细胞均有Smad4蛋白表达, 其中以腺体部分表达较强, 而胃小凹的黏液细胞表达较弱. 这与以往的研究结果一致[6-7]. 随着细胞恶变程度的增加, Smad4蛋白表达呈下降的趋势. 进一步地比较癌旁正常胃黏膜细胞与癌前病变(肠上皮化生和不典型增生), 以及癌前病变与癌细胞间的表达情况, 发现癌前病变中下降的趋势并不明显, 而在癌细胞中则显著下降(P<0.05), 说明Smad4基因失活可能多发生在癌变过程的后期. 在胰腺癌和结肠癌中的研究, 也证明了这一点[10-11]. 69号和H47号标本中的癌旁正常细胞、肠上皮化生和不典型增生细胞均为Smad4蛋白表达阳性, 而癌细胞中为阴性表达, 即为典型的例子. Smad4蛋白表达下降与癌变的密切关系, 也提示着Smad4基因失活在胃癌的发生过程中起到了重要作用. Xiangming et al[7]的研究还表明, Smad4蛋白表达下降与胃癌细胞的浸润深度密切相关, 并且那些出现了表达下降的胃癌患者往往预后不佳.
在胰腺癌和结肠癌中, 等位基因的纯合性丢失和点突变是Smad4基因失活的主要机制[12-14]. 在胃癌中, 虽然Smad4基因所在的18q21.1染色体区域经常出现丢失[15], 但Smad4基因的突变却较少见[16-17], 这并不符合抑癌基因失活的经典模式. 虽然存在着通过表观遗传学方式导致失活的可能性, 但通过对结肠癌等的研究, 目前尚未发现Smad4基因启动子区域的超甲基化(hypermethylation)[18]. 另外, 在动物实验中发现, Smad4杂合小鼠(Smad4+/-)的胃窦和胃底部在发育了6-12 mo后有息肉形成, 以后逐渐演变为浸润癌, 并在肿瘤形成晚期检测到Smad4的杂合性丢失(loss of heterozygosity, LOH), 提示单倍体不足(haploinsufficiency)可能是Smad4基因失活的机制之一[19]. 本研究的结果显示, Smad4蛋白表达与癌细胞的分化程度也密切相关. 低分化癌细胞中Smad4蛋白表达下降的频率更高. Kim et al[6]的研究表明, 弥漫型胃癌中Smad4蛋白表达下降的频率要显著的低于肠型胃癌. 本研究并没有将病例分为弥漫型和肠型, 但根据Lauren分型[20], 高中分化的胃癌(如管状腺癌和乳头状腺癌)多为肠型, 而低分化(如黏液腺癌和印戒细胞癌)多为弥漫型. 目前认为这两种类型的胃癌有着不同的发生机制[21]. Smad4蛋白表达的差异, 提示其在两种类型胃癌的癌变过程中可能起着不同的作用.
我们还发现, 贲门部癌中Smad4蛋白的阳性表达率要显著高于其他部位(胃底、胃体和胃窦). 贲门远侧部位的癌组织中Smad4蛋白表达下降的程度基本一致(46.4%-53.3%), 而贲门部癌仅有25%, 似乎贲门部癌与Smad4蛋白表达下降关系并不像胃的其他部位那么紧密. 目前, 贲门部腺癌的地位和发生机制还存在着争议[22-24]. 虽然, 从解剖学的角度来看, 贲门属于胃的一部分, 但贲门部腺癌与远端胃癌在流行病学、临床特点等方面都存在着不同之处[25-29]. 越来越多的研究表明, 贲门部腺癌可能是一种具有独特发生机制和生物学特点的疾病[30]. 本研究的结果提示, Smad4可能是区别胃癌和贲门部腺癌的分子特征之一, 进一步地研究Smad4基因的失活机制将有助于揭示其在胃癌和贲门部腺癌发生、发展过程中的作用.
衷心地感谢中国医科大学附属第一医院肿瘤研究所胃癌研究室的王梅先教授、董玉兰教授、王欣芳讲师对本研究中标本的病理诊断给予了必要的指导, 感谢吴烨秋技师、刘江技师、赵凤凯技师在制作病理标本和石蜡切片过程中的辛勤劳动.
1990年Fearon和Vogelstein提出结直肠肿瘤生成的多基因多步骤的分子发病模式, 大大加深了人们对肿瘤产生机制的认识. 同样, 如何描绘出胃癌发生、发展过程的路线图, 也成为胃癌研究者追求的目标. 本研究将Smad4基因作为切入点, 考察了胃癌癌变过程中Smad4蛋白的表达情况.
Xu et al对Smad4 杂合小鼠(SM-AD4+/-)的研究发现, 发育6-12 mo后的小鼠, 胃窦和胃底部有息肉形成, 以后逐渐经增生、不典型增生、原位癌, 演变为浸润癌, 并在肿瘤形成晚期检测到Smad4的杂合性丢失, 提示单倍体不足可能是导致Smad4基因失活的机制之一.
本研究不仅考察了正常胃黏膜和癌组织中Smad4蛋白的表达, 还比较了同一标本内的肠上皮化生和不典型增生等癌前病变中以及早期癌与进展期癌中Smad4蛋白的表达情况. 通过细致的分类和自身对照, 降低了假阳性和假阴性的发生率, 提高了实验的准确性.
本研究应用免疫组织化学染色的方法对胃癌患者正常胃黏膜、癌前病变和癌组织中Smad4蛋白进行了检测. 发现癌组织中Smad4蛋白表达下降的频率显著地高于正常胃黏膜和癌前病变, 这对判断胃黏膜病变程度以及胃癌的病理学诊断具有一定的指导意义.
本文研究了胃癌癌变过程中Smad4表达的变化及其与临床病理特征的关系, 对胃癌发病机制、临床诊断及预后有一定意义, 学术价值较高.
电编: 张敏 编辑:王晓瑜
| 1. | Correa P. Human gastric carcinogenesis: a multistep and multifactorial process--First American Cancer Society Award Lecture on Cancer Epidemiology and Prevention. Cancer Res. 1992;52:6735-6740. [PubMed] |
| 2. | Vieth M, Stolte M. Elevated risk for gastric adeno-carcinoma can be predicted from histomorphology. World J Gastroenterol. 2006;12:6109-6114. [PubMed] [DOI] |
| 3. | Kapadia CR. Gastric atrophy, metaplasia, and dysplasia: a clinical perspective. J Clin Gastroenterol. 2003;36:S29-36; discussion S61-62. [PubMed] |
| 4. | Hahn SA, Schutte M, Hoque AT, Moskaluk CA, da Costa LT, Rozenblum E, Weinstein CL, Fischer A, Yeo CJ, Hruban RH. DPC4, a candidate tumor suppressor gene at human chromosome 18q21.1. Science. 1996;271:350-353. [PubMed] [DOI] |
| 5. | Schutte M, Hruban RH, Hedrick L, Cho KR, Nadasdy GM, Weinstein CL, Bova GS, Isaacs WB, Cairns P, Nawroz H. DPC4 gene in various tumor types. Cancer Res. 1996;56:2527-2530. [PubMed] |
| 6. | Kim JY, Park DY, Kim GH, Choi KU, Lee CH, Huh GY, Sol MY, Song GA, Jeon TY, Kim DH. Smad4 expression in gastric adenoma and adenocarcinoma: frequent loss of expression in diffuse type of gastric adenocarcinoma. Histol Histopathol. 2005;20:543-549. [PubMed] |
| 7. | Xiangming C, Natsugoe S, Takao S, Hokita S, Ishigami S, Tanabe G, Baba M, Kuroshima K, Aikou T. Preserved Smad4 expression in the transforming growth factor beta signaling pathway is a favorable prognostic factor in patients with advanced gastric cancer. Clin Cancer Res. 2001;7:277-282. [PubMed] |
| 8. | ten Dijke P, Hill CS. New insights into TGF-beta-Smad signalling. Trends Biochem Sci. 2004;29:265-273. [PubMed] [DOI] |
| 9. | Ijichi H, Ikenoue T, Kato N, Mitsuno Y, Togo G, Kato J, Kanai F, Shiratori Y, Omata M. Systematic analysis of the TGF-beta-Smad signaling pathway in gastrointestinal cancer cells. Biochem Biophys Res Commun. 2001;289:350-357. [PubMed] [DOI] |
| 10. | Wilentz RE, Iacobuzio-Donahue CA, Argani P, McCarthy DM, Parsons JL, Yeo CJ, Kern SE, Hruban RH. Loss of expression of Dpc4 in pancreatic intraepithelial neoplasia: evidence that DPC4 inactivation occurs late in neoplastic progression. Cancer Res. 2000;60:2002-2006. [PubMed] |
| 11. | Maitra A, Molberg K, Albores-Saavedra J, Lindberg G. Loss of Dpc4 expression in colonic adenocarcinomas correlates with the presence of metastatic disease. Am J Pathol. 2000;157:1105-1111. [PubMed] [DOI] |
| 12. | Bartsch D, Hahn SA, Danichevski KD, Ramaswamy A, Bastian D, Galehdari H, Barth P, Schmiegel W, Simon B, Rothmund M. Mutations of the DPC4/Smad4 gene in neuroendocrine pancreatic tumors. Oncogene. 1999;18:2367-2371. [PubMed] [DOI] |
| 13. | Miyaki M, Iijima T, Konishi M, Sakai K, Ishii A, Yasuno M, Hishima T, Koike M, Shitara N, Iwama T. Higher frequency of Smad4 gene mutation in human colorectal cancer with distant metastasis. Oncogene. 1999;18:3098-3103. [PubMed] [DOI] |
| 14. | Koyama M, Ito M, Nagai H, Emi M, Moriyama Y. Inactivation of both alleles of the DPC4/SMAD4 gene in advanced colorectal cancers: identification of seven novel somatic mutations in tumors from Japanese patients. Mutat Res. 1999;406:71-77. [PubMed] [DOI] |
| 15. | 朱 亚青, 尹 浩然, 朱 正纲, 刘 炳亚, 张 奕, 陈 雪华, 于 颖彦, 林 言箴. 胃癌SMAD4/DPC4杂合性丢失的研究. 世界华人消化杂志. 2003;11:522-525. [DOI] |
| 16. | Lei J, Zou TT, Shi YQ, Zhou X, Smolinski KN, Yin J, Souza RF, Appel R, Wang S, Cymes K. Infrequent DPC4 gene mutation in esophageal cancer, gastric cancer and ulcerative colitis-associated neoplasms. Oncogene. 1996;13:2459-2462. [PubMed] |
| 17. | Powell SM, Harper JC, Hamilton SR, Robinson CR, Cummings OW. Inactivation of Smad4 in gastric carcinomas. Cancer Res. 1997;57:4221-4224. [PubMed] |
| 18. | Ando T, Sugai T, Habano W, Jiao YF, Suzuki K. Analysis of SMAD4/DPC4 gene alterations in multiploid colorectal carcinomas. J Gastroenterol. 2005;40:708-715. [PubMed] [DOI] |
| 19. | Xu X, Brodie SG, Yang X, Im YH, Parks WT, Chen L, Zhou YX, Weinstein M, Kim SJ, Deng CX. Haploid loss of the tumor suppressor Smad4/Dpc4 initiates gastric polyposis and cancer in mice. Oncogene. 2000;19:1868-1874. [PubMed] [DOI] |
| 20. | Lauren P. The two histological main types of gastric carcinoma: diffuse and so-called intestinal-type carcinoma. An attempt at a histo-clinical classification. Acta Pathol Microbiol Scand. 1965;64:31-49. [PubMed] |
| 21. | Tahara E. Genetic pathways of two types of gastric cancer. IARC Sci Publ. 2004;327-349. [PubMed] |
| 22. | Ichikura T, Ogawa T, Kawabata T, Chochi K, Sugasawa H, Mochizuki H. Is adenocarcinoma of the gastric cardia a distinct entity independent of subcardial carcinoma? World J Surg. 2003;27:334-338. [PubMed] [DOI] |
| 23. | von Rahden BH, Feith M, Stein HJ. Carcinoma of the cardia: classification as esophageal or gastric cancer? Int J Colorectal Dis. 2005;20:89-93. [PubMed] [DOI] |
| 24. | Rusch VW. Are cancers of the esophagus, gastroesophageal junction, and cardia one disease, two, or several? Semin Oncol. 2004;31:444-449. [PubMed] [DOI] |
| 25. | Saito H, Fukumoto Y, Osaki T, Fukuda K, Tatebe S, Tsujitani S, Ikeguchi M. Distinct recurrence pattern and outcome of adenocarcinoma of the gastric cardia in comparison with carcinoma of other regions of the stomach. World J Surg. 2006;30:1864-1869. [PubMed] [DOI] |
| 26. | Kim MA, Lee HS, Yang HK, Kim WH. Clinicopa-thologic and protein expression differences between cardia carcinoma and noncardia carcinoma of the stomach. Cancer. 2005;103:1439-1446. [PubMed] [DOI] |
| 27. | Pinto-De-Sousa J, David L, Seixas M, Pimenta A. Clinicopathologic profiles and prognosis of gastric carcinomas from the cardia, fundus/body and antrum. Dig Surg. 2001;18:102-110. [PubMed] [DOI] |
| 28. | Rudiger Siewert J, Feith M, Werner M, Stein HJ. Adenocarcinoma of the esophagogastric junction: results of surgical therapy based on anatomical/topographic classification in 1,002 consecutive patients. Ann Surg. 2000;232:353-361. [PubMed] [DOI] |
| 29. | Kajiyama Y, Tsurumaru M, Udagawa H, Tsutsumi K, Kinoshita Y, Ueno M, Akiyama H. Prognostic factors in adenocarcinoma of the gastric cardia: pathologic stage analysis and multivariate regression analysis. J Clin Oncol. 1997;15:2015-2021. [PubMed] |