修回日期: 2007-02-04
接受日期: 2007-02-21
在线出版日期: 2007-05-08
目的: 观察胃电刺激(GES)对大鼠海马CA1区胃扩张(GD)相关神经元放电活动的影响及脑内一氧化氮合酶(nNOS)和胃动素(MTL)表达的改变, 初步探讨GES的中枢作用机制.
方法: 选用成年Wistar大鼠58只, 采用细胞外记录神经元单位放电方法, 记录海马CA1区神经元自发放电活动, 根据神经元对胃扩张刺激反应的不同, 分为胃扩张兴奋性神经元(GD-E)和胃扩张抑制性神经元(GD-I). 观察3组不同参数的胃电刺激(GES-A, GES-B和GES-C)对CA1区内GD-E和GD-I放电频率的影响: GES-A (6 mA, 0.3 ms, 40 Hz, 2 s-on, 3 s-off)为标准参数; GES-B的串刺激波宽增至3 ms; GES-C的串刺激频率减少至20 Hz, 其他参数均同GES-A. 采用放射免疫法检测胃电刺激对大鼠不同脑区MTL含量的影响; 并采用免疫荧光组织化学染色方法观察胃电刺激2 h对大鼠海马内nNOS免疫阳性神经元的表达.
结果: CA1区记录的87个神经元中有79个神经元(90.8%)对胃扩张刺激(GD, 3-5 mL, 10-30 s)有反应, 其中40个(50.6%)为GD-E神经元, 39个(49.4%)为GD-I神经元. GES-A, -B, -C分别兴奋了62.5%, 100%和62.3%的GD-E神经元, GES-B对GD-E神经元的作用明显强于GES-C (神经元兴奋率GES-B 100% vs GES-C 62.3%, P<0.05). 在GD-I神经元中有63.6%, 85.7%和50%的GD-I神经元分别被GES-A, -B和-C所兴奋, 其中GES-C的兴奋作用较弱(P = 0.041, vs GES-A; P = 0.021, vs GES-B). GES-A刺激胃窦部2 h, 下丘脑(48.93±6.98 fmol/mg vs 96.23±12.93 fmol/mg, P<0.01)、中脑(30.96±4.86 fmol/mg vs 53.17±8.96 fmol/mg, P<0.05)、延脑(46.27±7.83 fmol/mg vs 73.86±9.37 fmol/mg, P<0.05)和海马(32.23±6.51 fmol/mg vs 62.72±10.07 fmol/mg, P<0.05)中MTL免疫反应物(MTL-IR)的含量与假手术对照组相比明显减少, 但脑桥内MTL-IR的含量与假手术对照组相比无显著差异; 且海马CA1区(16.75±0.91 cells/mm2vs 20.46±1.30 cells/mm2, P<0.05)和CA2-3区(14.91±1.17 cells/mm2vs 18.73±1.10 cells/mm2, P<0.05)nNOS免疫阳性神经元表达明显减少.
结论: GES可兴奋海马CA1区内胃扩张反应性神经元, 电刺激作用的强弱与GES刺激的频率和单个电刺激的持续时间有关; 脑内MTL和海马内nNOS可能参与了GES的中枢作用机制.
引文著录: 鹿勇, 徐珞, 孙向荣, 魏晓芳, 陆江, 陈建德. 胃电刺激对大鼠海马胃扩张反应神经元及胃动素和nNOS表达的影响. 世界华人消化杂志 2007; 15(13): 1463-1469
Revised: February 4, 2007
Accepted: February 21, 2007
Published online: May 8, 2007
AIM: To explore the effects of gastric electrical stimulation (GES) on gastric distension (GD) responsive neurons in rat hippocampus, and study the expression of neuronal nitric oxide synthase (nNOS) and motilin (MTL) in rat brain for exploring the central mechanism of GES.
METHODS: Fifty adult Wistar rats were used in this experiment. The effects of GES on GD responsive neurons in hippocampus CA1 area were observed by recording extracellular potentials of single neuron. GD responsive neurons were classified as GD-excitatory (GD-E) and GD-inhibitory (GD-I) neurons according to their responses to GD. GES with 3 sets of parameters were applied for 1 minute respectively: GES-A (6 mA, 0.3 ms, 40 Hz, 2 s-on, 3 s-off) with standard pulse trains; GES-B with increased wave width to 3 ms and GES-C with decreased frequency to 20 Hz. Two hours after GES-A was applied, we observed the expression of nNOS immunoreactive positive neurons in hippocampus by fluorescent immunohistochemistry and the content of motilin in rat brain by radioimmunoassay.
RESULTS: Eighty-seven neurons in hippocampus CA1 area were recorded and 79 responded to gastric distension (GD, 3-5 mL, 10-30 s). Of the 79 GD responsive neurons, 40 (50.6%) were GD-E neurons and 39 (49.4%) were GD-I ones. 62.5%, 100% and 62.3% of GD-E neurons were excited by GES-A, -B, and -C respectively. GES-B excited more GD-E neurons than GES-C (P = 0.016). Among the GD-I neurons, 63.6%, 85.7% and 50.0% neurons were excited by GES-A, -B and -C respectively. GES-C was noted to be less effective comparing with GES-A (P = 0.041) or GES-B (P = 0.021). Two hours after GES-A was used, the expressions of nNOS positive neurons significantly decreased in the CA1 and CA2-3 area of hippocampus (16.75 ± 0.91 cells/mm2vs 20.46 ± 1.30 cells/mm2, P < 0.05; 14.91 ± 1.17 cells/mm2vs 18.73 ± 1.10 cells/mm2, P < 0.05) and the content of motilin peptide decreased obviously in the hypothalamus (48.93 ± 6.98 fmol/mg vs 96.23 ± 12.93 fmol/mg, P < 0.01), mesencephalon (53.17 ± 8.96 fmol/mg vs 30.96 ± 4.86 fmol/mg, P < 0.05), medulla oblongata (46.27 ± 7.83 fmol/mg vs 73.86 ± 9.37 fmol/mg, P < 0.05) and hippocampus (32.23 ± 6.51 fmol/mg vs 62.72 ± 10.07 fmol/mg, P < 0.05) by radioimmunoassay.
CONCLUSION: GES may activate the gastric distension responsive neurons in hippocampus CA1 area and the excitatory effect of GES is related to the frequency and wave width of stimulation. Decreased expression of nNOS and motilin in the brain may also take part in the central mechanism of GES.
- Citation: Lu Y, Xu L, Sun XR, Wei XF, Lu J, Chen JD. Effects of gastric electrical stimulation on hippocampus gastric distension responsive neurons and the expression of motilin and neuronal nitric oxide synthase in rats. Shijie Huaren Xiaohua Zazhi 2007; 15(13): 1463-1469
- URL: https://www.wjgnet.com/1009-3079/full/v15/i13/1463.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i13.1463
肥胖逐渐成为现代生活的流行病, 在美国有50%的成人超重, 20%的成人肥胖. 近10 a来, 我国城市肥胖的发生率显著增加, 由其导致的糖尿病、高血压、癌症逐年递增, 死亡率不断上升. 因此, 行之有效的减肥已成为医学界及营养学界专家研究的一个热点. 治疗肥胖的方法很多, 最近在西方国家兴起了一种新型肥胖治疗方法--胃电刺激疗法[1-4]. 有文献报道, 胃电刺激可减少胃窦的运动频率、抑制胃排空、减弱胃的慢波节律, 从而减少食物摄入量[5-8]. 临床上胃电刺激可明显抑制肥胖患者的食欲并减轻患者体质量[1-4]. 有研究表明, 肥胖是一种由摄食和能量调节紊乱引起的疾病, 摄食受体内复杂的神经和体液因素的调节, 涉及到神经中枢、传入、传出神经以及许多同摄食有关的信号、神经递质和激素, 而中枢神经系统(CNS)是调控摄食的主要部位. 但胃电刺激的中枢作用机制至今仍不明了. 本研究通过观察胃电刺激对大鼠海马CA1区胃扩张敏感性神经元的作用以及中枢内nNOS和胃动素表达的影响, 探讨胃电刺激的中枢作用机制.
1.1.1 实验动物: 采用健康成年Wistar大鼠(由青岛市药检所提供), 雌雄兼备, 体质量250-350 g, 置于室温25±2 ℃, 12/12 h昼夜循环光照条件下生活, 自由摄食、饮水.
1.1.2 实验仪器: MEZ8201型微电极放大器; VC-Ⅱ型双道记忆示波器; QC-111J型直方图分析仪; SSEW-3301电子刺激器, 均由日本光电公司生产.
1.2.1 电生理实验: 200 g/L乌拉坦(1 g/kg)经腹腔注射麻醉大鼠. 颈部正中纵行切口, 行气管插管术. 腹部正中纵行切口, 经胃底部切口将胃内容物掏出, 以温和生理盐水清洗. 置入一薄软胶气囊, 经聚乙烯软管连至一5 mL注射器, 实验中注入生理盐水(3-5 mL, 0.5 mL/s, ±37 ℃)扩张胃, 用以鉴别胃扩张敏感神经元[8]. 胃窦部近胃小弯侧缝合一铂金刺激电极, 电极尖端相距约0.2 cm, 关闭腹腔. 头部正中切口, 牙科钻颅骨钻孔, 切开脑膜暴露脑表面, hippocampus CA1 area定位参照Paxions-Watson大鼠脑图谱. 坐标定位: P: 3.14-3.6 mm, L (R): 1.3-2 mm, H: 2.6-3.2 mm. 用液压推进器将电极送至预定深度后进行细胞外记录, 记录电极内充灌含有20 g/L滂胺天蓝的0.5 mol/L醋酸钠溶液, 观察细胞电信号与噪声比在3:1以上. 信号经MEZ-8201型微电极放大器输入VC-11双道示波器, 电信号经由示波器同步Y轴输出, 经SUMP-PC生物信号处理系统进行放电频率分析, 并绘出序列密度直方图. 以神经元放电频率的变化率超过20%作为神经元兴奋或抑制指标, 神经元表现兴奋或抑制反应可确定为GD敏感神经元. 给予3组不同参数的胃电刺激(GES-A: 6 mA, 0.3 ms, 40 Hz, 2 s-on, 3 s-off; GES-B: 6 mA, 3 ms, 40 Hz, 2 s-on, 3 s-off; GES-C: 6 mA, 0.3 ms, 20 Hz, 2 s-on, 3 s-off)观察GD神经元自发放电频率的变化.
1.2.2 放射免疫实验: Motilin放射免疫试剂盒由上海第二军医大学提供, 脑区内motilin的提取和放免检测严格按说明书进行操作. 首先配制motilin标准液(将motilin标准品用PBS缓冲液稀释成每100 μL分别含2.5, 5, 10, 20, 40, 80, 160, 320, 640, 1280 pg的motilin); motilin抗血清用PBS稀释至1:8000. 动物实验完毕, 迅速断头取脑. 分别将脑和垂体置于煮沸的生理盐水中煮5或3 min; 吸干、分离海马、下丘脑、中脑、桥脑和延脑, 称质量, 加1 mol/L盐酸1.0 mL制成匀浆, 室温下静置100 min. 然后加1 mol/L氢氧化钠1 mL中和, 离心(4000 r/min) 20 min, 取上清液测定. 测定程序: 各管加125I-motilin 100 μL, 抗motilin血清100 μL. 样品管加100-200 μL, 标准管加motilin 100 μL, 最后以磷酸缓冲液补足总反应体积为500 μL; 4 ℃冰箱内孵育24 h; 各管加1:3羊抗兔血清100 μL, 继续孵育24 h, 离心(4000 r/min) 20 min, 弃上清液. 测沉淀物的cpm, 根据同批测定管的motilin竞争抑止曲线, 求取每mg组织中motilin的含量.
1.2.3 免疫组织化学实验: GES-A电刺激胃2 h后立即用生理盐水、40 g/L多聚甲醛/PBS经心脏灌注固定. 断头取脑, 后固定2 h, 梯度蔗糖浸泡过夜, 待组织块沉底后行脑冠状连续冰冻切片, 片厚20 μm. 各组脑片均在同一水平每隔3张脑片取1张, 各组均取6张. 脑片经40 mL/L正常羊血清/0.5 mL/L Triton X-100/PBS孵育2-3 h后, 与nNOS单克隆抗体(1:500, Chemicon international, CA, USA)孵育液(4 mL/L NGS和0.5 mL/L Triton X-100的PBS孵育液)孵育40 h(4 ℃). 二抗选用羊抗小鼠Cy3-IgG (1:500, Jackson Immunoresearch, USA)孵育2 h(避光), 0.01 mol/L PBS冲洗后, 甘油/PBS封片剂(Citifluor, UK)封片, 激光共聚焦显微镜(Biorad, MRC1024型, 日本)下观察免疫阳性细胞.
统计学处理 采用软件GraphPad Prism 3.0 (GraphPad Software公司, 美国)进行统计分析, 数据以mean±SD表示, 两样本均数的比较采用t检验, 各组电刺激之间的作用差别用χ2检验, P<0.05为差异有显著性.
根据放电特点不同, 在58只大鼠记录的海马CA1区79个神经元中有3种放电模式, 即间断性的、连续性的和单个放电(表1).
| 放电模式 | 放电频率(Hz) | ||
| 低 | 中 | 高 | |
| 单个放电 | 10(12.1%) | ||
| 间断性放电 | 2(2.7%) | 12(16.8%) | 9(10.9%) |
| 连续性放电 | 28(34.4%) | 18(23.1%) | |
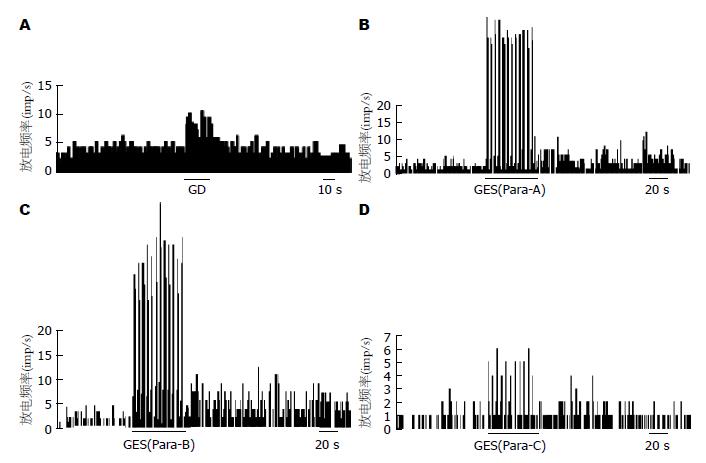
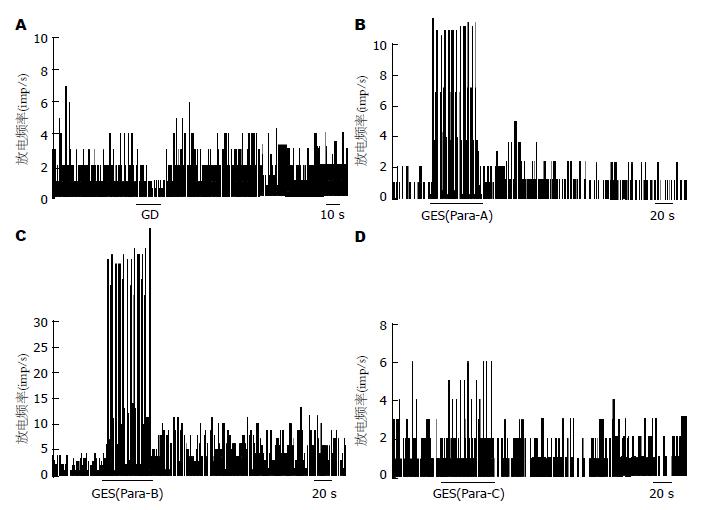
2.2.1 GD对大鼠海马CA1区神经元放电活动的影响: 58只大鼠的海马CA1区所记录到的87个神经元单位放电中有79个神经元(90.8%)为GD反应性神经元; 在79个GD反应性神经元中, 40个神经元(50.6%)为GD-E神经元(图1A), 39个 (49.4%)为GD-I神经元(图2A). 给以胃扩张刺激后, GD-E神经元的放电频率由1.42±0.21 Hz增加至2.95±0.51 Hz(P<0.01); 而GD-I神经元的放电频率却显著下降, 由1.35±0.29 Hz降至0.56±0.14 Hz(P<0.01).
2.2.2 GES对大鼠海马CA1区GD-E和GD-I神经元放电活动的影响: GES-A, GES-B和GES-C使GD-E神经元兴奋率分别为62.5%, 100%和62.3%. GES-B的作用与GES-C相比有显著差异(100% vs 62.3%, P = 0.016<0.05)(图1B-D). 与GES-A比较GES-B兴奋持续时间明显延长(54.44±6.69 s vs 108.57±85.92 s, P<0.05).
在GD-I神经元中, 分别有63.6%, 85.7%和50%的神经元被GES-A, GES-B和GES-C所兴奋, GES-C的作用与GES-A或GES-B的作用相比差别有显著意义(GES-C 50% vs GES-A 63.6%, P = 0.041<0.05; GES-C 50% vs GES-B 85.7% P = 0.021<0.05)(图2B-D). GES-B的放电变化率明显较GES-A组增高(79.07±19.0 Hz vs 367.30±88.9 Hz, P<0.01).
GES-A刺激大鼠胃窦部2 h后, 下丘脑、中脑、延脑和海马中胃动素样免疫阳性物(MTL-IR)的含量与对照组相比明显减少(P<0.05-0.01, 表2), 但脑桥内MTL-IR的含量与对照组相比无显著差异(P>0.05, 表2).
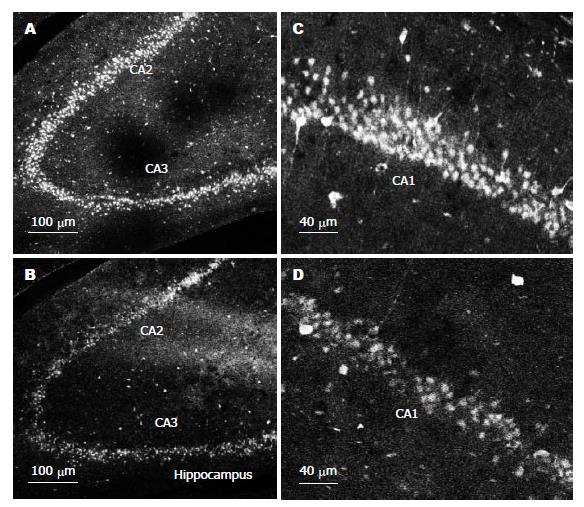
采用荧光免疫组化染色, 镜下可见海马CA1, CA2-3区和齿状回内有大量一氧化氮合酶免疫阳性(nNOS-IR)细胞的表达. 该神经元胞体呈卵圆形, 部分神经元的突起可见有nNOS-IR的表达. nNOS免疫反应阳性细胞主要分布在海马叠罗汉细胞层和齿状回的颗粒细胞层, 海马辐射层分布较少. 与假手术对照组比较, 电刺激大鼠胃窦部2 h (GES-A), 大鼠海马CA1区(假手术对照组20.46±1.30 cells/mm2vs GES组16.75±0.91 cells/mm2, P<0.05)和CA2-3区(假手术对照组18.73±1.10 cells/mm2vs GES组14.91±1.17 cells/mm2, P<0.05)内nNOS免疫反应阳性细胞的表达明显降低(图3).
近10 a来, 我国城市肥胖的发生率显著增加. 研究表明, 肥胖是一种由摄食和能量调节紊乱引起的疾病, 与遗传、环境、膳食结构等多种因素有关. 摄食是人类以及动物维持生命活动的最基本和最重要的复杂行为. 摄入的食物经过消化和吸收,为机体提供必需的能量和营养物质. 摄食受体内复杂的神经和体液因素的调节,涉及到神经中枢、传入、传出神经以及许多同摄食有关的信号、神经递质和激素, 而中枢神经系统(CNS)是调控摄食的主要部位. 近年来有文献报道, 胃电刺激可以通过改变胃慢波或胃运动节律[9-11]影响胃的排空和运动, 进而减少食物摄取和体质量[12]. 胃电刺激还可抑制肥胖大鼠的摄食量从而减轻大鼠体质量[13]. 临床研究也进一步证实GES可以减轻肥胖患者的体质量[1-4]. 最近有文献报道, 胃电刺激可以影响大鼠下丘脑摄食相关神经元的电活动[14]. 本研究发现, 胃电刺激(40 Hz/0.3 ms/2 s-on 3 s-off/6 mA)可兴奋大鼠海马CA1区的GD反应神经元. 为了进一步比较不同胃电刺激参数对GD敏感性神经元的影响, 我们又设置了刺激波宽增加组(GES-B)和刺激频率减少组(GES-C)做为对照, 结果显示GES-B对GD敏感性神经元的兴奋作用加强, 但GES-C的兴奋作用则减弱. 提示, 在GES改变中枢GD敏感性神经元兴奋过程中, 刺激的持续时间及刺激波宽均起着一定的影响.
胃的牵张刺激可兴奋胃壁机械性感受器, 兴奋通过迷走传入纤维上传至脑干的孤束核(NTS)继而上传至下丘脑及其他脑区, 如海马、杏仁核、皮层等, 引起进食后系统性的情绪、心理及植物神经系统的活动反应[15]. 电生理学上利用对胃扩张刺激的电应答反应, 鉴定消化道机械感受性传入信息的神经途径, 用以研究参与调控胃肠机能的中枢部位及影响其活动的神经体液因素. 有文献报道, 下丘脑外侧区[16]、嗅球[17]、迷走背核[18]、室旁核[19]、视上核[20]和臂旁核[21]等对胃肠道传入刺激有应答. 本研究首次报道海马CA1区神经元对胃牵张刺激敏感, 且CA1区大多数神经元(63.3%)对胃牵张刺激有反应. 结果提示, 海马CA1区神经元参与胃肠传入冲动的调节. 另有文献报道, 胃电刺激可抑制动物摄食主要通过改变胃肠肌电活动而影响其动力[22-23], 本研究发现, 海马内69.8%-90%的GD神经元对上述4种不同参数的GES均有反应, 且主要呈现兴奋性的效应, 该结果提示胃电刺激调节动物摄食活动可能与GD反应性神经元有关.
海马属于边缘神经系统的内脏整合中枢, 其参与内脏活动的调节, 故又称之为内脏脑. 海马与下丘脑、延髓和杏仁核等与摄食有关的中枢间存在广泛的纤维联系[24]. 海马除了参与学习记忆功能的调控外, 海马还在影响消化系统功能活动中起重要作用[12]. 近年来, 认为在下丘脑存在有一个调节摄食的网络环路, 在这个网络环路中有增食信号和抑食信号, 他们之间有着精确的相互联系的通路; 生成这些增食和抑食信号神经元的活性, 受到内环境中多种激素和活性分子的影响, 尤其是与胃肠运动和能量代谢与有关的胃动素. 胃动素是由22个氨基酸组成的脑肠肽, 其具有促进胃肠运动和调节摄食活动的功能. 有文献报道, 海马内注射胃动素可明显增加胃运动的幅度, 而海马内投以CCK-8则明显减弱胃肠运动[12]; 损毁海马可明显影响大鼠的摄食行为, 随之诱发大鼠产生肥胖[25]. 本研究发现, 电刺激大鼠胃窦部, 海马内胃动素的含量明显减少, 同时海马内NOS表达减少. 结果提示, 海马内胃动素可能参与了GES调节海马神经元的放电活动.
NO是由L-精氨酸在NO合酶(NOS)的催化下生成的[26]非胆碱能、非肾上腺素能神经递质. 有文献报道, 中枢NO参与某些疾病的发生和发展, NO在糖尿病大鼠NOS表达明显增加[27]; Sadler et al[28]报道侧脑室注射NOS抑制剂N-硝基-L-精氨酸甲酯(L-NAME)可显著改变肥胖大鼠的能量代谢活动. NOS抑制剂L-NAME可显著加强由胃动素促进小肠平滑肌条收缩作用, 而合成NO的前体L-AA则抑制胃动素促进小肠平滑肌条收缩作用[29], 提示在外周NO也参与了胃动素对平滑肌收缩的调控. 另有研究发现, 在海马区有NOS免疫阳性细胞的表达[30], L-NAME可使小鼠体质量减轻, NO参与能量平衡的调节[28]. 本研究的结果显示, 胃电刺激使大鼠海马内胃动素含量减少的同时, 海马内NOS表达量也显著减少. 结果提示, GES调节海马神经元的放电活动中胃动素含量的变化可能与NO信号通路活动改变有关.
总之, GES可兴奋海马CA1区的GD反应性神经元, 并减少海马内胃动素和NOS的表达; GES对神经元电活动影响的强弱与GES的强度、频率和刺激持续时间有关, 本研究为临床上治疗肥胖参数的选择提供了有价值的实验依据.
肥胖是一种由摄食和能量调节紊乱引起的疾病, 与遗传、环境、膳食结构等多种因素有关. 由其导致的糖尿病、高血压、癌症逐年递增, 死亡率不断上升. 因此行之有效的减肥已成为医学界及营养学界专家研究的一个热点. 有文献报道, 胃电刺激可减少胃窦的运动频率、抑制胃排空、减弱胃的慢波节律, 从而减少食物摄入量, 从而能减轻肥胖.
胃电刺激疗法是最近在西方国家兴起了一种新型肥胖治疗方法, 其作用的中枢机制及其临床应用是人们关注的热点之一.
目前研究发现胃电刺激可通减少饮食、减轻肥胖, 但对胃电刺激的中枢机制还不十分清楚. 本文从研究胃电刺激对大鼠海马CA1区胃扩张敏感性神经元的作用以及胃电刺激对中枢内nNOS和胃动素表达的影响, 探讨胃电刺激的中枢作用机制.
肥胖症(obesity): 是一组常见的、古老的代谢症候群. 当人体进食热量多于消耗热量时, 多余热量以脂肪形式储存于体内, 其量超过正常生理需要量, 且达一定值时遂演变为肥胖症. 因体脂增加使体质量超过标准体质量20%或体质量指数大于24者称为肥胖症. 如无明显病因可寻者称单纯性肥胖症; 具有明确病因者称为继发性肥胖症.
本研究通过观察胃电刺激对大鼠海马CA1区胃扩张相关神经元放电活动的影响及脑内一氧化氮合酶和胃动素表达的改变, 初步探讨胃电刺激的中枢作用机制. 文章研究内容较为重要, 方法、数据和结论尚可信, 符合伦理学要求, 有一定的研究价值和新意.
电编: 张敏 编辑:张焕兰
| 1. | Miller KA. Implantable electrical gastric stimulation to treat morbid obesity in the human: operative technique. Obes Surg. 2002;12 Suppl 1:17S-20S. [PubMed] [DOI] |
| 2. | D'Argent J. Gastric electrical stimulation as therapy of morbid obesity: preliminary results from the French study. Obes Surg. 2002;12 Suppl 1:21S-25S. [PubMed] [DOI] |
| 3. | Yao S, Ke M, Wang Z, Xu D, Zhang Y, Chen JD. Retrograde gastric pacing reduces food intake and delays gastric emptying in humans: a potential therapy for obesity? Dig Dis Sci. 2005;50:1569-1575. [PubMed] [DOI] |
| 4. | Cigaina V. Gastric pacing as therapy for morbid obesity: preliminary results. Obes Surg. 2002;12 Suppl 1:12S-16S. [PubMed] [DOI] |
| 5. | Zhu H, Chen JD. Implantable gastric stimulation inhibits gastric motility via sympathetic pathway in dogs. Obes Surg. 2005;15:95-100. [PubMed] [DOI] |
| 6. | Xu X, Zhu H, Chen JD. Pyloric electrical stimulation reduces food intake by inhibiting gastric motility in dogs. Gastroenterology. 2005;128:43-50. [PubMed] [DOI] |
| 7. | Ouyang H, Xing J, Chen JD. Tachygastria induced by gastric electrical stimulation is mediated via alpha- and beta-adrenergic pathway and inhibits antral motility in dogs. Neurogastroenterol Motil. 2005;17:846-853. [PubMed] [DOI] |
| 8. | Ouyang H, Yin J, Chen JD. Therapeutic potential of gastric electrical stimulation for obesity and its possible mechanisms: a preliminary canine study. Dig Dis Sci. 2003;48:698-705. [PubMed] [DOI] |
| 9. | Hocking MP, Vogel SB, Sninsky CA. Human gastric myoelectric activity and gastric emptying following gastric surgery and with pacing. Gastroenterology. 1992;103:1811-1816. [PubMed] [DOI] |
| 10. | Lin ZY, McCallum RW, Schirmer BD, Chen JD. Effects of pacing parameters on entrainment of gastric slow waves in patients with gastroparesis. Am J Physiol. 1998;274:G186-191. [PubMed] |
| 11. | Lin Z, Sarosiek I, Forster J, McCallum RW. Symptom responses, long-term outcomes and adverse events beyond 3 years of high-frequency gastric electrical stimulation for gastroparesis. Neurogastroenterol Motil. 2006;18:18-27. [PubMed] [DOI] |
| 12. | Guan Y, Tang M, Jiang Z, Peeters TL. Excitatory effects of motilin in the hippocampus on gastric motility in rats. Brain Res. 2003;984:33-41. [PubMed] [DOI] |
| 13. | Cigaina V V, Saggioro A, Rigo V V, Pinato G, Ischai S. Long-term Effects of Gastric Pacing to Reduce Feed Intake in Swine. Obes Surg. 1996;6:250-253. [PubMed] [DOI] |
| 14. | Sun X, Tang M, Zhang J, Chen JD. Excitatory effects of gastric electrical stimulation on gastric distension responsive neurons in ventromedial hypothalamus (VMH) in rats. Neurosci Res. 2006;55:451-457. [PubMed] [DOI] |
| 15. | Tache Y, Garrick T, Raybould H. Central nervous system action of peptides to influence gastrointestinal motor function. Gastroenterology. 1990;98:517-528. [PubMed] [DOI] |
| 16. | Jeanningros R. Modulation of lateral hypothalamic single unit activity by gastric and intestinal distension. J Auton Nerv Syst. 1984;11:1-11. [PubMed] [DOI] |
| 17. | Isaacson RL. A fuzzy limbic system. Behav Brain Res. 1992;52:129-131. [PubMed] [DOI] |
| 18. | Zhang X, Renehan WE, Fogel R. Neurons in the vagal complex of the rat respond to mechanical and chemical stimulation of the GI tract. Am J Physiol. 1998;274:G331-341. [PubMed] |
| 19. | Ueta Y, Kannan H, Yamashita H. Inhibition of vasopressin secreting neurons of the paraventricular nucleus by gastric distension in rats. J UOEH. 1986;8:429-435. [PubMed] |
| 20. | Renaud LP, Tang M, McCann MJ, Stricker EM, Verbalis JG. Cholecystokinin and gastric distension activate oxytocinergic cells in rat hypothalamus. Am J Physiol. 1987;253:R661-665. [PubMed] |
| 21. | Suemori K, Kobashi M, Adachi A. Effects of gastric distension and electrical stimulation of dorsomedial medulla on neurons in parabrachial nucleus of rats. J Auton Nerv Syst. 1994;48:221-229. [PubMed] [DOI] |
| 22. | Schusdziarra V. Regulation of food intake. Zentralbl Chir. 1996;121:354-357. [PubMed] |
| 23. | Xu X, Brining DL, Chen JD. Effects of vasopressin and long pulse-low frequency gastric electrical stimulation on gastric emptying, gastric and intestinal myoelectrical activity and symptoms in dogs. Neurogastroenterol Motil. 2005;17:236-244. [PubMed] [DOI] |
| 24. | Isaacson RL. A fuzzy limbic system. Behav Brain Res. 1992;52:129-131. [PubMed] [DOI] |
| 25. | King BM, Arceneaux ER, Cook JT, Benjamin AL, Alheid GF. Temporal lobe lesion-induced obesity in rats: an anatomical investigation of the posterior amygdala and hippocampal formation. Physiol Behav. 1996;59:843-848. [PubMed] [DOI] |
| 26. | Bredt DS, Snyder SH. Isolation of nitric oxide synthetase, a calmodulin-requiring enzyme. Proc Natl Acad Sci USA. 1990;87:682-685. [PubMed] [DOI] |
| 27. | Chang HK, Jang MH, Lim BV, Lee TH, Shin MC, Shin MS, Kim H, Kim YP, Kim EH, Kim CJ. Administration of Ginseng radix decreases nitric oxide synthase expression in the hippocampus of streptozotocin-induced diabetic rats. Am J Chin Med. 2004;32:497-507. [PubMed] [DOI] |
| 28. | Sadler CJ, Wilding JP. Reduced ventromedial hypothalamic neuronal nitric oxide synthase and increased sensitivity to NOS inhibition in dietary obese rats: further evidence of a role for nitric oxide in the regulation of energy balance. Brain Res. 2004;1016:222-228. [PubMed] [DOI] |
| 29. | Kitazawa T, Onodera C, Taneike T. Potentiation of motilin-induced contraction by nitric oxide synthase inhibition in the isolated chicken gastrointestinal tract. Neurogastroenterol Motil. 2002;14:3-13. [PubMed] [DOI] |
| 30. | Li M, Vizzard MA, Jaworski DM, Galbraith RA. The weight loss elicited by cobalt protoporphyrin is related to decreased activity of nitric oxide synthase in the hypothalamus. J Appl Physiol. 2006;100:1983-1991. [PubMed] [DOI] |