修回日期: 2007-03-14
接受日期: 2007-03-19
在线出版日期: 2007-04-28
目的: 构建一个表达胃癌相关基因GCRG213小干扰RNA的重组腺相关病毒载体, 制备能靶向性抑制GCRG213表达的重组腺相关病毒.
方法: 将构建好并经验证的包含胃癌相关基因GCRG213特异性小干扰RNA片段GCRG213-RNAi-2的IMG800-GCRG213i-2质粒用BamHⅠ+BglⅡ双酶切, 回收410 bp左右目的片段, 将pSNAV2.0质粒用BamHⅠ单酶切后同目的片段连接, 经酶切和测序鉴定后, 用新建质粒脂质体转染BHK-21细胞, G418筛选后大规模培养, 再用辅助病毒HSVl-rc/ΔUL2感染, 获取病毒.
结果: 成功构建包含U6启动子和胃癌相关基因GCRG213特异性RNA干扰片段的重组腺相关病毒载体, 并制备出滴度为5×1012 vector genome/L高滴度腺相关病毒.
结论: 载体的构建为进一步研究GCRG213的体内功能打下了基础, 也将为更多的基因干预和基因的功能研究提供有效的工具.
引文著录: 徐世平, 吴本俨, 王孟薇, 高利利, 伍银桥, 蒋立新, 王卫华, 尤纬缔. 表达胃癌相关基因GCRG213小干扰RNA腺相关病毒载体的构建和高滴度病毒制备. 世界华人消化杂志 2007; 15(12): 1417-1420
Revised: March 14, 2007
Accepted: March 19, 2007
Published online: April 28, 2007
AIM: To construct the recombinant adeno-associated virus vector expressing gastric cancer related gene GCRG213 short interference RNA (rAAV-GCRG213-siRNA) and use it for the preparation of high-titer virus.
METHODS: IMG800-GCRG213-siRNA plasmid, which was constructed with GCRG213 siRNA, was digested with BamHⅠ and BglⅡ. A 410-bp fragment, which contained U6 promoter and GCRG213 siRNA, was obtained and inserted into the adeno-associated virus vector plasmid pSNAV2.0 that was digested with BamHⅠ. The positive vectors were analyzed through enzyme digestion and DNA sequencing. The recombinant plasmid was transfected into BHK cells using LipofecLamineTM2000. The G418-resistant cells were obtained and infected with HSVl-rc/ΔUL2, which had the function of packaging rAAV. After purification, the target vector and virus were collected.
RESULTS: The target vector, rAAV-GCRG213-siRNA, was successfully constructed, and the rAAV with a titer of 5 × 1012 vg/L (vg: vector genome) was obtained.
CONCLUSION: Recombitant rAAV vector may be used for further investigation of GCRG213 function in vivo and gene therapy.
- Citation: Xu SP, Wu BY, Wang MW, Gao LL, Wu YQ, Jiang LX, Wang WH, You WD. Construction of recombined adeno-associated virus vector expressing GCRG213 short interference RNA and preparation of high-titer virus. Shijie Huaren Xiaohua Zazhi 2007; 15(12): 1417-1420
- URL: https://www.wjgnet.com/1009-3079/full/v15/i12/1417.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i12.1417
胃癌相关基因GCRG213是我们实验室筛选出的一条在肠型胃癌组织和癌旁组织高表达而在正常组织低表达的新基因[1]. 初步研究表明(待发表资料), 用其特异性小干扰RNA片段转染人胃癌细胞系MKN45细胞后, 能明显抑制GCRG213 mRNA和蛋白表达, 同时减弱细胞的生长速度和成瘤性.为了进一步研究GCRG213的体内功能和对其他相关基因的影响, 同时也为胃癌的基因治疗提供实验基础和理论依据, 我们设计构建了含GCRG213特异性RNAi片段腺相关病毒(AAV)载体, 并制备了高滴度腺相关病毒.
1.1 材料
1.1.1 菌株、质粒和培养基 感受态大肠杆菌DH-5α购自北京天根科技公司; IMG800-GCRG213i-2质粒为本实验室构建并保存, 是将我们设计的GCRG213特异性RNAi片段插入IMG-800载体而成.DMEM培养基为Gibco公司产品, 胎牛血清购自北京鼎国生物工程公司; 通用型AAV载体pSNAV2.0质粒、金黄地鼠肾BHK-21细胞、具有AAV复制和包装功能的重组I型单纯疱疹病毒HSVl-rc/ΔUL2均由北京本原正阳基因有限公司提供.
1.1.2 工具酶及其他试剂 限制性内切酶(BamHⅠ, BglⅡ)、T4 DNA Ligase、Marker-DL15000、Marker-DL2000均为TaKaRa公司产品, 琼脂糖凝胶DNA回收试剂盒、高纯度质粒小量提取试剂盒购自北京天根科技公司.
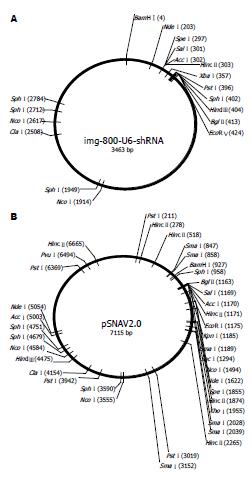
1.2.1 目的片段和酶切位点的选择: 根据我们既往的实验结果, 选用本实验室验证的干扰效率相对较高的GCRG213-RNAi-2片段作为包装对象, 片段核苷酸序列为: P1 5'TCGACGCACTCCTCACCAAATGTAGAGTACTGTACATTTGGTGAGGAGTGCTTTTT3', P2 5'CTAGAAAAAGCACTCCTCACCAAATGTACAGTACTCTACATTTGGTGAGGAGTGCG3', 由上海博亚生物工程公司合成. 用pSNAV2.0质粒作为载体, 但由于pSNAV2.0质粒不含U6启动子, 因此拟将构建好的IMG800-GCRG213i-2质粒中GCRG213-RNAi-2片段连同U6启动子一同切下, 插入pSNAV2.0质粒中. IMG800-GCRG213i-2质粒经分析得知U6及shRNA完整结构位于8-386位置, 在其上游4的位置具有一个BamHⅠ位点, 在其下游413的位置具有一个BglⅡ位点, 这两种限制酶是同尾酶. pSNAV2.0质粒经分析得知其多克隆位点中具有一个BglⅡ位点, 在多克隆位点上游927的位置具有一个BamHⅠ位点. 因此, 可分别将IMG800-GCRG213i-2质粒经BamHⅠ+BglⅡ双酶切、pSNAV2.0质粒经BamHⅠ单酶切, 回收目的片段后进行连接. 两种质粒酶切位点见图1.
1.2.2 IMG800-GCRG213i-2质粒的扩增和酶切: 取保存的含IMG800-GCRG213i-2质粒的菌液20 μL接种入5 mL LB培养基, 37 ℃振荡培养18 h, 取3 mL菌液按质粒小提试剂盒说明方法提取质粒, 提取质粒后用BamHⅠ+BglⅡ进行双酶切, 回收410 bp左右片段.
1.2.3 pSNAV2.0质粒酶切: 按前述方法将pSNAV2.0质粒扩增提取后用BamHⅠ单酶切, 回收7.1 kb左右片段.
1.2.4 目的片段和载体连接: 将上述两种回收片段按目的片段和载体3:1的浓度比例混合后, 加入T4 DNA连接酶, 16 ℃水浴连接过夜. 连接产物转化DH-5α, 涂布具有氨苄青霉素(100 mg/L)的LB琼脂平板, 于37 ℃培养过夜. 次日挑取单克隆培养, 提取质粒DNA后行进一步鉴定.
1.2.5 重组质粒的鉴定: 利用BamHⅠ+BglⅡ双酶切对提取的质粒进行筛选和方向鉴定, 如pSNAV2.0质粒中未连入目的片段或者连入目的片段但方向相反, 均应得到240 bp左右片段, 如pSNAV2.0质粒中连入目的片段且方向正确, 则应得到650 bp左右片段; 重组正确质粒使用pSNAV2.0-CMV-f测序引物测序鉴定, 测序结果与标准序列用BLAST分析比对. 重组质粒命名为pSNAV2.0-U6-shRNA.
1.2.6 病毒的制备: 按LipofecLamineTM 2000产品说明提供的方法, 用脂质体将pSNAV2.0-U6-shRNA转染金黄地鼠肾BHK-21细胞, 转染24 h后加入G418至终浓度800 μg/L选择培养, 培养直至细胞长满后用0.25 g/L的胰蛋白酶消化传代, 用转瓶大规模培养, 细胞长满后, 用辅助病毒HSVl-rc/ΔUL2感染, 待细胞完全病变, 裂解细胞, 得到粗制品. 用柱层析法分离纯化病毒, 纯度测定采用SDS-PAGE方法, 滴度测定采用real-time PCR方法进行测定.
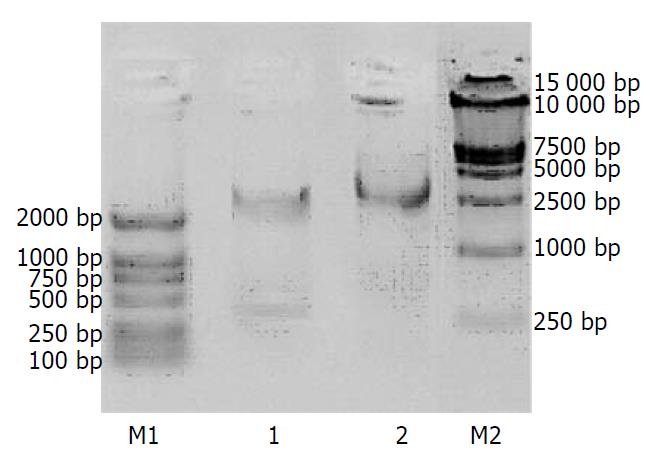
IMG800-GCRG213i-2质粒经BamHⅠ+BglⅡ双酶切酶切后, 得到预期的3 kb左右和410 bp左右两条带, 实验结果与预期相符(图2).
pSNAV2.0质粒用BamHⅠ酶切后, 得到7.1 kb左右片段, 回收该片段.
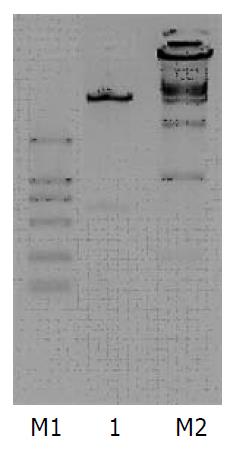
目的片段插入载体后形成新的质粒pSNAV2.0-U6-shRNA, 该质粒经BamHⅠ+BglⅡ双酶切后得到预期6.9 kb左右和650 bp左右两条带. 实验结果与预期相符(图3). 使用pSNAV2.0-CMV-f测序引物, 对pSNAV2.0-U6-shRNA质粒测序后, 将测序所得结果与原序列BLAST比对, 序列100%吻合, 表明质粒构建正确. pSNAV2.0-U6-shRNA转染BHK-21细胞后, 经G418筛选约l0 d至细胞长满, 用辅助病毒HSVl-rc/ΔUL2感染细胞后48 h细胞完全病变, 反复冻融细胞3次, 使之裂解, 释放出病毒, 新病毒命名为rAAV-U6-shRNA, 分离纯化后测定病毒滴度为5×1015 v.g./L(v.g.为病毒基因组数量vector genome).
我们既往的研究表明: 转染GCRG213正向克隆的MKN45细胞在裸鼠体内成瘤性增加, 而转染GCRG213反向克隆的MKN45细胞及转染siRNA的MKN45细胞在裸鼠体内成瘤性降低, 由此可以推断GCRG213可能是一种新发现的恶性肿瘤形成促进因子[2-3]. 由于既往的实验主要是体外实验, 为了进一步研究GCRG213在体内表达水平的变化对肿瘤的影响, 我们选用腺相关病毒载体进行了GCRG213特异性RNAi片段包装.
随着生物技术的发展, AAV载体成为目前载体工具研究的热点. 在用于人类基因治疗常用病毒载体中, AAV载体是目前唯一没有引起人类宿主任何病理反应的载体[4]. 作为体内实验一种理想的基因治疗的病毒载体, AAV具有如下优点: (1)使用安全: AAV不致病, 对机体无明显的免疫反应[5]; (2)AAV可以定点整合到第19号染色体上[6], 既避免了随机插入宿主基因诱发癌变的危险性, 又为外源基因的表达提供了较固定的染色体环境, 是唯一一种以位点特异性方式整合在人19号染色体上的真核病毒[7]; (3)AAV可以感染分裂和非分裂细胞[8]; (4)AAV宿主范围广, 可以感染现已建立的所有的人类细胞系; (5)携带的外源基因可长期存在,稳定表达[9]. 因此, AAV有望成为人体基因治疗和基因功能研究最理想的载体工具.
RNA干扰(RNA interference, RNAi)是由与靶序列同源的双链RNA所诱导的特异性的转录后基因沉默现象, 他具有高效性、特异性的特点. 随着RNAi现象的研究深入, RNAi己成为基因治疗和基因功能研究领域新的热点. 典型的转染外源合成的siRNA在转染7 d以后或者10次细胞分裂后会从mRNA抑制中恢复[10]. 然而用shRNA载体转染的细胞将经历长期稳定的mRNA抑制作用. 从而提供了比转染化学合成的siRNA更经济有效的方法. 如果能用病毒包装含目的基因特异性的shRNA进行体内感染并有效表达, 无疑是基因治疗的一种理想的方法. 由于RNAi的高效表达需要有特异性的U6启动子[11-12], 而一般病毒为CMV启动子, 因此到近两年仅有不多的以腺相关病毒为载体介导RNAi文献报道. 我们根据IMG-800质粒含有U6启动子特点, 利用已构建好的质粒把目的基因连同U6启动子一起切下, 插入腺相关病毒载体, 成功构建了含GCRG213特异RNA干扰片段的腺相关病毒载体, 并包装出了高滴度AAV, 为进一步研究GCRG213的体内功能打下了基础. 构建好的载体也将为更多的基因干预和基因的功能研究提供有效的工具.
在我国胃癌仍是威胁人们健康的重要疾病, 探索发病机制、寻找更有效的治疗手段仍是我们努力的方向. 胃癌相关基因GCRG213是本文作者所在实验室筛选出的一条在肠型胃癌、癌旁和正常组织间差异表达的新基因, 生物信息学分析发现, GCRG213与日本学者Tashiro et al发现的人类基因AK131313有90%以上的核苷酸序列相同, 与人体内无嘌呤无嘧啶核酸内切酶(APE/Ref-1)序列有61%同源性并且含有其保守的功能位点, 初步研究也证实GCRG213是一种胃癌促进因子. 为了进一步研究其功能, 本课题组包装了含GCRG213正、反义克隆和特异性RNAi片段的腺相关病毒, 同时也为胃癌基因治疗奠定基础.
本文在筛选出胃癌相关基因GCRG213的基础上, 旨在构建一个表达胃癌相关基因GCRG213小干扰RNA的重组腺相关病毒载体, 制备能靶向性抑制GCRG213表达的重组腺相关病毒, 为后续工作奠定研究基础. 文章具有一定的科学性、创新性, 有较好的理论和应用价值.
电编: 何基才 编辑:王晓瑜
| 1. | Wang GS, Wang MW, Wu BY, Liu XB, You WD, Yang XY. A gene encoding an apurinic/apyrimidinic endonuclease-like protein is up-regulated in human gastric cancer. World J Gastroenterol. 2003;9:1196-1201. [PubMed] [DOI] |
| 3. | 高利利, 吴本俨, 王孟薇, 王珊,黄海力,伍银桥,尤纬缔,王卫华. 胃癌相关基因GCRG213真核表达载体的构建及其对胃癌细胞生长特性的影响. 解放军医学杂志. 2006;31:881-884. |
| 4. | Flotte TR. Gene therapy progress and prospects: recombinant adeno-associated virus (rAAV) vectors. Gene Ther. 2004;11:805-810. [PubMed] [DOI] |
| 5. | Rabinowitz JE, Samulski RJ. Building a better vector: the manipulation of AAV virions. Virology. 2000;278:301-308. [PubMed] [DOI] |
| 6. | Samulski RJ, Zhu X, Xiao X, Brook JD, Housman DE, Epstein N, Hunter LA. Targeted integration of adeno-associated virus (AAV) into human chromosome 19. EMBO J. 1991;10:3941-3950. [PubMed] |
| 7. | Berns KI, Linden RM. The cryptic life style of adeno-associated virus. Bioessays. 1995;17:237-245. [PubMed] [DOI] |
| 8. | Xu R, Sun X, Tse LY, Li H, Chan PC, Xu S, Xiao W, Kung HF, Krissansen GW, Fan ST. Long-term expression of angiostatin suppresses metastatic liver cancer in mice. Hepatology. 2003;37:1451-1460. [PubMed] [DOI] |
| 9. | Wang H, Shayakhmetov DM, Leege T, Harkey M, Li Q, Papayannopoulou T, Stamatoyannopolous G, Lieber A. A capsid-modified helper-dependent adenovirus vector containing the beta-globin locus control region displays a nonrandom integration pattern and allows stable, erythroid-specific gene expression. J Virol. 2005;79:10999-11013. [PubMed] [DOI] |
| 10. | Elbashir SM, Harborth J, Lendeckel W, Yalcin A, Weber K, Tuschl T. Duplexes of 21-nucleotide RNAs mediate RNA interference in cultured mammalian cells. Nature. 2001;411:494-498. [PubMed] [DOI] |
| 11. | Brummelkamp TR, Bernards R, Agami R. A system for stable expression of short interfering RNAs in mammalian cells. Science. 2002;296:550-553. [PubMed] [DOI] |
| 12. | Yu JY, DeRuiter SL, Turner DL. RNA interference by expression of short-interfering RNAs and hairpin RNAs in mammalian cells. Proc Natl Acad Sci USA. 2002;99:6047-6052. [PubMed] [DOI] |