修回日期: 2007-02-10
接受日期: 2007-03-07
在线出版日期: 2007-04-28
目的: 评估结肠充气多层CT(MSCT)多期增强扫描对结肠癌患者术前检查的价值.
方法: 63例结肠癌患者术前1 wk内行全腹MSCT平扫与多期增强MSCT扫描. 采用Toshiba Aquilion16扫描仪, 增强扫描是在对比剂开始注射后22 s (Ⅰ期)、37-40 s (Ⅱ期)、60 s(Ⅲ期)采集数据. 在工作站对采集数据行CT仿真内镜(CTC)、X线模拟投影(XRP)、多平面重组(MPR)、表面遮盖显示(SSD)、CT血管造影(CTA)等后处理观察, 并与手术病理对照.
结果: CT显示64个癌灶, 升结肠18个, 结肠肝曲2个, 横结肠4个, 结肠脾曲2个, 降结肠6个, 乙状结肠20个(包括乙状结肠与直肠交界区5个), 直肠12个; 16例发现肠外病变; 与手术所见同. 在不同扫描期相, 原发灶为均匀或不均匀强化. 增强扫描肿物峰值强化Ⅱ期30个, Ⅱ期-Ⅲ期17个, Ⅲ期13个,Ⅰ-Ⅲ期4个. 58个原发灶(90.6%)可见相应供血动脉增粗, 分支增多. CT判断是否累及肠周脂肪敏感性100%, 特异性64.2%, 准确性92.1%. CT对腹部淋巴结转移瘤诊断总的敏感性78.5%, 特异性86.7%, 准确性86.1%.
结论: MSCT多期增强扫描一次检查为结肠癌术前了解肿瘤位置、数量、范围、血供及其他组织器官病变情况提供了其他影像技术难于同时提供的信息.
引文著录: 谢琦, 梁碧玲, 黄达德, 江新青, 张静, 陈明旺, 韦程纲. 结肠癌术前多层面CT一站式检查的临床价值. 世界华人消化杂志 2007; 15(12): 1382-1388
Revised: February 10, 2007
Accepted: March 7, 2007
Published online: April 28, 2007
AIM: To assess the value of three-phase contrasted multi-slice computed tomography (MSCT) pneumocolon in preoperative examina-tion of colon cancer.
METHODS: Sixty-three patients with colonic cancer underwent plain MSCT pneumocolon and multiphase contrasted MSCT within 1 week before operation. Contrasted MSCT scans were performed using 16-slices CT system (Toshiba aquilion16) 22 s (phaseⅠ), 37-40 s (phaseⅡ) and 60 s (phase Ⅲ) after intravenous administration of contrast medium. Images were then obtained by CT colonography (CTC), X-ray projection (XRP), multi-planar reformation (MPR), surface shadow display (SSD), CT angiography (CTA) in post-procession workstation. The results were comparatively analyzed with the surgical pathology.
RESULTS: Sixty-four cancer lesions were detected on CT images and in surgery. They located in ascending colon (18 lesions), hepatic flexure of colon (2 lesions), transverse colon (4 lesions), splenic flexure of colon (2 lesions), descending colon (6 lesions), sigmoid (20 lesions, of which 5 lesions in the injunction of sigmoid and rectum), and rectum (12 lesions). Extracolonic diseases were found in 16 patients by MSCT or surgery. On multi-phase contrasted CT images, colon caner lesions demonstrated homogeneous or inhomogenous enhancement, and the absolutely increased peaks in CT density were at phase Ⅱ (30 lesions), phase Ⅱ-Ⅲ (17 lesions), phase Ⅲ (13 lesions) and phaseⅠ-Ⅲ (4 lesions). CTA detected blood-supplying artery of 58 cancer lesions (90.6%). The sensitivity, specificity and positive accuracy were 100%, 64.2%, and 92.1% respectively, for pericolonic fat involvement, and 78.5%, 86.7%, and 86.1% respectively, for abdominal metastasis-positive lymph-nodes.
CONCLUSION: MSCT pneumocolon and preoperative three-phase contrasted CT can provide information about tumor location, number, stage, blood-supplying artery and extracolonic diseases.
- Citation: Xie Q, Liang BL, Huang DD, Jiang XQ, Zhang J, Chen MW, Wei CG. Value of multi-slice computed tomography in preoperative "one-station-style" examination for colon cancer. Shijie Huaren Xiaohua Zazhi 2007; 15(12): 1382-1388
- URL: https://www.wjgnet.com/1009-3079/full/v15/i12/1382.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i12.1382
结肠癌术前CT检查旨在了解肿瘤的侵犯范围, 为术前分期提供依据. 多层面CT(multi-slice CT, MSCT)实现了各向同性采集, 可得到高质量的任意断面图, 相应的后处理功能使CT在胃肠道病变的应用进一步拓展[1-5]. 为充分利用MSCT各种功能为结肠癌术前提供更多信息, 我们设计结肠MSCT的检查方法, 现对2004-09/2006-07 63例结肠癌患者的MSCT及手术病理资料总结分析如下.
2004-09/2006-07经全腹MSCT检查诊断为结肠癌患者128例, 其中63例符合以下条件: (1)在CT检查后1 wk内在本院行手术治疗, 术中作了原发灶切除与腹部淋巴结清扫, 有完整、详实的手术记录; (2)CT检查及手术前患者未行任何抗癌治疗, CT检查符合本研究要求, 并达到预期增强效果. 男41例, 女22例. 年龄33-83(平均62)岁. 术前所有患者行结肠镜检查, 术后癌灶的病理诊断: 黏液腺癌8例, 未分化腺癌1例, 低分化腺癌6例, 中分化腺癌45例, 高分化腺癌2例, 腺鳞癌1例.
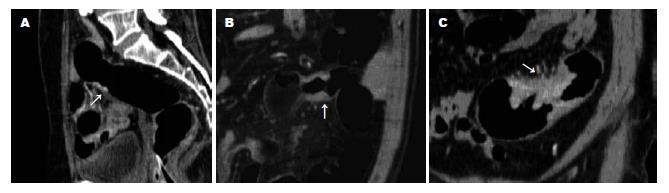
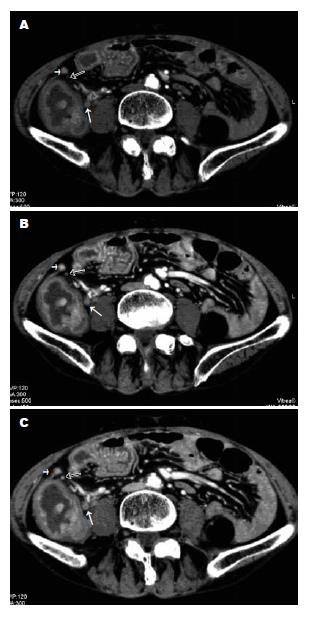
CT检查用Toshiba Aquilion16扫描仪. 检查前按钡灌肠要求对患者进行结肠清洁, 扫描前肌肉注射654-2 10-20 mg 10 min后, 经肛门插管缓慢注入空气1000-1500 mL, 使结肠充分扩张. 用定位片观察肠管充气情况, 如果不满意, 继续注入适量气体, 即行从膈顶至盆底的常规平扫, 再以3 mL/s的速度静脉注射300 mgI/mL(优维显300, Schering)的对比剂100 mL, 在开始注射对比剂后22 s(Ⅰ期)、37-40 s(Ⅱ期)、60 s(Ⅲ期)时嘱患者屏气, 重复上述范围的扫描. 扫描时间13-17.5 s, 采集层厚2 mm, 螺距(HP)15, 150 mAs, 120 kV, 所得数据以2 mm层厚、1 mm间隔重建后传到工作站进行多平面重组(multi-planar reformation, MPR)、表面遮盖显示(surface shadow display, SSD)、CT仿真结肠镜(CT colonography, CTC)、X线模拟投影(X-ray project, XRP)、CT血管造影(CT angiography, CTA)等后处理观察. CT值测量: 平扫时测量原发灶及长径至少2 mm的淋巴结的CT值, ROI面积1-10 mm2. 增强各期图像上, 在与平扫相对应的部位用相同ROI面积测得CT值, 两CT值之差为CT强化值, 以CT强化值观察肿瘤及淋巴结的强化情况. 肿瘤局部侵犯的CT诊断标准(图1): 肿瘤峰值强化期, (1)强化组织未侵犯病变段肠管全层, 为部分肌层受累; (2)强化组织侵犯病变段肠管全层, 但相应外缘光整, 周围脂肪间隙清晰, 为全层肌层受累; (3)病变段肠管外缘不光整、毛糙, 周围脂肪间隙可见结节或条索影, 为肠周脂肪受累; (4)肿瘤组织侵犯相邻脏器; (5)远隔脏器可见肿瘤灶. CT诊断淋巴结转移标准(图2-3): 淋巴结与原发灶同步强化, 淋巴结出现与原发灶相同的无强化区或钙化. 有上述改变之一判断为淋巴结转移瘤. CT上以伴行血管、最邻近的脏器为参照对腹部淋巴结的部位、大小(长轴为标准)、密度、形态进行观察, CT图像由放射科医师按上述标准在术前分析并记录.
手术病理及临床资料由病理医师和放射科医师收集, 由放射科医师独立整理. 病理上对原发灶在肉眼判断侵犯最广的部位取才并作连续切片检查; 对术中摘除的淋巴结, 以伴行血管、最邻近的脏器为参照对其部位、大小、形态作详细记录, 对所有切除的淋巴结进行了病理切片检查. 所得资料输入电脑, 在SPSS11.0版软件中建立数据库.
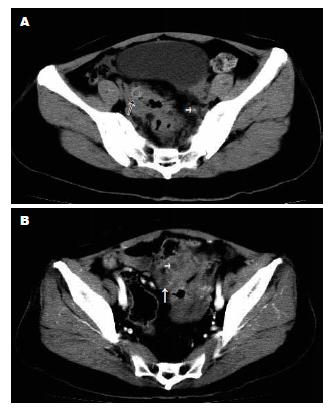
CT显示1例为升结肠与乙状结肠同时发生癌(图4), 余为结肠单发癌. 升结肠18个, 结肠肝曲2个, 横结肠4个, 结肠脾曲2个, 降结肠6个, 乙状结肠20个, 乙状结肠与直肠交界区5个, 直肠12个, 与手术所见相同. 手术见5例伴结肠息肉, CT显示3例, 2例未显示者是因肠段未扩张.
在不同扫描期相, 原发灶为均匀或不均匀强化(图1-2), 8例见无强化区, 3例伴钙化, 增强扫描肿物峰值强化Ⅱ期30个, Ⅱ期-Ⅲ期17个, Ⅲ期13个, Ⅰ-Ⅲ期4个. 术前CT判断肿瘤侵犯范围情况见表1. CTA成像示64个病灶中58个可见相应供血动脉增粗, 分支增多, 48个回流静脉显影较非病变段肠管的提早. CT显示2例腹膜播散、1例肝转移均经手术病理证实. CT判断是否累及肠周脂肪敏感性100%, 特异性64.2%, 准确性92.1%.
| 病理诊断 | CT诊断(cm) | 合计 | ||||
| 黏膜下层 | 部分肌层 | 全肌层 | 累及脂肪 | 脏器侵犯 | ||
| 黏膜下层 | 0 | 2 | 0 | 0 | 0 | 2 |
| 部分肌层 | 0 | 1 | 1 | 1 | 0 | 3 |
| 全肌层 | 0 | 0 | 5 | 4 | 0 | 9 |
| 累及脂肪 | 0 | 0 | 0 | 43 | 0 | 43 |
| 脏器侵犯 | 0 | 0 | 0 | 0 | 7 | 7 |
| 合计 | 0 | 3 | 6 | 48 | 7 | 64 |
CT显示177个淋巴结(表2). 平扫5个淋巴结可见钙化, 余淋巴结呈软组织密度. 增强扫描, 98个淋巴结均匀强化, 33不均匀强化, 23个环状强化, 23个淋巴结未见强化, 其中10个淋巴结的原发灶有相同改变, 5个伴钙化.
| 淋巴结大小(cm) | 淋巴结数目 | CT显示率(%) | |
| 手术病理 | CT | ||
| <0.5 | 110 | 45 | 40.9 |
| 0.5-0.9 | 102 | 75 | 73.5 |
| 1-1.4 | 39 | 34 | 87.2 |
| 1.5- | 23 | 23 | 100 |
| 合计 | 274 | 177 | 64.6 |
63例患者, 手术切除274个淋巴结. 有97个淋巴结(35.4%)CT未显示, 其中≥5 mm有32个, 分布于横结肠系膜12个, 乙状结肠系膜8个, 左半结肠中间淋巴结7个, 系膜根部5个, 均为消瘦患者. MSCT诊断腹部淋巴结转移情况见表3.
| 病理诊断 | CT诊断(cm) | 合计 | |||||||
| <0.5 | 0.5-0.99 | 1-1.49 | 1.5- | ||||||
| - | + | - | + | - | + | - | + | ||
| - | 95 | 5 | 62 | 6 | 6 | 2 | 0 | 0 | 190 |
| + | 6 | 4 | 9 | 25 | 5 | 21 | 0 | 23 | 84 |
| 合计 | 105 | 9 | 71 | 31 | 11 | 23 | 0 | 23 | 274 |
CT对腹部淋巴结转移瘤诊断总的敏感性78.5%, 特异性86.7%, 阳性预测值84.8%, 阴性预测值84.8%, 准确性86.1%. 若按普通CT诊断标准(淋巴结≥10 mm即为转移), 本组病例敏感性47.3%, 特异性83.9%, 阳性预测值77.2%, 阴性预测值74.1%, 准确性73.1%.
CT显示肾结石10例, 1例伴重度肾积水, 动脉瘤2例, 膀胱癌1例, 子宫肌瘤3例. 除9例肾结石手术未作探察, 余经手术、病理证实.
对严重衰竭、急性心衰、严重心衰不能平卧或对比剂过敏者不能做肠道CT检查. 保证肠道清洁度、结肠良好充气、扩张是取得良好质量图像的重要因素[6-7]. 本组病例根据患者的不同情况采用了不同的肠道清洁方法: (1)检查前2 d半流质, 检查前1 d流质, 检查前一夜7点口服200 mL/L甘露醇250 mL, 并随后2 h内饮温开水1500 mL, 检查当日早晨作清洁灌肠后2 h以上将肠道积水排尽后作CT检查. 此方法是常规的清肠方法, 特别是对于便秘的受检者; (2)对病情需要及早检查但又无便秘的患者, 可禁食、禁饮12 h, 检查前夜口服泻药(藩泻叶), 次日清晨清洁灌肠后2 h以上将肠道积水排尽后作CT检查.
仅做CTC检查只需平扫[2-3]. 目前结肠检查CT增强扫描采用单期扫描, 即在对比剂开始注射后40, 60或70 s[8-10]扫描, 根据所见肿块是否强化鉴别肿瘤与肠道内容物[8-9], 根据肿块强化程度鉴别结肠息肉与结肠癌[10]. 为了探讨术前CT检查能否根据肿瘤原发灶、转移灶的强化情况更好显示肿瘤侵犯范围, 显示肿瘤血供、腹部血管及其他脏器情况, 从而提供更多有价值的信息, 本研究采用了三期增强扫描, 即在开始注射对比剂后22 s(Ⅰ期, 动脉期)、37-40 s(Ⅱ期, 动脉晚期)、60 s(Ⅲ期, 门静脉期)行全腹扫描.
结肠MSCT检查的后处理技术包括: SSD, 容积再现(volume render, VR), 多平面容积重组(multi-planar volume reformation, MPVR), MPR, 曲面重组(curve planar reformation, CPR), XRP, CTC等. SSD、XRP所得图像可形象显示病变部位、相应肠段轮廓的改变, 相当于气钡双对比造影作用. CTC可清楚并以多角度显示病变外观, 相当于内镜功能; MPR或MPVR可多角度、多方位显示病变侵犯范围、密度改变、各区域淋巴结情况, 有助于淋巴结定位, 相当于虚拟真实的病理解剖; CTA可显示扫描范围内血管的分布、多少, 从而提供病变的血供情况, 相当于血管造影的功能. 为充分和快速利用上述后处理技术, 本组病例按以下程式进行观察: CTC观察肠腔有无病变、狭窄, 并标识→SSD、XRP定位→MPR、MPVR观察范围和强化情况→CTA观察病变的血供→观察腹部其他脏器、组织结构情况, 观察扫描野内肺和骨质情况.
结肠癌治疗前侵犯范围的判断是其术前分期的基础, 亦是治疗方法选择、评价预后的依据. 结肠癌的局部侵犯可沿肠壁纵轴方向扩散或突破肌层向周围组织浸润. 根据1997年国际抗癌联盟提出的分期标准, 病理上结肠癌T分期分为[11]: 肿瘤局限于上皮内或黏膜内(Tis), 侵达黏膜下层(T1), 肿瘤侵达肠壁固有肌层(T2), 肿瘤穿透固有肌层至浆膜下或无浆膜段的结肠和直肠的肠旁组织(T3), 肿瘤穿透脏层腹膜或累及其他器官、结构(T4). Ng et al[12]利用单螺旋CT 10 mm层厚研究认为CT上仅能显示有无累及肠周脂肪和腹膜侵犯, 肠周肿瘤脂肪浸润在CT上表现为脂肪间隙模糊, 见条状、斑片状、结节状影. 但上述表现不能与肠周脂肪间隙的纤维反应性增生、炎性反应、淋巴滤泡炎性反应等相鉴别, 而肠周脂肪间隙正常并不意味着肿瘤未累及肠腔外, CT不能显示肠腔外的微灶侵犯[12-13], 因此, CT在显示肿瘤局部侵犯有一定局限性, 在判断有无肠周脂肪间隙侵犯的敏感性为79%, 特异性33%, 阳性预测值91%, 阴性预测值15%[12]. Jang et al[14]用SCT增强扫描观察结肠癌侵犯范围, 结果显示非肿瘤段增厚肠壁不强化, 而肿瘤段肠壁有不均匀强化, SCT增强扫描有助于显示结肠癌侵犯的范围. 本研究采用MSCT薄层多期增强扫描, 后处理工作站多方位观察, 可见肿瘤组织明显强化, 与肠壁肌肉有密度差异, 但较难区分黏膜下层与肌层的侵犯, 因此对T2以上的肿瘤出现过度诊断, 显示是否累及肠周脂肪敏感性100%, 但因肠周充血而对肿瘤侵犯范围出现过度判断, 特异性64.2%.
结肠癌术前判断有无腹部淋巴结转移, 是治疗前分期的一重要环节. 常规CT对淋巴结缺乏组织特异性, 淋巴结转移的CT诊断常依据大小来判断, 一般以>10 mm者判断为转移淋巴结[15-18], 对转移淋巴结检出敏感性仅为11%-46%, 特异性95%-100%, 取值标准减小, 敏感性提高, 特异性降低. Noji et al[19]研究胆囊癌术前CT腹主动脉旁淋巴结表现, 将横切面经线>6 mm的淋巴结, 或淋巴结密度不均匀的淋巴结诊断为转移淋巴结, 结果为对淋巴结转移的阳性预测值仅为13%-36%. 而在病理检查时可见, 小的淋巴结也常发生转移, 且由于反应增生的淋巴结也可超过10 mm, 所以以大小判断转移有许多局限性. Fukuya et al[20]首次系统的总结了SCT增强扫描对腹部淋巴结转移瘤的检出情况, 结果显示, CT对5 mm以下的淋巴结难于显示; 有癌转移的淋巴结短轴与长轴之比>0.7, 且密度较高, >9 mm转移淋巴结的CT值一般>100 Hu; 在考虑淋巴结大小、密度、形态等因素基础上, 对≥5 mm的转移淋巴结检出敏感性为75.2%. 赵志清 et al[21]将胃癌患者≥10 mm或增强扫描CT≥100 Hu的淋巴结诊断为阳性淋巴结, 对淋巴结分期总的准确率为73.3%.
本组病例是采用16层CT 2 mm薄层采集, 50%的重叠重建, 在三维工作站进行连续层面观察, 并将CT平扫与多期增强扫描相结合, 结果提示, MSCT对5 mm以下的淋巴结显示率为40.9%, 大多数有癌转移的淋巴结(68/84, 81%)在MSCT多期增强扫描出现与原发灶同步强化, 部份淋巴结出现与原发灶相同的病理改变, 如黏液样变、钙化, 随着淋巴结的增大, 转移率明显增加. 综合上述表现, 对腹部淋巴结转移瘤诊断总的敏感性78.5%, 特异性86.7%, 阳性预测值84.8%, 阴性预测值86.7%, 准确性86.1%. 较按"淋巴结≥10 mm即为转移"的标准敏感性、准确性有明显提高. 结肠癌在腹部血行播散最常见的靶器官是肝脏, 研究表明MSCT动态增强CT检查结肠癌隐匿性肝转移瘤具有很大的优越性[22-23], 对无肉眼可见的肝转移瘤患者, CT可观测到因血管生成而引起的灌注改变[23]. MSCT可提供良好的CTA图像, 能直观显示腹部血管解剖结构、肠系膜上动脉、肠系膜下动脉、乙状结肠动脉[1,24-25]及动脉周围的淋巴结情况[15], 对肿瘤的微创治疗有重要价值. 本组病例观察见大部分肿瘤灶(58/64, 90.6%)可见增粗、增多的肿瘤动脉, 部分肿瘤灶(48/64, 75%)回流静脉提早显影, CTA可在术前显示肿瘤的血供状态.
CT图像还可显示胃肠道外的其他组织与器官的病变[26]及有无肠梗阻、肠缺血等伴发病变[27-28]对治疗前制定治疗方案, 评估治疗风险有重要意义.
总之, 在结肠充分扩张的情况下, MSCT薄层多期增强扫描一次检查及相应的后处理图像为结肠癌术前了解肿瘤位置、数量、范围、血供情况、其他组织器官病变情况提供了其他影像技术难于同时提供的信息, 应成为结肠癌治疗前常规检查.
结肠癌的发病率逐年上升, 在治疗前尽可能准确的判断肿瘤的侵犯范围, 对指导临床治疗和判断患者预后有重要的意义. MSCT扫描一圈可获得多层图像, 可进行大范围的薄层扫描, 可显示更好的组织细节, 增强扫描的分期更细、更准. 对于结肠癌, 探索最佳的MSCT检查方法、如何对所得大量图像及强大后处理功能进行规范化应用等需要系统的研究.
对结肠癌患者行结肠充气的动脉期、肿瘤实质期、门静脉期扫描, 采集的数据根据血管与组织的强化程度不同, 利用CTA、MPR、XRP、CTC等后处理技术系统观察肿瘤的部位、大小、形态、血供状态、侵犯范围, 同时观察肠道本身及肠外伴发与并发病变, 评价各种后处理技术在结肠癌治疗前检查的作用.
本文首次系统研究了结肠癌患者术前行结肠充气多期MSCT增强扫描的价值, 提出针对结肠癌后处理技术的使用及观察程式, 确立MSCT对结肠癌肿治疗前"一站式"规范化检查的方法, 有利于进一步探索同时显示癌肿大体形态与功能的最合理扫描程序.
结肠充充气MSCT薄层多期增强扫描一次检查及相应的后处理图像为结肠癌术前了解肿瘤位置、数量、范围、血供情况、其他组织器官病变情况提供了其他影像技术难于同时提供的信息.
1 CT仿真结肠镜(CTC): 利用计算机软件功能, 将螺旋CT容积扫描获得的图像数据进行后处理, 重建出结肠内腔表面立体图像, 产生类似纤维内镜所见的图像.
2 CT血管造影(CTA): 经静脉注入对比剂后, 利用螺旋CT对包括靶血管在内的受检层面进行连续不间断的簿层立体容积扫描, 然后运用计算机进行图像后处理, 最终使靶血管立体显影的血管成像技术.
本文研究了结肠癌术前多层面CT一站式检查的临床价值, 实验结果可信, 有较高实用价值.
电编: 张敏 编辑:王晓瑜
| 1. | Ohtani H, Kawajiri H, Arimoto Y, Ohno K, Fujimoto Y, Oba H, Adachi K, Hirano M, Terakawa S, Tsubakimoto M. Efficacy of multislice computed tomography for gastroenteric and hepatic surgeries. World J Gastroenterol. 2005;11:1532-1534. [PubMed] [DOI] |
| 2. | Macari M. CT colonography: the real deal. Abdom Imaging. 2005;30:184-194. [PubMed] [DOI] |
| 3. | Ristvedt SL, McFarland EG, Weinstock LB, Thyssen EP. Patient preferences for CT colonography, conventional colonoscopy, and bowel preparation. Am J Gastroenterol. 2003;98:578-585. [PubMed] [DOI] |
| 4. | Hur J, Park MS, Lee JH, Lim JS, Yu JS, Hong YJ, Kim KW. Diagnostic accuracy of multidetector row computed tomography in T- and N staging of gastric cancer with histopathologic correlation. J Comput Assist Tomogr. 2006;30:372-377. [PubMed] [DOI] |
| 5. | Haykir R, Karakose S, Karabacakoglu A, Sahin M, Kayacetin E. Three-dimensional MR and axial CT colonography versus conventional colonoscopy for detection of colon pathologies. World J Gastroenterol. 2006;12:2345-2350. [PubMed] [DOI] |
| 6. | Macari M, Lavelle M, Pedrosa I, Milano A, Dicker M, Megibow AJ, Xue X. Effect of different bowel preparations on residual fluid at CT colonography. Radiology. 2001;218:274-277. [PubMed] [DOI] |
| 7. | Mulhall BP, Veerappan GR, Jackson JL. Meta-analysis: computed tomographic colonography. Ann Intern Med. 2005;142:635-650. [PubMed] [DOI] |
| 8. | Summers RM, Huang A, Yao J, Campbell SR, Dempsey JE, Dwyer AJ, Franaszek M, Brickman DS, Bitter I, Petrick N. Assessment of polyp and mass histopathology by intravenous contrast-enhanced CT colonography. Acad Radiol. 2006;13:1490-1495. [PubMed] [DOI] |
| 9. | Oto A, Gelebek V, Oguz BS, Sivri B, Deger A, Akhan O, Besim A. CT attenuation of colorectal polypoid lesions: evaluation of contrast enhancement in CT colonography. Eur Radiol. 2003;13:1657-1663. [PubMed] [DOI] |
| 10. | Luboldt W, Kroll M, Wetter A, Toussaint TL, Hoepffner N, Holzer K, Kluge A, Vogl TJ. Phase- and size-adjusted CT cut-off for differentiating neoplastic lesions from normal colon in contrast-enhanced CT colonography. Eur Radiol. 2004;14:2228-2235. [PubMed] [DOI] |
| 11. | 汤 钊猷. 现代肿瘤学. 第2版. 上海: 上海医科大学出版社 2000; 784-785. |
| 12. | Ng CS, Doyle TC, Dixon AK, Miller R, Arends MJ. Histopathological correlates of abnormal pericolic fat on CT in the assessment of colorectal carcinoma. Br J Radiol. 2002;75:31-37. [PubMed] [DOI] |
| 14. | Jang HJ, Lim HK, Park CK, Kim SH, Park JM, Choi YL. Segmental wall thickening in the colonic loop distal to colonic carcinoma at CT: importance and histopathologic correlation. Radiology. 2000;216:712-717. [PubMed] [DOI] |
| 15. | Yoon YC, Lee KS, Shim YM, Kim BT, Kim K, Kim TS. Metastasis to regional lymph nodes in patients with esophageal squamous cell carcinoma: CT versus FDG PET for presurgical detection prospective study. Radiology. 2003;227:764-770. [PubMed] [DOI] |
| 16. | Tunaci M. Carcinoma of stomach and duodenum: radiologic diagnosis and staging. Eur J Radiol. 2002;42:181-192. [PubMed] [DOI] |
| 17. | Lim JS, Yun MJ, Kim MJ, Hyung WJ, Park MS, Choi JY, Kim TS, Lee JD, Noh SH, Kim KW. CT and PET in stomach cancer: preoperative staging and monitoring of response to therapy. Radiographics. 2006;26:143-156. [PubMed] [DOI] |
| 18. | Kim AY, Kim HJ, Ha HK. Gastric cancer by multidetector row CT: preoperative staging. Abdom Imaging. 2005;30:465-472. [PubMed] [DOI] |
| 19. | Noji T, Kondo S, Hirano S, Tanaka E, Ambo Y, Kawarada Y, Morikawa T. CT evaluation of paraaortic lymph node metastasis in patients with biliary cancer. J Gastroenterol. 2005;40:739-743. [PubMed] [DOI] |
| 20. | Fukuya T, Honda H, Hayashi T, Kaneko K, Tateshi Y, Ro T, Maehara Y, Tanaka M, Tsuneyoshi M, Masuda K. Lymph-node metastases: efficacy for detection with helical CT in patients with gastric cancer. Radiology. 1995;197:705-711. [PubMed] [DOI] |
| 22. | Terayama N, Matsui O, Ueda K, Kobayashi S, Sanada J, Gabata T, Kawamori Y, Kadoya M. Peritumoral rim enhancement of liver metastasis: hemodynamics observed on single-level dynamic CT during hepatic arteriography and histopathologic correlation. J Comput Assist Tomogr. 2002;26:975-980. [PubMed] [DOI] |
| 23. | Luccichenti G, Cademartiri F, Sianesi M, Roncoroni L, Pavone P, Krestin GP. Radiologic assessment of rectosigmoid cancer before and after neoadjuvant radiation therapy: comparison between quantitation techniques. AJR Am J Roentgenol. 2005;184:526-530. [PubMed] [DOI] |
| 24. | Matsuki M, Kani H, Tatsugami F, Yoshikawa S, Narabayashi I, Lee SW, Shinohara H, Nomura E, Tanigawa N. Preoperative assessment of vascular anatomy around the stomach by 3D imaging using MDCT before laparoscopy-assisted gastrectomy. AJR Am J Roentgenol. 2004;183:145-151. [PubMed] [DOI] |
| 25. | Sahani DV, Krishnamurthy SK, Kalva S, Cusack J, Hahn PF, Santilli J, Saini S, Mueller PR. Multidetector-row computed tomography angiography for planning intra-arterial chemotherapy pump placement in patients with colorectal metastases to the liver. J Comput Assist Tomogr. 2004;28:478-484. [PubMed] [DOI] |
| 26. | Mauchley DC, Lynge DC, Langdale LA, Stelzner MG, Mock CN, Billingsley KG. Clinical utility and cost-effectiveness of routine preoperative computed tomography scanning in patients with colon cancer. Am J Surg. 2005;189:512-517; discussion 517. [PubMed] [DOI] |
| 27. | Hara AK. Extracolonic findings at CT colonography. Semin Ultrasound CT MR. 2005;26:24-27. [PubMed] [DOI] |
| 28. | Taourel P, Garibaldi F, Arrigoni J, Le Guen V, Lesnik A, Bruel JM. Cecal pneumatosis in patients with obstructive colon cancer: correlation of CT findings with bowel viability. AJR Am J Roentgenol. 2004;183:1667-1671. [PubMed] [DOI] |