修回日期: 2007-02-20
接受日期: 2007-03-17
在线出版日期: 2007-04-28
目的: 在人胚肾HEK293细胞中转染真核表达载体pSNA2/hEndostatin (hEndostatin, 人血管抑素), 建立能稳定分泌hES的基因工程细胞株.
方法: 将含有IL-2分泌肽的人endostatin(ES)全长cDNA插入真核表达载体pSNA2, 产生重组质粒pSNA2/hEndostatin; 利用阳离子脂质体介导将其转染入HEK293细胞中; 用G418筛选出阳性克隆细胞, 将其命名为hE/293细胞. 用Western blot法检测hE/293细胞培养上清中分泌的hES蛋白. 血管内皮细胞(ECV304)增殖抑制试验及鸡胚尿囊膜试验观察其分泌的hES蛋白的抗增殖活性.
结果: 经过双酶切和DNA测序证实构建出了含hES基因的真核表达载体. 通过G418抗性筛选筛选出稳定表达hES的细胞株3株, 将其命名为hE/293细胞; Western blot检测该细胞株培养上清中存在分子量为20 kDa的ES蛋白; ECV304增殖抑制试验显示, 与HEK293细胞组相比,hE/293细胞组分泌的ES蛋白对bFGF刺激的血管内皮细胞增殖有明显的抑制作用(48 h: 0.125±0.007 vs 0.159±0.020, P<0.01; 72 h: 0.088±0.016 vs 0.249±0.070, P<0.01); 鸡胚尿囊膜试验证实hE/293细胞分泌的ES蛋白可以抑制鸡胚尿囊膜血管生长.
结论: 所构建的hE/293细胞株可以稳定的分泌hES蛋白, 并能抑制ECV304细胞生长及鸡胚尿囊膜血管生长.
引文著录: 赵卉, 潘静坤, 罗芸, 田磊, 薛毅珑. 持续释放人血管抑素的基因修饰化工程细胞hE/293细胞株的建立. 世界华人消化杂志 2007; 15(12): 1370-1375
Revised: February 20, 2007
Accepted: March 17, 2007
Published online: April 28, 2007
AIM: To express the recombinant eukaryotic expression vector containing human endostatin gene in human embryonic kidney HEK293 cells, and construct a cell line continuously secreting human endostatin (hES).
METHODS: Human endostatin cDNA containing interleukin-2 (IL-2) secreting peptide was cloned into eukaryotic expression plasmid pSNA2 to construct the recombinant plasmid pSNA2/endostatin. The plasmid pSNA2/endostatin was transfected into HEK293 cells by cationic liposome. The positive cell clones were selected by G418 and then named hE/293 cells. The expression of endostatin protein was analyzed by Western blot. The release of biologically active endostatin was confirmed using assays of ECV304 proliferation and the angiogenesis experiment of chicken chorioallantoic membrane (CAM).
RESULTS: Enzyme digestion and sequence analysis confirmed that the eukaryotic expression vector pSNA2/endostatin had been successfully constructed. After G418 selection, 3 strains of cells stably expressing hES were obtained, named as hE/293 cells. Western blot showed that ES protein with a molecular weight of 20 kDa existed in the supernatant of hE/293 cells. No endostatin expression was found in the control cells. The assays of ECV304 proliferation showed that the supernatant of hE/293 cells inhibited ECV304 cell proliferation induced by basic fibroblast growth factor in comparison with that of HEK29 cells (48 h: 0.125 ± 0.007 vs 0.159 ± 0.020, P < 0.01; 72 h: 0.088 ± 0.016 vs 0.249 ± 0.070, P < 0.01). There were fewer blood vessels in the CAM treated with ES protein.
CONCLUSION: Target cell line hE/293 is successfully constructed which it can stably secret hES protein, inhibit the ECV304 cell proliferation and CAM angiogenesis.
- Citation: Zhao H, Pan JK, Luo Y, Tian L, Xue YL. Construction of gene engineered hE/293 cells continuously releasing human endostatin. Shijie Huaren Xiaohua Zazhi 2007; 15(12): 1370-1375
- URL: https://www.wjgnet.com/1009-3079/full/v15/i12/1370.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i12.1370
肿瘤的生长必须依赖于新生血管形成, 抑制肿瘤血管的生成可以抑制肿瘤的生长和转移, 这为肿瘤的治疗提供了一条新的思路, 并形成了抗肿瘤血管生成疗法[1-2]. 近年来人们发现了大量的抗血管生成复合物, 其中有许多已经在试验研究中显示了抗血管生成活性[3-4]. 在目前发现的内源性血管生成抑制因子中以内皮抑素(endostatin, ES)最引人瞩目. ES是1997年O'Relly et al[5]从鼠血管内皮瘤(EOMA)细胞的培养液上清中分离到一种分子量为20 kDa左右的蛋白, 对血管内皮细胞有特异性生长抑制作用. 大量研究发现, ES能在一定浓度范围内(100-600 mg/L)特异性的抑制内皮细胞增殖并表现出剂量依赖性, 对静止的细胞、正常的细胞、发生转化的细胞及瘤细胞无明显影响[6]. Bergers et al[7]发现, 无论在预防期(实体瘤开始形成)、干扰期(实体瘤已形成)还是抑制晚期(肿瘤晚期), ES都能抑制血管生成的启动及进一步生长. 我们成功的构建了分泌型人内皮抑素的真核表达载体pSNA2/endostatin, 将其转染到人胚胎肾细胞系HEK293中, 为进一步利用该基因进行细胞移植治疗奠定了基础.
人携带血管内皮抑素基因的质粒pAVV-hEndostatin质粒由哈佛大学教授馈赠, 含人IL-2信号肽, IL-2信号肽加内皮抑素序列endostatin cDNA全长为672 bp; 真核表达载体pSNA2.0质粒由解放军总医院消化内科徐世平主任馈赠, 全长7.1 kb; PCR、RT-PCR试剂盒为TaKa公司产品; DH-5α感受态细胞购于北京京科宏达公司; 无内毒素质粒大提试剂盒、DNA快速纯化/回收试剂盒、LipofectamineTM2000细胞转染试剂盒购自Invitrogen公司, DMEM培养基购于Gibco公司, HEK293细胞由军科院王嘉宁博士馈赠; 引物合成由上海生工合成, 测序由英俊公司完成; 鼠抗人endostatin抗体购自R&D公司, 二抗购自武汉博士德公司; G418购自Promega公司, SPF级鸡胚购自维通利华.
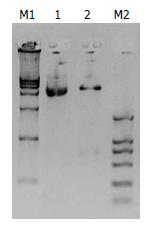
1.2.1 表达载体的构建: pSNAV2.0和pAVV-hEndostatin质粒各1 μg以EcoRⅠ和BglⅡ双酶切, 10 g/L琼脂糖凝胶电泳鉴定, DNA凝胶回收试剂盒回收pSNAV2.0质粒酶切产物的7.1 kb片段和pAVV-hEndostatin质粒酶切产物的672 bp片段. 取pSNAV2.0质粒酶切产物7.1 kb片段1 μL, pAVV-hEndostatin质粒酶切产物672 bp片段7 μL, T4 DNA连接酶Buffer 1 μL, T4 DNA连接酶1 μL, 16 ℃水浴连接过夜. 取5 μL连接产物热休克法转化入感受态大肠杆菌DH-5α, 次日挑取单克隆培养, 接入5 mL Amp LB培养基, 37 ℃振荡培养过夜, 取3 mL菌液提取质.
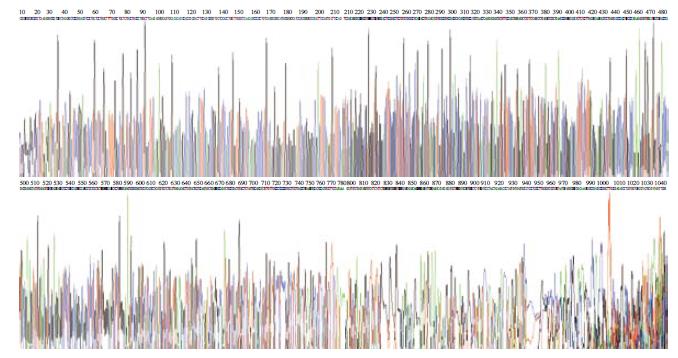
1.2.2 构建后表达质粒鉴定: (1)EcoRⅠ+BglⅡ双酶切鉴定目的片段, 将构建好的质粒命名为pSNA2-hEndostatin. 质粒5 μL稀释于含BglⅡ限制酶10 U, EcoR限制酶10 U缓冲液中, 37 ℃水浴酶切4 h. 行10 g/L琼脂糖凝胶电泳, BIO-RAD凝胶成像系统下观察结果; (2)PCR鉴定插入目的片段. 引物1: 5'- CGAATTCGCGGGCGGCCGCTC, 引物2: 5'-TCTGCATTGAGAACAGCTTC(上海基康合成). 反应总体积25 μL: 连接产物pSNAV2.0-hEndostatin质粒0.1 μL, 10×PCR Buffer 2 μL, 引物20 pmmol/L各0.4 μL, dNTP 1.6 μL, 无菌去离子双蒸水15.2 μL, Taq酶0.3 μL(Promega). 采用BIO-RAD扩增仪, 94 ℃预变性5 min; 94 ℃变性50 s, 56 ℃退火50 s, 72 ℃延伸1 min, 30个循环后, 72 ℃ 延伸5 min. 反应完毕取PCR产物5 μL 20 g/L琼脂糖凝胶电泳; (3)测序鉴定目的片段. 将培养pSNAV2.0-hEndostatin的菌种送到英俊公司测序. 测序结果与PubMed上公布的序列进行Blast比对, 确定测序正确后, 用大提试剂盒提取质粒, 用于转染.
1.2.3 pSNAV2.0-hEndostatin转染HEK293细胞: HEK293细胞用100 mL/L小牛血清DMEM培养基培养, 常规传代、接种、冻存. 转染方法参照LipofectamineTM2000说明书进行. 转染完毕加入无抗生素的100 mL/L小牛血清DMEM培养液继续培养24 h.
1.2.4 转染细胞的筛选: 按照1:3比例传代, 传代后用无抗生素的100 mL/L小牛血清DMEM培养液继续培养24 h, 去除培养液, 更换为含G418 350 mg/L的DMEM培养液继续培养14 d, 每隔2 d更换一次培养液, 第15天换为含G418 175 mg/L的DMEM培养液继续培养14 d, 每隔2 d更换一次培养液. 标记阳性集落位置, 去除培养液, 用微量加样枪吸取少量2.5 g/L胰酶轻轻吹打细胞, 使细胞脱落, 将消化液连同脱落的细胞一起转移到含G418 100 mg/L的DMEM培养液继续培养, 每株细胞给以编号、扩增培养、传代、冻存同时收集上清备用, 并将其命名为hE/293细胞.
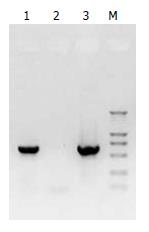
1.2.5 Western印迹分析: 收集稳定转染的细胞和未经转染的对照组细胞培养液上清, 1000 g离心2 min沉淀细胞, 收集上清, 离心式超滤浓缩装置(美国Millipore公司)浓缩, 样品蛋白经150 g/L SDS-PAGE上分离后湿转到PVDF膜上, 封闭液处理, 以鼠抗人ES多克隆抗体为一抗, HRP标记的兔抗鼠多克隆抗体为二抗, 温育, 充分洗膜后, 加入显色液, 避光显色至出现条带时放入双蒸水中终止反应.
1.2.6 血管内皮细胞(ECV304)细胞增殖抑制试验: ECV304细胞常规消化传代, 以1×103细胞/孔种植于96孔板中, 24 h贴壁后, 加入E/293浓缩上清培养液20 μL, 对照组加入正常HEK293细胞培养液20 μL,每组做5个复孔, 吸附2 h后, 加入正常培养液80 μL,含bFGF终浓度为3 mg/L继续培养24, 48, 72 h后, 取出培养板吸弃培养液PBS清洗两遍, 加入MTT 10 μL 7 ℃孵育4 h, 吸去MTT, 加入150 μL DMSO, 37 ℃孵育5 min, 剧烈振荡15 min, 490 nm检测吸光度值.
1.2.7 鸡胚尿囊膜试验: 选取5日龄鸡胚用碘酒和酒精消毒后, 在超净工作台用眼科尖嘴镊小心敲开蛋壳, 将甲基纤维素膜加在绒毛尿囊膜上, 用微量加样器吸取浓缩的hE/293细胞分泌上清加在甲基纤维素膜上, 然后用无菌的滤纸膜覆盖蛋壳缺口, 避免蛋清直接与空气接触, 放入37 ℃培养箱中培养4 d, 每4 h翻动一次, 5 d后打开扩大蛋壳缺口, 观察鸡胚绒毛膜血管生成情况, 并用彩色相机摄影保存.
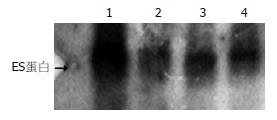
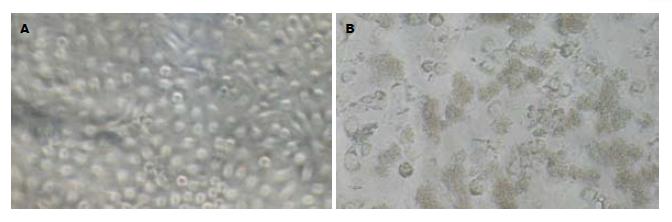
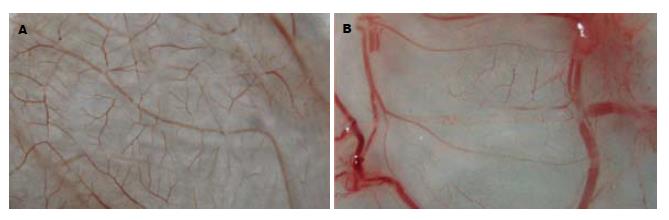
构建的重组质粒pSNAV2.0-hEndostatin质粒经EcoRⅠ+BglⅡ双酶切得到7.1 kb和672 bp两条带(图1). PCR扩增条带预期为637 bp(图2). 测序结果与NCBI上BLAST比对同源性达到100%(图3). pSNAV2.0-hEndostatin转染HEK293细胞后, 经过G418筛选后形成阳性克隆(图4). 选取hE/293细胞培养上清, 离心过滤后, 超滤浓缩后行SDS-PAGE和Western blot检测, 结果在hE/293细胞培养液上清中可以检测到能与ES抗体发生特异性抗原抗体反应的条带, Mr 20 000, 与人内皮抑素蛋白分子量一致, 说明筛选的hE/293细胞能分泌ES蛋白(图5). ECV-304细胞生长抑制试验显示, 48 h后试验组ECV304细胞开始不同程度的死亡, 细胞形态及折光性出现异常, 活细胞数量明显减少(图6). 鸡胚绒毛尿囊膜实验显示, 在给予hE/293培养上清的鸡胚尿囊膜血管稀疏, 血管密度明显减少(图7).
尽管有大量的动物实验证实ES有抗肿瘤活性[8-10], 但应用ES蛋白进行抗肿瘤治疗存在以下问题: (1)ES在体内半衰期短, 理想的抗肿瘤疗效的产生需要相对较高的注射剂量, 并且需要反复、多次给药, 疗程持续时间比较长; (2)ES在体外极不稳定, 在体外短时间内即失去活性; (3)应用基因工程获得的外源性重组蛋白的制备纯化十分困难, 且ES蛋白生成需要正确的重折叠, 目前的制备的工艺提供临床长期、大剂量用药有一定困难[11-15]. 针对以上问题, 国内外科学家一直在积极的探索利用ES的基因进行治疗, 期望通过ES在体内的表达,维持有效的ES浓度,获得更好的治疗效果. 应用最多的是利用腺病毒载体、腺相关病毒载体等载体等将ES基因导入动物体内, 产生了持续表达的内源性蛋白产物, 观察到与体外重组蛋白相同的生物学活性与功能[16-18]. 虽然基因治疗避免了反复注射及可能发生的免疫反应, 但存在着潜在的毒性和感染颗粒传播, 治疗的长效性, 转染的效率, 以及目的蛋白表达的量也存在着问题[19-20]. 近来Read et al[21]报道用微胶囊包裹可分泌内皮抑素的细胞, 然后将其植入胶质瘤荷瘤鼠内, 18 d后观察到治疗组中肿瘤细胞向周围组织的侵润受到抑制, 治疗组中肿瘤血管生成显著减少, 肿瘤抑制率达35%, 但这方面的报道仅限于几项治疗脑胶质瘤的研究[22-24].
本研究构建了真核表达载体pSNAV2.0-hEndostatin, 测序证实hES插入位点和方向正确,其中ES的序列和已知的ES序列完全相同, 保证了产物的正确性. 重组质粒具有真核细胞的筛选标志, 便于阳性细胞的筛选, 并且由于携带人IL2信号肽序列, 因此转染细胞具有外分泌的功能, 可以成功分泌ES蛋白到组织中发挥其生物学功能. 我们用其转染人体正常细胞HEK293, 经过G418筛选成功建立蛋白稳定表达细胞系并命名为hE/293, 蛋白印迹表明hE/293细胞能分泌ES蛋白到细胞外. 应用hE/293细胞分泌上清对bFGF刺激的血管内皮细胞(ECV304)增殖能力的影响进行了测定. 结果显示hE/293细胞培养上清对bFGF刺激的血管内皮细胞有显著的增殖抑制作用. 鸡胚尿囊膜试验显示hE/293细胞培养上清能够抑制新生血管的生成. 我们前期研究中建立了稳定的微囊化基因工程细胞制备平台, 借助维囊的免疫隔离作用, 进行微囊化的基因工程细胞移植使其在体内持续表达目的蛋白, 这样既可以保证蛋白在体内的活性又无需对其进行化学提纯, 并且大大降低了工作量和工作成本, 最重要的是不会引起机体免疫反应, 无需改变宿主基因组, 具有安全性[25-27]. 本次研究将hE/293细胞在体外大量培养、扩增, 建立细胞"银行", 为进一步利用微囊包裹hE/293细胞治疗肿瘤奠定了基础.
近年来的研究发现, 血管新生(angiogenesis)是绝大多数实体瘤维持其恶性进展所必需的, 这为肿瘤的治疗提供了一条新的思路, 并形成了抗肿瘤血管生成疗法. 到目前为止, 多种血管形成抑制因子已被分离纯化并对其抑制肿瘤的作用进行了研究, 其中一些因子已经进入临床试验有希望在肿瘤治疗领域发挥重要作用.
内皮抑素(endosta-tin, ES)是目前发现的作用最强的内源性血管抑制因子, 其研究主要集中在以下几个方面: 利用基因工程表达的重组蛋白开发为抗肿瘤药物, 内皮抑素基因治疗, 腹膜内植入渗透泵持续释放ES.
最近有研究报道利用应用微囊化分泌ES的细胞治疗肿瘤, 发现经过微囊移植的裸鼠瘤组织血管生成显著减少, 肿瘤抑制率达到35%, 但这方面的报道仅限于几项治疗脑胶质瘤的研究.
本研究成功的构建了真核表达载体, 并将其转染到人正常细胞中, 筛选了3株稳定分泌ES的细胞.
稳定分泌ES的细胞可以在体外大量培养、扩增, 建立细胞"银行", 为进一步利用hE/293细胞治疗肿瘤奠定了基础.
微囊化细胞(microen capsulat-ed cells): 是用亲水性高分子材料与细胞混合, 经过微囊发生器形成直径0.4-0.8 mm的包裹细胞的球囊, 具有半通透性、免疫隔离性和良好的组织相容性. 微囊化细胞可在体内长期存活, 维持正常的生理功能.
本文目的明确,思路清楚, 成功构建了human ES表达载体, 并证实了表达产物抑制血管生长功能. 文字通顺, 语言简练, 结果和数据准确, 有参考价值.
电编: 郭海丽 编辑:王晓瑜
| 1. | Folkman J. Angiogenesis: an organizing principle for drug discovery? Nat Rev Drug Discov. 2007;6:273-286. [PubMed] [DOI] |
| 2. | Scappaticci FA. Mechanisms and future directions for angiogenesis-based cancer therapies. J Clin Oncol. 2002;20:3906-3927. [PubMed] [DOI] |
| 3. | Iruela-Arispe ML, Dvorak HF. Angiogenesis: a dynamic balance of stimulators and inhibitors. Thromb Haemost. 1997;78:672-677. [PubMed] |
| 4. | O'Reilly MS, Holmgren L, Shing Y, Chen C, Rosenthal RA, Moses M, Lane WS, Cao Y, Sage EH, Folkman J. Angiostatin: a novel angiogenesis inhibitor that mediates the suppression of metastases by a Lewis lung carcinoma. Cell. 1994;79:315-328. [PubMed] [DOI] |
| 5. | SO'Reilly MS, Boehm T, Shing Y, Fukai N, Vasios G, Lane WS, Flynn E, Birkhead JR, Olsen BR, Folkman J. Endostatin: an endogenous inhibitor of angiogenesis and tumor growth. Cell. 1997;88:277-285. [PubMed] |
| 6. | KArnaud S, Malatesta F, Guigliarelli B, Gayda JP, Bertrand P, Miraglio R, Denis M. Purification and characterization of the oxidase from the marine bacterium Pseudomonas nautica 617. Eur J Biochem. 1991;198:349-356. [PubMed] [DOI] |
| 7. | Bergers G, Javaherian K, Lo KM, Folkman J, Hanahan D. Effects of angiogenesis inhibitors on multistage carcinogenesis in mice. Science. 1999;284:808-812. [PubMed] [DOI] |
| 8. | Isayeva T, Ren C, Ponnazhagan S. Recombinant adeno-associated virus 2-mediated antiangiogenic prevention in a mouse model of intraperitoneal ovarian cancer. Clin Cancer Res. 2005;11:1342-1347. [PubMed] |
| 9. | Chen QR, Kumar D, Stass SA, Mixson AJ. Liposomes complexed to plasmids encoding angiostatin and endostatin inhibit breast cancer in nude mice. Cancer Res. 1999;59:3308-3312. [PubMed] |
| 10. | Peroulis I, Jonas N, Saleh M. Antiangiogenic activity of endostatin inhibits C6 glioma growth. Int J Cancer. 2002;97:839-845. [PubMed] [DOI] |
| 11. | Dutour A, Monteil J, Paraf F, Charissoux JL, Kaletta C, Sauer B, Naujoks K, Rigaud M. Endostatin cDNA/cationic liposome complexes as a promising therapy to prevent lung metastases in osteosarcoma: study in a human-like rat orthotopic tumor. Mol Ther. 2005;11:311-319. [PubMed] [DOI] |
| 12. | Thomas JP, Arzoomanian RZ, Alberti D, Marnocha R, Lee F, Friedl A, Tutsch K, Dresen A, Geiger P, Pluda J. Phase I pharmacokinetic and pharmacodynamic study of recombinant human endostatin in patients with advanced solid tumors. J Clin Oncol. 2003;21:223-231. [PubMed] [DOI] |
| 13. | Eisterer W, Jiang X, Bachelot T, Pawliuk R, Abramovich C, Leboulch P, Hogge D, Eaves C. Unfulfilled promise of endostatin in a gene therapy-xenotransplant model of human acute lymphocytic leukemia. Mol Ther. 2002;5:352-359. [PubMed] [DOI] |
| 14. | Jia L, Zhang MH, Yuan SZ, Huang WG. Antiangiogenic therapy for human pancreatic carcinoma xenografts in nude mice. World J Gastroenterol. 2005;11:447-450. [PubMed] [DOI] |
| 15. | Jia S, Zhu F, Li H, He F, Xiu R. Anticancer treatment of endostatin gene therapy by targeting tumor neovasculature in C57/BL mice. Clin Hemorheol Microcirc. 2000;23:251-257. [PubMed] |
| 16. | 李 喆, 潘 欣, 潘 卫, 曹 贵松, 闻 兆章, 方 国恩, 戚 中田, 毕 建威, 华 积德. 内皮抑素-可溶性血管内皮细胞生长抑制因子融合基因重组腺病毒的包装与鉴定. 世界华人消化杂志. 2003;11:741-744. [DOI] |
| 17. | 潘 欣, 李 喆, 张 珉, 王 泳, 潘 卫, 戚 中田. 内皮抑素-血管内皮细胞抑制因子重组腺病毒对荷胃癌裸鼠的治疗. 世界华人消化杂志. 2003;11:1282-1285. [DOI] |
| 18. | Martinico SC, Jezzard S, Sturt NJ, Michils G, Tejpar S, Phillips RK, Vassaux G. Assessment of endostatin gene therapy for familial adenomatous polyposis-related desmoid tumors. Cancer Res. 2006;66:8233-8240. [PubMed] [DOI] |
| 19. | Bertolini F, Fusetti L, Mancuso P, Gobbi A, Corsini C, Ferrucci PF, Martinelli G, Pruneri G. Endostatin, an antiangiogenic drug, induces tumor stabilization after chemotherapy or anti-CD20 therapy in a NOD/SCID mouse model of human high-grade non-Hodgkin lymphoma. Blood. 2000;96:282-287. [PubMed] |
| 20. | Nakashima Y, Yano M, Kobayashi Y, Moriyama S, Sasaki H, Toyama T, Yamashita H, Fukai I, Iwase H, Yamakawa Y. Endostatin gene therapy on murine lung metastases model utilizing cationic vector-mediated intravenous gene delivery. Gene Ther. 2003;10:123-130. [PubMed] [DOI] |
| 21. | Read TA, Farhadi M, Bjerkvig R, Olsen BR, Rokstad AM, Huszthy PC, Vajkoczy P. Intravital microscopy reveals novel antivascular and antitumor effects of endostatin delivered locally by alginate-encapsulated cells. Cancer Res. 2001;61:6830-6837. [PubMed] |
| 22. | Joki T, Machluf M, Atala A, Zhu J, Seyfried NT, Dunn IF, Abe T, Carroll RS, Black PM. Continuous release of endostatin from microencapsulated engineered cells for tumor therapy. Nat Biotechnol. 2001;19:35-39. [PubMed] [DOI] |
| 23. | Read TA, Sorensen DR, Mahesparan R, Enger PO, Timpl R, Olsen BR, Hjelstuen MH, Haraldseth O, Bjerkvig R. Local endostatin treatment of gliomas administered by microencapsulated producer cells. Nat Biotechnol. 2001;19:29-34. [PubMed] [DOI] |
| 24. | Bjerkvig R, Read TA, Vajkoczy P, Aebischer P, Pralong W, Platt S, Melvik JE, Hagen A, Dornish M. Cell therapy using encapsulated cells producing endostatin. Acta Neurochir Suppl. 2003;88:137-141. [PubMed] [DOI] |