修回日期: 2007-02-02
接受日期: 2007-02-09
在线出版日期: 2007-04-28
目的: 研究趋化性细胞因子受体CXCR4短干扰RNA (siRNA)对大肠癌细胞系体外侵袭及增殖能力的影响.
方法: 利用T7 RNA聚合酶体外合成以CXCR4为靶基因的siRNA, 用脂质体转染大肠癌SW480细胞, 同时设立空白对照组和无关对照组. 于转染后48 h采用RT-PCR方法检测CXCR4 mRNA水平, 免疫印迹方法检测CXCR4和MT1-MMP的蛋白质水平, Boyden小室模型检测体外侵袭能力的变化, 流式细胞术检测细胞周期的分布情况, MTT法测定细胞增殖状况.
结果: SW480细胞转染CXCR4 siRNA 48 h后, 与空白对照和无关对照相比, CXCR4 mRNA水平明显下调(51.53%±6.1% vs 78.4%±3.3%, P<0.01; 51.53%±6.1% vs 87.4%±5.3%, P<0.01), CXCR4的蛋白质水平明显降低(47.3%±3.7% vs 107.2%±3.6%, P<0.01; 47.3%±3.7% vs 114.7%±4.8%, P<0.01), MT1-MMP蛋白表达水平也明显下降(43.8%±2.5% vs 64.4%±4.4%, P<0.01; 43.8%±2.5% vs 67.0%±2.9%, P<0.01), 细胞的体外侵袭能力减弱(26.5%±6.1% vs 73.7%±3.4%, P<0.01; 26.5%±6.1% vs 64.5%±5.7%, P<0.01), 细胞周期的分布无明显差异. 在无SDF-1存在的情况下, 各组细胞的增殖无明显改变; 经SDF-1刺激后, 各组细胞增殖增加, 但CXCR4 siRNA转染组细胞的增殖显著低于空白对照组和无关对照组(24 h: 0.55±0.03 vs 0.68±0.06, 0.71±0.04, P<0.05; 48 h: 0.67±0.04 vs 0.89±0.03, 0.94±0.07, P<0.05; 72 h: 0.72±0.06 vs 1.36±0.08, 1.53±0.07, P<0.01). 以上各指标在空白对照和无关对照之间无显著性差异(P>0.05).
结论: 以CXCR4为靶向的siRNA能够有效下调CXCR4基因, 降低SDF-1诱导的大肠癌细胞系体外侵袭能力及增殖活性.
引文著录: 张孟贤, 韩娜, 冷彦. 趋化性细胞因子受体CXCR4基因沉默对大肠癌细胞体外侵袭及增殖能力的影响. 世界华人消化杂志 2007; 15(12): 1331-1337
Revised: February 2, 2007
Accepted: February 9, 2007
Published online: April 28, 2007
AIM: To study the inhibitory effect of chemokine receptor CXCR4 short interference RNA (siRNA) on the invasion capability and proliferation of colorectal cancer cell line SW480.
METHODS: SiRNA specifically targeting CXC chemokine receptor CXCR4 was designed in vitro using T7 RNA polymerase. Colorectal cancer SW480 cells were cultured under standard condition and the siRNA was transfected into SW480 cells with Lipofectamine 2000. Negative control and mock control were used at the same time. The levels of CXCR4 mRNA and protein were detected by reverse transcription-polymerase chain reaction (RT-PCR) and Western blotting 48 h after transfection respectively. The changes of invasion capability and MT1-MMP protein in SW480 cells were evaluated using Boyden Chamber invasion assay and Western blotting respectively. The cell cycle distribution and proliferation status were detected by flow cytometry and MTT assay respectively.
RESULTS: Forty-eight hours after transfection with CXCR4 siRNA, in comparison with those in negative and mock control group, the levels of CXCR4 mRNA (51.53% ± 6.1% vs 78.4% ± 3.3%, P < 0.01; 51.53% ± 6.1% vs 87.4% ± 5.3%, P < 0.01) and protein (47.3% ± 3.7% vs 107.2% ± 3.6%, P < 0.01; 47.3% ± 3.7% vs 114.7% ± 4.8%, P < 0.01) decreased significantly (47.3% ± 3.7% vs 107.2% ± 3.6%, P < 0.01; 47.3% ± 3.7% vs 114.7% ± 4.8%, P < 0.01); the invasion capability (26.5% ± 6.1% vs 73.7% ± 3.4%, P < 0.01; 26.5% ± 6.1% vs 64.5% ± 5.7%, P < 0.01) and the MT1-MMP protein expression (43.8% ± 2.5% vs 64.4% ± 4.4%, P < 0.01; 43.8% ± 2.5% vs 67.0% ± 2.9%, P < 0.01) in SW480 cells decreased significantly, but the cell cycle distribution didn't change remarkably. At the absence of SDF-1, cell proliferation status was similar to that in control and mock control group. After stimulation by SDF-1, the proliferation of SW480 cells increased in all the groups, but it was much less active in the CXCR4 siRNA group than in the other two control groups.
CONCLUSION: CXCR4 siRNA can inhibit the expression of CXCR4 and decrease the invasion capability and proliferation of SW480 cells.
- Citation: Zhang MX, Han N, Leng Y. Effect of specific suppression of chemokine receptor CXCR4 by short interference RNA on the invasion capability and proliferation of colorectal cancer cells. Shijie Huaren Xiaohua Zazhi 2007; 15(12): 1331-1337
- URL: https://www.wjgnet.com/1009-3079/full/v15/i12/1331.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i12.1331
侵袭和转移是恶性肿瘤的本质特征, 也是导致治疗失败的主要原因, 现代分子生物学研究揭示, 恶性肿瘤的侵袭和转移是一个多阶段、多步骤的复杂过程, 受许多基因的共同调控, 导致其表达产物的改变, 由此影响肿瘤细胞的生物学行为. 其中, 趋化性细胞因子及其受体参与癌症侵袭和转移的多个关键环节. 在纷繁复杂的趋化性细胞因子网络系统中, CXCL12/CXCR4作为少数之一具有点对点精确传导生物信息的生物轴系统, 很快引起了一些学者的重视. 近年来不少研究指出, CXCL12/CXCR4生物轴在多种肿瘤的侵袭和转移中发挥着重要作用. 为研究CXCR4对大肠细胞侵袭力及增殖的影响, 本实验通过设计合成以CXCR4为靶点的siRNA, 利用脂质体转染人大肠癌SW480细胞系, 特异性抑制CXCR4基因表达, 检测转染siRNA细胞体外侵袭及增殖能力的变化.
大肠癌细胞系SW480购自中国典型培养物保藏中心. RPMI1640培养基(Gibco/BRL公司), 小牛血清(Hyclone), RNAi试剂Silencer siRNA construction KIT(Ambion公司), LipofectamineTM 2000脂质体(Invitrogen公司), MMLV逆转录酶(Promega公司), 兔抗人CXCR4 mAb(R&D), HRP标记的羊抗兔二抗(Santa Cruz), ECL(Enhanced Chemical luminescence)显色试剂盒(晶美生物), BCA蛋白测定试剂盒(Pierce公司), MTT, 碘化吡啶PI(Sigma公司).
大肠癌细胞系SW480细胞用含100 mL/L小牛血清的RPMI1640培养液, 在37 ℃, 50 mL/L CO2孵育箱中培养. 每3天更换培养液, 按1:3传代. 取对数生长期细胞用于实验.
1.2.1 CXCR4 siRNA的制备: 根据Elbashir et al siRNA的设计原则设计针对CXCR4 cDNA (accession no.NM_003467)符合特征的靶序列. 同时设计无关对照序列(GC含量与靶序列相同). 靶序列: 5'-AAGGAACCCTGTTTCCGTGAA-3', 无关序列: 5'-AACCGGATGTCGAGAACTTCA-3'. 根据靶序列设计靶序列siRNA模板DNA, 反义链为靶序列, 正义链为靶序列的互补序列, 3'端加T7启动子的引物序列CCTGTCTC. 正义链(S1): 5'-AATTCACGGAAACAGGGTTCCCCTGTCTC-3'; 反义链(A1): 5'-AAGGAACCCTGTTTCCGTGAACCTGTCTC-3'. 同样方法设计无关序列siRNA模板DNA. 正义链(S2): 5'-AATGAAGTTCTCGACATCCGGCCTGTCTC-3'; 反义链(A2): 5'-AACCGGATGTCGAGAACTTCACCTGTCTC-3'. 按试剂盒操作说明取等摩尔浓度的A1和S1(或A2和S2)和T7启动子混合(70 ℃加热混合物5 min, 室温下放置5 min), T7启动子和DNA引导序列退火结合, 然后用DNA聚合酶Klenow大片段补齐成为可用于转录的双链DNA模板, 分别用T7 RNA聚合酶进行体外转录, 再将产物混合37 ℃水浴箱持续孵育过夜, 形成双链RNA. 以DNA酶降解模板同时用单链专一的核糖核酸酶(RNase)消化5'的引导序列, 由于RNase不能切开U碱基也不能降解双链RNA, 所以得到的产物就是所需的21 bp的双链siRNA有19对碱基互补, 3'端各有2个U突出. 按试剂盒操作说明进行纯化, 得到的siRNA用去核酸酶的水溶解, 紫外分光光度计定量, -20 ℃保存备用.
1.2.2 细胞分组和转染: 取对数生长期SW480细胞接种于6孔板(5×105/孔), 培养细胞至密度为50%. 转染siRNA的浓度为80 nmol/L. 实验分为3组: A组: 只加脂质体(空白对照组, control); B组: 转染无关siRNA(无关对照组, mock control); C组: CXCR4 siRNA干预组. 利用Lipofectamine2000将siRNA转染SW480细胞的实验方法参考说明书进行, 简要步骤如下: 转染前24 h将6孔板每孔加入无抗生素的DMEM培养基2 mL. 往每孔中加入siRNA-Lipofectamine2000混合液500 µL, 轻轻混匀. 在37 ℃, 50 mL/L CO2孵育箱中培养48 h.
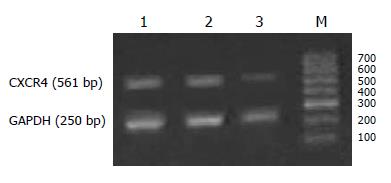
1.2.3 RT-PCR: 细胞转染48 h后收集细胞, 按TRIzol说明书操作提取细胞总RNA, 用于扩增人CXCR4 cDNA. PCR引物(上海博亚公司合成)序列如下: CXCR4上游序列: 5'-CGGAATTCCAGCAGGTAGCAAAGTGACG-3', 下游序列: 5'-GACGCCAACATAGACCACCT-3'. 同时以人GAPDH为内参照, 引物的上游序列: 5'-ACGGATTTGGTCGTATTGGG-3', 下游序列: 5'-TGATTTTGGAGGGATCTCGC-3'. PCR扩增条件如下: 94 ℃预变性5 min, 94 ℃变性30 s, 60 ℃退火30 s, 72 ℃延伸60 s, 35个循环; 72 ℃延伸10 min. CXCR4和GAPDH的PCR片段大小为561 bp和250 bp. PCR产物采用图像扫描仪拍照并进行条带灰度分析, 以CXCR4/GAPDH的比值代表其相对含量.
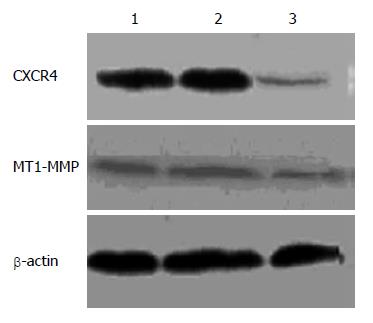
1.2.4 Western blotting分析: CXCR4蛋白检测: 细胞转染48 h后收集细胞, 加入细胞裂解液, 提取细胞总蛋白, 用BCA试剂盒检测蛋白质浓度, 灌制100 g/L SDS-PAGE凝胶, 每孔上样50 µg, 经电泳, 转膜, 封闭, 依次与CXCR4抗体(1:200)及辣根过氧化物酶标记的二抗(1:500)反应1 h, 化学发光法(ECL)曝光显影, 冲洗胶片, 用密度扫描仪测定条带的光密度值(A值), β-actin为内参. MT1-MMP蛋白检测: 以上各组细胞分别与含和不含SDF-1(100 mg/L)的培养液孵育2 h后, 洗涤细胞, 加入细胞裂解液, 提取细胞总蛋白, 同上述方法检测MT1-MMP蛋白水平, 一抗为兔抗人MT1-MMP单抗(1:100).
1.2.5 体外趋化侵袭实验: 用24孔Boydem趋化小室(8 µm; Becton Dickinson), 按照说明书方法进行. 简要步骤如下: 收获转染48 h后的各实验组细胞, 用无血清培养基悬浮, 将0.2 mL细胞悬液(1×104)加入上室内, 将含诱引剂SDF-1的趋化上清(RPMI1640+5 g/L BSA+100 µg/L SDF-1)加入下室, 每组设3个复孔. 在37 ℃, 50 mL/L CO2条件下培养24 h. 取出膜, 用棉拭子去除上室底部基质胶并移除未侵袭细胞, 甲醇固定, HE染色, 光学显微镜下观察迁移至膜上的细胞, 每孔计数5个高倍视野(×100)的细胞数.
1.2.6 流式细胞检测: 细胞转染48 h后回收各实验组细胞, 胰酶消化, 制成单细胞悬液, 调整细胞浓度为5×108/L, PBS充分洗涤, 800 mL/L冰乙醇固定, 加入终浓度为100 mg/L的Rnase A 10 µL, 37 ℃水浴30 min后移入冰浴中停止酶反应, 再加入终浓度为5 mg/L的PI染色剂10 µL, 4 ℃避光保存, 孵育过夜, 美国Becton-Dicknson公司的FACSort型流式细胞仪检测和细胞周期的分布. 数据获取用CELLQuest软件, 分析细胞周期用ModFit2.0.
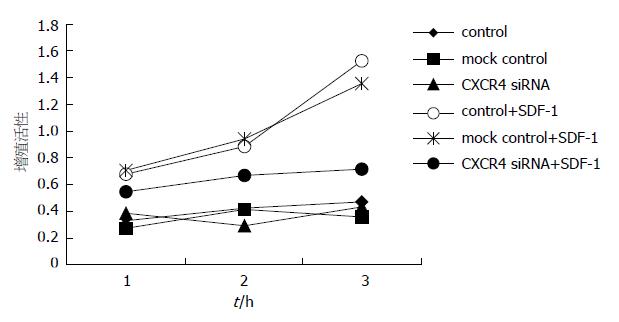
1.2.7 MTT分析: 收获转染48 h后的各实验组细胞, 按104/孔分别接种于96孔培养板, 每组细胞分别加入含诱引剂SDF-1的趋化上清 (RPMI1640+5 g/L BSA+100 µg/L SDF-1)和空白对照液(RPMI1640+5 g/L BSA). 分别于24, 48和72 h, 各孔加入MTT溶液(5 g/L) 20 µL, 孵育4 h, 吸弃孔内培养液, 加入DMSO 150 µL, 充分溶解结晶物, 读取各孔光吸收值(490 nm波长). 每组设3个平行样本, 取各组值的均数表示细胞的增殖情况.
统计学处理 采用Windows SPSS10.0软件进行t检验, 数据以均数±标准差表示, P<0.05被认为具有统计学意义.
为明确siRNA转染对靶基因CXCR4的影响, 我们进行RT-PCR和Western blot检测. RT-PCR结果表明: CXCR4 siRNA转染SW480细胞48 h后, CXCR4基因mRNA水平明显下调, 与空白对照组(control)和无关对照组(mock control)比较差异有显著性意义(51.53%±6.1% vs 78.4%±3.3%, P<0.01; 51.53%±6.1% vs 87.4%±5.3%, P<0.01), 而mock siRNA不引起靶基因mRNA水平的明显变化(87.4%±5.3% vs 78.4%±3.3%, P>0.05)(图1). Western blotting检测也得出类似结果: CXCR4 siRNA转染SW480细胞48 h后, CXCR4蛋白表达水平较空白对照组和无关对照组明显下降(47.3%±3.7% vs 107.2%±3.6%, P<0.01; 47.3%±3.7% vs 114.7%±4.8%, P<0.01), 空白对照组和无关对照组间无明显差异(P>0.05)(图2).
为了解CXCR4基因表达下调对大肠癌细胞体外侵袭能力的影响, 我们采用体外趋化侵袭实验. 结果发现转染CXCR4 siRNA 48 h后, SW480大肠癌细胞的穿膜细胞数较空白对照组和无关对照组明显减少(26.5%±6.1% vs 73.7%±3.4%, P<0.01; 26.5%±6.1% vs 64.5%±5.7%, P<0.01), 空白对照组和无关对照组间无明显差异(P>0.05).
为初步探讨CXCR4调控大肠癌细胞体外侵袭力的可能机制, 采用Western blotting方法检测siRNA转染对MT1-MMP表达水平的影响. 结果发现转染CXCR4 siRNA 48 h后, MT1-MMP蛋白表达较空白对照组和无关对照组明显降低(43.8%±2.5% vs 64.4%±4.4%, P<0.01; 43.8%±2.5% vs 67.0%±2.9%, P<0.01), 空白对照组和无关对照组间无明显差异(P>0.05)(图2).
转染CXCR4 siRNA 48 h后, SW480大肠癌细胞各时相的细胞比例与空白对照组和无关对照组无明显差异. 经t检验, P值均>0.05, 差异无显著性意义(表1).
| 分组 | G0/G1 | S | G2/M |
| control | 62.73±2.19 | 19.23±2.53 | 18.04±1.97 |
| mock control | 54.32±4.07 | 22.05±3.26 | 13.63±1.63 |
| CXCR4 siRNA | 60.82±5.01 | 17.71±1.27 | 21.47±2.34 |
经MMT方法检测, 结果发现, 转染CXCR4 siRNA后, 未经SDF-1刺激的SW480细胞的增殖状况与空白对照和无关对照无明显差别; 经SDF-1刺激后24-72 h后, 各组细胞的增殖都有所增加, 但CXCR4 siRNA转染组的增殖明显低于空白对照组和无关对照组(24 h: 0.55±0.03 vs 0.68±0.06, P<0.05; 0.55±0.03 vs 0.71±0.04, P<0.05; 48 h: 0.67±0.04 vs 0.89±0.03, P<0.05; 0.67±0.04 vs 0.94±0.07, P<0.05; 72 h: 0.72±0.06 vs 1.36±0.08, P<0.01; 0.72±0.06 vs 1.53±0.07, P<0.01). 空白对照组和无关对照组间无明显差异(P>0.05)(图3).
恶性肿瘤的侵袭转移是多环节、多步骤且连续的复杂生物学过程, 涉及到细胞迁移的信号通路的调节失常, 肿瘤细胞与宿主细胞间相互作用等[1-2]. 近年研究显示, 趋化性细胞因子和受体网络可能参与了肿瘤的侵袭和转移的多个关键环节[3-4].
趋化性细胞因子受体CXCR4是趋化性细胞因子基质衍生因子SDF-1的专属受体. 对于SDF-1/CXCR4信号系统的研究主要集中在免疫系统, 研究表明他在造血干细胞归巢、淋巴细胞迁移和HIV感染等方面发挥着重要作用[5-6]. 而近年研究发现, SDF-1/CXCR4轴在肿瘤细胞迁移、侵袭和转移过程中有着重要的作用[7-10]. 2001年Muller et al[11]首先报道CXCR4在人类乳腺癌中高表达, 而CXCR4的特异性配体CXCL12(SDF-1)在乳腺癌容易发生转移的器官中高表达. 如果用抗体体内中和CXCR4, 可以导致乳腺癌器官特异性转移潜能的明显下降. 目前有越来越多的研究表明在人类多种肿瘤中存在CXCR4的选择性高表达, 包括卵巢癌[12]、肺癌[13]、黑色素瘤[14]、食道癌[15]等也存在着CXCR4的选择性表达. 在前期的研究工作中, 我们也发现CXCR4在大肠癌和肺癌组织中选择性高表达, 并且与淋巴结受累、复发转移、生存时间密切相关[16-17]. 为进一步研究SDF-1/CXCR4生物轴是否介导大肠癌的侵袭和转移, 我们设计合成针对CXCR4的siRNA, 特异性下调大肠癌细胞CXCR4基因表达, 研究大肠癌细胞体外侵袭的改变及可能机制.
短干扰RNA(short interfering RNA, siRNA)介导的RNA干扰(RNA interfering, RNAi), 为哺乳动物基因功能的研究提供了强大的工具[18]. 由于RNAi的关键效应分子就是siRNA, 因此要产生有效的RNAi效应关键是针靶向基因如何设计及制备siRNA. 本实验中, 我们根据Elbashir原则[19], 设计针对CXCR4 cDNA(GenBank accession no.NM_003467)符合特征的靶序列. 首先在GenBank中获取CXCR4 cDNA的全长序列, 然后利用Ambion公司提供的siRNA Target Finder在线工具搜索符合要求的靶序列, 同时设计无关对照序列.
我们将体外转录合成的CXCR4 siRNA转染大肠癌SW480细胞后48 h, 采用RT-PCR和Western blotting方法分析靶基因CXCR4 mRNA及蛋白质水平的变化. 结果表明CXCR4 siRNA能够有效降低CXCR4基因的表达. 为了研究CXCR4 siRNA转染对大肠癌细胞体外侵袭力的影响, 我们采用Boyden小室体外侵袭实验. 实验结果发现转染CXCR4 siRNA 48 h后, SW480细胞的穿膜细胞数较空白对照组和无关对照组明显减少. 提示CXCR4 siRNA下调CXCR4基因的表达可以降低SW480细胞的体外侵袭力. 这与Liang et al[20]报道研究结果一致, 他们通过siRNA技术下调CXCR4的表达实现抑制乳腺癌细胞体外侵袭力的目的.
癌细胞发生侵袭时需要降解细胞外基质与基底膜, 此过程与MMPs作用密切相关[21-23]. 为探讨MMPs是否参与大肠癌细胞的体外侵袭过程, 我们用Western blotting方法检测了CXCR4 siRNA转染对MT1-MMP表达水平的影响. 发现CXCR4 siRNA转染可以显著下调SW480细胞MT1-MMP的表达, 提示SDF-1/CXCR4生物轴可能通过MT1-MMP来调控大肠癌细胞的体外侵袭过程. MT1-MMP是细胞外基质蛋白降解机制的重要组分[24], 也是MMP-2前体的激活剂, MT1-MMP表达于肺癌、乳腺癌和黑色素瘤等多种实体瘤中, 且其表达常常与肿瘤的侵袭相关[25-28].
SDF-1/CXCR4生物轴不仅参与调控肿瘤细胞的侵袭和转移, 可能还与肿瘤细胞的增殖密切相关[29-30], 为进一步了解CXCR4的表达对大肠癌细胞增殖状况的影响, 我们对各组细胞进行流式细胞术及MTT检测. 实验结果提示在没有配体SDF-1作用的情况下, CXCR4表达下调对SW480细胞的增殖状况无明显影响, 各时相的细胞比例与空白对照组和无关对照组无明显差异. 但经SDF-1作用后, 转染CXCR4 siRNA 的SW480细胞增殖活性明显下降, 提示SDF-1/CXCR4生物轴在大肠癌细胞的增殖过程中可能也起着重要的作用.
总之, 本实验通过合成针对CXCR4的siRNA, 有效抑制大肠癌细胞CXCR4基因的表达, 显著降低大肠癌细胞体外侵袭能力及增殖活性. SDF-1/CXCR4生物轴有望成为预防和治疗大肠癌侵袭和转移的重要靶点之一.
恶性肿瘤侵袭和转移是一个多阶段多步骤的复杂过程, 是恶性肿瘤的本质表型, 也是当前研究的热点, 但其具体机制尚不清楚. 最新研究表明, 趋化性细胞因子及其受体的相互作用可能在癌症的侵袭和转移过程中起着关键作用, 其中最令人瞩目的是趋化性细胞因子受体CXCR4与其配体CXCL12的相互作用与多种癌症侵袭和转移密切相关.
在前期的研究工作中, 本课题组也发现CXCR4在大肠癌和肺癌组织中选择性高表达, 并且与淋巴结受累、复发转移、生存时间密切相关, 提示如果采取分子干预手段阻断SDF-1/CXCR4生物轴功能, 可能抑制肿瘤细胞的侵袭和转移潜能, 为控制和预防恶性肿瘤的侵袭和转移提供靶点.
实验通过体外合成以CXCR4为靶基因的SiRNA, 用脂质体转染大肠癌SW480细胞, 不仅检测癌细胞体外侵袭力的改变, 也检测了对细胞周期和增殖活性的影响, 同时也初步探讨了MT-MMP1在SDF-1/CXCR4生物轴介导的大肠癌侵袭和转移中的可能作用.
研究结果表明, SDF-1/CXCR4生物轴参与大肠癌的侵袭和转移, 具有体外促增殖作用. 抑制大肠癌细胞CXCR4基因的表达, 能够显著降低大肠癌细胞体外侵袭能力及增殖活性. SDF-1/CXCR4生物轴有望成为预防和治疗大肠癌侵袭和转移的重要靶点之一.
1 趋化性细胞因子: 趋化性细胞因子是不同类型细胞分泌的低分子量(8-10 kDa)的细胞因子, 他们对各种白细胞亚类, 如中性粒细胞、单核细胞、淋巴细胞具有趋化和预激活作用.
2 趋化性细胞因子受体: 是一类表达于不同类型细胞上的含有7个跨膜区的G蛋白偶联受体. 趋化性细胞因子通过作用于趋化性细胞因子受体参与多种生理和病理过程, 如细胞的生长、发育、分化、凋亡等, 通过趋化吸引白细胞及调节其效应功能等参与免疫应答过程.
本文研究了趋化性细胞因子受体CXCR4基因沉默对大肠癌细胞体外侵袭及增殖能力的影响, 反映了学科领域的前沿问题, 科学性较强, 有较高的学术价值.
电编: 张敏 编辑:张焕兰
| 1. | Gupta GP, Massague J. Cancer metastasis: building a framework. Cell. 2006;127:679-695. [PubMed] [DOI] |
| 3. | Balkwill F, Mantovani A. Inflammation and cancer: back to Virchow? Lancet. 2001;357:539-545. [PubMed] [DOI] |
| 4. | Inoue K, Slaton JW, Eve BY, Kim SJ, Perrotte P, Balbay MD, Yano S, Bar-Eli M, Radinsky R, Pettaway CA. Interleukin 8 expression regulates tumorigenicity and metastases in androgen-independent prostate cancer. Clin Cancer Res. 2000;6:2104-2119. [PubMed] |
| 5. | Kim CH, Broxmeyer HE. SLC/exodus2/6Ckine/TCA4 induces chemotaxis of hematopoietic progenitor cells: differential activity of ligands of CCR7, CXCR3, or CXCR4 in chemotaxis vs. suppression of progenitor proliferation. J Leukoc Biol. 1999;66:455-461. [PubMed] |
| 6. | Bleul CC, Farzan M, Choe H, Parolin C, Clark-Lewis I, Sodroski J, Springer TA. The lymphocyte chemoattractant SDF-1 is a ligand for LESTR/fusin and blocks HIV-1 entry. Nature. 1996;382:829-833. [PubMed] [DOI] |
| 7. | Lapteva N, Yang AG, Sanders DE, Strube RW, Chen SY. CXCR4 knockdown by small interfering RNA abrogates breast tumor growth in vivo. Cancer Gene Ther. 2005;12:84-89. [PubMed] [DOI] |
| 8. | Harvey JR, Mellor P, Eldaly H, Lennard TW, Kirby JA, Ali S. Inhibition of CXCR4-mediated breast cancer metastasis: a potential role for heparinoids? Clin Cancer Res. 2007;13:1562-1570. [PubMed] [DOI] |
| 9. | Zhang L, Yeger H, Das B, Irwin MS, Baruchel S. Tissue microenvironment modulates CXCR4 expression and tumor metastasis in neuroblastoma. Neoplasia. 2007;9:36-46. [PubMed] [DOI] |
| 10. | Rubie C, Frick VO, Wagner M, Weber C, Kruse B, Kempf K, Konig J, Rau B, Schilling M. Chemokine expression in hepatocellular carcinoma versus colorectal liver metastases. World J Gastroenterol. 2006;12:6627-6633. [PubMed] [DOI] |
| 11. | Muller A, Homey B, Soto H, Ge N, Catron D, Buchanan ME, McClanahan T, Murphy E, Yuan W, Wagner SN. Involvement of chemokine receptors in breast cancer metastasis. Nature. 2001;410:50-56. [PubMed] [DOI] |
| 12. | Jiang YP, Wu XH, Shi B, Wu WX, Yin GR. Expression of chemokine CXCL12 and its receptor CXCR4 in human epithelial ovarian cancer: an independent prognostic factor for tumor progression. Gynecol Oncol. 2006;103:226-233. [PubMed] [DOI] |
| 13. | Su L, Zhang J, Xu H, Wang Y, Chu Y, Liu R, Xiong S. Differential expression of CXCR4 is associated with the metastatic potential of human non-small cell lung cancer cells. Clin Cancer Res. 2005;11:8273-8280. [PubMed] [DOI] |
| 14. | Scala S, Giuliano P, Ascierto PA, Ierano C, Franco R, Napolitano M, Ottaiano A, Lombardi ML, Luongo M, Simeone E. Human melanoma metastases express functional CXCR4. Clin Cancer Res. 2006;12:2427-2433. [PubMed] [DOI] |
| 15. | Koishi K, Yoshikawa R, Tsujimura T, Hashimoto-Tamaoki T, Kojima S, Yanagi H, Yamamura T, Fujiwara Y. Persistent CXCR4 expression after preoperative chemoradiotherapy predicts early recurrence and poor prognosis in esophageal cancer. World J Gastroenterol. 2006;12:7585-7590. [PubMed] [DOI] |
| 17. | 张 孟贤, 于 世英, 夏 曙. 趋化性细胞因子受体CXCR4与肺癌侵袭和转移的关系. 华中科技大学学报(医学版). 2006;35:801-803. |
| 18. | Hammond SM, Caudy AA, Hannon GJ. Post-transcriptional gene silencing by double-stranded RNA. Nat Rev Genet. 2001;2:110-119. [PubMed] [DOI] |
| 19. | Elbashir SM, Harborth J, Lendeckel W, Yalcin A, Weber K, Tuschl T. Duplexes of 21-nucleotide RNAs mediate RNA interference in cultured mammalian cells. Nature. 2001;411:494-498. [PubMed] [DOI] |
| 20. | Liang Z, Yoon Y, Votaw J, Goodman MM, Williams L, Shim H. Silencing of CXCR4 blocks breast cancer metastasis. Cancer Res. 2005;65:967-971. [PubMed] |
| 21. | Jodele S, Blavier L, Yoon JM, DeClerck YA. Modify-ing the soil to affect the seed: role of stromal-derived matrix metalloproteinases in cancer progression. Cancer Metastasis Rev. 2006;25:35-43. [PubMed] [DOI] |
| 22. | Deryugina EI, Quigley JP. Matrix metalloproteinases and tumor metastasis. Cancer Metastasis Rev. 2006;25:9-34. [PubMed] [DOI] |
| 23. | Wagenaar-Miller RA, Gorden L, Matrisian LM. Matrix metalloproteinases in colorectal cancer: is it worth talking about? Cancer Metastasis Rev. 2004;23:119-135. [PubMed] [DOI] |
| 24. | Seiki M. The cell surface: the stage for matrix metalloproteinase regulation of migration. Curr Opin Cell Biol. 2002;14:624-632. [PubMed] [DOI] |
| 25. | Seftor RE, Seftor EA, Koshikawa N, Meltzer PS, Gardner LM, Bilban M, Stetler-Stevenson WG, Quaranta V, Hendrix MJ. Cooperative interactions of laminin 5 gamma2 chain, matrix metalloproteinase-2, and membrane type-1-matrix/metalloproteinase are required for mimicry of embryonic vasculogenesis by aggressive melanoma. Cancer Res. 2001;61:6322-6327. [PubMed] |
| 26. | Sato H, Takino T, Miyamori H. Roles of membrane-type matrix metalloproteinase-1 in tumor invasion and metastasis. Cancer Sci. 2005;96:212-217. [PubMed] [DOI] |
| 27. | Seiki M. Membrane-type 1 matrix metalloproteinase: a key enzyme for tumor invasion. Cancer Lett. 2003;194:1-11. [PubMed] [DOI] |
| 28. | Sabeh F, Ota I, Holmbeck K, Birkedal-Hansen H, Soloway P, Balbin M, Lopez-Otin C, Shapiro S, Inada M, Krane S. Tumor cell traffic through the extracellular matrix is controlled by the membrane-anchored collagenase MT1-MMP. J Cell Biol. 2004;167:769-781. [PubMed] [DOI] |
| 29. | Scotton CJ, Wilson JL, Scott K, Stamp G, Wilbanks GD, Fricker S, Bridger G, Balkwill FR. Multiple actions of the chemokine CXCL12 on epithelial tumor cells in human ovarian cancer. Cancer Res. 2002;62:5930-5938. [PubMed] |
| 30. | Dewan MZ, Ahmed S, Iwasaki Y, Ohba K, Toi M, Yamamoto N. Stromal cell-derived factor-1 and CXCR4 receptor interaction in tumor growth and metastasis of breast cancer. Biomed Pharmacother. 2006;60:273-276. [PubMed] [DOI] |