修回日期: 2007-01-20
接受日期: 2007-01-31
在线出版日期: 2007-04-08
目的: 观察复合乳酸菌对早期肠内营养(EEN)和肠外营养(PN)治疗的重症急性胰腺炎(SAP)大鼠肠屏障功能的影响.
方法: ♂ SD大鼠胰腺被膜下均匀注射38 g/L牛磺胆酸钠制作SAP模型, 96只大鼠随机分为假手术早期肠内营养治疗组(Sham-EEN)、早期肠内营养治疗组(EEN)、早期肠内营养联合复合乳酸菌治疗组(EEN+Lac); 假手术肠外营养治疗组(Sham-PN)、肠外营养治疗组(PN)、肠外营养联合复合乳酸菌组(PN+Lac), 每组16只, 分别于第4和7天随机取8只大鼠, 预处理后取材, 检测肝和肠系膜淋巴结(MLN)肠道菌群易位(BT)、血浆内毒素(ET)、肠转运指数, TUNEL法检测肠上皮细胞凋亡、BCA法测定小肠黏膜蛋白含量、ELISA法测定小肠黏液SIgA含量.
结果: PN组大鼠的BT率高于EEN组和PN+Lac组(14/16 vs 9/16, 10/16, 均P<0.05); 4 d EEN组高于EEN+Lac组(12/16 vs 9/16, P = 0.026). PN组血浆ET高于EEN组(276.83±30.81 EU/L vs 138.52±22.56 EU/L, P<0.05); 不加用Lac组高于加用Lac组(均P<0.05). PN+Lac组肠转运系数高于PN组(0.70±0.08 vs 0.59±0.05, P<0.01). PN组小肠上皮细胞AI高于EEN组和PN+Lac组(22.67%±4.97% vs 15.31%±4.18%, 18.40%±2.01%, P<0.01). 加用Lac组空肠黏膜蛋白含量高于不加用Lac组(均P<0.05); EEN+Lac组高于PN+Lac组(56.91±3.73 mg/g vs 44.69±2.99 mg/g, P<0.01). EEN+Lac组小肠黏液SIgA含量高于EEN组和PN+Lac组(82.17±6.02 μg/g vs 69.26±5.66 μg/g, 59.87±5.54 μg/g, P<0.05及P<0.01).
结论: 加用复合乳酸菌可改善EEN和PN治疗的SAP大鼠肠屏障功能, 其中EEN+Lac的作用最为显著, EEN在维护SAP大鼠肠屏障方面的作用优于PN.
引文著录: 陈凌云, 蔡东联, 林健, 钟燕, 耿珊珊, 韩婷. 复合乳酸菌对不同营养治疗途径的重症急性胰腺炎大鼠肠屏障功能的影响. 世界华人消化杂志 2007; 15(10): 1073-1081
Revised: January 20, 2007
Accepted: January 31, 2007
Published online: April 8, 2007
AIM: To investigate the influence of different nutritional support with compound lactobacilli on the intestinal barrier function in rats with severe acute pancreatitis (SAP) and its mechanism.
METHODS: SAP model was established in male Sprague Dawley rats via injection of l mL of 38 g/L sodium taurocholate beneath the pancreatic capsule. A total of 96 rats were randomly divided into 6 groups (n = 16): sham-operation with early enteral nutrition support (Sham-EEN), ENN group, EEN with compound lactobacilli (EEN + Lac) group, sham-operation with parenteral nutrition support (Sham-PN), PN group and PN with compound lactobacilli (PN + Lac) group. Half of rats in each group were killed on the 4th and 7th day respectively to determine the bacterial translocation (BT) in live and mesenteric lymph node (MLN), endotoxin (ET) in plasma, intestinal transit index, epithelial cell apoptosis in intestinal barrier (by TUNEL), protein content in small intestinal mucosa (by bicinchoninic acid), and SIgA content in small intestinal mucus (by enzyme-linked immunosorbent assay).
RESULTS: The rate of BT in PN group was higher than that in EEN and PN + Lac group (14/16 vs 9/16, 10/16, both P < 0.05), and there was also a significant difference between EEN and EEN + Lac group on the 4th day (12/16 vs 9/16, P = 0.026). As compared with that in EEN group, the level of ET in plasma was higher in PN group (276.83 ± 30.81 EU/L vs 138.52 ± 22.56 EU/L, P < 0.05), and it was also higher in groups without Lac than that in the groups with Lac (all P < 0.05). Intestinal transit index was significantly increased in PN + Lac group in comparison with that in PN group (0.70 ± 0.08 vs 0.59 ± 0.05, P < 0.01). As compared with that in EEN group and PN + Lac group, intestinal epithelial apoptosis was higher in PN group (22.67% ± 4.97% vs 15.31% ± 4.18%, 18.40% ± 2.01%, P < 0.01). The protein content in small intestinal mucosa was higher in groups with Lac than that in the groups without Lac (all P < 0.05), and it was also increased significantly in PN + Lac group as compared with that in EEN + Lac group (56.91 ± 3.73 mg/g vs 44.69 ± 2.99 mg/g, P < 0.01). In comparison with that in EEN and PN + Lac group, SIgA content in small intestinal mucus was significantly higher in EEN + Lac group (82.17 ± 6.02 μg/g vs 69.26 ± 5.66 μg/g, 59.87 ± 5.54 μg/g, P < 0.05 and P < 0.01).
CONCLUSION: EEN and PN with compound lactobacilli can dramatically benefit the intestinal barrier function SAP rats, and the former is superior to the latter.
- Citation: Chen LY, Cai DL, Lin J, Zhong Y, Geng SS, Han T. Influence of different nutritional support with compound lactobacilli on intestinal barrier function of rats with severe acute pancreatitis. Shijie Huaren Xiaohua Zazhi 2007; 15(10): 1073-1081
- URL: https://www.wjgnet.com/1009-3079/full/v15/i10/1073.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i10.1073
重症急性胰腺炎(severe acute pancreatitis, SAP)是临床常见危重症之一, 死亡率高达20%-30%; 起病急剧, 表现复杂, 病情凶险, 进展迅猛, 近几年还有发病率上升的趋势. 疾病的发展中, 肠屏障功能障碍可导致细菌和内毒素易位[1]以及继发的全身炎症反应综合征(systemic inflammatory response syndrome, SIRS)和多器官功能障碍综合征(multiple organ dysfunctions syndrome, MODS)[2]等严重并发症, 是SAP高死亡率的重要原因. 近年来, 采用早期肠内营养和免疫微生态制剂[3]包括益生菌(probiotics)、益生元(prebiotics)和合生元(synbiotics)[4]等用于很多危重疾病的肠屏障功能保护治疗中. 本研究通过使用复合乳酸菌, 来考察其对不同营养治疗方式的SAP大鼠肠屏障的作用, 并初步探讨其机制, 为临床SAP微生态营养治疗提供理论基础.
♂SD大鼠(体质量200±10 g), 由第二军医大学实验动物中心提供, 清洁级; 牛磺胆酸钠(Sigma公司), 纯度95%; 复合乳酸菌(商品名: 聚克, 江苏泰州美通制药有限公司生产, 日本Greencross公司菌种), 由乳酸乳杆菌、嗜酸乳杆菌、乳酸链球菌及多种具有抑菌活性的细菌素与灭菌淀粉混合而成的微生态制剂, 含活菌数超过109 CFU/g, 每粒0.33 g; EN制剂主要原料: 95%水解乳清蛋白(GRANDE公司, 美国); 中链脂肪酸(上海食疗公司); 混合维生素、矿物质(军事医学科学院营养研究所). 碳水化合物、蛋白质、脂肪供能量比为49:17:34. PN制剂由PN制剂500 g/L的葡萄糖、85 g/L的复方氨基酸和200 g/L的脂肪乳剂组成基本营养成分, 加用安达美和水乐维他, 胰岛素(IU): 糖(g) = 1:3.5. PN和EN营养液均每100 mL提供总能量100 kcal, 热氮比为124.7:1, 碳水化合物、蛋白质、脂肪供能量比为55:17:28. 内毒素鲎试剂盒(上海市医学化验所); TUNEL原位检测试剂盒(Roche公司, 德国); 伊文思蓝(国药集团上海化学制剂有限公司); BCA蛋白质定量试剂盒(KC-430, 上海康成生物制剂有限公司); sIgA双抗体夹心试剂盒(Bethy公司, 美国); 山羊抗大鼠occludin抗体和ABC试剂盒抗山羊IgG(Santa Crus公司, 美国); 静脉推注泵(Baxter, Flo-Gard 6201, 英国); 彩色图文计算机图像处理系统: (HPIAS1000, 远东蔡司公司).
1.2.1 动物分组: SD大鼠96只, 适应性喂养1 wk, 随机分为假手术早期肠内营养治疗组(Sham-operated early enternal nutrition group, Sham-EEN)、SAP早期肠内营养治疗组(EEN)、早期肠内营养加复合乳酸菌治疗组(EEN with complex lactobacilli group, EEN+Lac); 假手术肠外营养治疗组(Sham-operated parenteral group, Sham-PN)、SAP肠外营养治疗组(PN)、SAP肠外营养加复合乳酸菌治疗组(PN+Lac), 每组16只, 分别于第4天和7天随机取8只预处理后处死, 收集血、小肠、小肠黏液及小肠黏膜预处理后储存于液氮中待分析.
1.2.2 动物模型构建: (1)SAP大鼠模型的建立[5]: 实验前大鼠禁食不禁水12 h以上, 严格消毒无菌下行胰被膜下均匀注入38 g/L牛磺胆酸钠1 mL; Sham组注射生理盐水1 mL. 术后置于25 ℃的干洁环境中, 自由饮水. (2)EN组构建胃空肠通道, 经胃幽门区, 置入外径1.5 mm无菌硅胶管, 远端位于十二指肠屈氏韧带以下5 cm左右, 在胃部荷包缝合固定, 经皮下隧道将硅胶管自颈部引出, 通过弹簧管道, 用自制背扣固定于颈部皮肤. (3)PN组构建颈外静脉通道, 经颈外静脉置入外径1.2 mm无菌软硅管, 由颈背部皮下隧道引出固定. (4)加用复合乳酸菌组, 同时构建胃空肠和颈外静脉通道.
1.2.3 营养支持方案: EN使用间隙推注法(每1.5 h推注5 mL, 每次10 min), 动物术后清醒6 h后给予2 mL生理盐水冲洗肠管, 8 h时起肠内推注EN制剂, 逐渐增加浓度至24 h时达总量50 mL(每天250 kcal/kg)并维持; PN给予方式: 微量输液泵24 h均匀输入, 术后于平衡液, 8 h始予以PN, 速度由1 mL/h逐渐增加至, 至24 h内至达50 mL(每天250 kcal/kg)并维持. 加用复合乳酸菌组(2粒/d), 将胶囊破囊后立即用25 ℃无菌生理盐水2 mL调匀, 快速推注后用生理盐水冲洗硅胶管, 并夹闭管口.
1.2.4 标本采集和处理: 第4, 7天, 处死大鼠前30 min, 给大鼠灌胃5%伊文思蓝液1 mL; 眼球取血, 将血液置于抗凝管中, 静置30 min后, 2500 r/min离心15 min, 取血浆, -80 ℃保存至分析. (1)肠系膜淋巴结和肝细菌培养: 处死大鼠后, 无菌条件下取肠系膜淋巴结和肝少许, 称质量后匀浆, 37 ℃增菌培养24 h后, 进行细菌学鉴定. (2)肠转运功能: 测量幽门至蓝染距离与整个小肠长度(幽门至回盲部)比, 用百分数表示为肠转运系数. (3) 血浆内毒素(endotoxin, ET)检测: 鲎试验法[6]; (4)TUNEL法检测小肠上皮细胞凋亡: 屈氏韧带下10 cm处剪空肠1 cm左右, 60 mL/L的甲醛固定, 常规石蜡切片, 操作根据试剂盒进行. 光镜下计数: 以细胞核棕黄色染色为阳性凋亡细胞, 计数每100个上皮细胞中凋亡细胞个数, 即凋亡指数(apoptotic index, AI), 每张切片各任选3个视野, 取其平均值. (5)小肠黏液SIgA含量(ELISA法)和黏膜蛋白质含量(BCA法)检测: 距Treitz韧带15 cm剪取空肠约10 cm, 再分成3-4段, 纵行剖开, 轻轻刮除肠腔内粪便, 再用玻片刮取肠黏液, 收集于EP管, 加入l mL 0.01 mol/L PBS, 充分溶解, 3000 r/min离心10 min, 取上清, -80 ℃冻存待检; 刮取肠黏膜组织迅速称质量后, 置人盛有1.5 mL预冷的0.01 mol/L TrisHCl(pH7.2)缓冲液的离心管中, 迅速匀浆, 2000 r/min×5 min离心, 取上清液进行检测.
统计学处理 结果用均数±标准差(mean±SD)表示, 进行单因素方差分析; 必要时使用Scheff法进行各组间的两两比较, 细菌易位采用确切概率法. 数据采用STATA9.0软件进行统计分析, P<0.05有统计学意义.
Sham组肝和淋巴结偶有培养出细菌, SAP模型组大鼠的BT率高于Sham组(均P<0.01); PN组大鼠BT率高于EEN组(4 d组P = 0.037, 7 d组P = 0.025); PN+Lac组BT率低于PN组(4 d组P = 0.038, 7 d组P = 0.045), 4 d EN组高于EN+Lac组(P = 0.026), 7 d组间比较无差异(P = 1.000)(表1). 检出的菌经鉴定, 主要是大肠杆菌、肠球菌、阴沟肠杆菌、摩根摩根菌, 偶见金黄色葡萄链球菌和肺炎克雷伯杆菌等.
SAP模型组血浆ET均高于Sham组(均P<0.01); PN组高于EEN组(均P<0.001); 不加用Lac组高于加用Lac组(EN 4, 7 d组P分别0.001和0.047; PN组4, 7 d组P分别0.009和0.003); SAP模型组4, 7 d组组间比较(EN组t = 8.32, P<0.001; EN+Lac组t = 5.57, P<0.001; PN组t = 6.46, P<0.01; PN+Lac组, t = 18.18, P<0.001)(表2).
与Sham组相比, 4 d组除了EEN+ Lac组(P = 0.138), 其他组SAP大鼠的肠转运系数降低(P<0.01); PN+Lac组高于PN组(4 d, P = 0.037; 7 d, P = 0.016); PN 7 d和4 d两组比较有显著统计学差异(均P<0.05)(表3).
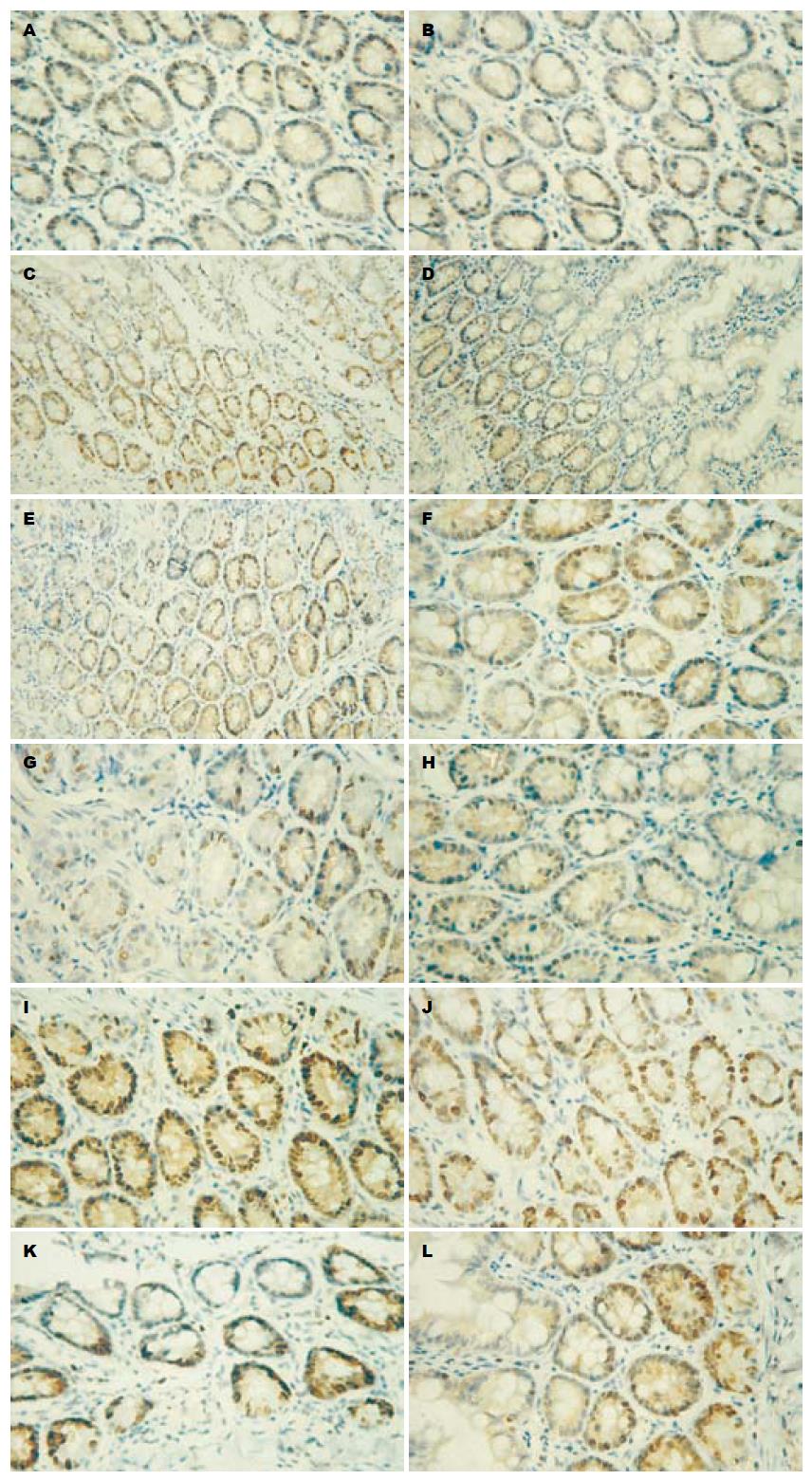
细胞核中出现棕黄色颗粒, 即为凋亡细胞, 部分凋亡细胞也有因核DNA碎片的逸出呈核外阳性着色(图1). 各SAP模型组的肠上皮细胞AI均高于Sham组(均P<0.001); PN组肠上皮细胞AI高于EEN组(4 d P = 0.006; 7 d P = 0.013); 7 d PN组肠上皮细胞AI高于PN+Lac组(P<0.01); PN+Lac组7 d与4 d比较有统计学差异(t = 2.33, P = 0.042), 其他组7 d和4 d比较没有统计学差异(均P>0.05)(表4).
SAP模型组除了EEN+Lac 7 d组(P = 0.142)外, 均低于Sham组(均P<0.001); 加用Lac组高于单独EN和PN组(均P<0.05), EEN(+Lac)组高于PN(+Lac)组(均P<0.001, 除EEN vs PN+Lac, 4 d P = 0.013; 7 d P = 0.013); 各组4 d和7 d组比较无统计学差异(除EEN+Lac组4 d低于7 d, t = 4.70, P<0.05). 结果见表5.
SAP模型组除EN+Lac 7 d组(P = 0.142)外小肠黏液SIgA低于Sham组(均P<0.001), EEN+Lac组高于EEN组(均P<0.001), EEN(+Lac)组高于PN组(均P<0.001); 各SAP模型4 d组小肠黏液SIgA含量低于7 d组(EN组t = 5.74, P<0.001; EN+Lac组t = 5.87, P<0.001; PN组t = 2.87, P = 0.017; PN+Lac组, t = 5.91, P<0.001)(表6).
SAP患者继发感染发生率高达40%-70%, 且死亡者中有80%与继发感染有关. 肠管除了是一个消化吸收的场所外, 还是人体最大的免疫器官, 是发生MODS的原动力[7]. 肠屏障功能的损害引起的BT和ET是SAP继发感染的主要原因, 所以对于SAP患者的治疗中改善其肠屏障功能的治疗尤为重要.
Schrezenmeir et al[8]认为益生菌是指含有足够指数的特定的活菌的微生物制剂, 通过改变宿主的微生态, 达到有益于宿主健康的目的. 也有认为益生菌还应包括活菌的产物和死菌. 益生菌除了直接补充机体的正常菌群或选择性刺激正常菌群的生长繁殖, 抑制外源性致病菌和内源性条件致病菌的过度生长和繁殖, 防止内源性感染的发生和发展[9]外, 还能通过促进肠黏膜的增生和抑制肠上皮细胞的凋亡[10], 保护肠黏膜的紧密连接蛋白的作用, 降低肠黏膜的通透性等作用来维护肠黏膜屏障的完整性; 另外还能够增强机体的特异性免疫和非特异性免疫的功能[11]. 所以常用于很多危重疾病的肠屏障功能保护治疗. 急性胰腺炎患者表现为以能量消耗、糖异生、高脂血症[12]、蛋白降解[13]和尿素氮增多为特征的高代谢状态; 营养治疗在SAP治疗中的地位越来越重要, 营养治疗可改善胰腺炎的自然病程, 降低并发症和死亡率[14], 尤其是EN, 在SAP的治疗中很多方面优于PN[15-19].
本研究通过添加复合乳酸菌于不同途径的营养治疗方式, 经综合指标的考察来评判其对SAP大鼠肠屏障功能的影响及其机制. 结果表明: (1)对BT的影响: 本研究对各组MLN和肝脏进行细菌培养的结果显示, SAP模型组BT发生率增高; EEN组BT发生率要低于PN组, 提示EEN相对于PN而言能够较好的缓解肠BT的发生, 这与大多数学者的研究结论一致. 加用Lac组跟不加用组比较(除EN+Lac 7 d组外)BT较少, 提示复合乳酸菌能改善SAP大鼠EN和PN尤其是长期PN治疗大鼠的BT状态, 可能与提供直接的有益菌, 竞争性拮抗有害菌定植肠壁, 抑制致病菌的繁殖有关; 乳酸杆菌产生的菌素可以特异性的抑制G+菌, 产生的组织酸能够对G-菌抑制作用更明显[20]; 乳酸杆菌本身还能抑制病原体复制的作用; 而且益生菌的联合使用, 可以增加其益生菌自身的黏附效果[21]. EN+Lac组和EN 7 d组BT比较无统计学差异, 较考虑可能跟标本数少有关或EN治疗各组疾病恢复较好有关. 从培养的细菌来看, 主要是大肠杆菌、肠球菌、阴沟肠杆菌、摩根菌, 偶见金黄色葡萄链球菌和肺炎克雷伯杆菌, 这可能是跟这些细菌对肠上皮表面的黏液有更强大的黏附性和穿透性[22]有关. (2)血浆内毒素水平: 有研究认为内毒素血症可能与SAP胰外器官的损害或MODS的发生有紧密的联系[23]. 本实验研究结果显示, 各SAP组的血浆内毒素浓度均高于假手术组, 说明SAP大鼠存在内毒素血症; PN组显著高于EEN组, 提示在缓解SAP大鼠内毒素血症方面, EEN优于PN; 加入复合乳酸菌的组中, 这种缓解的效果更为明显; 益生菌可以通过抑制G-菌的繁殖增生, 减少内毒素的产生. SAP 7 d组与4 d组比较, 7 d组内毒素显著降低, 但是PN组还是维持在较高的水平, 提示随着时间的推移, SAP得到一定的恢复, 肠黏膜屏障得以慢慢修复, 但是长时间的PN相对于EEN而言, 肠黏膜屏障的通透性是较高的. (3)肠转运系数: SAP时肠运动功能低下可能跟BT和胰腺感染有密切的关系[24]. 本研究中, 与Sham组相比, 4 d组除了EEN+Lac组, 其他组SAP大鼠的肠转运系数降低, 提示SAP大鼠存在肠转运功能的障碍; PN+Lac 4 d组, 较PN组肠转运系数高, 而在EEN组未见到明显的改变, 提示复合乳酸菌在SAP大鼠进行PN营养治疗的时候, 能够在早期改善其受损的肠转运功能; EEN与PN比较, 没有统计学差异(P = 0.989), 考虑为SAP时尽管肠运转功能受损, 但残存的肠功能可能在我们给大鼠伊文思蓝灌胃时, 对空腹很久的PN组刺激产生的胃肠蠕动较一直EN治疗的大鼠强些. 7 d组EEN和EEN+Lac组之间比较没有统计学差异, 提示可能EN营养成分对于肠转运功能的影响不是主要的, 关键是EN这种喂养方式; PN组间、PN与EEN组间比较也不具统计学差异, 可能跟SAP大鼠病情恢复, 肠功能改善有关; 另外禁食长久的PN组, 加上稍有恢复的肠功能使得其对灌胃的示踪剂的蠕动会较EN组强些. 不过尽管这些组间统计学上没有差异, 但是在数据上, 我们可以看到EEN组大鼠肠转运功能有优于PN组的趋势. (4)对肠上皮细胞的凋亡的影响: 凋亡对机体来说虽然是保护机制, 但一旦各种刺激肠上皮细胞凋亡过度, 修复和再生受阻, 肠黏膜屏障就会发生障碍[1]. 肠上皮细胞凋亡参与了SAP肠黏膜屏障功能障碍的病理过程[25]. 本研究结果显示: SAP造模的大鼠肠上皮细胞的凋亡均较Sham组大鼠要高, 提示SAP大鼠肠上皮细胞的凋亡是增加的, 这跟既往很多的研究结果相似. PN治疗组的肠上皮细胞凋亡情况要比EN治疗组明显, 提示EN在改善及缓解肠上皮细胞凋亡方面的作用优于PN; 加用复合乳酸菌的组别尽管只是在7 d PN+Lac组对于肠上皮细胞凋亡的影响优于PN组, 但是其他组也能看到肠上皮细胞凋亡改善的趋势, 提示复合乳酸菌在缓解SAP肠上皮细胞的凋亡作用上, PN治疗组效用较明显. 这可能跟PN治疗组, SAP的肠转运慢, 微生态的紊乱比较明显, 一旦有沙门杆菌或侵入性大肠杆菌侵入肠上皮细胞, 细胞就会发生凋亡[26]; 另外大量炎性介质的释放, 对黏膜造成损伤, TNF-α, IL-2等都可以增加体内外细胞的凋亡[27-28]. 加入复合乳酸菌后, 可以改善这些状况, 从而缓解SAP长期PN治疗肠上皮凋亡过度的情况. (5)对肠黏膜蛋白质含量的影响: 肠上皮黏膜蛋白质含量可以反应肠黏膜的营养状况. 本研究结果显示, 除了SAP模型中EEN+Lac 7 d组, 其他大鼠单位重量黏膜中的蛋白质含量均低于假手术组, 提示SAP大鼠存在黏膜损伤严重或黏膜营养供应不足. EEN比PN能更好的改善黏膜蛋白合成情况, 提示SAP大鼠EEN较PN治疗能够改善肠黏膜的营养状况, 促进肠黏膜蛋白的合成或促进黏膜的修复; 这可能因为肠黏膜营养物质的70%直接来源于肠腔内营养物[29], 所以EN成分可作为蛋白质合成原料物质, 同时也为快速生长和分化的肠黏膜上皮细胞提供足够的能量底物, 促进其更新和修复; 而且通过EN的给予, 可以维持肠的蠕动, 可以排出SAP大鼠肠内的有害菌, 也减少肠黏膜的损害. 添加复合乳酸菌的EEN或PN较未添加组的空肠上皮黏膜蛋白含量高, 可能因为加用复合乳酸菌, 可以直接减少其他有害菌对上皮细胞的损伤作用, 而且通过改善SAP大鼠局部肠黏膜的内环境, 促进上皮细胞的再生、修复. 7 d Sham-EEN组跟Sham-PN比较, 尽管未有统计学的差异, 但是发现长期PN对于正常的大鼠肠黏膜的蛋白合成有减少的趋势; SAP模型组7 d组的数值要比4 d组大些, 可能跟病情的减缓, 黏膜上皮修复增生有关. (6)对肠内局部免疫功能的影响: 现代研究表明肠管是机体最大的免疫器官, 其中起核心作用的是分泌性IgA(SIgA), 增加SIgA分泌也是改善SAP肠道和全身炎症状况的重要环节. 有研究发现长期PN大鼠的Peyer's淋巴结、黏膜固有层和上皮内淋巴细胞计数要显著降低, SIgA水平显著下降, 而给予EN组则会使细胞的计数和SIgA水平保持稳定[30]. 本研究结果显示, SAP模型大鼠中, 除了EEN+Lac 7 d组外其他各组的黏膜SIgA都有些降低, 提示SAP大鼠存肠局部免疫功能的下降, 而EEN+Lac可以明显提高肠管的免疫能力. EEN组在增加黏膜SIgA方面的效用要强于PN组. 加用复合乳酸菌的组跟不加的组别比较能够增加黏膜SIgA的含量. 考虑EEN可能通过提供肠黏膜细胞营养底物, 改善肠的局部和机体全身的内环境比如炎症反应状态, 血液循环状态等, 还能促进肠的蠕动, 减少有害菌的繁殖机会等来减少Peyer's淋巴结B的损伤, 促进细胞的分化增殖, 来增加黏膜SIgA的分泌. 另外肠黏液SIgA的合成、分泌有赖于健康稳定的肠菌群[30], 所以SAP大鼠加用复合乳酸菌后, 可以通过改善肠微生态环境紊乱的状况, 减少有害菌的定植和繁殖; 还可以增加肠对营养成分的利用; 可以改善SAP大鼠全身和肠局部的内环境状况, 增加SIgA分泌.
总之, 本研究系统全面的研究了加用复合乳酸菌可以改善不同营养治疗途径的SAP大鼠肠黏膜屏障的多种功能以及部分机制探索, 为临床SAP的治疗提供了很好的理论基础. 但临床SAP的治疗是多种措施的综合治疗方式, EEN在临床上治疗的时期和制剂尚有很多争议, 益生菌的治疗也有很多待解决的问题, 比如菌种的选择、用量、给予方式、给予时期以及与抗生素合用的耐药性问题等. 本研究使用的复合乳酸菌是由三种乳酸菌构成, 同时含有多种具有抑菌活性的细菌素与灭菌淀粉混合而成的微生态制剂, 对多种抗菌药物具有耐药性, 可同时服用; 其用于SAP的临床治疗有待深入的规范化的临床研究.
重症急性胰腺炎(SAP)中因肠屏障功能障碍, 引起肠源性内毒素合细菌细菌易位引起的全身炎症反应综合征(SIRS)和多器官功能障碍综合征(MODS)是患者死亡的主要原因, 临床缺乏有效的治疗手段. 近年来, 添加免疫微生态制剂的肠内营养治疗备受关注, 其在SAP治疗中的机制尚不明确. 本研究通过考察复合乳酸菌对不同营养治疗方式的SAP大鼠肠屏障的作用, 并初步探讨其机制, 为临床SAP微生态营养治疗提供理论基础.
本文研究了复合乳酸菌对不同营养治疗途径的重症急性胰腺炎大鼠肠屏障功能的影响, 该研究技术路线合理可靠, 设计严谨, 实验证据充足, 数据通过统计学处理, 科学性较强, 有较高价值.
编辑: 张焕兰 电编:张敏
| 1. | Yasuda T, Takeyama Y, Ueda T, Shinzeki M, Sawa H, Nakajima T, Kuroda Y. Breakdown of intestinal mucosa via accelerated apoptosis increases intestinal permeability in experimental severe acute pancreatitis. J Surg Res. 2006;135:18-26. [PubMed] [DOI] |
| 2. | Shi C, Zhao X, Lagergren A, Sigvardsson M, Wang X, Andersson R. Immune status and inflammatory response differ locally and systemically in severe acute pancreatitis. Scand J Gastroenterol. 2006;41:472-480. [PubMed] [DOI] |
| 3. | Xu GF, Lu Z, Gao J, Li ZS, Gong YF. Effect of ecoimmunonutrition supports on maintenance of integrity of intestinal mucosal barrier in severe acute pancreatitis in dogs. Chin Med J (Engl). 2006;119:656-661. [PubMed] |
| 4. | Oláh A, Belágyi T, Issekutz A, Olgyai G. Combination of early nasojejunal feeding with modern synbiotic therapy in the treatment of severe acute pancreatitis (prospective, randomized, double-blind study). Magy Seb. 2005;58:173-178. [PubMed] |
| 7. | Deitch EA, Xu D, Kaise VL. Role of the gut in the development of injury- and shock induced SIRS and MODS: the gut-lymph hypothesis, a review. Front Biosci. 2006;11:520-528. [PubMed] [DOI] |
| 8. | Schrezenmeir J, de Vrese M. Probiotics, prebiotics, and synbiotics--approaching a definition. Am J Clin Nutr. 2001;73:361S-364S. [PubMed] |
| 9. | Parkes GC. An overview of probiotics and prebiotics. Nurs Stand. 2007;21:43-47. [PubMed] [DOI] |
| 10. | Yan F, Polk DB. Probiotic bacterium prevents cytokine-induced apoptosis in intestinal epithelial cells. J Biol Chem. 2002;277:50959-50965. [PubMed] [DOI] |
| 11. | Madsen K. Probiotics and the immune response. J Clin Gastroenterol. 2006;40:232-234. [PubMed] [DOI] |
| 12. | Modzelewski B, Janiak A, Hołlyński J. Hyperlipoproteinemia in necrotizing pancreatitis. Pol Merkur Lekarski. 2005;18:415-417. [PubMed] |
| 13. | Lasztity N, Biro L, Nemeth E, Pap A, Antal M. Protein status in pancreatitis--transthyretin is a sensitive biomarker of malnutrition in acute and chronic pancreatitis. Clin Chem Lab Med. 2002;40:1320-1324. [PubMed] [DOI] |
| 14. | Avgerinos C, Delis S, Rizos S, Dervenis C. Nutritional support in acute pancreatitis. Dig Dis. 2003;21:214-219. [PubMed] [DOI] |
| 15. | Buchman AL. Complications of long-term home total parenteral nutrition: their identification, prevention and treatment. Dig Dis Sci. 2001;46:1-18. [PubMed] [DOI] |
| 16. | Dahl PE, Karlsen BH, Kristiansen KA, Kjaeve JC. Prevention of catheter thrombosis increases survival, but does not modify lung injury in rats receiving long-term parenteral nutrition. Scand J Clin Lab Invest. 2004;64:737-744. [PubMed] [DOI] |
| 17. | McClave SA, Chang WK, Dhaliwal R, Heyland DK. Nutrition support in acute pancreatitis: a systematic review of the literature. JPEN J Parenter Enteral Nutr. 2006;30:143-156. [PubMed] [DOI] |
| 18. | Gupta R, Patel K, Calder PC, Yaqoob P, Primrose JN, Johnson CD. A randomised clinical trial to assess the effect of total enteral and total parenteral nutritional support on metabolic, inflammatory and oxidative markers in patients with predicted severe acute pancreatitis (APACHE II > or =6). Pancreatology. 2003;3:406-413. [PubMed] [DOI] |
| 19. | Petrov MS, Kukosh MV, Emelyanov NV. A randomized controlled trial of enteral versus parenteral feeding in patients with predicted severe acute pancreatitis shows a significant reduction in mortality and in infected pancreatic complications with total enteral nutrition. Dig Surg. 2006;23:336-344; discussion 344-345. [PubMed] [DOI] |
| 20. | Alakomi HL, Skyttä E, Saarela M, Mattila-Sandholm T, Latva-Kala K, Helander IM. Lactic acid permeabilizes gram-negative bacteria by disrupting the outer membrane. Appl Environ Microbiol. 2000;66:2001-2005. [PubMed] [DOI] |
| 21. | Alvarez-Olmos MI, Oberhelman RA. Probiotic agents and infectious diseases: a modern perspective on a traditional therapy. Clin Infect Dis. 2001;32:1567-1576. [PubMed] [DOI] |
| 22. | Ljungdahl M, Lundholm M, Katouli M, Rasmussen I, Engstrand L, Haglund U. Bacterial translocation in experimental shock is dependent on the strains in the intestinal flora. Scand J Gastroenterol. 2000;35:389-397. [PubMed] [DOI] |
| 23. | Windsor JA, Fearon KC, Ross JA, Barclay GR, Smyth E, Poxton I, Garden OJ, Carter DC. Role of serum endotoxin and antiendotoxin core antibody levels in predicting the development of multiple organ failure in acute pancreatitis. Br J Surg. 1993;80:1042-1046. [PubMed] [DOI] |
| 24. | Rabeneck L, Feinstein AR, Horwitz RI, Wells CK. A new clinical prognostic staging system for acute pancreatitis. Am J Med. 1993;95:61-70. [PubMed] [DOI] |
| 25. | Takeyama Y. Significance of apoptotic cell death in systemic complications with severe acute pancreatitis. J Gastroenterol. 2005;40:1-10. [PubMed] [DOI] |
| 26. | Kim JM, Eckmann L, Savidge TC, Lowe DC, Witthöft T, Kagnoff MF. Apoptosis of human intestinal epithelial cells after bacterial invasion. J Clin Invest. 1998;102:1815-1823. [PubMed] [DOI] |
| 27. | Yang RC, Jao HC, Huang LJ, Wang SJ, Hsu C. The essential role of PKCalpha in the protective effect of heat-shock pretreatment on TNF-alpha-induced apoptosis in hepatic epithelial cell line. Exp Cell Res. 2004;296:276-284. [PubMed] [DOI] |
| 28. | Lesur O, Brisebois M, Thibodeau A, Chagnon F, Lane D, Füllöp T. Role of IFN-γamma and IL-2 in rat lung epithelial cell migration and apoptosis after oxidant injury. Am J Physiol Lung Cell Mol Physiol. 2004;286:L4-L14. [PubMed] [DOI] |
| 29. | Sahin M, Ozer S, Vatansev C, Aköz M, Vatansev H, Aksoy F, Dilsiz A, Yilmaz O, Karademir M, Aktan M. The impact of oral feeding on the severity of acute pancreatitis. Am J Surg. 1999;178:394-398. [PubMed] [DOI] |
| 30. | Tanaka S, Miura S, Tashiro H, Serizawa H, Hamada Y, Yoshioka M, Tsuchiya M. Morphological alteration of gut-associated lymphoid tissue after long-term total parenteral nutrition in rats. Cell Tissue Res. 1991;266:29-36. [PubMed] [DOI] |