修回日期: 2006-02-19
接受日期: 2006-02-21
在线出版日期: 2006-03-28
目的: 检测重组蛋白rhTRAIL55-281与GST-rhTRAIL55-281的对肝细胞的毒性, 以确定其是否可以开发为抗肿瘤药物.
方法: 采用胰酶消化与机械分离结合的方法,获取原代成人肝细胞和胎肝细胞. 用Factor-Xa切除重组蛋白GST-rhTRAIL55-281的GST标签获取rhTRAIL55-281蛋白, 然后分别利用rhTRAIL55-281与GST-rhTRAIL55-281干预肝细胞株L-02、原代成人肝细胞、原代胎肝细胞及对照组正常人外周血单个核细胞(PBMC), 最后利用流式细胞仪检测细胞的凋亡率.
结果: 获得的原代成人肝细胞和胎肝细胞细胞活力达95%以上, 无GST标签的rhTRAIL55-281蛋白纯度达到97%; rhTRAIL55-281与GST-rhTRAIL55-281使肝细胞株L-02及原代成人肝细胞、胎肝细胞大量凋亡. 在10 mL/L的浓度下, 48 h后凋亡率分别为79.1%, 72.8%, 42.2%与80.3%, 74.7%, 47.2%, 而对照组正常人PBMC基本不凋亡.
结论: 重组蛋白rhTRAIL55-281与GST-rhTRAIL55-281有肝细胞毒性.
引文著录: 刘洪波, 范学工, 黄建军, 李宁, 应若素, 彭建平. 重组蛋白rhTRAIL55-281与GST-rhTRAIL55-281有肝细胞毒性. 世界华人消化杂志 2006; 14(9): 869-873
Revised: February 19, 2006
Accepted: February 21, 2006
Published online: March 28, 2006
AIM: To investigate the toxicity of recombinant protein rhTRAIL55-281 and GST-rhTRAIL55-281 to human hepatic cells, and to provide the experi-ment evidence for development of anti-tumor drugs.
METHODS: Primary cultured human hepatic cells were obtained from adult and fetus by trypsin digestion and mechanical separation. GST tag was cut off by Factor-Xa from recombinant protein GST-rhTRAIL55-281 to gain rhTRAIL55-281. Human hepatic cell strain L-02, primary cultured human hepatic cells from adult and fetus and normal human peripheral blood mononuclear cells (PBMCs) were intervened by recombinant protein rhTRAIL55-281 or GST-rhTRAIL55-281, and finally the apoptosis of cells were detected by flow cytometry.
RESULTS: The viability of primary cultured human hepatic cells from adult and fetus exceed 95%, and the purity of rhTRAIL55-281 without GST tag was 97%. Mass of apoptosis was detected in L-02, adult human hepatocytes and human fetal hepatocytes, and the apoptosis rates were 79.1%, 72.8%, and 42.2% or 80.3%, 74.7%, and 47.2%, respectively, 48 h after rhTRAIL55-281or GST-rhTRAIL55-281 intervention at concentration of 10 mL/L. However, PBMCs showed little apoptosis.
CONCLUSION: Recombinant protein rhTRAIL55-281 or GST-rhTRAIL55-281 is limited in the development of antineoplastics due to its hepatocyte toxicity.
- Citation: Liu HB, Fan XG, Huang JJ, Li N, Ying RS, Peng JP. Toxicity assay for recombinant protein of rhTRAIL55-281 and GST-rhTRAIL55-281 to hepatic cells. Shijie Huaren Xiaohua Zazhi 2006; 14(9): 869-873
- URL: https://www.wjgnet.com/1009-3079/full/v14/i9/869.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i9.869
肿瘤坏死因子相关凋亡诱导配体(TNF related apoptosis inducing ligand, TRAIL)是TNF超家族成员中的一员. TRAIL能强烈诱导转化细胞、肿瘤细胞和病毒感染细胞等凋亡, 而正常组织细胞却对其不敏感, 这一特征使其在肿瘤治疗中有着潜在的广泛应用前景[1-2]. 但近来的研究表明, 重组蛋白rhTRAIL有肝细胞毒性[3], 这制约着rhTRAIL作为抗肿瘤药物开发. 本研究组已经克隆出非全长人TRAIL基因, 随后对他进行了体外表达及纯化的深入研究, 纯化出大量GST-rhTRAIL55-281, 并检测了GST-rhTRAIL55-281的凋亡活性[4-5]. 本研究在此基础上, 利用rhTRAIL55-281与GST-rhTRAIL55-281干预肝细胞株L-02及原代成人肝细胞、胎肝细胞, 然后利用流式细胞仪进行凋亡检测, 以确定rhTRAIL55-281与GST-rhTRAIL55-281肝细胞毒性的大小, 为重组蛋白rhTRAIL55-281与GST-rhTRAIL55-281是否可以作为抗肿瘤药物开发提供实验依据.
重组蛋白GST-rhTRAIL55-281系本研究室纯化[5]. Factor-Xa购自Pharmacia公司. 超滤器Centricon YM-10, 30购自Millipore公司. Glutathione Sepharose 4B、胰酶购自Amersham公司. 胎牛血清、DMEM等购自Gibco公司. 细胞生长因子、铁硫蛋白、鼠尾胶系卢瑾硕士惠赠. 人肝细胞株L-02系我室保存. 成人肝组织系本院手术取得, 人胎肝组织系本院水囊式人工流产约14 wk胎儿身上取得(以上均取得病患与医院伦理委员会批准). 凋亡检测试剂盒购自鼎国生物科技公司.
用Factor-Xa切除重组蛋白GST-rhTRAIL55-281的GST标签, 重组蛋白GST-rhTRAIL55-281溶于冰浴PBS中, 加入Glutathione Sepharose 4B琼脂糖珠, 冰浴缓摇2 h后, 4 ℃, 500 r/min离心5 min, 将琼脂糖珠重悬于冰浴20 mmol/L Tris-HCl (pH 7.4), 0.1 mol/L NaCl缓冲液中. 加入适量的Factor-Xa, 4 ℃, 24 h, 500 r/min离心5 min, 上清小心倒入超滤器Centricon YM-30, 4 ℃, 1 500 r/min离心15 min, 滤液小心加入超滤器Centricon YM-10, 4 ℃, 1 500 r/min离心15 min, 适量PBS溶解超滤器中截留的切除了GST的rhTRAIL55-281蛋白, 利用紫外分光光度仪检测其蛋白浓度. 原代成人肝细胞与胎肝细胞的分离与培养采用胰酶消化与机械分离结合的方法, 试剂准备同肝脏原位灌注消化法[5]. 收集细胞, 在DMEM中加入10 mL/L胎牛血清, 500 r/min离心5 min, 如此洗涤细胞2-3次, 最后用含100 mL/L胎牛血清、0.1 g/L细胞生长因子、1 g/L铁硫蛋白DMEM培养基、用鼠尾胶处理[6]后的一次性塑料培养瓶, 在37 ℃, 50 mL/L CO2的培养条件下培养. 24 h贴壁后换液, 用台盼蓝排斥法检测细胞活力, 细胞活力达95%以上的就可用于重组蛋白rhTRAIL55-281与GST-rhTRAIL55-281的肝细胞毒性检测实验. 人肝细胞株L-02的培养按照常规方法进行, 培养基为DMEM+100 mL/L小牛血清, 培养条件为37 ℃, 50 mL/L CO2. 培养至细胞80%-85%时进行rhTRAIL55-281与GST-rhTRAIL55-281肝细胞毒性检测实验. 以分离的正常人的外周血单个核细胞(PBMC)为对照组, 在L-02细胞株、活力检测后的原代成人肝细胞与胎肝细胞中加入稀释度为100 mL/L的rhTRAIL55-281与GST-rhTRAIL55-281, 及无关蛋白(白蛋白)干预24, 36及48 h. 然后按流式细胞术检测的要求与方法分别收获细胞, 碘化丙啶(PI)染色后, 用流式细胞仪检测细胞凋亡率.
统计学处理 采用配对t检验和相关分析.
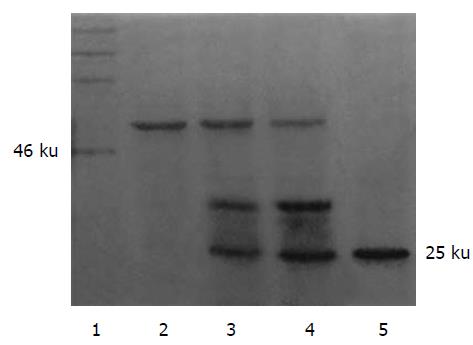
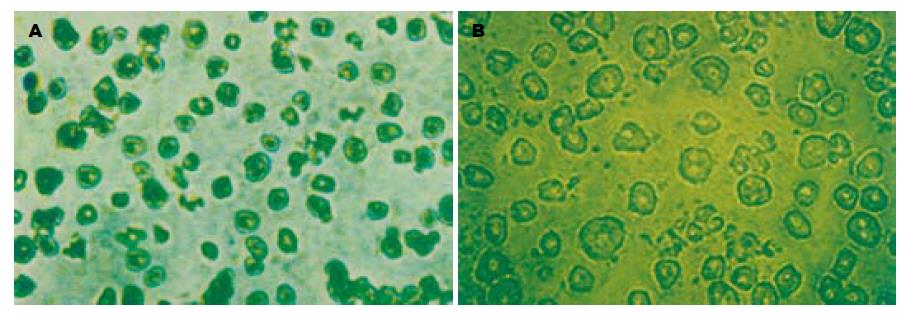
GST-rhTRAIL55-281的GST标签被Factor-Xa有效的切除, 切除GST标签后, rhTRAIL55-281的分子量大小约为Mr 25 000, 利用超滤器Centricon YM-10, 30, 有效的去除了Factor-Xa(Mr 48 000), 使rhTRAIL55-281纯度达到97%, 与GST-rhTRAIL55-281相当(图1). 用胰酶消化与机械分离结合的方法获得了大量的原代成人肝细胞与胎肝细胞. 这些原代细胞贴壁换液后, 逐渐伸展为多边型(图2). 利用台盼蓝排斥法进行活力检测,发现其活力在95%以上. 胎肝细胞还有很强的分裂能力, 但成人肝细胞却基本不能分裂, 原代成人肝细胞在培养10 d逐渐开始死亡. 他们都可以很好的满足重组蛋白rhTRAIL55-281与GST-rhTRAIL55-281的肝细胞毒性检测实验. 通过对L-02细胞株、检测后的原代成人肝细胞与胎肝细胞等细胞的干预, 发现rhTRAIL55-281与GST-rhTRAIL55-281对L-02细胞株、原代成人肝细胞与胎肝细胞均有较强的细胞毒性(表1), 且两者的毒性无统计学差异, 原代胎肝细胞的凋亡率明显低于L-02细胞株与原代成人肝细胞. 他们对正常人PBMC无细胞毒性.
| 分组 | Th | PBMC | L-02 | 成人肝细胞 | 人胎肝细胞 |
| 白蛋白 (无关蛋白) | 48 | 0.8±0.15 | 0.6±0.17 | 0.9±0.20 | 0.7±0.16 |
| 1:100 rhTRAIL55-281 | 12 | 0.8±0.14 | 17.49±1.21bcd | 16.22±1.27bcd | 9.0±1.79bc |
| 24 | 1.2±0.31 | 39.52±3.11bcd | 33.17±4.57bcd | 18.64±3.06bc | |
| 48 | 2.3±0.20 | 79.11±4.79bcd | 72.83±6.12bcd | 42.15±3.93bc | |
| 1:100 GST-rhTRAIL55-281 | 12 | 0.9±0.12 | 19.89±2.03bcd | 16.63±0.79bcd | 11.01±1.29bc |
| 24 | 1.5±0.17 | 41.47±3.45bcd | 34.86±2.19bcd | 19.67±4.22bc | |
| 48 | 2.3±0.23 | 80.31±5.13bcd | 74.73±5.03bcd | 47.15±5.31bc |
TRAIL能强烈诱导转化细胞、肿瘤细胞和病毒感染细胞等凋亡, 而正常组织细胞却对其不敏感, 这种选择性细胞毒性使其在肿瘤治疗中有着潜在的广泛应用前景. 通过多次小鼠的体内试验研究发现, 重组人TRAIL蛋白并没有毒副作用, 应该是安全的[2,7-8]. 但是, 随后Jo et al[3]发现, 虽然人TRAIL-His对鼠肝细胞没有毒性, 对原代成人肝细胞却有强烈的细胞毒性. Nagata与Gura呼吁对于TRAIL药物的开发要十分谨慎[9-10]. 当然, 也有不同的声音: 认为通过去除标签, 加入锌离子使外源表达的TRAIL分子形成完整的三聚体后, 不会对肝细胞产生毒性[11]; 天然的TRAIL蛋白对于人正常的角质化细胞与黑色素细胞几乎没有细胞毒性[12]. 最近研究又发现: DR4和DR5可诱导肝细胞凋亡[13]; 在体的正常肝细胞可抵抗TRAIL诱导的凋亡, 而在体外则无法避免[14]; 胆汁酸可对死亡受体的信号转导起调节作用, 他可以促进TRAIL诱导肝细胞凋亡[15-17]; 正常人关节软骨细胞对TRAIL诱导的凋亡也很敏感[18]; 也有人认为在体内与体外均对肝细胞无毒性[19]. 基于以上正反两方面的观点, TRAIL药物的开发还是要十分谨慎, 安全性亟待深入研究. 然而, 我国有人在追捧TRAIL, 甚至某大型生物科技有限公司为TRAIL药物的开发投入资金达亿元. 为了为TRAIL抗肿瘤药物开发的可行性提供实验依据, 我们利用rhTRAIL55-281与GST-rhTRAIL55-281干预肝细胞株L-02及原代成人肝细胞、胎肝细胞, 然后利用流式细胞仪进行凋亡检测, 以确定rhTRAIL55-281与GST-rhTRAIL55-281肝细胞毒性的大小. 通过实验, 重组蛋白rhTRAIL55-281与GST-rhTRAIL55-281对正常人PBMC无细胞毒性, 这与本研究小组早前报道的结果是一致的[20], 综合本研究小组对可溶性GST-rhTRAIL55-281凋亡活性的检测实验[4], 可以再次肯定: TRAIL重组蛋白对细胞有选择性毒性. 重组蛋白rhTRAIL55-281与GST-rhTRAIL55-281对肝细胞有毒性, 这与Jom et al对有His标签的重组蛋白TRAIL-His的研究结果一致. 因此, 无论是全长还是非全长的, 无论是TRAIL-His还是GST-rhTRAIL55-281与rhTRAIL55-281都对肝细胞有较强的毒性, 重组蛋白rhTRAIL55-281与GST-rhTRAIL55-281作为抗肿瘤药物开发受到其肝细胞毒性的制约. 至于原代胎肝细胞的凋亡率明显低于L-02细胞株与原代成人肝细胞的原因, 可能是胎儿尚处于免疫发育不完全时期, 胎肝细胞的TRAIL死亡受体表达不完整抑或诱骗受体TRAIL-R4高表达造成[21-22], 有待我们进一步研究.
鉴于以上实验结果, 我们认为: 对于TRAIL药物的开发要把安全性放在首位, 在大量投入资金之前, 必须验证他对正常细胞可能的杀伤作用, 以免如同Fas药物开发一样[23], 造成不必要的巨大浪费.
宋惠萍教授及张卫社教授给予了热忱的帮助.
TRAIL能强烈诱导转化细胞、肿瘤细胞和病毒感染细胞等凋亡, 而正常组织细胞却对其不敏感, 这种选择性细胞毒性使其在肿瘤治疗中有着潜在的广泛应用前景. Jo et al发现, 虽然人TRAIL-His对鼠肝细胞没有毒性, 对原代成人肝细胞却有强烈的细胞毒性. Nagata与Gura呼吁对于TRAIL药物的开发要十分谨慎.
本文经过对肝细胞株、原代成人肝细胞、胎肝细胞进行测试, 验证了自制的两种重组蛋白rhTRAIL55-281与GST-rhTRAIL55-281对人肝细胞的毒性.
文章有理论意义和实际应用价值. 是一篇具有较高价值的论文.
电编: 张敏 编辑:潘伯荣
| 2. | Walczak H, Miller RE, Ariail K, Gliniak B, Griffith TS, Kubin M, Chin W, Jones J, Woodward A, Le T. Tumoricidal activity of tumor necrosis factor-related apoptosis-inducing ligand in vivo. Nat Med. 1999;5:157-163. [PubMed] [DOI] |
| 3. | Jo M, Kim TH, Seol DW, Esplen JE, Dorko K, Billiar TR, Strom SC. Apoptosis induced in normal human hepatocytes by tumor necrosis factor-related apoptosis-inducing ligand. Nat Med. 2000;6:564-567. [PubMed] [DOI] |
| 6. | Lu J, Gu YP, Xu X, Liu ML, Xie P, Song HP. Adult islets cultured in collagen gel transdifferentiate into duct-like cells. World J Gastroenterol. 2005;11:3426-3430. [PubMed] [DOI] |
| 7. | Ashkenazi A, Pai RC, Fong S, Leung S, Lawrence DA, Marsters SA, Blackie C, Chang L, McMurtrey AE, Hebert A. Safety and antitumor activity of recombinant soluble Apo2 ligand. J Clin Invest. 1999;104:155-162. [PubMed] [DOI] |
| 8. | Chinnaiyan AM, Prasad U, Shankar S, Hamstra DA, Shanaiah M, Chenevert TL, Ross BD, Rehemtulla A. Combined effect of tumor necrosis factor-related apoptosis-inducing ligand and ionizing radiation in breast cancer therapy. Proc Natl Acad Sci USA. 2000;97:1754-1759. [PubMed] [DOI] |
| 9. | Nagata S. Steering anti-cancer drugs away from the TRAIL. Nat Med. 2000;6:502-503. [PubMed] [DOI] |
| 10. | Gura T. Cancer research. Caution raised about pos-sible new drug. Science. 2000;288:786-787. [PubMed] [DOI] |
| 11. | Lawrence D, Shahrokh Z, Marsters S, Achilles K, Shih D, Mounho B, Hillan K, Totpal K, DeForge L, Schow P. Differen-tial hepatocyte toxicity of recombinant Apo2L/TRAIL versions. Nat Med. 2001;7:383-385. [PubMed] [DOI] |
| 12. | Qin J, Chaturvedi V, Bonish B, Nickoloff BJ. Avoid-ing premature apoptosis of normal epidermal cells. Nat Med. 2001;7:385-386. [PubMed] [DOI] |
| 13. | Armeanu S, Lauer UM, Smirnow I, Schenk M, Weiss TS, Gregor M, Bitzer M. Adenoviral gene transfer of tumor necrosis factor-related apoptosis-inducing ligand overcomes an impaired response of hepatoma cells but causes severe apoptosis in primary human hepatocytes. Cancer Res. 2003;63:2369-2372. [PubMed] |
| 14. | Mundt B, Kuhnel F, Zender L, Paul Y, Tillmann H, Trautwein C, Manns MP, Kubicka S. Involvement of TRAIL and its receptors in viral hepatitis. FASEB J. 2003;17:94-96. [PubMed] |
| 15. | Higuchi H, Bronk SF, Takikawa Y, Werneburg N, Takimoto R, El-Deiry W, Gores GJ. The bile acid glycochenodeoxycholate induces trail-receptor 2/DR5 expression and apoptosis. J Biol Chem. 2001;276:38610-38618. [PubMed] [DOI] |
| 16. | Higuchi H, Bronk SF, Taniai M, Canbay A, Gores GJ. Cholestasis increases tumor necrosis factor-related apoptotis- inducing ligand (TRAIL)-R2/DR5 expression and sensitizes the liver to TRAIL-mediated cytotoxicity. J Pharmacol Exp Ther. 2002;303:461-467. [PubMed] [DOI] |
| 17. | Higuchi H, Yoon JH, Grambihler A, Werneburg N, Bronk SF, Gores GJ. Bile acids stimulate cFLIP phosphorylation enhancing TRAIL-mediated apop-tosis. J Biol Chem. 2003;278:454-461. [PubMed] [DOI] |
| 18. | Pettersen I, Figenschau Y, Olsen E, Bakkelund W, Smedsrod B, Sveinbjornsson B. Tumor necrosis factor-related apoptosis-inducing ligand induces apoptosis in human articular chondrocytes in vitro. Biochem Biophys Res Commun. 2002;296:671-676. [PubMed] [DOI] |
| 19. | Hao C, Song JH, Hsi B, Lewis J, Song DK, Petruk KC, Tyrrell DL, Kneteman NM. TRAIL inhibits tumor growth but is nontoxic to human hepatocytes in chimeric mice. Cancer Res. 2004;64:8502-8506. [PubMed] [DOI] |