修回日期: 2006-01-15
接受日期: 2006-01-26
在线出版日期: 2006-03-18
目的: 制备幽门螺杆菌(Helicobacter pylori, H. pylori)重组VacA的鸡蛋黄抗体IgY(VacA-IgY), 了解其理化特性和生物学活性, 评价其抗H. pylori感染的作用.
方法: 以纯化的重组VacA免疫产蛋鸡, 水稀释法提取蛋黄抗体(VacA-IgY), 硫酸铵沉淀法纯化IgY. 将一定浓度的VacA-IgY在不同温度的水浴中维持一定时间, 评价其耐热性; 在不同pH的Tris-HCl中孵育一定时间, 评价其耐酸性; 加入胃蛋白酶并作用一定时间后, 评价其对酶消化的耐受作用. 以上评价均采用ELISA法测定抗体效价变化. 采用Hela细胞体外培养MTT法分析VacA-IgY对H. pylori细胞毒活性的中和作用.
结果: 本实验制备的VacA-IgY在70℃水浴15min后活性保持约50%; 在pH≥5时, 抗体活性几乎无改变, pH<5时, 抗体活性下降较快, pH2.0左右, 抗体活性几乎丧失; pH4.0时, 60 kU/L胃蛋白酶作用1 h, 抗体活性几乎无变化, 2 h后活性仍保持50%以上. VacA-IgY能浓度依赖性地中和H. pylori菌体蛋白的Hela细胞毒活性. 20 mg/L超声提取物即可降低1/2的Hela细胞增殖能力, 80-320 mg/L的VacA-IgY能完全中和H. pylori菌体蛋白的Hela细胞毒活性(P<0.01).
结论: 成功制备了重组VacA的IgY, 且具有较好的耐热性、耐胃酶消化和一定的耐酸性; 在其体外具有中和H. pylori细胞毒活性的作用.
引文著录: 毛小琴, 杨致邦, 张绍兰, 田一玲, 黄进. 幽门螺杆菌重组VacA蛋黄抗体的体外活性. 世界华人消化杂志 2006; 14(8): 789-794
Revised: January 15, 2006
Accepted: January 26, 2006
Published online: March 18, 2006
AIM: To explore the physicochemical and biolo-gical properties of IgY extracted from the yolk of hen's egg immunized with recombinant VacA protein of Helicobacter pylori.
METHODS: The purified antigen of recombinant VacA was used to immunize the hens and the VacA-IgY antibody was extracted from the yolk of hen's egg by water dilution methods and then purified by deposition technique with ammonium sulfate. In order to evaluate VacA-IgY heat stability, the titer of VacA-IgY was detected by enzyme-linked immunosorbent assay (ELISA) after being heated for 15 min under different temperatures. VacA-IgY was added into Tris-HCl of different pH values and incubated under a temperature of 37℃ to access its acid stability using ELISA. The competence of anti-pepsin digestion was also measured by ELISA. The VacA+H. pylori were co-cultured with Hela cells and VacA-IgY antibody was added to observe its neutralization on the cytotoxity of H. pylori by MTT assay in vitro.
RESULTS: The activity of VacA-IgY was maintained about 50% after water baths (70℃, 15 min). The activity of VacA-IgY seldom changed at pH values 5.0-7.0, but declined rapidly below the pH value 5.0, even absolutely disappeared at pH value 2.0. After incubation with pepsin (pH4.0, 60 kU/L) for 1 h, the activity of VacA-IgY had no changes, and 2 h after incubation, it still maintained over 50%. The VacA-IgY antibody neutralized the cytotoxity of VacA+H. pylori in a concentration-dependent manner. VacA+H. pylori ultrasonic extracts inhibited 50% proliferation of Hela cells at a concentration of 20 mg/L, while VacA-IgY completely neutralized the cytotoxity of H. pylori at concentrations of 80-320 mg/L (P < 0.01).
CONCLUSION: The VacA-IgY antibody shows a good heat stability, certain acid stability, and competence of anti-pepsin digestion, and can neutralize the cytotoxity of VacA protein of H. pylori effectively in vitro.
- Citation: Mao XQ, Yang ZB, Zhang SL, Tian YL, Huang J. In vitro activity of IgY against recombinant VacA protein of Helicobacter pylori. Shijie Huaren Xiaohua Zazhi 2006; 14(8): 789-794
- URL: https://www.wjgnet.com/1009-3079/full/v14/i8/789.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i8.789
胃部疾病的发生、复发和幽门螺杆菌(Helicobacter pylori, H. pylori) 感染有关[1-14]. H. pylori感染呈全世界流行, 人群中有50%-60%感染, 发展中国家则可高达70%-90%. 近年的研究发现, H. pylori感染者患胃癌的危险性是未感染者的4-6倍[15]. 细胞空泡毒素抗原(vacuolating cytotoxin antigen, VacA)是H. pylori引起细胞损伤的主要毒力因子, 可导致细胞空泡样变性和细胞死亡, 与消化性溃疡和胃癌的细胞病变相关, 并具有良好的免疫原性[16-20]. 因此针对VacA毒株感染的防治措施显得尤为重要. 目前H. pylori的治疗多采用多种抗生素联合疗法, 但其易产生副作用、治疗费用高和耐药菌株产生等问题, 使得寻找抗生素替代疗法成为迫切需要并具有重要意义. 1893年Klemperer发现母鸡的抗体可从血清传递至蛋黄中, 赋予鸡胚和雏鸡被动免疫. 由于鸡蛋黄的英文名称为Yolk, 故将鸡蛋黄中的免疫球蛋白IgG命名为IgY. IgY具有突出的生物学优势, 近年来将之用于人类疾病的治疗也受到关注. 众多研究已证实蛋黄抗体(IgY)为一种有效的被动免疫制剂, 尤其是防治胃肠道感染性疾病方面有很好的效果[21-23]. Mine et al[24]总结了IgY的治疗作用后表明口服IgY是抗人胃肠道病原的有效防治制剂. 我们探讨H. pylori重组细胞空泡毒素蛋黄抗体(vacuolating cytotoxin antigen IgY, VacA-IgY)的理化特性和体外中和H. pylori细胞毒活性的作用. 为进一步研究IgY在体内的抗H. pylori感染作用和开发治疗性IgY抗体制剂奠定实验基础.
VacA+H. pylori菌株从重庆医科大学附属第一医院胃镜室提供的胃窦黏膜中, 经自制H. pylori选择培养基分离培养, 鉴定后保存. Hela细胞为重庆医科大学病理生理学教研室馈赠. VacA阳性株H. pylori重组蛋白VacA, 菌体蛋白抗原为本室制备保存[25]. VacA+血清为本室用Helico Blot试剂盒从H. pylori阳性患者血清筛选并保存. 胎牛血清、RPMI 1640、胰蛋白酶(1∶250)、MTT、DMSO均为北京中杉金桥生物技术有限公司产品. 胃蛋白酶(Pepsin 1∶3 000)为上海生工生物工程公司产品. HRP标记的羊抗人IgG为BioRad公司产品. HRP标记羊抗鸡IgY为Promega公司产品. 布氏肉汤为北京陆桥商检新技术公司产品. 22周龄洛曼产蛋鸡, 由西南农业大学荣昌分校生物中心提供.
选22周龄健康产卵洛曼鸡, 按该种属鸡要进行饲养. 将重组VacA蛋白抗原与等体积完全弗氏佐剂混匀并充分乳化后, 胸肌多点肌肉注射洛曼鸡作基础免疫, 剂量为100 μg/只. 分别于第1次免疫后15, 45, 75 d改为不完全弗氏佐剂颈背部皮下多点注射进行第2, 3, 4次加强免疫, 免疫剂量分别是200 μg/只, 300 μg/只, 300 μg/只. 于第1次免疫后15 d开始每天收集鸡蛋, 编号后于4℃保存, 并留取免疫前的鸡蛋作阴性对照. 取免疫后所产鸡蛋, 弃蛋壳、蛋清及卵黄衣膜, 取出蛋黄(约10 mL/只), 用无菌双蒸水稀释10倍, 充分振荡混匀后置4℃过夜; 然后10 000 g低温超速离心20 min, 收集上清, 再在上清液中加入饱和硫酸铵使终浓度达500 mg/L, 经充分均匀搅拌后, 于4℃放置2 h, 15 000-20 000 g离 15-20 min后收集沉淀. 再将沉淀溶于原体积的1 mmol/L的磷酸盐缓冲液(或生理盐水)中, 并加入饱和硫酸铵, 使其浓度达330 mg/L, 离心收集沉淀. Bradford法测定蛋白含量, ELISA法检测抗体效价.
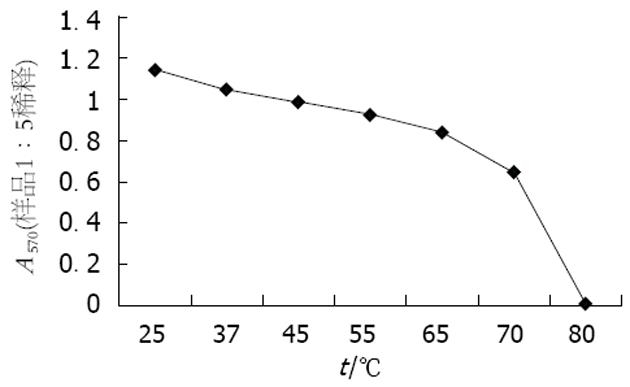
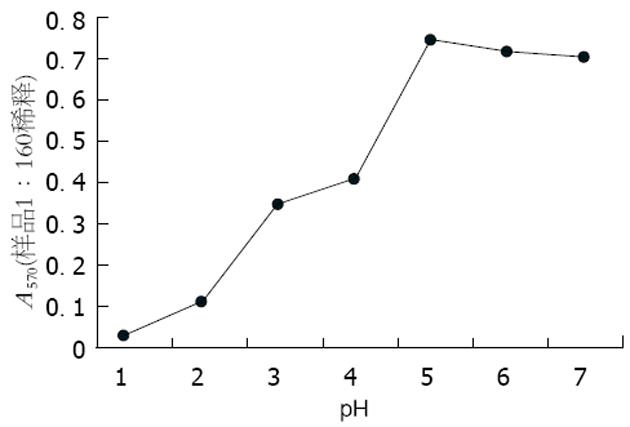
1.2.1 IgY稳定性试验: 用pH 7.0的0.05 mol/L Tris-HCl缓冲液将IgY稀释成1 g/L, 分别放入25, 37, 45, 56, 65, 70, 80, 90℃水浴中维持15 min, ELISA法测定抗体效价. 分别用pH值为1, 2, 3, 4, 5, 6, 7的0.05 mol/L Tris-HCl缓冲液将IgY分别稀释成1 g/L, 37℃孵育2 h, 立即加入适量的2 mol/L Tris碱中和, 使pH值均为7.0, ELISA法测定IgY的抗体效价. 用无菌的pH 4.0, 0.05 mol/L Tris-HCl缓冲液将IgY稀释成1 g/L. 在100 μL IgY溶液中分别加入5, 10 μL上述胃蛋白酶溶液, 37℃分别作用1, 2, 4, 8 h后, 用2 mol/L Tris碱调整pH至7.0, 同时设立空白对照; ELISA法测定IgY抗体效价.
1.2.2 VacA-IgY的活性: 采用MTT法, 本实验方法参见文献[26]. 收集选择性培养基培养3 d的VacA+H. pylori菌体, 离心(4℃, 8 000 g)10 min, PBS洗涤2次后用小体积PBS重悬, 冰浴下超声破碎10 min, 离心(4℃, 12 000 g)20 min收集上清, 沉淀再次冰浴超声破碎10 min, 重复上述过程一次, 合并两次上清, Bradford法测定蛋白含量. 吸取200 μL(1×108 个/L)Hela细胞培养液转种于96孔细胞培养板孔中, CO2孵箱(37℃, 50 mL/L CO2, 饱和湿度)中培养24 h. 实验孔加入10, 20, 40, 80, 160, 320 mg/L的超声提取物, 每个稀释度作4孔平行. 同时设空白孔、对照孔. 空白孔只加入RPMI-1640培养液200 μL, 不加细胞和超声提取物, 对照孔加细胞但不加超声提取物. 以上各组在CO2孵箱(37℃, 50 mL/L CO2, 饱和湿度)中继续培养48 h后, 1 000 r/min离心后弃去上清, 每孔加入200 μL不含血清的RPMI-1640和20 μL 5 g/L MTT溶液, 37℃继续孵育4 h. 离心后弃去孔内培养液, 每孔加入DMSO 150 μL, 振荡10 min. 以空白孔调零, 测定实验组和对照组的570 nm吸光度值(A570), 计算各个稀释度4孔A570平均值(mean), 用mean±SD表示各稀释度的A值. 以不加超声粉碎提取物(对照组)的细胞存活率为100%, 以细胞存活率=实验组A570值/对照组A570值×100%计算细胞存活率, t检验分析计算结果. 吸取200 μL(2×108 个/L)Hela细胞培养液转种于96孔细胞培养板孔中, CO2孵箱(37℃, 50 mL/L CO2, 饱和湿度)中培养24 h. 将60 mg/L超声提取物与不同浓度IgY(10, 20, 40, 80, 160, 320 mg/L)按1∶1混合, 37℃作用2 h后吸20 μL加入细胞板孔中. 同时设立对照组和空白组. 每组作4个复孔. 其余方法同上.
Bradford法测定蛋白含量为25.66 g/L, ELISA法测定抗体效价为1∶12 800. 制备的IgY在低于55℃时抗体活性无明显改变, 效价稳定. 在70℃, 15 min条件下仍能保持约50%的活性(图1). IgY在pH 5-7时, 抗体活性几乎无改变, pH<5时, 抗体活性下降很快, 在pH 2.0左右, 抗体活性几乎完全丧失(图2). 在pH 4.0, IgY与40-60 ku/L胃蛋白酶(体内正常浓度)共同温育1 h可保持其抗体效价, 在超过正常胃蛋白酶浓度(120 kU/L)时仍能保持50%以上的抗体效价. 总体来讲, VacA-IgY在胃蛋白酶存在情况下, 活性下降得很快(表1).
| 胃蛋白酶(1200 kU/L) | 消化时间(h) | IgY滴度 |
| 5 μL | 1 | 1∶320 |
| 5 μL | 2 | 1∶80 |
| 5 μL | 4 | 1∶20 |
| 5 μL | 8 | 0 |
| 10 μL | 1 | 1∶160 |
| 10 μL | 2 | 1∶40 |
| 10 μL | 4 | 1∶10 |
| 10 μL | 8 | 0 |
| 对照 | 0 | 1∶320 |
MTT测定结果显示, H. pylori超声裂解蛋白明显降低Hela细胞的增生能力. 20 mg/L超声提取物即可降低Hela细胞增生能力的1/2, 随超声提取物浓度的增高, 细胞的增生能力逐渐降低(表2).
用H. pylori超声裂解全菌蛋白制备的IgY的抗感染作用虽有报道[27], 但有研究发现这种IgY无抗VacA的活性, 故限制了其应用[28]. 制备特异的有抗VacA活性的IgY将更有临床意义和应用价值. 用H. pylori培养物提取的天然VacA作抗原制备的IgY的抗感染作用虽有报道[29], 但由于诸多因素使其应用受到限制: (1)H. pylori培养条件苛刻, 成本高, 大量培养较困难; (2)VacA基因存在所有的菌株中, 但仅在50%-60%的菌株表达; (3)从培养物中提取VacA程序复杂, 得率极低; (4)VacA基因呈多态性, 导致不同来源的菌株表达的蛋白在结构上有一定差异. 因此用天然VacA来大量生产IgY生物制剂效率极低, 且均一性欠佳. 目前基因工程技术成熟、简便, 可容易地大量获得均一性的目的蛋白. 用重组VacA为抗原制备IgY和其抗H. pylori感染的作用国内外尚无报道. 我们通过BLAST对5株有代表性的中国菌株VacA毒性亚单位进行同源性比较, 得到一个高度同源的基因片段为待表达的目的基因, 利用基因工程技术克隆表达并纯化了重组VacA蛋白, 以此作免疫原大量制备了高浓度、高效价、高纯度和高特异性的蛋黄抗体(VacA-IgY). 有望获得更适用于国内临床的免疫制剂用于H. pylori诊断和防治. 我们考虑到本IgY可能作为一种口服制剂或食品添加剂, 必须具有耐热、耐酸、耐胃蛋白酶消化的特性, 故考察了其在体外不同温度、酸性和胃酶环境中的稳定性.
巴氏消毒法是对牛奶、啤酒等不能进行高温灭菌的食品进行消毒的一种常用方法, 其主要目的是杀死无芽胞的病原菌, 而又不影响食品的营养成分. 现食品生产上常用高温瞬时法, 即只需在72℃保持15 s即可. 本研究制备的VacA-IgY在低浓度(1 g/L)、72℃维持15 min也能保持50%以上的活性, 说明VacA-IgY若制成口服制剂或用作食品添加剂可完全经受巴氏消毒法中的高温瞬时法. 胃内生态环境最主要的特点是酸性. 胃壁细胞和喷门、幽门腺体的分泌液构成胃液, 含有盐酸和胃蛋白酶等. 儿童胃腺体和±状细胞较少, 盐酸和各种酶的分泌量较成人低. 1岁内的儿童, 吸乳时胃液pH为3.5-5.5, 4-9岁时, 胃酸的分泌量为42.5 mL/h(成人为146 mL/h), H+的产生量为成人的1/3. 这也可能是儿童易受H. pylori感染的原因之一. 因此, IgY作为防治胃肠道感染的口服制剂必须能抵抗胃内的强酸环境才能凑效. 本研究制备的VacA-IgY在pH 5-7时抗体活性几乎无改变, 在pH 3-4时活性保持50%左右, 但在pH 2时活性几乎完全丧失. 由于5 mo以内的婴儿胃内pH值通常为4-5, 2岁以内也不小于3, 说明VacA-IgY可用于防治婴幼儿胃肠道感染. 但在成人胃内pH环境, 该IgY不能保持活性. 这表明该IgY要用于成人胃肠道感染, 必须加入适量的保护剂. 另外, IgY到达胃内时易受胃蛋白酶降解而失活. Gutierrez et al[30]发现胃蛋白酶对IgY生物活性作用小, 但在pH 2.0时胃蛋白酶可完全灭活IgY. 本实验考虑到IgY在pH小于4时抗体活性下降, 而胃蛋白酶在pH大于4时活性几乎丧失, 故采用pH 4.0的Tris-HCl配制IgY溶液和胃蛋白酶. 同时考虑到成人胃内胃蛋白酶正常浓度为40-60 ku/L(取其高限值60 ku/L), 按1∶20体积比加入VacA-IgY溶液中后其终浓度达到60 ku/L, 故配制1 200 ku/L的胃蛋白酶原液. 并比较胃蛋白酶在生理浓度和病理浓度情况下IgY抗体活性的变化. 结果显示, VacA-IgY对正常浓度的胃蛋白酶有较好的耐受能力, 甚至在胃蛋白酶浓度异常增高至正常浓度2倍时, IgY仍能保持一定的活性. 因此特异性IgY口服进入消化道后, 有望在胃内发挥良好的作用.
我们制备的重组VacA-IgY在大于80 mg/L时可完全中和VacA+H. pylori超声提取物对Hela细胞的毒性作用, 说明用重组VacA毒性片段制备的VacA-IgY也具有天然VacA制备的IgY中和H. pylori细胞毒活性的作用. 我们首次成功制备了针对重组VacA的特异性的、大量的、高纯度的蛋黄抗体. 但仍存在许多问题, 如耐酸性和耐酶消化的能力不太理想. 后续工作将进一步探索如何提高抗体的耐酸性和耐酶消化的特性, 以保证抗体在胃内活性的保持和作用的发挥, 为探讨该抗体在动物体内抗H. pylori作用的研究提供实验依据, 为制备IgY口服制剂或食品添加剂奠定基础.
幽门螺杆菌(Helicobacter pylori)与胃部疾病的发生、复发有关. 对已感染者的大量研究表明, 多种抗生素和铋剂的联合应用是清除H. pylori的有效方法, 但10%-15%的病例由于细菌产生耐药性而治疗失败. 而且随着抗生素的应用, 耐药菌株不断增加. 寻找清除H. pylori感染的有效措施是临床急需解决的问题, 也是研究的热点和重点.
本文对制备的IgY进行了体外活性测定, 与其他研究者不同的是, 在设计稳定性试验时, 紧密联系IgY作为口服制剂应用于人体的要求, 充分考虑到胃内正常与异常情况下的pH环境和胃蛋白酶的浓度, 为下一步应用于体内的动物实验奠定坚实的基础. 研究发现, 制备的IgY具有良好的稳定性和生物学活性, 有望作为口服制剂应用于H. pylori的治疗.
本文研究成功制备重组Va-cA的IgY, 并且具有良好的耐热性、耐酸性, 在体外具有中和H. pylori细胞毒性作用, 具有临床意义和使用价值. 本文章具有科学性、创新性和可读性, 较好地反映了我国目前在胃肠病学基础和临床对H. pylori的研究水平.
电编: 韩江燕 编辑:潘伯荣
| 5. | Xue FB, Xu YY, Wan Y, Pan BR, Ren J, Fan DM. Association of H. pylori infection with gastric carci-noma: a Meta analysis. World J Gastroenterol. 2001;7:801-804. [PubMed] [DOI] |
| 10. | Wang RT, Wang T, Chen K, Wang JY, Zhang JP, Lin SR, Zhu YM, Zhang WM, Cao YX, Zhu CW. Helicobacter pylori infection and gastric cancer: evidence from a retros-pective cohort study and nested case-control study in China. World J Gastroenterol. 2002;8:1103-1107. [PubMed] [DOI] |
| 11. | Hu GY, Yu BP, Dong WG, Li MQ, Yu JP, Luo HS, Rang ZX. Expression of TFF2 and Helicobacter pylori infection in carcinogenesis of gastric mucosa. World J Gastroenterol. 2003;9:910-914. [PubMed] [DOI] |
| 13. | Mitani K, Tatsuta M, Iishi H, Yano H, Uedo N, Iseki K, Narahara H. Helicobacter pylori infection as a risk factor for gastric ulceration. Hepatogastroente-rology. 2004;51:309-312. [PubMed] |
| 15. | Testino G. Immature cells and Helicobacter pylori infection in early gastric cancer. An immunohis-tochemical study. Minerva Med. 1997;88:183-186. [PubMed] |
| 16. | Muller I, Medina-Selby A, Palacios JL, Martinez P, Opazo P, Bruce E, Mancilla M, Valenzuela P, Yude-levich A, Venegas A. Cloning and comparison of ten gene sequences of a Chilean H. pylori strain with other H. pylori strains revealed higher variab-ility for VacA and CagA virulence factors. Biol Res. 2002;35:67-84. [PubMed] [DOI] |
| 17. | Pessina A, Bayo M, Croera C, Meringolo F, Neri MG, Montesissa L, Raimondi A. In vitro sensitivity of human gastric cancer cells (HGC-27) to Helicoba-cter pylori cytotoxin. Scand J Gastroenterol. 2003;38:1228-1234. [PubMed] [DOI] |
| 18. | Tabel G, Hoa NT, Tarnawski A, Chen J, Domek M, Ma TY. Helicobacter pylori infection inhibits healing of the wounded duodenal epithelium in vitro. J Lab Clin Med. 2003;142:421-430. [PubMed] [DOI] |
| 19. | Willhite DC, Blanke SR. Helicobacter pylori va-cuolating cytotoxin enters cells, localizes to the mitochondria, and induces mitochondrial mem-brane permeability changes correlated to toxin cha-nnel activity. Cell Microbiol. 2004;6:143-154. [PubMed] [DOI] |
| 20. | Boncristiano M, Paccani SR, Barone S, Ulivieri C, Patrussi L, Ilver D, Amedei A, D'Elios MM, Telford JL, Baldari CT. The Helicobacter pylori vacuolating toxin inhibits T cell activation by two independent mechanisms. J Exp Med. 2003;198:1887-1897. [PubMed] [DOI] |
| 21. | Lee EN, Sunwoo HH, Menninen K, Sim JS. In vitro studies of chicken egg yolk antibody (IgY) against Salmonella enteritidis and Salmonella typhi-murium. Poult Sci. 2002;81:632-641. [PubMed] [DOI] |
| 22. | Sarker SA, Casswall TH, Juneja LR, Hoq E, Hossain I, Fuchs GJ, Hammarstrom L. Randomized, place-bocontrolled, clinical trial of hyperimmunized chicken egg yolk immunoglobulin in children with rotavirus diarrhea. J Pediatr Gastroenterol Nutr. 2001;32:19-25. [PubMed] [DOI] |
| 23. | 王 忠泽, 侯 小军, 荫 俊, 宋 伟, 张 松乐, 王 威, 白 洁. 抗大肠杆菌O157: H7鸡蛋黄抗体的制备及其被动保护作用的研究. 中国人兽共患病杂志. 2002;18:17-19. |
| 24. | Mine Y, Kovacs-Nolan J. Chicken egg yolk antibod-ies as therapeutics in enteric infectious disease: a review. J Med Food. 2002;5:159-169. [PubMed] [DOI] |
| 26. | 司 徙镇强, 吴 军正. 细胞培养. 第1版. 北京: 世界图书出版公司. 2004;250-252. |
| 27. | Shin JH, Yang M, Nam SW, Kim JT, Myung NH, Bang WG, Roe IH. Use of egg yolk-derived immun-oglobulin as an alternative to antibiotic treatment for control of Helicobacter pylori infection. Clin Diagn Lab Immunol. 2002;9:1061-1066. [PubMed] |
| 28. | Shin JH, Nam SW, Kim JT, Yoon JB, Bang WG, Roe IH. Identification of immunodominant Helicobacter pylori proteins with reactivity to H. pylori-specific egg-yolk immunoglobulin. J Med Microbiol. 2003;52:217-222. [PubMed] [DOI] |
| 29. | 陈 翠萍, 杨 朝晖, 王 永谦. IgY抗体在体外和体内对幽门螺杆菌作用的研究. 中华微生物和免疫学杂志. 2002;22:37-40. |