修回日期: 2005-11-29
接受日期: 2005-12-02
在线出版日期: 2006-02-28
目的: 利用Y染色体体细胞的特异性来寻找卵圆细胞分化为肝癌细胞的直接证据, 从而为卵圆细胞源性的研究及临床肝癌治疗方法提供理论依据.
方法: 选择健康♂Wistar大鼠30只饲喂每千克含0.6 g 3-甲基-4-二甲基偶氮苯(DAB)的饲料4 wk, 建立卵圆细胞增生的♂Wistar大鼠动物模型. 卵圆细胞的分离、提取和鉴定(光镜、电镜、免疫组化). 将实验用♀Wistar大鼠60只随机平分成对照组和实验组. 对照组不接种细胞悬液, 连续喂含DAB饲料14 wk. 实验组按25 mg/kg体重戊巴比妥腹腔麻醉, 消毒开腹, 用吸取♂Wistar大鼠卵圆细胞悬液, 接种至肝脏包膜下, 每点106个, 之后连续喂含DAB饲料14 wk, 促进肝肿瘤的生成. 从GenBank调出雄性大鼠的SRY基因, 利用引物设计软件设计引物片断. 14 wk后提取两组大鼠肝肿瘤组织的基因组DNA, 利用所设计的引物进行PCR扩增, 对PCR产物进行电泳分析.
结果: 光镜下可找到卵圆细胞, 核仁小而清晰, 胞质少, 细胞体积较小, 约为正常肝细胞的1/3, 直径约9-12 μm不等. 电镜下观察可见细胞表面少量短而小的微绒毛突起, 呈现未分化细胞的形态. 免疫组化观察肝卵圆细胞胞质c-kit染色呈棕黄色阳性信号. 14 wk后对照组和实验组共计60只大鼠均见肝脏肿瘤生成, 肿瘤组织在外观上和性状上无显著性差异. 实验组电泳后见与设计片断长度相符的电泳阳性条带.
结论: 大鼠的卵圆细胞可以分化为肝癌细胞, 为卵圆细胞源性肝癌细胞的假说提供实验依据.
引文著录: 陈铁军, 方驰华, 朱明德. 利用大鼠Y染色体特异性PCR技术检测卵圆细胞源性肝癌细胞. 世界华人消化杂志 2006; 14(6): 563-567
Revised: November 29, 2005
Accepted: December 2, 2005
Published online: February 28, 2006
AIM: To find out the evidence that hepatic oval cells could differentiated into liver cancer cells, and to provide the theoretical basis for clinical therapy of liver cancer.
METHODS: Thirty male Wistar rats were fed with the animal food containing 0.6 g 3'3-diaminobenzidine (3'-Me-DAB) per kilogram for 4 weeks to establish the model of hepatic oval cell proliferation. Then the hepatic oval cells were extracted and identified by immunohistochemistry under light and electron microscope. Sixty female Wistar rats were randomly and averagely divided into experiment group and control group. The rats in the control group were fed with the DAB-containing food for 14 weeks without transplantation. While the rats in experiment group were narcotized with 25 mg/kg nembutal via abdominal cavity, and the male hepatic oval cells (in suspension) were inoculated (106 each point) under the liver envelope after the abdominal part was cut open. The rats received transplantation were also fed with DAB-containing food for 14 weeks to promote the formation of liver cancer. At the end of 14 wk, the DNA of cancer tissues was extracted from both groups. According to the GenBank, the specific primer of rat SRY gene was designed. Then the extracted DNA was amplified using the specific primer by polymerase chain reaction (PCR). The PCR product was analyzed by electrophoresis.
RESULTS: Under light microscope, hepatic oval cells were observed, showing the characteristics of small and clear nucleolus, small sizes (9-12 μm in diameter), which were one third of normal liver cells. By electron microscopy, hepatic oval cells manifested typical morphological features of undifferentiation, with some short and tiny microvillus on their surfaces. By immunohistochemistry, c-kit was positively expressed in the oval cells. At the end of 14 wk, liver tumor formed in both groups of rats, and the tumor characters and appearances had no significant difference between experiment and control group. The PCR product showed the same length of positive bands after electrophoresis at the designed ones.
CONCLUSION: Hepatic oval cells can differentiate into liver cancer cells.
- Citation: Chen TJ, Fang CH, Zhu MD. Detection of liver cancer cells originated from hepatic oval cells using rats' Y chromosome specific polymerase chain reaction technique. Shijie Huaren Xiaohua Zazhi 2006; 14(6): 563-567
- URL: https://www.wjgnet.com/1009-3079/full/v14/i6/563.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i6.563
近年来肝脏卵圆细胞的研究越来越受到人们的重视, 已成为近年的热点[5-7], 在组织胚胎学中发现: 肝脏干细胞来源于前肠内胚层, 是肝前体细胞. 在体内可分化为肝实质细胞或胆管上皮细胞[8-10]. 在临床研究中发现: 在肝脏损伤、肝硬化、肝癌这一递进式过程中, 人们发现卵圆细胞的大量增殖并参与肝脏损伤的修复. 卵圆细胞与肝癌细胞间是否有必然的联系? 至今未获得肝癌细胞来源于卵圆细胞的直接证据. 我们知道SRY基因是决定人类和其他哺乳动物性别的重要基因. 在1990年首先由Sinclair et al[11]揭示在哺乳动物包括人类的Y染色体短臂上存在着决定性别的主宰基因(sex-determining regin of the Y), 并定位于Yp11.3. 我们的目的就是利用Y染色体的这种特异性PCR技术检测卵圆细胞源性肝癌细胞.
(1)实验动物: 南方医科大学实验动物中心提供标准动物, 选择健康♂Wistar大鼠30只, ♀Wistar大鼠60只, 体质量为120±20 g. (2)实验试剂: 3'-甲基-4-二甲基偶氮苯(3'-me-DAB)(日本东京化成工业株氏会社), 他克莫司(Tarcrolimus)(日本藤泽药厂), SABC免疫组化试剂盒、小鼠抗大鼠c-kit抗体、癌胚抗原(AFP)(武汉博士德公司), DMEM(高糖)(北京鼎国生物技术有限责任公司), 胎牛血清、F12、Hanks液、PBS(广州威佳责任有限公司), Tris饱和酚、氯仿(中山大学遗传教研室提供), DNA抽提试剂盒、Taq DNA聚合酶(1.667×108 nkat/L)(中山大学达安基因诊断中心), 蛋白酶K(Serra公司), 琼脂糖(Promega公司), Marker(100 bp DNA LADDER)(大连宝生物公司), 所有引物合成(上海博亚公司), DTT(中山大学法医教研室). (3)主要仪器: 17597-K针头滤器(广州英韦创津公司), 日本Olympus BHSPM-10AD自动曝光显微照像系统, Olympus SIX70型倒置显微镜(日本Olympus公司), JEM-1200EX型电镜(日本电子株氏会社JEOL公司), 台式高速离心机(TGL-16G)(上海安亭科学仪器厂), 电子天平(BS210S)(日本Satorius公司), 紫外分光光度计(Shimadzu UV-1206)(日本Shimadzu公司), PCR扩增仪(美国PE公司PE 9600), GDS7600凝胶扫描系统(英国UVP公司), 水平式电泳仪(DF-23B)(北京东方仪器厂), 普通冰箱(中国青岛海尔公司). (4)其他实验所需物品由南方医科大学组胚教研室提供.
1.2.1 动物的分组及模型的制备: 选择健康♂Wistar大鼠30只, 体质量为120±20 g. 饲养温度为28 ℃, 湿度为40%-70%. 正常饲料喂养1 wk后, ♂Wistar大鼠30只饲喂含DAB饲料4 wk, 4 wk后随机抽取5只处死, 取肝脏, 多聚甲醛固定, 常规石蜡包埋. 所有蜡块均做5 μm厚连续切片, 用于HE染色和免疫组化, 做光镜、电镜、组织免疫组织化学鉴定卵圆细胞增生. 大鼠肝干细胞的分离、培养采用马俊勋 et al[12-13]提到的Percoll密度梯度离心法. 台盼蓝染色细胞活力达95%, 调整细胞浓度为5×105/mL接种于血清培养基, 在37 ℃ 50 mL/L CO2孵箱中培养. 提取♂Wistar大鼠的卵圆细胞悬液. 选择健康♀Wistar大鼠60只, 体质量为120±20 g, 随机均分成对照组和实验组. 对照组不接种♂Wistar大鼠卵圆细胞悬液, 连续喂含DAB饲料14 wk. 实验组按25 mg/kg体质量戊巴比妥腹腔麻醉, 消毒开腹, 用4号针头吸取♂Wistar大鼠卵圆细胞悬液, 接种至肝脏包膜下, 每点106个, 之后连续喂含DAB饲料14 wk, 促进肝肿瘤的生成, 用免疫抑制剂他克莫司0.1 mg/(kg·d)喂饲抑制免疫排斥反应.
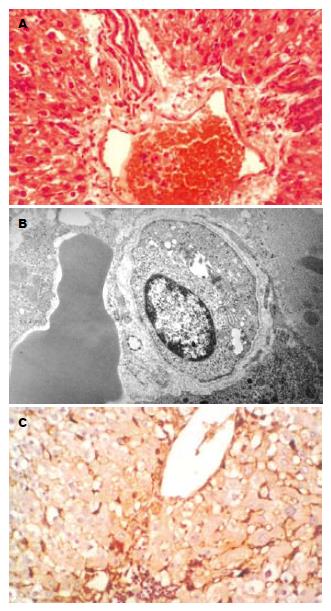
1.2.2 卵圆细胞的检测方法: (1)光镜: 标本采用多聚甲醛固定后, 依次放入70 mL/L、80 mL/L、90 mL/L、95 mL/L酒精脱水各2 h, 1 000 mL/L酒精脱水两次各1 h, 最后将标本放入二甲苯中透明, 透明后放入石蜡中包埋, 恒温箱37 ℃过夜, 第二日见标本已被石蜡充分浸润固定于包埋器皿中变硬, 即可做切片. 将蜡块固定于标本台, 用石蜡切片机切成厚度为4-8 μm的切片. 将切片放入40 ℃温水中, 展平, 将载玻片伸入水中在切片下托起, 置于37 ℃烤箱中烤干, HE染色, 光镜下观察. (2)透射电镜: 另取门脉处肝脏组织大小2 mm×2 mm×2 mm于4 ℃下用多聚甲醛戊二醛(pH 7.3)固定4 h, 磷酸蔗糖缓冲液冲洗, 锇酸固定1 h, 系列酒精及丙酮脱水, Epon812渗透包埋, 制成超薄切片; 醋酸双氢铀及枸橼酸铅双重染色[14], JEM-1200EX型透射电镜观察并拍照. (3)免疫组织化学: 肝组织c-kit抗体的检测: 采用SABC免疫组化染色法, 连续石蜡切片经脱蜡至水后, 以30 mL/L过氧化氢溶液浸泡10 min灭活内源性过氧化物酶, 抗原热修复后以正常山羊血清封闭, 加c-kit抗体4 ℃过夜, 加生物素标记的第二抗体37 ℃ 45 min, 加结合过氧化物酶链霉亲和素37 ℃ 45 min, 加DAB显色剂, 镜下观察并拍照. 棕黄色染色者为阳性细胞.
1.2.3 标本收集: 14 wk后提取两组大鼠肝肿瘤组织置-20 ℃低温冰箱保存, 备以后集中抽提基因组DNA. DNA模板的制备主要按照经典的酚氯仿抽提方法和中山大学达安基因诊断中心组织细胞DNA抽提试剂盒说明进行. (1)酚氯仿抽提方案: 取10 mg组织, 用研钵研磨碎, 加入500 μL STE、3.5 μL蛋白酶K, 56 ℃消化2-3 h, 定期倒转混匀; 加入等体积的Tris饱和酚充分混匀5 min, 8 000 g离心10 min, 取上清, 加入1/2体积的Tris饱和酚和1/2体积氯仿充分混匀5 min, 8 000 g离心10 min; 取上清加入1/10体积3 moL/L 醋酸钠和2倍体积的预冷无水乙醇, 轻轻混匀至可见絮状DNA沉淀; 用干净吸管或枪头将絮状DNA挑出, 加入预冷的75 mL/L乙醇, 10 000 g离心后弃上清液, 自然晾干, 加入100 μL TE溶解DNA, 4 ℃或-20 ℃保存备用. (2)抽提的DNA用紫外分光光度计测波长260 nm、280 nm处的吸光度(A)值, 计算两者比值并算出所抽提DNA量.
1.2.4 引物的设计和PCR检测: 从GenBank调出♂大鼠的SRY基因, 用ABI公司primer express引物设计软件设计如下: SRY 68F: 5'AGGCGCAAGTTGGCTCAAC3'; SRY 168R: 5'GGCCTTTTTTCGGCTTCTG3'产物长度101 bp. SRY PCR反应体系: 反应总体积25 μL. 5×PCR Buffer 5 μL, dNTP(10 mmoL/L)0.5 μL, 引物SRY 1 μL, Taq DNA聚合酶(1.667×108 nkat/L) 0.15 μL, 模板DNA 1 μL, 补足灭菌去离子水至总体积25 μL. PCR反应条件: PE 9 600扩增仪上, 93 ℃ 预变性3 min, 93 ℃ 30 s, 55 ℃ 25 s, 72 ℃ 45 s, 共30个循环, 72 ℃延伸10 min. 反应后检测: 取8 μL扩增产物在20 g/L琼脂糖凝胶电泳25 min后, 紫外灯下观察、拍照.
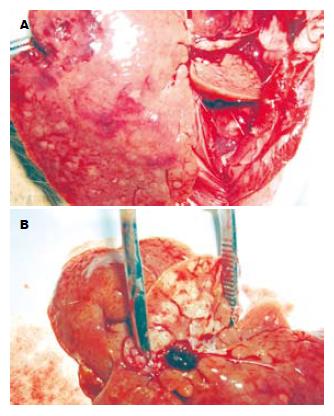
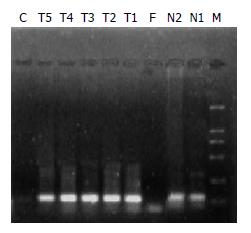
光镜下HE染色观察均可找到卵圆细胞, 细胞核呈卵圆形, 核仁小而清晰, 胞质少, 细胞体积较小, 约为正常肝细胞的1/3, 直径约9-12 μm不等. (图1A). 电镜下观察可见核浆比较大, 核仁明显, 胞质内细胞器少, 仅见少量线粒体和内质网, 细胞表面见少量短而小的微绒毛突起, 呈现未分化细胞的形态(图1B). 免疫组化观察肝卵圆细胞胞质c-kit染色呈棕黄色阳性信号(图1C). 对照组不接种♂Wistar大鼠卵圆细胞悬液, 连续喂DAB 14 wk后解剖, 见全部肝脏组织都有肿瘤生成, 肿瘤组织呈现结节状或者菜花状. 实验组接种♂Wistar大鼠卵圆细胞悬液, 之后连续喂DAB 14 wk后解剖, 见全部肝脏组织都有肿瘤生成, 肿瘤组织也呈现结节状、菜花状, 与对照组的肿瘤组织在外观上和性状上(AFP均阳性)无显著性差异(图2A-B). 由电泳条带(图3)可见: ♂大鼠与肿瘤组织样本有相同的电泳条带(N1, N2与T1, T2, T3, T4, T5相同), ♂大鼠与♀大鼠有不相同的电泳条带(N1, N2与F不相同), 电泳阴性对照泳道未见任何电泳条带.
许多证据表明, SRY基因在胚胎的极早期决定着原始性腺向睾丸发育, 该结论经Koopman et al[15]转基因小鼠实验证明. 国外有人用Y染色体荧光原位杂交法追踪骨髓源干细胞[16]. 由于真核表达载体表达效率和表达时限[17-18]的限制, 移植到体内的基因标记的干细胞常不能被检测到. 相反Y染色体是♂个体的特异性基因结构[19], 不受时间和细胞表型变化的影响, 为此, 我们拟用Y染色体体细胞的特异性来寻找卵圆细胞在体内分化为肝癌细胞的直接证据. 采用Wistar大鼠作为实验动物, 先建立♂大鼠卵圆细胞增生动物模型, 把分离出的♂大鼠肝脏卵圆细胞接种于♀大鼠肝内, 然后对♀大鼠进行致癌剂诱导, 分析♀大鼠肝癌细胞的来源. 如果在癌细胞中发现有Y染色体(+)的细胞可以证明植入的卵圆细胞可以在体内分化为肝癌细胞, 从而得出肝癌细胞可以来源于卵圆细胞的直接证据. 利用PCR加电泳对照的方法来检验卵圆细胞源性的肝癌细胞, 国内文献中未见有类似报道. 肝卵圆细胞的肝脏移植国内文献可供参考的经验很少, 我们用他克莫司0.1 mg/(kg·d)喂饲抑制免疫排斥效果良好[20], 提高了移植成活率. 他克莫司是由日本藤泽制药公司于1982年提取的一种真菌代谢产物, 该药对T细胞具有选择性抑制作用, 主要是通过抑制TH细胞释放IL-2、IL-3、IFN-γ, 以及抑制IL-2R的表达而发挥其强大的免疫抑制作用. 适用于防治器官移植后的排斥反应, 据报道其临床疗效是环孢霉素A(CsA)的100倍. 他克莫司能减少肝肾移植受体的急、慢性排斥反应[21-24], 尤其是该药品有较强的亲肝性, 对肝移植的功效高100倍. 移植♂卵圆细胞的肿瘤肿块组织有与设计片段长度相符的电泳阳性条带, 且与♂大鼠的条带相同, 说明肝癌细胞存在卵圆细胞源性, 即可以来源于卵圆细胞, 结论明确可靠. 电泳阴性对照(图3中的C条带)泳道未见任何电泳条带, 说明标本未被污染, 如出现电泳条带则表明标本可能被污染.
在肝脏损伤、肝硬化、肝癌这一递进式过程中, 人们发现卵圆细胞的大量增殖并参与肝脏损伤的修复. 卵圆细胞与肝癌细胞间是否有必然的联系? 至今未获得肝癌细胞来源于卵圆细胞的直接证据. 在哺乳动物包括人类的Y染色体短臂上存在着决定性别的主宰基因(sex-determining regin of the Y), 并定位于Yp11.3. 我们的目的就是利用Y染色体的这种特异性PCR技术检测卵圆细胞源性肝癌细胞, 寻找卵圆细胞分化为肝癌细胞的直接证据, 从而为卵圆细胞源性的研究及临床肝癌治疗方法提供理论依据.
利用PCR加电泳对照的方法来检验卵圆细胞源性的肝癌细胞, 国内文献中未见有类似报道. 本实验证明大鼠的卵圆细胞可以分化为肝癌细胞, 为卵圆细胞源性肝癌细胞的假说提供实验依据.
本文旨在研究肝癌细胞的来源, 有重要研究意义, 作者采用Y染色体特异性基因SYB作为标志来追踪检测肝癌细胞的来源有一定新颖性.
电编: 李琪 编辑:张海宁
| 10. | Tian YW, Smith PC, Teoh GC. The oval-shaped cells as a candidate for a liver sten in embryonic, neonatal and precancerous liver: indentification based on morphology immunohistochemical staining for albumin and pyruvate kinase isoenzyme expression. Histo-chem Cell Hiol. 1997;107:243-250. |
| 11. | Sinclair AH, Berm P, Palmer MS, Hawkins JR, Griffiths BL, Smith MJ, Foster JW, Frischauf AM, Lovell-Badge R, Goodfellow PN. A gene from the human sex-determining region encode a protein with homology to conserved DNA-binding merif. Nature. 1990;346:240-244. |
| 15. | Koopman P, Gubbay J, Vivian N, Goodfellow P, Lovell-Badge R. Male development of chromosomally female mice transgenic for Sry. Nature. 1991;351:117-121. |
| 16. | Eglitis MA, Mezey E. Hematopoietic cells differentiate into both microglia and macroglia in the brains of adult mice. Proc Natl Acad Sci USA. 1997;94:4080-4085. |
| 17. | Grove JE, Lutzko C, Priller J, Henegariu O, Theise ND, Kohn DB, Krause DS. Marrow-derived cells as vehicles for delivery of gene therapy to Pulmonary epithelium. Am J Respir Cell Mol Biol. 2002;27:645-651. |
| 18. | Robbins PB, Skelton DC, Yu XJ, Halene S, Leonard EH, Kohn DB. Consistent, persistent expression from modified retroviral vectors in murine hemato-poietic stem cells. Proc Natl Acad Sci USA. 1998;95:10182-10187. |
| 21. | Pirsch JD, Miller J, Deierhoi MH, Vincenti F, Filo RS. A comparison of tacrolimus(FK506) and cyclosporine for immunosuppression after cada-veric renal transplantation. Transplantation. 1997;15:977-983. |
| 22. | Mayer AD, Dmitrewski J, Squifflet JP, Besse T, Grabensee B, Klein B, Eigler FW, Heemann U, Pichlmayr R, Behrend M. Multicenter randomized trial comparing tacrolimus (FK506) and cyclosporine in the prevention of renal allograft rejection:a report of the European Tacrolimus Multicenter Renal Study Group. Transplantation. 1997;15:436-443. |
| 23. | Reimer J, Franke GH, Philipp T, Heemann U. Quality of life in kidney recipients: comparison of tacrolimus and cyclosporine-microemulsion. Clin Transplant. 2002;16:48-54. |
| 24. | Henry Ml. Cyclosporine and tacrolimus(FK506):a comparison of efficacy and safety profiles. Clin Transplant. 1999;13:209-220. |