修回日期: 2005-12-25
接受日期: 2006-01-07
在线出版日期: 2006-02-08
目的: 探讨血小板活化因子(platelet activating factor, PAF)受体拮抗剂对肠黏膜上皮细胞间紧密连接蛋白ZO-1的影响.
方法: 18日龄Wistar大鼠, 随机分为对照组, 内毒素组(LPS组)和PAF受体拮抗剂组(预防组和治疗组). LPS组和对照组分别腹腔注射内毒素(5 mg/kg)和生理盐水(1 mL/kg). 预防组和治疗组分别于每一时相点注射LPS前、后30 min腹腔注射PAF受体拮抗剂BN52021(5 mg/kg). 按时间点分别处死动物, 取回肠用于电镜观察, 免疫组化及RT-PCR检测ZO-1.
结果: 电镜下对照组肠微绒毛及细胞间紧密连接未见异常. 实验组上皮细胞连接增宽; 微绒毛变细、稀疏, 部分断裂、脱落; 细胞器受损. 拮抗剂组改变较实验组减轻. 紧密连接蛋白ZO-1正常时均匀一致地分布于小肠上皮细胞连接处的尖端, 呈蜂巢状, 实验组ZO-1分布不均, 染色变淡. 免疫组化平均光密度值及RT-PCR结果可见LPS组ZO-1表达明显低于对照组, 6 h表达最低, 光密度从对照组0.224 7降至LPS组0.198 5, ZO-1 mRNA从1.18降至0.16(P<0.01). 预防组及治疗组变化趋势同LPS组, 6 h预防组及治疗组光密度分别为0.199 2和0.203 8, ZO-1 mRNA分别为0.47和0.53, 与对照组相比均有显著差异(P<0.01). 各时相点ZO-1较LPS组高, 预防组较治疗组ZO-1略低, 无统计学差异.
结论: PAF可降低肠道紧密连接蛋白ZO-1, 从而损害肠道的屏障功能, 而PAF受体拮抗剂可减轻肠道屏障功能损伤的程度.
引文著录: 王丽杰, 刘春英, 许玲芬, 高红, 姜卫国, 孙梅. 血小板活化因子受体拮抗剂对幼年大鼠肠黏膜上皮细胞间紧密连接蛋白的影响. 世界华人消化杂志 2006; 14(4): 392-397
Revised: December 25, 2005
Accepted: January 7, 2006
Published online: February 8, 2006
AIM: To investigate the effect of platelet acti-vating factor (PAF) receptor antagonist on the tight junction associated protein ZO-1 (zonula occludens-1) between epithelial cells of intestinal mucosa in young rats.
METHODS: Eighteen day-old Wistar rats were randomly assigned into lipopolysaccharide (LPS) group, PAF receptor antagonist (prevention and treatment) group and control group. The rats in LPS and control group were intraperitoneally injected with LPS (5 mg/kg) and normal saline (1 mL/kg), while the rats in prevention and treatment group were intraperitoneally injected with PAF receptor antagonist BN52021 (5 mg/kg) 30 min before and after LPS injection. Terminal ileum of each rat was collected for transmission electron microscopy. The expression of ZO-1 was determined by immunohistochemistry and reverse transcription polymerase chain reaction (RT-PCR) at both protein and mRNA level.
RESULTS: Microvilli and tight junctions were intact in control group. Enlargement of tight junctions were observed in LPS group and microvilli were thin, rare or disrupt, and shed. The rough endoplasmic reticulum, mitochondria, and glycogen particles were damaged. The above changes were alleviated in PAF receptor antagonist group. The staining of ZO-1 in the control rats was similar to a honeycomb, which reflected a continuous and uniform distribution localized at the apical portion of cell-to-cell contact of the enterocytes. In LPS group, the signals of ZO-1 were disrupted and irregularly distributed at the outer enterocyte periphery. The content of ZO-1 was obviously lower in LPS group than that in the control group at 6 h (optical density: 0.198 5 ± 0.015 9 vs 0.224 7 ± 0.021 0, P < 0.01; mRNA: 0.16 ± 0.02 vs 1.18 ± 0.09, P < 0.01). The content of ZO-1 was also significantly decreased in prevention and treatment group in comparison with that in control group at 6 h (optical density: 0.199 2 ± 0.008 7, 0.203 8 ± 0.006 7 vs 0.224 7 ± 0.021 0, P < 0.01; mRNA: 0.47 ± 0.08, 0.53 ± 0.21 vs 1.18 ± 0.09, P < 0.01). Meanwhile, the level of ZO-1 in prevention and treatment group was higher than that in LPS group at different time points, but there were no marked differences.
CONCLUSION: PAF may decrease tight junction associated protein ZO-1 and thereby damage the function of intestinal barrier. PAF receptor antagonist can alleviate the degree of the damages to some extent.
- Citation: Wang LJ, Liu CY, Xu LF, Gao H, Jiang WG, Sun M. Effect of platelet activating factor receptor antagonist on tight junction associated protein between epithelial cells of intestinal mucosa in young rats. Shijie Huaren Xiaohua Zazhi 2006; 14(4): 392-397
- URL: https://www.wjgnet.com/1009-3079/full/v14/i4/392.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i4.392
肠源性感染是儿科危重症中胃肠功能障碍的常见病因之一, 其发病机制与肠屏障功能破坏密切相关, 紧密连接蛋白ZO-1是肠屏障的重要组成部分. 近年来血小板活化因子(platelet activating factor, PAF)在胃肠黏膜损害中的作用日益受到重视. 由于PAF通过其受体发挥作用, 故我们应用PAF受体拮抗剂对PAF在幼年大鼠内毒素血症模型中肠黏膜上皮细胞间紧密连接蛋白ZO-1的影响作初步研究.
健康18日龄Wistar大鼠, 平均体质量32.21±6.67 g, 与母鼠共同饲养, 由中国医科大学附属第二临床学院实验动物中心提供. PAF(1-O-hexadecyl-2-acetyl-sn-glycero-3-phosphocholine, Sigma公司). PAF受体拮抗剂BN52021(Ginkgolide B, Sigma公司). 内毒素LPS(lipopolysaccharide, O55: B5脂多糖, Sigma公司). 鼠抗ZO-1紧密连接多聚单克隆抗体(CHEMICON公司). SP-9000免疫组化染色试剂盒(北京中杉金桥生物技术有限公司). RNA裂解液、总RNA提取试剂盒(上海华美生物工程公司). TaKaRa试剂盒及DNA Marker(大连宝生物公司). Primer由上海博亚生物技术有限公司合成. 日本电子JEM100CX-Ⅱ型透射电镜, OLYMPUS-BX41图像采集系统. 美国Meta Morph/DP10/BX41软件分析系统. 紫外分光光度计UV-1201型(日本). 自动电泳凝胶成像分析仪ALPHAINNOTECH ChemiImager5500(美国). PTR-100PCR扩增仪(美国). KODAK ID型凝胶成像分析系统(美国).
随机分为对照组(n = 8), 内毒素组(LPS组)和PAF受体拮抗剂组(预防组和治疗组), 每一时相点(1.5, 3, 6, 24, 48, 72 h)各8只. 对照组腹腔注射生理盐水1 mL/kg, LPS组腹腔注射内毒素5 mg/kg(1 mL/kg), 用生理盐水溶解. 预防组和治疗组分别于每一时相点注射LPS前、后30 min腹腔注射PAF受体拮抗剂BN52021 5 mg/kg. BN52021用二甲基亚砜配成20 g/L, 用药当天37℃水浴, 再用无菌生理盐水配成5 g/L. 用药后各组均放回鼠笼, 继续哺乳, 直至实验结束. 按时间点分别处死动物, 距回盲部3 cm处环形切取回肠.
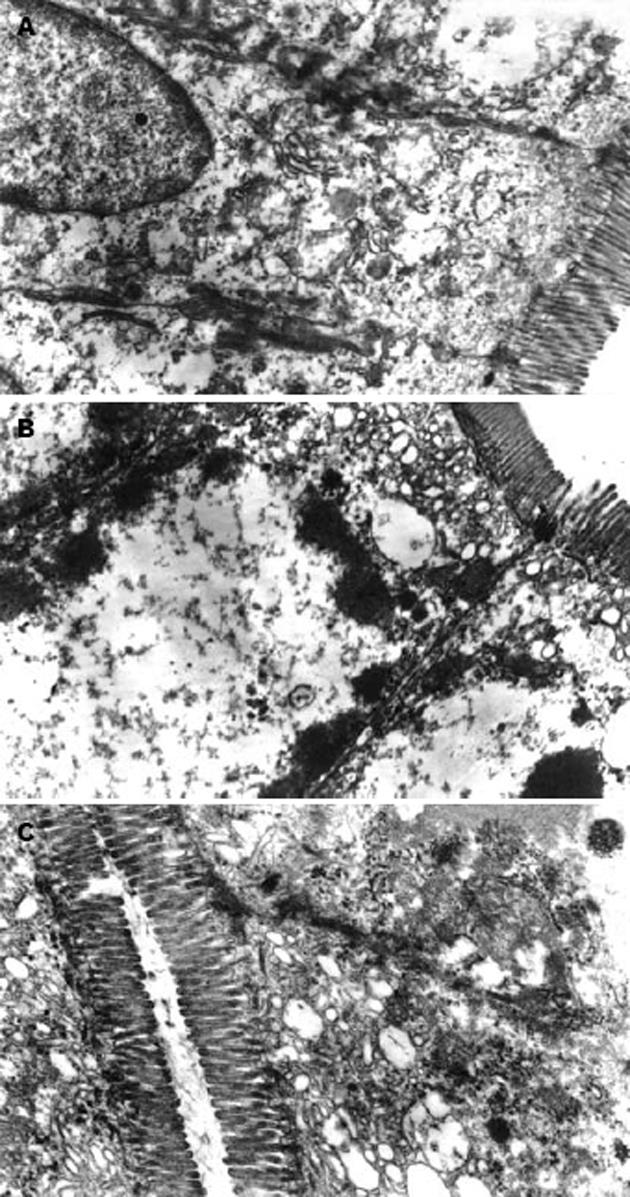
1.2.1 电镜观察: 回肠于25 g/L戊二醛溶液中固定, 取1 mm3小块若干用10 g/L锇酸双固定, 乙醇梯度脱水, 环氧树脂Epon812包埋, LKB超薄切片机切片, 厚度0.05 μm, 钠、铅双染色, 透射电镜下观察.
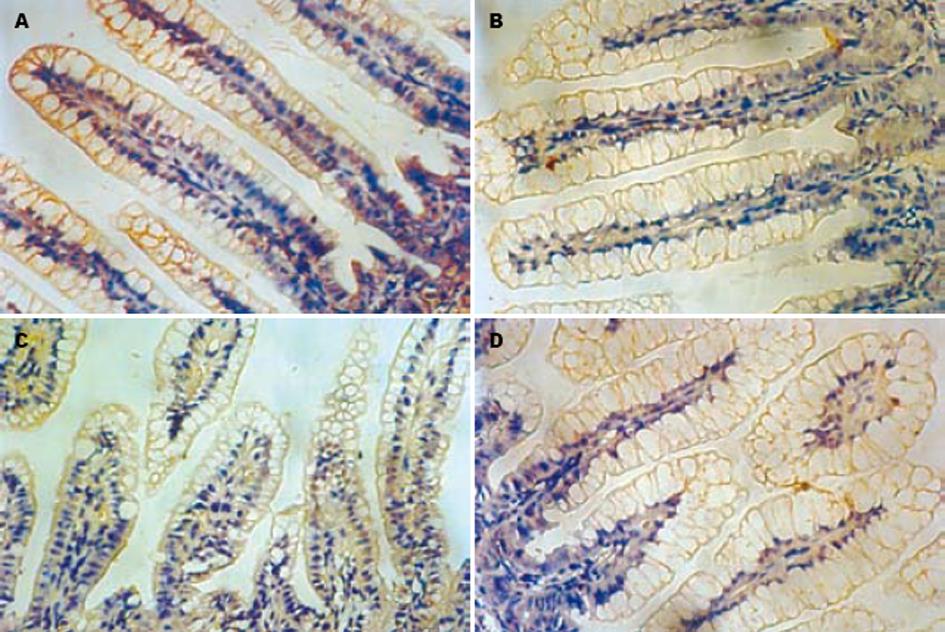
1.2.2 免疫组织化学技术检测回肠ZO-1蛋白: 回肠于40 g/L甲醛溶液中固定, 包埋, 石蜡切片. 免疫组化应用S-P法(过氧化物酶标记的链霉卵白素法, streptavidin/peroxidase)测定ZO-1, 按常规S-P法操作步骤进行. 鼠抗ZO-1紧密连接多聚单克隆抗体稀释比例1∶75. 每个时间点选取染色清晰的切片5-8张, 于光镜下(×40)随机选取2-3个视野, 应用OLYMPUS-BX41图像采集系统, Meta Morph/DP10/BX41软件分析系统测定平均光密度值(optical density average).
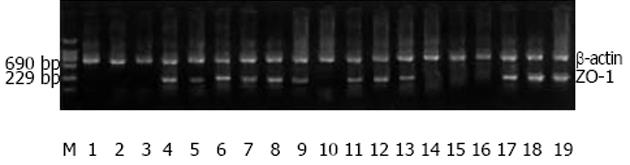
1.2.3 RT-PCR检测回肠ZO-1 mRNA的表达: TRIZOL裂解待测的回肠组织, 用酚-氯仿抽提总RNA, 逆转录合成cDNA后进行PCR扩增, 反应总体积25 µL, ZO-1正义引物序列: 5'-AAT GCT GCT TTA TTGGG-3'; 反义序列: 5'-AGTGGT TGG TGG TCT TCT-3', 扩增长度229 bp. b-肌动蛋白正义引物序列: 5'-CAC CCT GTG CTG CTC ACC GAG GCC-3'; 反义序列: 5'-CCA CAC AGA TGA CTT GCG CTC AGG-3', 扩增长度690 bp. ZO-1的反应条件: 94℃变性3 min, 然后进行PCR反应共35次循环: 94℃变性45 s, 47.5℃退火1 min, 72℃延伸1 min, 最后行72℃延伸27 min. b-肌动蛋白PCR反应35次循环: 94℃变性30 s, 55℃退火1 min, 72℃延伸1 min 30 s. 取PCR反应产物10 µL加入2 g/L琼脂糖凝胶中电泳, 应用计算机凝胶成像分析系统处理软件量化PCR扩增产物. 基因相对表达量 = 待测基因光密度值/内参照光密度值.
统计学处理 采用SPSS 10.0数据分析软件, 所有数据用mean±SD表示, 组间比较采用方差分析LSD法(least significant difference), P<0.05为有统计学意义.
对照组肠黏膜上皮细胞表面微绒毛排列整齐, 柱状上皮细胞结构完整; 细胞质内细胞器丰富, 结构未见异常; 细胞间连接紧密(图1A). 实验组上皮细胞连接增宽; 微绒毛变细、稀疏、排列不整、呈倒伏状, 部分断裂、脱落; 线粒体严重肿胀, 嵴肿胀、断裂甚至消失, 呈空泡变性, 内质网扩张, 核糖体脱落, 染色质浓缩分布在核周边, 可见核碎裂. 拮抗剂组改变较实验组减轻(图1B, C).
紧密连接蛋白ZO-1正常时均匀一致地分布于小肠上皮细胞连接处的尖端, 呈蜂巢状(图2A). 实验组ZO-1分布不均, 染色变淡(图2B-D). 免疫组化平均光密度值可见LPS组ZO-1蛋白表达明显低于对照组, 6 h表达最低, 预防组及治疗组变化趋势同LPS组, 各时相点ZO-1较LPS组高, 预防组较治疗组ZO-1略低, 无统计学差异(表1).
胃肠道黏膜的损伤会引起肠道通透性增加、肠道细菌和内毒素移位、释放大量炎性介质等, 其结果可能导致脓毒症、其他器官损伤, 最终导致多系统器官功能衰竭(multiple system organ failure, MSOF). 肠黏膜通透性增高, 为肠腔内毒素及其他毒素吸收入血提供了机会, 也是肠道细菌移位的病理基础. 防止细菌移位的屏障由以下几部分构成: (1)肠道连续的黏膜上皮构成的机械屏障; (2)由肠道淋巴样组织细胞网提供的细胞及体液免疫系统; (3)正常的、大量的肠道厌氧菌群, 防止致病微生物的过度增生及在肠道黏膜的定植. 其中任一部分或几部分遭到破坏, 都会造成细菌移位, 因此肠道屏障功能备受学者关注[1-3]. 肠黏膜的机械屏障由肠表面黏液、微绒毛、肠黏膜上皮细胞及其间的紧密连接以及黏膜的特殊结构组成[4]. 肠上皮细胞间连接由紧密连接、黏附连接、缝隙连接等构成. 构成肠上皮细胞间连接的蛋白主要有ZO-1、occludin、cadheren、claudin和β-catenin等[5-8]. 这些分子直接或间接地与多种细胞内蛋白, 特别是骨架蛋白连接构成上皮细胞的紧密连接, 主要功能是作为选择性的细胞间屏障, 调节各种分子和离子的扩散[6,9,10]. ZO-1是膜相关鸟苷酸激酶家族成员之一, 与细胞质内的occludin和claudin相互作用[11-13], 同时也参与蛋白与蛋白相互作用的信号转导.
研究认为PAF在诸多参与胃肠黏膜损害的炎症介质中可能起到"中心放大"的介导作用[14]. 腹腔注射LPS, 能诱发肠组织产生内源性PAF[15]. PAF很可能是内毒素作用的主要效应因子. 已有实验证实[16], 用PAF和LPS引起的坏死性小肠结肠炎的改变相似, 用PAF受体拮抗剂WEB 2170可明显减轻LPS所致的肠坏死. 本文电镜结果可见, 应用拮抗剂后可明显改变肠道细胞损伤的程度, 使细胞器及细胞间连接的损伤较实验组减轻. 免疫组化及RT-PCR结果可见, 实验组应用内毒素后ZO-1蛋白及mRNA水平均明显降低, 6 h内改变明显, 随时间推移改变逐渐减轻; 应用拮抗剂后ZO-1下降程度较实验组减轻. 本文实验结果说明PAF在内毒素血症中可损伤肠道紧密连接蛋白ZO-1, 从而损伤肠道的屏障功能, 而PAF受体拮抗剂可降低肠道屏障功能损伤的程度.
另外, 本文研究结果显示, 治疗性应用BN52021较预防性应用效果稍好, 其原因可能由于预防性应用BN52021通过阻滞PAF与其受体结合而不能发挥PAF的生物效应, 但BN52021不能直接阻滞PAF的合成与释放; 而治疗性应用BN52021之所以疗效好是否由于BN52021不仅可直接阻滞已释放的PAF与其受体结合, 还可直接中和PAF, 有待于进一步研究. 另外, PAF的合成有两条酶促途径[17], 是否预防性应用BN52021大多与新生(denovo)途径合成的生理条件下的PAF的受体结合, 部分性阻滞其病理功能; 而治疗性应用BN52021大多与LPS激活后上调的PAF受体结合, 从而阻断其病理功能, 这一观点也有待于进一步证实. 但总的来说, 预防和治疗性应用特异性PAF受体拮抗剂BN52021作为有效的干预措施, 可维护肠道免疫屏障功能的稳定, 防治肠源性感染以减少对机体的继发损伤.
胃肠功能障碍与肠屏障功能破坏密切相关, 而紧密连接蛋白ZO-1是肠屏障的重要组成部分. 血小板活化因子可损害胃肠黏膜, 故我们应用PAF受体拮抗剂对PAF在幼年大鼠内毒素血症模型中肠黏膜ZO-1的影响作初步研究.
通过PAF受体拮抗剂对ZO-1的影响, 间接证明PAF对肠屏障功能的损害作用.
本文通过在内毒素血症模型中应用PAF受体拮抗剂对ZO-1的保护作用, 间接证明PAF对肠屏障功能存在损害作用.而其他相关文章多通过细菌移位等证明PAF可损害肠屏障功能.
ZO-1: 膜相关鸟苷酸激酶家族成员之一, 膜周蛋白质, 与膜内蛋白质如occludin和claudin相互作用,使膜内蛋白质与细胞质和细胞骨架紧密相连, 共同维持紧密连接和肠屏障功能的稳定.
肠黏膜上皮细胞间紧密连接蛋白具有很多重要的生理功能, 与IBD、IBS、肠源性感染等疾病的发生关系密切, 是临床基础研究的热点之一. 本文通过模拟肠源性感染, 并应用PAF受体拮抗剂防治, 探讨了PAF对紧密连接蛋白表达的影响, 研究新颖,选题准确, 有一定学术价值.
电编: 张敏 编辑:张海宁
| 2. | Zareie M, Riff J, Donato K, McKay DM, Perdue MH, Soderholm JD, Karmali M, Cohen MB, Hawkins J, Sherman PM. Novel effects of the prototype trans-locating Escherichia coli, strain C25 on intestinal epi-thelial structure and barrier function. Cell Microbiol. 2005;7:1782-1797. |
| 3. | McConnell KW, Coopersmith CM. Epithelial cells. Crit Care Med. 2005;33:S520-S522. [PubMed] [DOI] |
| 5. | Gonzalez-Mariscal L, Betanzos A, Nava P, Jaramillo BE. Tight junction proteins. Prog Biophys Mol Biol. 2003;81:1-44. [PubMed] [DOI] |
| 6. | Mazzon E, Sturniolo GC, Puzzolo D, Frisina N, Fries W. Effect of stress on the paracellular barrier in the rat ileum. Gut. 2002;51:507-513. [PubMed] [DOI] |
| 7. | Simonovic I, Rosenberg J, Koutsouris A, Hecht G. Enteropathogenic Escherichia coli dephos-phorylates and dissociates occludin from intestinal epithelial tight junctions. Cell Microbiol. 2000;2:305-315. [PubMed] [DOI] |
| 8. | Dublineau I, Lebrun F, Grison S, Griffiths NM. Functional and structural alterations of epithelial barrier properties of rat ileum following X-irradia-tion. Can J Physiol Pharmacol. 2004;82:84-93. [PubMed] [DOI] |
| 9. | Kimizuka K, Nakao A, Nalesnik MA, Demetris AJ, Uchiyama T, Ruppert K, Fink MP, Stolz DB, Murase N. Exogenous IL-6 inhibits acute infla-mmatory responses and prevents ischemia/reper-fusion injury after intestinal transplantation. Am J Transplant. 2004;4:482-494. [PubMed] [DOI] |
| 10. | Muza-Moons MM, Schneeberger EE, Hecht GA. Enteropathogenic Escherichia coli infection leads to appearance of aberrant tight junctions strands in the lateral membrane of intestinal epithelial cells. Cell Microbiol. 2004;6:783-793. [PubMed] [DOI] |
| 11. | Mitic LL, Schneeberger EE, Fanning AS, Anderson JM. Connexin-occludin chimeras containing the ZO-binding domain of occludin localize at MDCK tight junctions and NRK cell contacts. J Cell Biol. 1999;146:683-693. [PubMed] [DOI] |
| 12. | Baltes S, Nau H, Lampen A. All-trans retinoic acid enhances differentiation and influences permea-bility of intestinal Caco-2 cells under serum-free conditions. Dev Growth Differ. 2004;46:503-514. [PubMed] [DOI] |
| 13. | Weiler F, Marbe T, Scheppach W, Schauber J. Influ-ence of protein kinase C on transcription of the tight junction elements ZO-1 and occludin. J Cell Physiol. 2005;204:83-86. [PubMed] [DOI] |
| 14. | Anderson BO, Bensard DD, Harken AH. The role of platelet activating factor and its antagonists in shock, sepsis and multiple organ failure. Surg Gynecol Obstet. 1991;172:415-424. [PubMed] |
| 15. | Shindou H, Ishii S, Yamamoto M, Takeda K, Akira S, Shimizu T. Priming effect of lipopolysaccharide on acetyl-coenzyme A:lyso-platelet-activating factor acetyltransferase is MyD88 and TRIF independent. J Immunol. 2005;175:1177-1183. [PubMed] [DOI] |
| 16. | Ewer AK, Al-Salti W, Coney AM, Marshall JM, Ramani P, Booth IW. The role of platelet activating factor in a neonatal piglet model of necrotising enterocolitis. Gut. 2004;53:207-213. [PubMed] [DOI] |
| 17. | Ikeda O, Egami H, Ishiko T, Ishikawa S, Kamohara H, Hidaka H, Mita S, Ogawa M. Expression of proteinase-activated receptor-2 in human pancreatic cancer: a possible relation to cancer invasion and induction of fibrosis. Int J Oncol. 2003;22:295-300. [PubMed] [DOI] |