修回日期: 2006-07-18
接受日期: 2006-08-10
在线出版日期: 2006-11-28
目的: 构建针对人环氧合酶-2(COX-2)基因编码区的短发夹状RNA(shRNA)真核表达载体质粒, 观察其在不同时间点对人不同肝癌细胞株COX-2表达的影响.
方法: 以人COX-2 mRNA编码区作为RNA干扰靶点, 构建shRNA真核表达载体质粒WBH1和WBH2, 应用阳离子脂质体分别转染人肝癌细胞株HepG2和Bel7402, 利用逆转录聚合酶链反应和Western blot法分别观察两株细胞转染后24, 48, 72,和96 h COX-2 mRNA和蛋白的表达变化, 检测抑制效果.
结果: 质粒在HepG2细胞和Bel7402细胞中的转染率分别约为60%和54%. WBH1导入细胞24, 48, 72和96 h后, 逆转录聚合酶链反应检测COX-2 mRNA表达抑制率, HepG2细胞分别为18.5%, 88.6%, 52.8%和42.4%(P<0.01). Bel7402细胞分别为9%, 45.1%, 70.1%和56.3%(P<0.01). Western blot法检测蛋白表达抑制率, HepG2细胞分别为10.3%, 80.5%, 45.3%和39.0%(P<0.01); Bel7402细胞分别为8.3%, 40.2%, 66.4%和35.6%(P<0.01). 质粒WBH2对COX-2的表达无影响(P>0.05).
结论: 针对人COX-2的shRNA能高效特异的抑制不同肝癌细胞株的COX-2表达. HepG2细胞和Bel7402细胞分别以48 h和72 h抑制效果最明显.
引文著录: 王华枫, 徐可树, 钱伟, 汪步海. 短发夹状RNA对人肝癌细胞环氧合酶-2的抑制作用. 世界华人消化杂志 2006; 14(33): 3184-3189
Revised: July 18, 2006
Accepted: August 10, 2006
Published online: November 28, 2006
AIM: To construct the eukaryotic expression plasmids of short hairpin RNA (shRNA) specific to human cyclooxygenase-2 (COX-2) gene and observe their inhibitory effects on COX-2 expression in human hepatocellular carcinoma cells.
METHODS: Plasmids named WBH1 and WBH2, containing the different sequences of human COX-2 mRNA coding region, were constructed. The expression of COX-2 was assayed by reverse transcription-polymerase chain reaction (RT-PCR) and Western blot, respectively, 24, 48, 72 and 96 h after HepG2 and Bel7402 cells were transfected with liposomes.
RESULTS: The transfection rates in HepG2 and Bel7402 cells were about 60% and 54% respectively. RT-PCR showed that the inhibition efficiencies of the plasmid WBH1 were 18.5%, 88.6%, 52.8%, 42.4% in HepG2 cells and 9%, 45.1%, 70.1%, 56.3% in Bel7402 cells, respectively, 24, 48, 72 and 96 h after transfection (P < 0.01). Western blot demonstrated that the inhibition efficiencies of the plasmid WBH1 were 10.3%, 80.5%, 45.3%, 39.0% in HepG2 cells and 8.3%, 40.2%, 66.4%, 35.6% in Bel7402 cells, respectively (P < 0.01). The plasmid WBH2 had no significant inhibitory effect on COX-2 expression (P > 0.05).
CONCLUSION: COX-2 expression in human hepatocellular carcinoma cells can be inhibited significantly by construction of eukaryotic expression vector expressing the shRNA. The maximal inhibition occurs at the 48th and 72th h after transfection, respectively.
- Citation: Wang HF, Xu KS, Qian W, Wang BH. Silencing cyclooxygenase-2 gene by construction of eukaryotic expression vector expressing short hairpin RNA in human hepatocellular carcinoma cells. Shijie Huaren Xiaohua Zazhi 2006; 14(33): 3184-3189
- URL: https://www.wjgnet.com/1009-3079/full/v14/i33/3184.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i33.3184
肝癌的发生和发展是多因素、多步骤的过程. 环氧合酶-2(cyclooxygenase-2, COX-2)作为前列腺素生物合成过程中的一个重要限速酶, 在多种肿瘤的发生、发展和转移中起重要作用[1]. 研究表明COX-2在肝癌组织中呈高表达, 应用COX-2抑制剂能抑制肿瘤细胞生长并诱导其凋亡[2]. 作为特异性阻断基因表达的新方法, RNA干扰(RNA interference, RNAi)是近年来出现的一种基因沉默技术, 能快速、高效的阻滞肿瘤细胞或组织中异常或突变蛋白的表达, 目前已应用于基因功能、肿瘤及病毒性疾病等的研究[3-5]. 我们利用RNA干扰技术, 设计构建编码人COX-2 mRNA的短发夹状双链RNA(small hairpin RNA, shRNA)的质粒载体, 并转染人不同肝癌细胞株, 观察其对COX-2表达的影响, 同时探讨利用RNA干扰技术作为肿瘤基因治疗的一种方法.
pGenesil-1质粒、感受态大肠杆菌DH-5α购自武汉晶赛生物工程技术公司, 限制性核酸内切酶BamHⅠ, Hind Ⅲ,SalⅠ, PstⅠ, T4多聚核苷酸激酶和Taq酶购自大连宝生物工程有限公司, T4 DNA连接酶购自New England Biolabs, 凝胶回收试剂盒和小量质粒提取试剂盒购自宁波中鼎公司, 寡核苷酸DNA单链由上海博亚生物技术有限公司合成. 阳离子脂质体jetPEITM购自Biontex公司, COX-2, actin羊抗人多克隆一抗和辣根酶标记兔抗山羊IgG购自Santa Cruz公司. 人肝癌细胞株HepG2, Bel7402由消化内科实验室提供, 细胞用含100 mL/L胎牛血清(FCS)的RPMI 1640液, 置于37 ℃, 50 mL/L CO2孵育箱中培养, 定期观察细胞生长情况, 每2-3 d消化传代培养.
根据shRNA设计原则构建质粒[6]. 从人COX-2 mRNA编码区的起始密码(AUG)下游寻找两条以"AA"二联序列开始, 设计长度为21 nts的序列, 分别为5'-AAGTGCGATTGTACCCGGACA-3', 5'-AAGAACGTTCGACTGAACTGT-3', 同时设计一条非特异性序列: 5'-GACTTCATAAGGCGCATGC-3'作为阴性对照, 并利用BLAST查询排除与其他人源基因的同源性. 按下列结构设计并合成编码shRNA序列的DNA单链: BamHⅠ+Sense+Loop+Antisense+终止信号+SalⅠ+ HindⅢ, 黑色背景为Loop环和终止信号, 两端框中为限制性核酸内切酶BamHⅠ和HindⅢ部分酶切残基. 设计的编码两条靶序列如下. 序列1: 5'-GATCCGTGCGATTGTACCCGGACATTCAAGACGTGTCCGGGTACAATCGCACTTTTTTGAATTCA-3'; 3'-GCACGCTAACATGGGCCTGTAAGTTCTGCACAGGCCCATGTTAGCGTGAAAAAACTTAAGTTCGA-5'. 序列2: 5'-GATCCGAACGTTCGACTGAACTGTTTCAAGACGACAGTTCAGTCGAACGTTCTTTTTTGAGCTCA-3'; 3'-GCTTGCAAGCTGACTTGACAAAGTTCTGCTGTCAAGTCAGCTTGCAAGAAAAAACTCGAGTTCGA-5'. 阴性对照序列: 5'-GATCCGACTTCATAAGGCGCATGCTTCAAGACGGCATGCGCCTTATGAAGTCTTTTTTGTCGACA-3'; 3'-GCTGAAGTATTCCGCGTACGAAGTTCTGCCGTACGCGGAATACTTCAGAAAAAACAGCTGTTCGA-5'. 合成上述设计的双链DNA, 退火连接. 与BamHⅠ和Hind Ⅲ酶切的质粒pGenesil-1连接, 转化感受态细胞. 挑选克隆扩增, 质粒提取, 限制性核酸内切酶SalⅠ和PstⅠ做酶切鉴定, 对重组质粒测序(上海博亚), 验证序列的准确性. 序列1, 2分别将重组质粒命名为WBH1和WBH2, 阴性对照质粒命名为HK.
1.2.1 细胞转染: 将HepG2细胞和Bel7402细胞在含有100 mL/L FCS的RPMI 1640培养液中连续培养. 转染前1 d将两株细胞分别接种于6孔培养板, 每孔2×105个细胞, 过夜培养后将构建的WBH1, WBH2和HK 3种质粒分别转染细胞, 操作按脂质体jetPEITM转染手册进行. 取一试管加入质粒3 μg, 用100 μL 150 mmol/L NaCl混合稀释, 另一试管加入脂质体jetPEITM 6 μL, 用100 μL 150 mmol/L NaCl混合稀释. 室温无菌条件下放置5 min, 两试管液体混合后放置25 min, 在6孔板中每孔加入量为200 μL混合液后培养4 h, 更换培养液继续培养. 实验以未转染细胞为空白对照组, 细胞分4组: 空白对照组、WBH1转染组、WBH2转染组、HK转染组. 每组设3复孔, 每个实验均重复3次. 转染后48 h, 荧光显微镜下观察10个200倍视野下发绿色荧光的细胞占全部细胞的百分比例即为细胞转染率.
1.2.2 COX-2 mRNA表达的测定: 转染后24, 48, 72和96 h, 用TRIzol法分别提取各组细胞中总RNA, RT-PCR法分别扩增COX-2 mRNA, COX-2上游引物5'-TCAAGTCCCTGAGCATCTAC-3', 下游引物5'-CATTCCTACCACCAGCAACC-3'. PCR法反应条件为94 ℃ 5 min, 94 ℃ 30 s, 55 ℃ 30 s, 72 ℃ 45 s, 共35个循环, 循环结束后72 ℃ 6 min延伸, 扩增片段长度为488 bp. β-actin为内参照, β-actin上游引物为5'-GAAACTACCTTCAACTCCATC-3', 下游引物为5'-CGAGGCCAGGATGGAGCCGCC-3', PCR法反应条件为94 ℃ 5 min, 94 ℃ 30 s, 48 ℃ 30 s, 72 ℃ 45 s, 共35个循环, 循环结束后72 ℃ 6 min延伸, 扩增片段长度为219 bp. 扩增产物用15 g/L琼脂糖凝胶电泳检测结果, 在凝胶成像系统中测出各条带面积灰度值, 以各组COX-2与自身β-actin灰度值的比作为各组细胞中COX-2 mRNA的相对含量.
1.2.3 Western blot法对COX-2蛋白表达测定: 转染后24, 48, 72和96 h, 收集上述各组细胞, 消化后加入预冷的细胞裂解液, 置冰上30 min, 4 ℃, 12 000 g离心, 取上清液进行蛋白定量, 每组取50 mg蛋白加热变性后, 100 g/L SDS-PAGE电泳分离, 转移至PVDF膜上, 含50 g/L脱脂奶粉的Tris盐溶液封闭2 h, 加入COX-2羊抗人多克隆一抗(1:200), 4 ℃孵育过夜. 用含吐温-20的Tris盐溶液洗膜3次, 加入辣根过氧化物酶标记的兔抗羊二抗(1:2000), 室温下孵育1 h. 化学发光法(ECL法)检测条带. actin作为内参. 计算机扫描图像, 测出各条带面积灰度值, 以各组COX-2与自身actin灰度值的比作为各组细胞中COX-2蛋白的相对含量.
统计学处理 PCR法及Western blot法所得相应的条带, 采用美国Biorad公司Quantity One 4.0图像分析软件进行扫描分析, 采用SPSS 10.0统计软件包进行单因素方差分析.
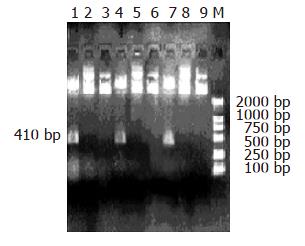
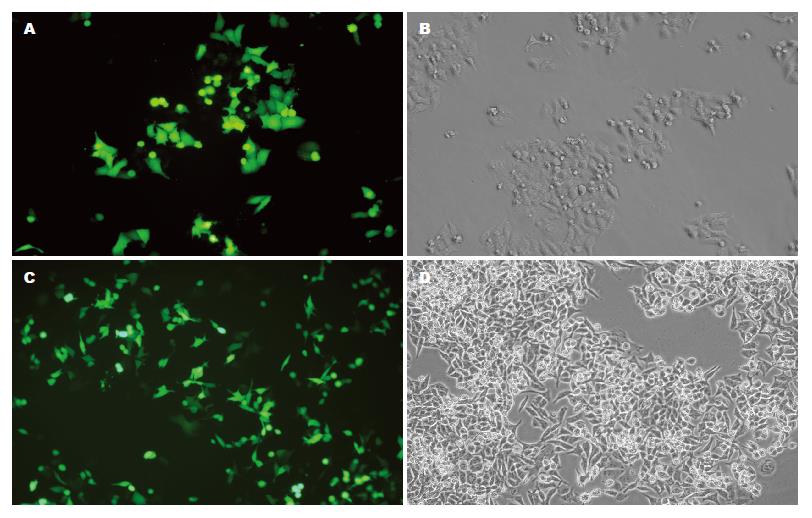
我们共得到3个重组质粒, 编码两条靶序列的重组质粒WBH1, WBH2及阴性对照质粒HK. 质粒pGenesil-1能够被PstⅠ所酶切, 而插入目的基因片段之后, PstⅠ酶切位点被取代, 不能被PstⅠ所酶切. pGenesil-1序列中无SalⅠ的酶切位点, 在插入的目的基因片段里, 我们设计了一个SalⅠ的酶切位点, 如若插入正确, 就能被SalⅠ酶切出一条约410 bp的条带, 重组shRNA表达质粒WBH1, WBH2和HK均能被SalⅠ酶切, 而不能为PstⅠ酶切, 即为插入正确的质粒(图1). 质粒中含有编码绿色荧光蛋白的基因, 转染后48 h荧光显微镜下以10个200倍视野下有绿色荧光的细胞占全部细胞的百分比计算转染率. HepG2细胞WBH1转染组、WBH2转染组和HK转染组转染率分别为60.20%±1.95%, 60.30%±1.00%, 60.84%±0.05%(图2A-B). Bel7402细胞WBH1转染组、WBH2转染组和HK转染组转染率分别为54.19%±1.09%, 54.10%±0.83%, 54.21%±0.78%(图2C-D). 两株细胞3组间转染率均无统计学差异(P>0.05).
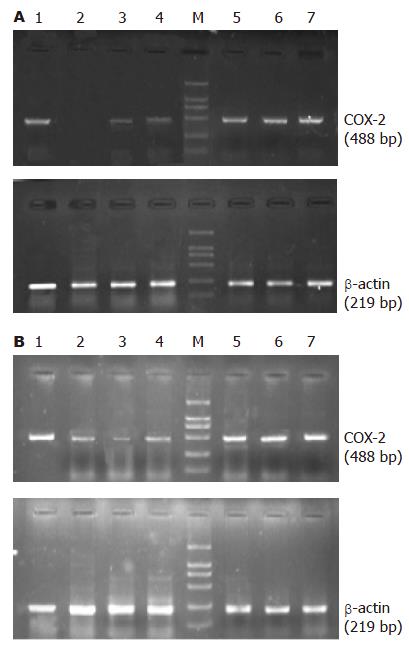
如表1所示, HepG2细胞WBH2转染组与HK转染组COX-2相对表达量分别为0.607±0.054, 0.610±0.041, 与空白对照组(0.614±0.048)比较无显著差异(P>0.05, 图3A). 转染后24, 48, 72, 96 h, WBH1转染组COX-2相对表达量分别为0.500±0.012, 0.070±0.023, 0.290±0.010, 0.354±0.018, 与空白对照组比较有显著差异(P<0.01, 图3A). 24, 48, 72, 96 h抑制率分别为18.5%, 88.6%, 52.8%, 42.4%. 质粒WBH1对HepG2细胞COX-2 mRNA的表达以48 h时间点的抑制率最高, 以后逐渐下降. Bel7402细胞WBH2转染组与HK转染组COX-2相对表达量分别为0.720±0.018, 0.723±0.020, 与空白对照组(0.726±0.024)比较无显著差异(P>0.05, 图3B). WBH1转染组COX-2相对表达量分别为0.660±0.020, 0.398±0.014, 0.217±0.031, 0.354±0.038, 与空白对照组比较有显著差异(P<0.01, 图3B). 24, 48, 72, 96 h抑制率分别为9.0%, 45.1%, 70.1%, 56.3%. 质粒WBH1对Bel7402细胞COX-2 mRNA的表达以72 h时间点的抑制率最高, 以后逐渐下降.
| 指标 | 细胞 | 空白对照 | HK | WBH2 | WBH1 | |||
| 24 h | 48 h | 72 h | 96 h | |||||
| mRNA | HepG2 | 0.614±0.048 | 0.610±0.041 | 0.607±0.054 | 0.500±0.012b | 0.070±0.023b | 0.290±0.010b | 0.354±0.018b |
| Bel7402 | 0.726±0.024 | 0.723±0.020 | 0.720±0.018 | 0.660±0.020b | 0.398±0.014b | 0.217±0.031b | 0.354±0.038b | |
| 蛋白 | HepG2 | 0.415±0.023 | 0.403±0.017 | 0.397±0.011 | 0.372±0.007b | 0.081±0.015b | 0.227±0.017b | 0.253±0.008b |
| Bel7402 | 0.526±0.007 | 0.523±0.006 | 0.520±0.011 | 0.482±0.014b | 0.316±0.014b | 0.176±0.014b | 0.340±0.007b | |
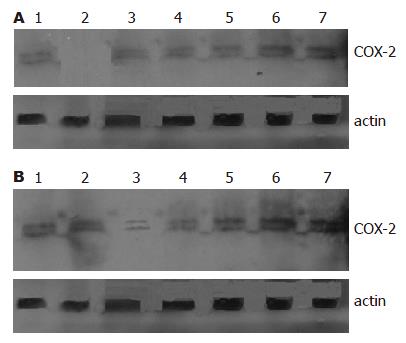
COX-2在SDS-PAGE凝胶电泳中表现为72 kDa和74 kDa两条条带. 如表1所示, HepG2细胞WBH2转染组与HK转染组COX-2蛋白相对表达量分别为0.397±0.011, 0.403±0.017, 与空白对照组(0.415±0.023)相比无显著差异(P>0.05, 图4A). 转染后24, 48, 72, 96 h, WBH1转染组COX-2蛋白相对表达量分别为0.372±0.007, 0.081±0.015, 0.227±0.017, 0.253±0.008, 与空白对照组比较有显著差异(P<0.01, 图4A). 24, 48, 72, 96 h抑制率分别为10.3%, 80.5%, 45.3%, 39.0%. Bel7402细胞 WBH2转染组与HK转染组COX-2蛋白相对表达量分别为0.520±0.011, 0.523±0.006, 与空白对照组(0.526±0.007)相比无显著差异(P>0.05, 图4B). 转染后24, 48, 72, 96 h, WBH1转染组COX-2蛋白相对表达量分别为0.482±0.014, 0.316±0.014, 0.176±0.014, 0.340±0.007, 与空白对照组比较有显著差异(P<0.01, 图4B). 24, 48, 72, 96 h抑制率分别为8.3%, 40.2%, 66.4%, 35.6%.
环氧合酶是催化花生四烯酸形成前列腺素的关键酶, 其包括COX-1和COX-2两种亚型. COX-2是一种可诱导型酶, 不仅能启动炎症反应, 而且通过调节细胞增殖、抑制凋亡、促进新生血管形成等机制参与肿瘤的发生和发展过程[7-8]. 研究显示, COX-2的表达水平在高分化肝癌组织中明显高于中、低分化肝癌组织, 与肿瘤的分化有关. 这种在高分化的肝癌组织中呈高表达而在进展期中低分化肝癌组织中呈低表达, 提示COX-2发挥作用是在肝癌发生的早期阶段而不是进展期[9-10]. 国外研究还发现, 将COX-2基因质粒转染肝癌细胞株能明显促进肝癌细胞的增殖, 且发现COX-2的过度表达可诱导Akt磷酸化, 且磷酸化位点在Thr308, 推测COX-2可能通过Akt/PI3K信号通路起作用[11]. Cheng et al[12]在对HBV相关的肝癌研究发现, COX-2的表达与血管内皮生长因子(VEGF)的表达及肿瘤微血管密度(MVD)相关, 在使用COX-2抑制剂NS-398后PGE2及VEGF表达下调, 加入前列腺素PGE2和PGI2可增加VEGF的表达, 推测COX-2可能通过产生前列腺素促进VEGF表达, 刺激新生血管形成, 参与肿瘤的产生与发展.
RNA干扰是近年来发现的一种新技术, 其原理是利用双链RNA特异性介导其互补同源mRNA序列的降解, 阻断体内特定基因的表达. 由于RNA干扰具有高度的序列专一性, 目前已作为一种简单有效的代替基因敲除工具. 肿瘤的形成是一个多因素和多步骤参与的过程, 肿瘤相关基因的异常表达及部分关键酶的过量表达与细胞癌变关系密切. 已有报道利用腺病毒介导的COX-2反义RNA技术在抑制COX-2表达的同时, 可抑制人肝癌细胞株的生长[13]. 与反义寡核苷酸基因治疗手段相比, RNA干扰技术对其基因抑制作用更强, 特异性更高[14]. 目前为止, 尚未见到有关应用RNAi技术抑制肝癌细胞COX-2表达的报道, 因此, 本研究选用RNA干扰技术构建针对COX-2基因的shRNA真核表达载体WBH1和WBH2[15], 转染不同分化程度的人肝癌细胞株: 高分化程度的HepG2细胞和中分化程度的Bel7402细胞, 分别在不同时间点从mRNA和蛋白质水平观察COX-2的抑制情况. 实验表明, 肝癌细胞株HepG2及Bel7402均有COX-2表达. WBH1质粒对HepG2细胞COX-2 mRNA和蛋白表达的抑制率分别可达88.6%和80.5%, 抑制效率均在48 h最高. 而对于Bel7402细胞, WBH1质粒对COX-2 mRNA和蛋白表达的抑制率分别可达70.1%和66.5%, 抑制效率在72 h最高. 两株细胞的有效抑制时间均可维持在48-96 h. 这种不同细胞株间抑制效率的不同, 考虑为不同细胞株中U6启动子转录后RNA受到抑制和干扰的效果存在较大差异, 因此对肿瘤细胞的抑制效果也不同. 两株细胞的脂质体转染率分别为60%, 54%, 而COX-2抑制率可达上述水平, 说明抑制作用可以在细胞间传递[16]. 此外, 对中分化的肝癌细胞株抑制高峰时间较高分化的肝癌细胞株出现晚, 推测shRNA真核表达载体在不同分化的肝癌细胞内转录过程存在差异而导致最佳干扰效果时间的不同. 而同为编码COX-2 shRNA的质粒WBH2对两株细胞均无干扰效应, 说明干扰效应与干扰靶点的选择高度相关.
总之, 我们所构建的针对COX-2基因的shRNA真核表达载体WBH1对两种不同分化程度的肝癌细胞株均有明显抑制作用, 为进一步研究COX-2与肝癌的生物学特性及肿瘤的基因治疗提供了实验依据.
环氧合酶-2在多种肿瘤的发生、发展和转移中起重要作用. RNA干扰是近年来出现的一种基因沉默技术, 能快速、高效的阻滞肿瘤细胞或组织中异常或突变蛋白的表达.
目前研究较多的COX-2抑制剂并非真正意义的特异性抑制, 其使用安全性也有待进一步的临床验证. RNA干扰作为特异性阻断基因表达的新方法, 目前已应用于基因功能、肿瘤及病毒性疾病等的研究.
COX-2在肝癌组织中呈高表达, 应用COX-2抑制剂能抑制肿瘤细胞生长并诱导其凋亡. 已有报道利用腺病毒介导的COX-2反义RNA技术在抑制COX-2表达的同时, 可抑制人肝癌细胞株的生长. 与反义寡核苷酸基因治疗手段相比, RNA干扰技术对其基因抑制作用更强, 特异性更高.
本文设计构建编码人COX-2 mRNA的短发夹状双链RNA的质粒载体, 并转染人不同肝癌细胞株, 观察其对COX-2表达的影响, 为进一步研究COX-2与肝癌的生物学特性及肿瘤的基因治疗提供了实验依据.
RNA干扰(RNAi): 是利用双链RNA特异性介导其互补同源mRNA序列的降解的基因沉默技术.
本文实验设计合理, 内容新颖, 方法先进, 所得结果可靠, 图片资料可信, 文献引用得当, 讨论具体客观, 是一篇较好的论著.
电编: 张敏 编辑:潘伯荣
| 1. | Subbaramaiah K, Dannenberg AJ. Cyclooxygenase 2: a molecular target for cancer prevention and treatment. Trends Pharmacol Sci. 2003;24:96-102. [PubMed] [DOI] |
| 2. | Liu NB, Peng T, Pan C, Yao YY, Shen B, Leng J. Overexpression of cyclooxygenase-2 in human HepG2, Bel-7402 and SMMC-7721 hepatoma cell lines and mechanism of cyclooxygenase-2 selective inhibitor celecoxib-induced cell growth inhibition and apoptosis. World J Gastroenterol. 2005;11:6281-6287. [PubMed] [DOI] |
| 3. | Bagasra O. RNAi as an antiviral therapy. Expert Opin Biol Ther. 2005;5:1463-1474. [PubMed] [DOI] |
| 4. | Lv W, Zhang C, Hao J. RNAi technology: a revolu-tionary tool for the colorectal cancer therapeutics. World J Gastroenterol. 2006;12:4636-4639. [PubMed] [DOI] |
| 5. | Romano PR, McCallus DE, Pachuk CJ. RNA interference-mediated prevention and therapy for hepatocellular carcinoma. Oncogene. 2006;25:3857-3865. [PubMed] [DOI] |
| 6. | Tuschl T. Expanding small RNA interference. Nat Biotechnol. 2002;20:446-448. [PubMed] [DOI] |
| 7. | Wang W, Bergh A, Damber JE. Cyclooxygenase-2 expression correlates with local chronic inflamma-tion and tumor neovascularization in human prostate cancer. Clin Cancer Res. 2005;11:3250-3256. [PubMed] [DOI] |
| 8. | Tjiu JW, Liao YH, Lin SJ, Huang YL, Tsai WL, Chu CY, Kuo ML, Jee SH. Cyclooxygenase-2 overexpression in human basal cell carcinoma cell line increases antiapoptosis, angiogenesis, and tumorigenesis. J Invest Dermatol. 2006;126:1143-1151. [PubMed] [DOI] |
| 9. | Koga H, Sakisaka S, Ohishi M, Kawaguchi T, Taniguchi E, Sasatomi K, Harada M, Kusaba T, Tanaka M, Kimura R. Expression of cyclooxygenase-2 in human hepatocellular carcinoma: relevance to tumor dedifferentiation. Hepatology. 1999;29:688-696. [PubMed] [DOI] |
| 10. | Qiu DK, Ma X, Peng YS, Chen XY. Significance of cyclooxygenase-2 expression in human primary hepatocellular carcinoma. World J Gastroenterol. 2002;8:815-817. [PubMed] [DOI] |
| 11. | Leng J, Han C, Demetris AJ, Michalopoulos GK, Wu T. Cyclooxygenase-2 promotes hepatocellular carcinoma cell growth through Akt activation: evidence for Akt inhibition in celecoxib-induced apoptosis. Hepatology. 2003;38:756-768. [PubMed] [DOI] |
| 12. | Cheng AS, Chan HL, To KF, Leung WK, Chan KK, Liew CT, Sung JJ. Cyclooxygenase-2 pathway correlates with vascular endothelial growth factor expression and tumor angiogenesis in hepatitis B virus-associated hepatocellular carcinoma. Int J Oncol. 2004;24:853-860. [PubMed] [DOI] |
| 14. | Aoki Y, Cioca DP, Oidaira H, Kamiya J, Kiyosawa K. RNA interference may be more potent than antisense RNA in human cancer cell lines. Clin Exp Pharmacol Physiol. 2003;30:96-102. [PubMed] [DOI] |
| 15. | 汪 步海, 钱 伟, 郜 元军, 王 华枫, 侯 晓华. 利用RNA干扰技术抑制环氧合酶-2表达对人胃癌细胞系SGC-7901增殖和凋亡影响的实验研究. 中华医学杂志. 2006;86:266-271. |
| 16. | Svoboda P, Stein P, Hayashi H, Schultz RM. Selective reduction of dormant maternal mRNAs in mouse oocytes by RNA interference. Development. 2000;127:4147-4156. [PubMed] |