修回日期: 2006-09-28
接受日期: 2006-10-11
在线出版日期: 2006-11-28
目的: 观察感染Ad-IκBαM对NF-κB激活的抑制及对亚砷酸诱导肝癌细胞凋亡的增强效应, 探讨亚砷酸对肝癌细胞的治疗作用.
方法: 选择人肝癌细胞系BEL-7402和SMMC- 7721, 以不同浓度亚砷酸处理. 制备重组腺病毒Ad-IκBαM, 用来转染经和未经亚砷酸处理的肝癌细胞. MTT和TUNEL方法观察各组细胞生长及凋亡情况; 应用EMSA及Western blot研究肝癌细胞核内NF-κB的激活情况和感染Ad-IκBαM对NF-κB激活的抑制效果.
结果: MTT结果表明各浓度亚砷酸对肝癌细胞的作用较正常肝细胞显著(P<0.01); Western blot和EMSA结果提示亚砷酸可明显抑制肝癌细胞生长, 使细胞内NF-κB系统活化; 感染重组腺病毒Ad-IκBαM的肝癌细胞后, 亚砷酸引起的NF-κB的激活受到明显抑制. 亚砷酸联合Ad-IκBαM或Ad-IκBα作用于肝癌细胞SMMC-7721的凋亡指数分别为66.47%和36.67%; 亚砷酸联合Ad-IκBαM或Ad-IκBa作用于肝癌细胞Bel-7402的凋亡指数分别为74.5%和32.37%.
结论: 亚砷酸对肝癌细胞有明显的杀灭作用, 同时激活了肝癌细胞内的NF-κB; 应用重组腺病毒Ad-IκBαM可以有效抑制NF-κB的激活, 并可明显增强亚砷酸对肝癌细胞的作用.
引文著录: 刘丹, 刘冰熔, 胡丽红, 杜雅菊, 裴凤华, 吕志武, 关景明. 亚砷酸联合重组腺病毒Ad-IκBαM对肝细胞癌的治疗作用. 世界华人消化杂志 2006; 14(33): 3169-3174
Revised: September 28, 2006
Accepted: October 11, 2006
Published online: November 28, 2006
AIM: To observe the inhibitory effect of recombinant adenovirus Ad-IκBαM on the activation of nuclear factor kappa B (NF-κB) as well as the enhancing effect of arsenious acid on the apoptosis of hepatocellular carcinoma cells.
METHODS: Hepatocellular carcinoma cell lines BEL-7402 and SMMC-7721 were treated with different concentrations of arsenious acid, respectively. The recombinant adenoviruses were prepared to transfect BEL-7402 and SMMC-7721 cells received or not received arsenious acid treatment. MTT assay and TUNEL method were used to observe the growth and apoptosis of the cells, respectively. Electrophoretic mobility shift assay (EMSA) and Western blot were performed to detect the activation of NF-κB and its inhibition after Ad-IκBαM transfection, respectively.
RESULTS: MTT indicated that the proliferations of BEL-7402 and SMMC-7721 cells were significantly suppressed after treatment of arsenious acid with different concentrations (P < 0.05). Western blot and EMSA showed that arsenious acid markedly inhibited the growth of liver cancer cells, and promoted the activation of NF-κB. After transfection with Ad-IκBαM, the activation of NF-κB induced by arsenious acid was dramatically inhibited. The apoptosis rates were 66.47% and 36.67% in SMMC-7721 cells transfected with Ad-IκBαM and Ad-IκBa, respectively, and they were 74.5% and 32.37% in Bel-7402 cells transfected with Ad-IκBαM and Ad-IκBa, respectively.
CONCLUSION: Arsenious acid has obvious effect in the treatment of hepatocarcinoma, but it promotes the activation of NF-κB at the same time. Recombinant adenovirus Ad-IκBαM can inhibit NF-κB activation while increase the effect of Arsenious acid effectively.
- Citation: Liu D, Liu BR, Hu LH, Du YJ, Pei FH, Lv ZW, Guan JM. Therapeutic effect of arsenious acid combined with recombinant adenovirus Ad-IκBαM on hepatocellur carcinoma. Shijie Huaren Xiaohua Zazhi 2006; 14(33): 3169-3174
- URL: https://www.wjgnet.com/1009-3079/full/v14/i33/3169.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i33.3169
亚砷酸最初用于急性早幼粒细胞白血病(ALP)的治疗, 取得了极高的临床缓解率, 得到全世界的普遍认可. 近年来, 国内外学者尝试将砷剂用于肝癌的治疗, 同样取得了一定的效果[1-4]. 核转录因子NF-κB[5-7]是调节细胞基因转录的关键因子, 参与多种凋亡相关基因转录, 在肿瘤的发生和发展过程中发挥重要作用. 本研究观察了亚砷酸对肝癌细胞的作用以及肝癌细胞核内转录因子NF-κB的激活情况; 联合应用NF-κB的超抑制物Ad-IκBαM, 观察其对NF-κB的激活的抑制作用及对亚砷酸疗效的增强效果, 探索药物联合基因治疗肝癌的新途径.
肝癌细胞系BEL-7402和SMMC-7721, 正常肝细胞系HL-7702, 均购自中科院上海细胞所细胞库; 人胚肾细胞293细胞由重庆医科大学肝病研究所惠赠; 第32和36位丝氨酸位点诱变为丙氨酸的中国人IκBaM重组腺病毒和未突变的对照腺病毒重组体Ad-IκBa为刘冰熔博士构建[8-9]; 亚砷酸注射液(哈尔滨伊达药业有限公司), 使用时用RPMI 1640配制成所需浓度; RPMI 1640培养液、HDMEM培养液及胎牛血清(Gibco公司产品); MTT试剂(上海华舜生物公司); TUNEL反应试剂盒(Roche公司); 核蛋白提取蛋白酶抑制剂及EMSA试剂盒(Promega), ECL试剂盒(Pharmacia); g-32P-ATP(Perkin Elmer).
1.2.1 重组腺病毒Ad-IκBαM和Ad-IκBa的扩增: 将1 mL病毒原液加无血清培养基4-5 mL加入含有5×106个293细胞的25 cm培养瓶中, 于37 ℃, 50 mL/L CO2孵育4-6 h, 弃掉培养液; 加入新鲜含20 mL/L胎牛血清的DMEM培养基3 mL, 于37 ℃, 50 mL/L CO2培养, 感染不同时间后在荧光显微镜下观察GFP表达情况; 待有大量细胞表达GFP且有部分细胞漂浮时(约5-10 d), 将293细胞用细胞刮子刮下, 加DMEM 2 mL, 800 r/min离心5 min弃上清, 用1 mL冷PBS重悬, 收集细胞于EP管中-20 ℃保存; 将收集的293细胞以反复冻融法(将细胞和上清液收集到塑料离心管中, 密封后放置液氮中10 s, 在室温下缓慢解冻并震荡, 反复5次, 离心, 取上清)提取病毒液.
1.2.2 重组腺病毒Ad-IκBαM和Ad-IκBa的病毒滴度测定: 将293细胞以4×105/孔培养于6孔板中; 取待测的病毒液0.2 mL加入装有1.8 mL PBS的EP管中, 混匀后一次做10倍比稀释至第6管; 取每一稀释度病毒液400 mL稀释液加至293细胞培养板(6孔板)中, 37 ℃, 于50 mL/L CO2孵箱中吸附4-6 h; 换新鲜培养基, 继续培养18-36 h于荧光显微镜下计数GFP阳性细胞数; 选择70%-80%细胞被感染的孔内细胞, 按下列公式计算病毒滴度. 病毒滴度(PFU/mL) = GFP阳性细胞数×病毒上清稀释倍数/0.4 mL.
1.2.3 病毒感染效率测定: 将肝癌细胞系SMMC-7721, BEL-7402以105/孔接种六孔培养板中, 待24 h后感染病毒; Ad-IκBαM以25, 50, 100, 200 MOI(病毒感染单位)感染2种肝癌细胞; 按以下公式计算加入病毒体积, 吸附1 h后追加培养基, 48 h后倒置荧光显微镜观察计数所有发绿光细胞, 同时计数该视野所有细胞数. V(加入病毒体积) = MOI×接种细胞数/(pfu/mL).
1.2.4 不同浓度亚砷酸对肝癌细胞的抑制率: 血球计数板计数后将细胞密度调整为4-5×107/L. 96孔板每孔加细胞悬液100 μL, 培养液100 μL, 调零孔加200 μL培养基. 细胞贴壁后按预定计划分别加入不同浓度的化疗药. 于24, 48, 72 h, 各取一块96孔板, 除调零孔外, 每孔小心吸弃培养基110 μL后, 加入新鲜配制的浓度为5 g/L的MTT 10 μL. 继续培养3 h后取出培养皿, 每孔加DMSO 100 μL, 轻轻晃摇5 min后放入培养箱30 min后取出, 用酶联仪于570 nm测定吸光度值(A). 结果用多因素方差分析进行统计学分析; 抑制率(%) = (1-加药孔平均A值/对照孔平均A值)×100%.
1.2.5 实验分组及处理: 以常规培养的BEL-7402, SMMC-7721以及HL-7702三种细胞为空白对照, 治疗组以两种肝癌细胞感染腺病毒Ad-IkBaM, 24 h后加入2 mmol/L亚砷酸, 继续培养24 h后收取细胞进行进一步实验; 治疗对照组为两种肝癌细胞感染Ad-IkBa, 24 h后加入2 mmol/L的亚砷酸, 继续培养24 h.
1.2.6 Western blot法: 按照Sasaki et al[10]方法提取各组细胞的核蛋白, Bradford方法测定蛋白浓度. SDS聚丙烯酰胺凝胶电泳: PAGE胶电泳, 每孔加入蛋白30 mg与6×加样缓冲液混均, 加热煮沸5 min; 立即放于冰上, 待完全冷却后, 加样. 电泳时用200 V恒定电压, 泳动1 h左右. 转膜: 剪切与凝胶大小一致的12张Whatman 3 mm滤纸和1张PVDF膜, 作好标记后, 将其浸泡于甲醇中3 s, 待完全湿透后, 浸于转移缓冲液中30 min; 然后, 按"三明治"法将其安放于电转移器中, 加入适量转移缓冲液, 30 V, 转移3 h. 封闭: 将PVDF膜放入含50 g/L脱脂奶粉的TBS-T液中, 室温下震荡封闭1 h. 杂交: 用TBS-T液漂洗膜3次, 5 min/次, 加入1:500稀释的一抗, 室温下杂交2 h; TBS-T液洗膜3次, 5 min/次, 加入1:500稀释的HRP标记的二抗, 室温下杂交1 h, 再用TBS-T液洗膜3次. 化学发光自显影: 将杂交后的膜放于一个干净的器皿中. 将ECL的A, B液以1:1比例混合并加到膜面上, 暗处反应1 min, 用保鲜膜包好, 放入暗盒中, 在暗室中压片、发光自显影2-5 min、洗片.
1.2.7 凝胶迁移率分析法(EMSA)检测细胞核内NF-κB的活性: 按照Promega公司Gel Shift Assay Systems试剂盒说明书进行. g-32P标记NF-κB寡核苷酸探针, 配制60 g/L聚丙稀酰胺凝胶, 胞核提取物和NF-κB寡核苷酸探针结合反应37 ℃水浴中反应45 min, 1×TBE中, 4 ℃ 250 V电泳, 直到溴酚兰距凝胶底部约1/2; 600 mL/L冰醋酸溶液浸泡15 min取出凝胶并吸干残余水分, 用保鲜膜覆盖; 将凝胶放入装有X光片的暗盒中, 保鲜膜面朝向X光片, 于-30 ℃放射自显影24-48 h.
1.2.8 原位末端脱氧核苷酸转移酶标记法(TUNEL)检测凋亡: 将细胞进行冷丙酮固定30 min, 于紫外灯下照射10 min, 荧光显微镜下观察, 至GFP完全淬灭. 30 g/L过氧化氢室温作用10 min, PBS冲洗3次, 5 min/次; 1 mL/L Triton X-100冰上作用2 min, PBS冲洗3次, 5 min/次; 每片加入TUNEL反应混合液, 避光37 ℃作用1 h; PBS冲洗3次, 5 min/次后, 荧光显微镜下观察计数并照相.
Ad-IkBa和Ad-IkBaM经293细胞扩增滴度分别为8.3×1012 pfu/L和8.5×1012 pfu/L. 25, 50, 100, 200 MOI对SMMC-7721的感染效率分别为: 11%, 46%, 95%和90%; 25, 50, 100, 200 MOI对Bel-7402的感染效率分别为: 6%, 30%, 74%和95%. 选择100 MOI为Ad-IkBaM对SMMC-7721的感染剂量; 200 MOI为Ad-IkBaM对BEL-7402的感染剂量.
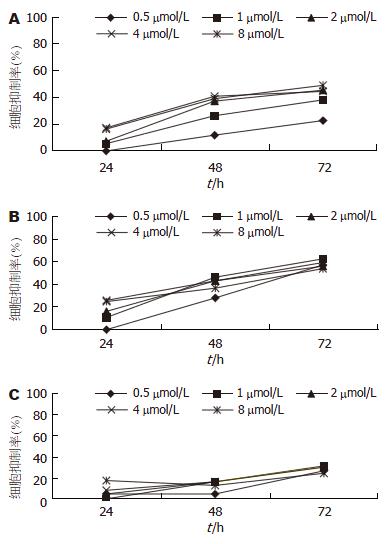
不同浓度的亚砷酸(0.5, 1, 2, 4, 8 mmol/L)处理细胞Bel-7402, SMMC-7721, HL-7702, 于24, 48, 72 h观察亚砷酸对肝癌细胞生长的抑制情况. 亚砷酸可以抑制肝癌细胞及正常肝细胞增殖, 随着作用时间的延长, 抑制作用逐渐增强, 呈时间依赖性; 各浓度亚砷酸对肝癌细胞的作用较正常肝细胞显著(P<0.01), 表明亚砷酸的作用有选择性, 对肝癌细胞的作用强于正常细胞. 选择对肝癌细胞抑制率没有明显差别的最小亚砷酸浓度为以下实验的浓度, 即2 mmol/L(图1).
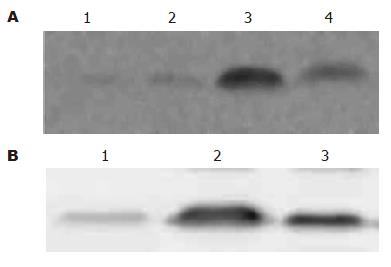
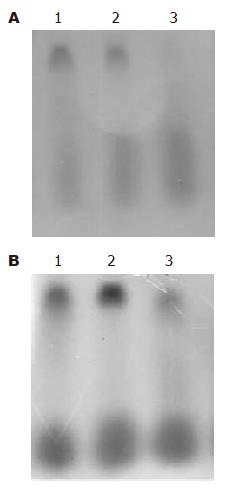
正常肝细胞HL-7702细胞核内几乎没有NF-κB表达; 肿瘤细胞系BEL-7402, SMMC-7721仅有NF-κB的低水平表达. 感染重组腺病毒Ad-IkBa的细胞经化疗药物作用后其NF-κB的表达量显著增加; 而感染Ad-IkBaM后再给予表阿霉素、丝裂霉素处理后可见NF-κB表达量较Ad-IkBa组明显减低(图2).
肝癌细胞SMMC-7721和Bel-7402在三氧化二砷的作用下有NF-κB的表达, 感染了重组腺病毒Ad-IkBa的两种细胞, 其NF-κB的表达无明显变化. 但感染了重组腺病毒Ad-IkBaM的两种细胞NF-κB的表达被明显抑制(图3).
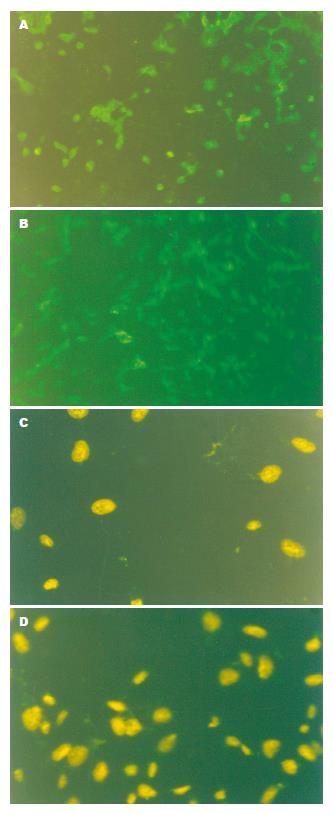
以有荧光者为阳性, 选择细胞分布均匀, 背景清晰的区域, 在高倍镜下计数同一视野细胞总数, 计算荧光细胞所占百分比为凋亡率(AI). 亚砷酸联合Ad-IkBaM或Ad-IkBa作用于肝癌细胞SMMC-7721的凋亡指数分别为66.47%和36.67%; 亚砷酸联合Ad-IkBaM或Ad-IkBa作用于肝癌细胞Bel-7402的凋亡指数分别为74.5%和32.37%(图4).
低剂量的砷剂作为药物使用在传统中医中药已有近千年的历史, Science著文称"这是继全反式维甲酸(ATRA)之后又一令人震惊的发现" [11]. 几十年来, 亚砷酸在APL的治疗中取得了突破性进展, 初发的APL患者仅仅依靠单一用药即可取得70%-90%的完全缓解率, 同时只引起轻度的骨髓抑制. 表明低剂量砷剂对肿瘤细胞的治疗作用远远超过了他对正常细胞的毒性作用, 使其有望成为一种优于其他细胞毒药物的抗肿瘤制剂. 研究发现, 亚砷酸通过不同的机制影响细胞的信号传导途径, 最终产生一系列细胞学效应, 包括诱导细胞的凋亡、生长抑制、促发或抑制分化和抑制血管形成等. 核转录因子NF-κB(nuclear factor-kB), 是由Sen和Baltimore[12]于1986年首先在B细胞中发现的一种结合于免疫球蛋白k轻链增强子上的核蛋白. 随后他们发现NF-κB不仅存在于B细胞而且也存在于多种细胞中. 进一步的研究表明, NF-κB是一种重要的核转录因子. 他存在于多种细胞, 并参与炎症、免疫、细胞增殖等多种生理、病理过程的基因调控. 1996年Hsu et al[13]发现, 当TNF作用于肿瘤细胞时, 肿瘤细胞通过激活NF-κB而发挥抗凋亡途径. 随后, 越来越多的研究表明肿瘤细胞的抗凋亡能力与NF-κB激活直接相关[14-17]. NF-κB抗凋亡机制的发现, 使人们对肿瘤细胞抗凋亡作用机制的研究有了突破性进展. 因而如何有效地抑制肿瘤细胞的NF-κB活性进而将其应用于抗肿瘤治疗是一个具有重要现实意义的课题[18-21]. 我们从中国人外周血单核细胞中成功克隆了中国人IkBa基因, 进而应用定点诱变方法成功构建了NF-κB超抑制物IkBaM, 并在此基础上应用最新的腺病毒构建系统构建了重组腺病毒Ad-IkBaM. 本研究在已有的研究基础上, 以两株肝癌细胞为对象, 应用三氧化二砷对其进行治疗研究, 进一步证实了亚砷酸能够明显抑制肿瘤细胞生长的同时对正常肝细胞影响很小(P<0.01), 他通过诱导肿瘤细胞凋亡发挥作用, 同时应用Western blot及EMSA发现应用亚砷酸后出现肝癌细胞内NF-κB系统活化. 提示肝癌细胞可能通过NF-κB系统活化使亚砷酸诱导的肿瘤细胞凋亡机制受阻, 从而影响了亚砷酸治疗实体肿瘤的效果. 为了提高亚砷酸对肝癌的治疗效果, 我们进一步联合应用NF-κB超抑制物重组腺病毒Ad-IkBaM, 观察到肝癌细胞内NF-κB激活被明显抑制, 观察到联合应用凋亡细胞明显增多. 本研究结果提示, 化学治疗联合基因治疗可提高化疗抗肿瘤的治疗效果. 这一治疗模式有希望成为极有发展前途的治疗方式.
肝癌是消化系统常见的恶性肿瘤, 大多数患者发现时已是晚期或一般状态差, 失去了手术机会, 被称为"癌中之王". 选择一种适合晚期肝癌患者的治疗方法, 提高化疗药物的效果是临床医生亟待解决的问题.
基因治疗是近年来随着分子生物学的发展而发展起来的一种极具前途的肿瘤治疗方法. NF-κB是一种重要的核转录因子, 近年来受到广泛关注, 其具有重要的生物学功能, 在多种肿瘤细胞的抗凋亡机制中起着十分重要的作用.
国内外均有关于NF-κB相关报道, 探讨其在炎症、免疫、细胞增殖等多种生理、病理过程的基因调控, 并把NF-κB抑制剂应用于基础及临床研究中.
本文研究方法和技术具有一定创新性, 实验对照的设计合理可靠, 统计学处理方法的使用恰当, 文章的科学性、创新性和可读性较好.
电编: 张敏 编辑:张焕兰
| 1. | Chow SK, Chan JY, Fung KP. Suppression of cell proliferation and regulation of estrogen receptor alpha signaling pathway by arsenic trioxide on human breast cancer MCF-7 cells. J Endocrinol. 2004;182:325-337. [PubMed] [DOI] |
| 2. | 邓 友平, 林 晨, 梁 萧, 陈 洁平, 付 明, 肖 培根, 吴 旻. 三氧化二砷诱导人宫颈癌Hela细胞凋亡及Bcl-2保护作用的机制研究. 中国科学(C辑). 1999;29:426-434. |
| 5. | Chen LW, Egan L, Li ZW, Greten FR, Kagnoff MF, Karin M. The two faces of IKK and NF-kappaB inhibition: prevention of systemic inflammation but increased local injury following intestinal ischemia-reperfusion. Nat Med. 2003;9:575-581. [PubMed] [DOI] |
| 6. | Huang TT, Wuerzberger-Davis SM, Wu ZH, Miyamoto S. Sequential modification of NEMO/IKKgamma by SUMO-1 and ubiquitin mediates NF-kappaB activation by genotoxic stress. Cell. 2003;115:565-576. [PubMed] [DOI] |
| 7. | Zhou H, Wertz I, O'Rourke K, Ultsch M, Seshagiri S, Eby M, Xiao W, Dixit VM. Bcl10 activates the NF-kappaB pathway through ubiquitination of NEMO. Nature. 2004;427:167-171. [PubMed] [DOI] |
| 10. | Sasaki N, Morisaki T, Hashizume K, Yao T, Tsuneyoshi M, Noshiro H, Nakamura K, Yamanaka T, Uchiyama A, Tanaka M. Nuclear factor-kappaB p65 (RelA) transcription factor is constitutively activated in human gastric carcinoma tissue. Clin Cancer Res. 2001;7:4136-4142. [PubMed] |
| 12. | Sen R, Baltimore D. Multiple nuclear factors interact with the immunoglobulin enhancer sequences. Cell. 1986;46:705-716. [PubMed] [DOI] |
| 13. | Hsu H, Shu HB, Pan MG, Goeddel DV. TRADD-TRAF2 and TRADD-FADD interactions define two distinct TNF receptor 1 signal transduction pathways. Cell. 1996;84:299-308. [PubMed] [DOI] |
| 14. | Davis N, Ghosh S, Simmons DL, Tempst P, Liou HC, Baltimore D, Bose HR Jr. Rel-associated pp40: an inhibitor of the rel family of transcription factors. Science. 1991;253:1268-1271. [PubMed] [DOI] |
| 15. | Beg AA, Baltimore D. An essential role for NF-kappaB in preventing TNF-alpha-induced cell death. Science. 1996;274:782-784. [PubMed] [DOI] |
| 16. | Tergaonkar V, Pando M, Vafa O, Wahl G, Verma I. p53 stabilization is decreased upon NFkappaB activation: a role for NFkappaB in acquisition of resistance to chemotherapy. Cancer Cell. 2002;1:493-503. [PubMed] [DOI] |
| 17. | 胡 丽红, 刘 冰熔, 刘 丹, 关 景明, 吕 志武, 杜 雅菊. 重组腺病毒Ad-IkBaM在5-氟尿嘧啶诱导胃癌细胞凋亡中的作用. 世界华人消化杂志. 2006;14:2270-2274. [DOI] |
| 18. | Dong QG, Sclabas GM, Fujioka S, Schmidt C, Peng B, Wu T, Tsao MS, Evans DB, Abbruzzese JL, McDonnell TJ. The function of multiple IkappaB : NF-kappaB complexes in the resistance of cancer cells to Taxol-induced apoptosis. Oncogene. 2002;21:6510-6519. [PubMed] [DOI] |
| 19. | Holmes-McNary M, Baldwin AS Jr. Chemopreven-tive properties of trans-resveratrol are associated with inhibition of activation of the IkappaB kinase. Cancer Res. 2000;60:3477-3483. [PubMed] |
| 20. | Dhanalakshmi S, Singh RP, Agarwal C, Agarwal R. Silibinin inhibits constitutive and TNFalpha-induced activation of NF-kappaB and sensitizes human prostate carcinoma DU145 cells to TNFalpha-induced apoptosis. Oncogene. 2002;21:1759-1767. [PubMed] [DOI] |
| 21. | Kwon KB, Kim EK, Jeong ES, Lee YH, Lee YR, Park JW, Ryu DG, Park BH. Cortex cinnamomi extract prevents streptozotocin- and cytokine-induced beta-cell damage by inhibiting NF-kappaB. World J Gastroenterol. 2006;12:4331-4337. [PubMed] [DOI] |