修回日期: 2006-08-20
接受日期: 2006-09-01
在线出版日期: 2006-11-08
目的: 探讨VEGF165转染大鼠血管内皮细胞诱导移植胰岛再血管化及对功能的影响.
方法: 受体糖尿病大鼠随机分为3组, 对照组于肾被膜下移植300当量(1当量相当于1个直径为150 μm的胰岛)胰岛, 转染组和内皮细胞组分别加入1×106转染质粒pIRES2-EGFP/VEGF165的血管内皮细胞和正常血管内皮细胞. 移植后监测血糖及血清胰岛素水平. 术后10 d行静脉糖耐量实验(IVGTT). 术后14 d, 取受者肾脏HE染色及Insulin-6, VEGF和CD34 免疫组化染色, 计算微血管密度.
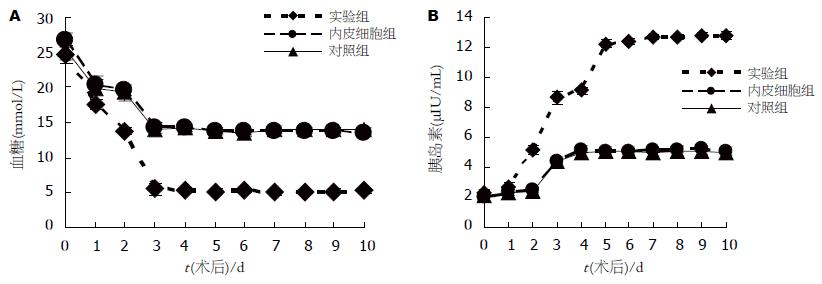
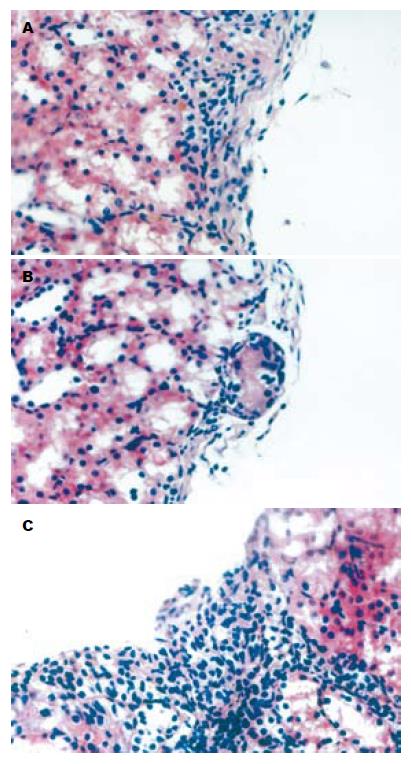
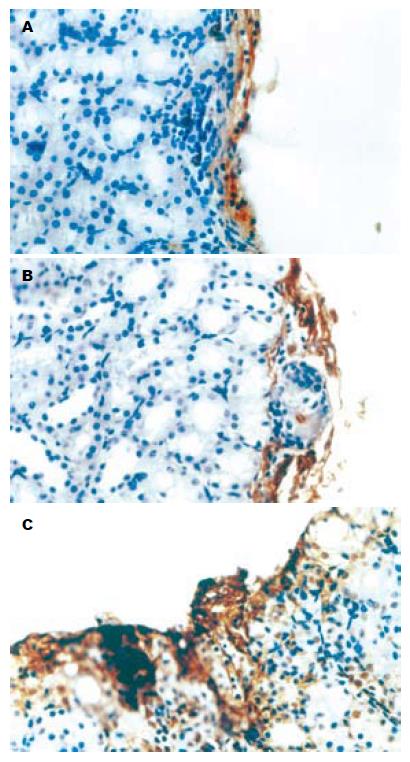
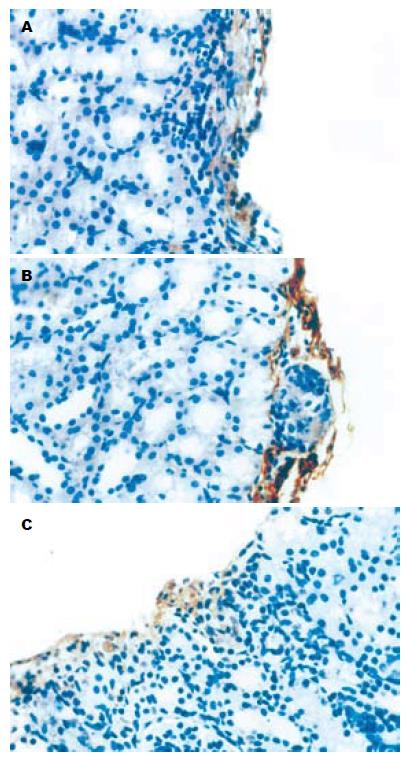
结果: 实验组大鼠于移植术后3 d血糖及胰岛素水平恢复正常. 对照组和内皮细胞组虽有所改善, 但未恢复到正常水平. IVGTT显示实验组K值(K = 2.69)与正常大鼠相似, 对照组和内皮细胞组K值分别为1.9和1.87, 两组间无明显差异, 而与实验组有明显差异(P<0.05). 实验组大鼠肾被膜下可见成团胰岛, Insulin-6免疫组化呈阳性, 周围及内部有大量内皮细胞. VEGF165免疫组化及CD34免疫组化染色呈阳性. 对照组和内皮细胞组肾被膜下的细胞团中心细胞较少, 部分被纤维组织代替, 内部仅有少量CD34染色阳性的内皮细胞. Insulin-6免疫组化仅有少量细胞染成棕黄色. VEGF165免疫组化呈阴性. 对照组(11.43±2.22)和内皮细胞组MVD(10.9±2.45)无显著差异, 而与实验组间(74.3±6.74)有明显差别(P<0.05).
结论: VEGF165转染大鼠血管内皮细胞可以诱导移植胰岛新生血管生成, 促进再血管化, 降低移植胰岛早期死亡率, 减少供胰用量.
引文著录: 程颖, 刘永锋, 张佳林, 李铁民, 赵宁. 转染VEGF165的大鼠血管内皮细胞与胰岛共移植对糖尿病大鼠的治疗作用. 世界华人消化杂志 2006; 14(31): 3013-3019
Revised: August 20, 2006
Accepted: September 1, 2006
Published online: November 8, 2006
AIM: To observed whether the elevated vascular endothelial growth factor (VEGF) expression, induced by VEGF165-transfected vascular endothelial cells (VEC), can affect the angiogene-sis and function of the grafts.
METHODS: The diabetic rats were divided into 3 groups, named group A, B and C, respectively. The rats in group A received 300-IEQ islets transplantation under the capsule of the kidney. The rats in group B underwent VEC and islets transplantation, while those in group C were transplanted with islets and VEC transfected by pIRES2-EGFP/VEGF165 plasmid. The levels of blood glucose and insulin were evaluated after operation every other day. Intravenous glucose tolerance test (IVGTT) was performed 10 d after transplantation. HE and immunohistochemical staining was used to detect the expression of insulin-6, VEGF and CD34 in the rat kidney. The microvessel density (MVD) was also calculated.
RESULTS: The blood glucose and insulin in group C restored to the normal level 3 d after transplantation. In contrast, diabetic rats in group A and B displayed moderate hyperglycemia, and no significant difference was found between the two groups. IVGTT showed both the K value in group C was 2.69, which was significantly higher than that in group A or B (K = 1.9 or 1.87). HE and immunohistochemical staining showed that a large amount of islet grafts were observed under the capsule of the kidney in group C, which were positively stained by insulin-6Ab and VEGF Ab. In the mass of the cells, the VEC positively stained by CD34 were observed. The similar mass was observed in group A and B, but with few positive cells stained by insulin-6 Ab and CD34 Ab. No positive cells stained by VEGF appeared in group A and B. The MVD in group C was markedly higher than that in group A or B (74.3 ± 6.74 vs 11.43 ± 2.22, 10.9 ± 2.45, P < 0.05).
CONCLUSION: VEGF165-transfected VEC-induced expression of VEGF can stimulate the angiogenesis and reduce the mortality of the grafts, and further improve the outcome of islet transplantation.
- Citation: Cheng Y, Liu YF, Zhang JL, Li TM, Zhao N. Co-transplantation of VEGF165-transfected vascular endothelial cells and islets in treatment of rats with diabetes. Shijie Huaren Xiaohua Zazhi 2006; 14(31): 3013-3019
- URL: https://www.wjgnet.com/1009-3079/full/v14/i31/3013.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i31.3013
胰岛移植是治疗糖尿病的有效手段之一, 但供胰量大、移植物长期存活率低仍是阻碍胰岛移植发展的"瓶颈". 造成这种现象的主要原因之一是胰岛分离纯化过程中破坏了其内部的微循环系统, 导致移植后无法象胰腺移植那样立即恢复血运[1]. 移植后早期(7-14 d)内近70%移植胰岛因缺血、缺氧死亡[2]. 在移植早期, 胰岛的存活率依赖于再血管化的时间和程度[3]. 本实验拟将转染VEGF165的大鼠血管内皮细胞与胰岛共同移植到糖尿病大鼠肾被膜下, 在胰岛移植的部位造成局部高VEGF环境诱导移植胰岛再血管化, 改善微循环, 降低胰岛移植物早期死亡率, 减少供胰用量.
供受者均采用♂Wistar大鼠(中国医科大学动物中心提供), 体质量150±20 g. 受者大鼠于移植前14 d, 采取链尿霉素化学灼伤法[4] (20 g/L STZ, 65 mg/kg, ip)造成糖尿病大鼠模型(连续3 d在非禁食情况下, 血糖>16.8 mmol/L). 根据移植物不同随机分为3组(n = 10), 实验组: 胰岛与转染VEGF165的大鼠血管内皮细胞共同移植; 内皮细胞组: 胰岛与正常大鼠血管内皮细胞共同移植; 对照组: 仅进行胰岛移植. pIRES2-EGFP/VEGF165质粒经扩增、鉴定后, 采用层析法大量提纯, 回收. 采用胶原酶消化贴片法培养大鼠血管内皮细胞. 取2-5代细胞备用, 采用脂质体法转染, 转染72 h后收集备用, 采用明尼苏达大学改良方法分离纯化胰岛[2]. 供鼠经戊巴比妥麻醉开腹后, 逆行胆管插管, 缓慢灌注含消化酶(胶原酶Ⅴ型, 1.5 mg/kg)的Hanks缓冲液10-12 mL, 使胰腺完全膨胀. 完整切取胰腺后置入含相同浓度胶原酶的缓冲液中, 37 ℃水浴消化15-20 min. 消化的胰腺组织离心, 经80目不锈钢筛网过滤后, 采用250, 230, 205, 110 g/L Ficoll和Hanks液梯度密度离心(4 ℃, 3000 r/min×10 min), 于230, 110 g/L层交界间吸取胰岛细胞. 经Hanks液洗3次, 备用.
收集正常血管内皮细胞和转染VEGF165血管内皮细胞, 计数1×106细胞离心去除上清备用. 将纯化后的胰岛离心, 弃上清, 取锥形离心管底部的沉淀. 倒置显微镜下手检计数300当量胰岛, 与上述血管内皮细胞混合. 将细胞移植至大鼠右肾被膜下.
1.2.1 移植胰岛功能检测: 移植术后24 h开始尾静脉采血血糖仪检测大鼠空腹血糖, 以血糖<7.8 mmol/L判定移植物存活, 移植有效. 空腹条件下, 隔天采尾静脉血, 采用化学发光免疫方法(美国雅培AXSYM)检测血清胰岛素水平. 于移植术后10 d行静脉糖耐量实验(IVGTT). 大鼠禁食12 h后, 戊巴比妥麻醉, 于尾静脉快速注射500 g/L葡萄糖溶液(0.5 g/kg), 以开始注射至注射完毕之间的任何时间为0点, 在注射后1, 5, 10, 15, 30, 60及90 min, 于尾静脉采血检测血糖. 将5 min至30 min范围内测得的血糖值取自然对数, 并进行直线回归, 通过回归系数计算T1/2(即从该范围内某一血糖值下降到其一半时的时间), 再按公式: K = (0.69/T1/2)×100算出K值[5].
1.2.2 组织形态学检查: 于移植后14 d, 切取糖尿病受者大鼠肾脏标本, HE及Insulin-6, VEGF, CD34免疫组化染色, 光镜下观察组织形态学变化. 微血管呈棕黄色, 计数方法为盲法下每张切片在移植胰岛部位选择5个血管最高的区域, 在200倍下由3个病理医生独立计数, 求微血管密度(microvascular density, MVD)平均数. 微血管判定标准: 凡染成棕黄色的数个内皮细胞或内皮细胞簇均为一个血管计数, 管腔大于8个红细胞大小, 有较厚肌层的血管不计数[6].
统计学处理 所用数据以平均数±标准差表示, 采取方差分析q检验, P<0.05为有统计学差异, 所有数据均由SPSS 10.0软件处理.
实验组大鼠于移植术后3 d空腹血糖恢复正常. 对照组和内皮细胞组于术后3 d血糖有所下降, 但未能恢复到正常水平, 平均波动在13-14 mmol/L之间. 对照组和内皮细胞组的血糖值与术后同一时间的实验组相比有显著差异(P<0.05), 但这两组相比无显著性差异(P>0.05, 图1A), 实验组大鼠于移植术后2 d胰岛素分泌水平开始上升, 3-4 d后恢复正常水平. 对照组和内皮细胞组于术后2 d胰岛素分泌有所增加, 但幅度不大, 未达到正常水平. 对照组和内皮细胞组的胰岛素水平与术后同一时间的实验组相比有显著差异(P<0.05), 但这两组相比无显著性差异(P>0.05, 图1B). 于术后10 d行IVGTT发现移植组糖耐量曲线与正常大鼠相似. 而对照组和内皮细胞组大鼠注射高糖溶液后, 血糖升高明显, 在90 min后仍未恢复正常. 实验组、内皮细胞组和对照组K值分别为2.69, 1.9和1.87. 内皮细胞组和对照组在血糖水平和动力学方面与实验组有明显差异, 但这两组之间无明显差异.
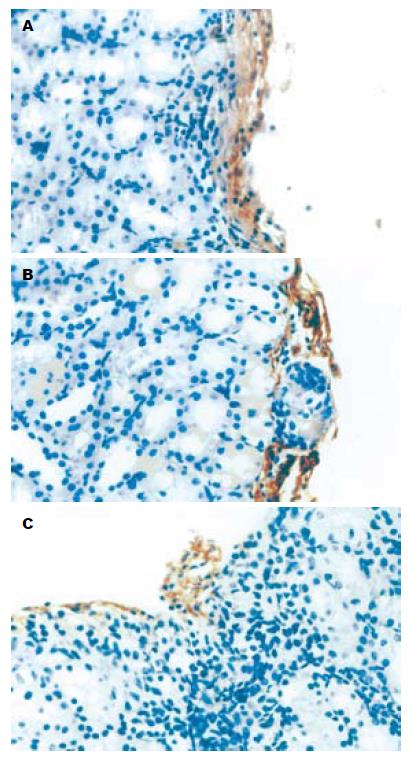
实验组大鼠肾被膜下可见有成团的核深染细胞, 不同于肾小球和肾小管细胞, 核深染、胞质较少, 排列成团但并不形成管腔, 也不具备肾小球的囊壁结构, 周围可见大量核呈细长状的内皮细胞, 并可见部分细胞伸入到细胞团内部. 对照组和内皮细胞组也可见类似结构, 但细胞团中心细胞较少, 部分被纤维组织代替. 对照组细胞团周围无内皮细胞围绕, 而内皮细胞组周围虽然可见内皮细胞, 但细胞团内部未发现类似细胞(图2). 胰岛素免疫组化实验组大鼠肾被膜下可见上述成团的细胞染成棕黄色, 呈颗粒状, 证实确为有功能的胰岛. 对照组和内皮细胞组上述类似细胞团仅有少量细胞染成棕黄色, 证明上述细胞可能是移植胰岛但功能丧失(图3). VEGF165免疫组化实验组大鼠肾被膜下可见有抗胰岛素抗体免疫组化染色呈阳性的细胞团同样抗VEGF免疫组化染色也呈阳性. 而对照组和内皮细胞组无阳性染色(图4). CD34免疫组化实验组大鼠肾被膜下可见有抗胰岛素抗体免疫组化染色呈阳性的细胞团同样抗CD34免疫组化染色也呈阳性, 胰岛细胞团内部可见有大量细胞胞质染成棕黄色. 而对照组和内皮细胞组胰岛细胞团周围虽有阳性细胞, 但内部仅有少量阳性细胞染色, 于实验组之间有明显差异(图5). MVD实验组大鼠肾被膜下胰岛内部MVD平均为74.3±6.74, 对照组和内皮细胞组MVD分别为11.43±2.22和10.9±2.45, 两组与实验组间有明显差别(P<0.05), 而对照组和内皮细胞组两组间无明显差别(P>0.05).
胰岛移植与胰腺移植相比具有对全身干预小、手术简单、并发症少等优点. 但供胰需求量大、移植物生存率和胰岛素不依赖率低等制约了胰岛的广泛应用. 近期研究发现, 胰岛移植物在移植后早期(7-14 d内)有近70%的胰岛失功[7]. 导致失功的原因有很多, 主要包括胰岛入血后即刻发生的血液介导的炎性反应、移植早期供胰岛血管尚未阶段造成的缺血缺氧损伤以及免疫攻击等[8-10]. 近年来, 移植胰岛再血管化问题受到人们的普遍关注, 认为移植胰岛的存活在很大程度上, 尤其是在早期取决于其血管化的程度和速度. 胰岛的血运十分丰富, 血流占胰腺的10%, 具有密集的毛细血管网以保证足够的组织供氧[11]. 胰岛内门脉系统具有特殊的血流灌注顺序, B细胞→A细胞→D细胞和PP细胞, 这也是胰岛细胞内相互联系和激素分泌调节的基本条件[12]. 本实验采用肾被膜下将大鼠血管内皮细胞或VEGF165转染的大鼠血管内皮细胞与胰岛共同移植, 观察内皮细胞及VEGF165诱导移植胰岛再血管化及对功能影响. 肾被膜下胰岛移植模型, 属于异位胰岛移植, 移植胰岛限于肾被膜下形成细胞团, 便于观察血管形成情况. 本实验移植300当量胰岛, 对于大鼠来说, 该数量为边缘数量, 即不能完全满足糖尿病大鼠的需求, 以便于术后利用大鼠血糖水平变化监测移植胰岛功能以及实验因素对胰岛功能的影响. 本实验表明, 单纯接受移植胰岛的大鼠术后虽然血糖有所下降但未降到正常水平, 证明移植胰岛存在死亡现象. 病理学观察也证实在胰岛中心的B细胞已经被大量结蒂组织代替, 仅有少量细胞残留被抗胰岛素抗体染成棕黄色.
胰岛分离纯化过程中破坏了其内部的微循环系统, 原有的血管内皮细胞连续性遭到破坏需要进行微循环重建, 异体胰岛移植物再血管化较晚. Furuya et al[13]研究发现, 移植在肾被膜下的胰岛原有的血管内皮细胞逐渐减少, 至移植术后第5天完全消失, 至术后第7-14天才开始从周边逐渐形成毛细血管雏形, 4 wk后方能完全重建特有的灌注系统. 本实验也观察到术后14 d, 单纯接受胰岛移植组的移植物内部的内皮细胞几乎完全消失, 周围虽有内皮细胞, 但未向内部延伸, 表明再血管化尚未开始. 血流系统重建依赖于结构基础和微环境基础. 有人认为在胰岛分离纯化过程中胰岛内部原有的内皮细胞被破坏是导致微循环系统重建延迟的重要原因[14]. 本实验将血管内皮细胞与胰岛共同移植, 为再血管化提供了良好的结构基础, 但实验结果表明虽然血管内皮细胞存活, 但处于静止状态, 并没有向胰岛内皮生长延伸, 没有形成血窦. 与单纯胰岛移植组相比, 胰岛功能无明显改善. 因此我们认为胰岛内原有的供体血管内皮细胞及受体内的毛细血管和毛细血管后小静脉已经构成了血管新生的良好的结构基础. 因此微环境基础, 即各种促血管生成因子才是再血管化的关键因素.
VEGF165是VEGF家族中发挥生物学效应的主要成分, 可高效特异地作用于血管内皮细胞, 有强烈的促分裂和趋化作用, 并可增强微血管通透性, 促进血浆纤维蛋白外渗, 为血管形成过程中多种细胞迁移提供一个纤维网络[15-16]. 可以通过内皮细胞上的两个特殊受体flt和flk(KDR)作用, 直接刺激内皮细胞增殖并产生纤维蛋白溶酶原激活剂和胶原酶, 促进内皮细胞移动和血管生成[17]. 目前已经广泛应用于缺血性疾病的治疗[18]. 组织在受到缺血缺氧刺激时, 内源性VEGF表达会有所增加[19], 但不足以尽快恢复内皮细胞的完整性. 这在移植胰岛中也得到了证明[20]. 许多研究致力于给予移植胰岛外源性VEGF, 试图在局部造成VEGF高浓度环境, 其途径包括: 直接注射人重组VEGF[21]; 应用VEGF的蛋白制剂; 在移植部位应用VEGF缓释系统(在胰岛微囊上包被VEGF)持续给药等. 但VEGF在体内半衰期极短(<6 min), 直接注射和应用蛋白制剂难以在移植局部维持足够的浓度, 必须反复大剂量给药, 往往带来很大不便. 且受到移植部位的限制(只能在皮下等容易注射的部位进行治疗), 临床应用前景较差[22]. 改良微囊、应用VEGF缓释系统虽然有一定效果, 但受到微囊的生物可容性、释放浓度、持续时间等多种不确定因素的影响, VEGF在体内持续时间仍较短, 仅1-3 d左右, 不能满足移植胰岛的需要[23]. 因此, 寻找一种能够在移植胰岛局部持续高表达VEGF的方法是促进血管生长的关键.
本实验利用基因转染技术, 以VEGF基因为目的基因, 使VEGF以旁分泌和自分泌的形式在移植局部形成高浓度, 为新生血管形成创造良好的微环境, 诱导移植组织再血管化. 但胰岛本身是一种不具有分化能力的细胞, 一般的转染效率很低, 有实验成功的利用腺病毒载体[24]和改良于HIV病毒的lenti病毒载体转染胰岛[25], 但病毒载体存在一些潜在危险, 如在宿主体内过度复制, 对机体基因组DNA产生不良影响等. 鉴于以上原因, 本实验并不以胰岛细胞作为直接的靶细胞, 而采用同源的大鼠血管内皮细胞作为载体, 在不增加异种抗原的基础上在移植局部高浓度表达VEGF, 促进再血管化进程. 血管内皮细胞既是再血管化的必需的结构基础, 也是VEGF165作用的靶细胞, 且具有取材方便, 便于培养等优点, 是一种良好的中介细胞. 本实验证明VEGF165转染的大鼠血管内皮细胞于移植后14 d在局部仍能表达较高浓度的VEGF. 同时, CD34免疫组化染色显示共同移植的胰岛内部内皮细胞明显增多, 出现了明显的血窦. 移植胰岛功能得到明显改善, 虽然移植边缘数量的胰岛, 但术后3 d血糖水平以及胰岛素分泌水皮恢复正常, 说明移植胰岛早期因为缺血缺氧而导致死亡的现象得到改善, 死亡数量减少, 供胰需求量明显减少. 胰岛分离纯化提高后, 胰岛移植并未出现所预料的大幅度进步, 胰岛早期大量死亡又成为制约胰岛移植发展的主要障碍和难以突破的"瓶颈". 通过本研究可为这一问题提供解决途径, 减少供胰用量, 为临床大量开展胰岛移植增加可行性、奠定基础.
胰岛移植是治疗糖尿病的有效手段之一, 但供胰量大、移植物长期存活率低仍是阻碍胰岛移植发展的"瓶颈". 造成这种现象的主要原因之一是胰岛分离纯化过程中破坏了其内部的微循环系统, 导致移植后无法象胰腺移植那样立即恢复血运. 移植后早期(7-14d)内近70%移植胰岛因缺血、缺氧死亡. 在移植早期, 胰岛的存活率在很大程度上依赖于再血管化的时间和程度.
以往关于胰岛移植的研究多数集中在改进胰岛分离、纯化过程, 建立低毒高效的免疫抑制剂方案方面. 近年来人们开始意识到胰岛微循环的重要性, 其不仅是胰岛生存的必需环境, 也是发挥生理功能的必要条件. 移植早期迅速重建移植胰岛微循环, 将有助于降低胰岛移植物早期死亡率, 提高存活率, 减少供胰用量.
许多研究试图在局部造成VEGF高浓度环境, 包括: 直接注射人重组VEGF; 应用VEGF的蛋白制剂; 在移植部位应用VEGF缓释系统持续给药等. 但VEGF在体内半衰期极短, 直接注射和应用蛋白制剂难以在移植局部维持足够的浓度, 且受到移植部位的限制. 改良微囊、应用VEGF缓释系统虽然有一定效果, 但受到微囊的生物可容性、释放浓度、持续时间等多种不确定因素的影响.
本实验并不以胰岛细胞作为直接的靶细胞, 而创新性采用同源的大鼠血管内皮细胞作为载体, 在不增加异种抗原的基础上在移植局部高浓度表达VEGF, 促进再血管化进程.
胰岛分离纯化提高后, 胰岛移植并未出现所预料的大幅度进步, 胰岛早期大量死亡又成为制约胰岛移植发展的主要障碍和难以突破的"瓶颈". 通过本研究可为这一问题提供解决途径, 减少供胰用量, 为临床大量开展胰岛移植增加可行性、奠定基础.
血管内皮生长因子(VEGF)可高效特异地作用于血管内皮细胞, 有强烈的促分裂和趋化作用, 并可增强微血管通透性, 促进血浆纤维蛋白外渗, 为血管形成过程中多种细胞迁移提供一个纤维网络. 可以直接刺激内皮细胞增殖并产生纤维蛋白溶酶原激活剂和胶原酶, 促进内皮细胞移动和血管生成. 目前广泛用于治疗缺血性疾病.
本研究采用VEGF165转染大鼠血管内皮细胞, 探讨诱导移植胰岛再血管化及对功能影响, 具有一定的科研和临床意义.
编辑: 潘伯荣 电编:张敏
| 1. | Stagner JI, Samols E. Altered microcirculation and secretion in transplanted islets. Transplant Proc. 1994;26:1100-1102. [PubMed] |
| 2. | Shapiro AM, Ryan EA, Lakey JR. Diabetes. Islet cell transplantation. Lancet. 2001;358 Suppl:S21. [PubMed] |
| 3. | Boker A, Rothenberg L, Hernandez C, Kenyon NS, Ricordi C, Alejandro R. Human islet transplanta-tion: update. World J Surg. 2001;25:481-486. [PubMed] |
| 4. | Dehghani GA, Sotoodeh M, Omrani GR. Trophic effects of vanadium on beta-cells of STZ-induced insulin dependent diabetic rats & evidence for long-term relief of diabetes mellitus. Indian J Med Res. 1999;110:70-75. [PubMed] |
| 5. | Russell JC, Graham SE, Dolphin PJ. Glucose tolerance and insulin resistance in the JCR:LA-corpulent rat: effect of miglitol (Bay m1099). Metabolism. 1999;48:701-706. [PubMed] |
| 6. | Imao T, Egawa M, Takashima H, Koshida K, Namiki M. Inverse correlation of microvessel density with metastasis and prognosis in renal cell carcinoma. Int J Urol. 2004;11:948-953. [PubMed] |
| 7. | Fontaine MJ, Fan W. Islet cell transplantation as a cure for insulin dependent diabetes: current improve-ments in preserving islet cell mass and function. Hepatobiliary Pancreat Dis Int. 2003;2:170-179. [PubMed] |
| 8. | Ozmen L, Ekdahl KN, Elgue G, Larsson R, Korsgren O, Nilsson B. Inhibition of thrombin abrogates the instant blood-mediated inflammatory reaction triggered by isolated human islets: possible application of the thrombin inhibitor melagatran in clinical islet transplantation. Diabetes. 2002;51:1779-1784. [PubMed] |
| 9. | Gainer AL, Suarez-Pinzon WL, Min WP, Swiston JR, Hancock-Friesen C, Korbutt GS, Rajotte RV, Warnock GL, Elliott JF. Improved survival of biolistically transfected mouse islet allografts expressing CTLA4-Ig or soluble Fas ligand. Transplantation. 1998;66:194-199. [PubMed] |
| 10. | Fotiadis C, Xekouki P, Papalois AE, Antonakis PT, Sfiniadakis I, Flogeras D, Karampela E, Zografos G. Effects of mycophenolate mofetil vs cyclosporine administration on graft survival and function after islet allotransplantation in diabetic rats. World J Gastroenterol. 2005;11:2733-2738. [PubMed] |
| 11. | Jansson L, Carlsson PO. Graft vascular function after transplantation of pancreatic islets. Diabetologia. 2002;45:749-763. [PubMed] |
| 12. | Barshes NR, Wyllie S, Goss JA. Inflammation-mediated dysfunction and apoptosis in pancreatic islet transplantation: implications for intrahepatic grafts. J Leukoc Biol. 2005;77:587-597. [PubMed] |
| 13. | Furuya H, Kimura T, Murakami M, Katayama K, Hirose K, Yamaguchi A. Revascularization and function of pancreatic islet isografts in diabetic rats following transplantation. Cell Transplant. 2003;12:537-544. [PubMed] |
| 14. | Brissova M, Fowler M, Wiebe P, Shostak A, Shiota M, Radhika A, Lin PC, Gannon M, Powers AC. Intraislet endothelial cells contribute to revascularization of transplanted pancreatic islets. Diabetes. 2004;53:1318-1325. [PubMed] |
| 15. | Brown LF, Detmar M, Claffey K, Nagy JA, Feng D, Dvorak AM, Dvorak HF. Vascular permeability factor/vascular endothelial growth factor: a multifunctional angiogenic cytokine. EXS. 1997;79:233-269. [PubMed] |
| 16. | Shimizu H, Mitsuhashi N, Ohtsuka M, Ito H, Kimu-ra F, Ambiru S, Togawa A, Yoshidome H, Kato A, Miyazaki M. Vascular endothelial growth factor and angiopoietins regulate sinusoidal regeneration and remodeling after partial hepatectomy in rats. World J Gastroenterol. 2005;11:7254-7260. [PubMed] |
| 17. | Sugihara T, Wadhwa R, Kaul SC, Mitsui Y. A novel alternatively spliced form of murine vascular endothelial growth factor, VEGF 115. J Biol Chem. 1998;273:3033-3038. [PubMed] |
| 18. | Wu JC, Chen IY, Wang Y, Tseng JR, Chhabra A, Salek M, Min JJ, Fishbein MC, Crystal R, Gambhir SS. Molecular imaging of the kinetics of vascular endothelial growth factor gene expression in ischemic myocardium. Circulation. 2004;110:685-691. [PubMed] |
| 19. | Okuda T, Azuma T, Ohtani M, Masaki R, Ito Y, Yamazaki Y, Ito S, Kuriyama M. Hypoxia-inducible factor 1 alpha and vascular endothelial growth factor overexpression in ischemic colitis. World J Gastroenterol. 2005;11:1535-1539. [PubMed] |
| 20. | Sigrist S, Mechine-Neuville A, Mandes K, Calenda V, Braun S, Legeay G, Bellocq JP, Pinget M, Kessler L. Influence of VEGF on the viability of encapsulated pancreatic rat islets after transplantation in diabetic mice. Cell Transplant. 2003;12:627-635. [PubMed] |
| 21. | Szuba A, Skobe M, Karkkainen MJ, Shin WS, Beynet DP, Rockson NB, Dakhil N, Spilman S, Goris ML, Strauss HW. Therapeutic lymphangiogenesis with human recombinant VEGF-C. FASEB J. 2002;16:1985-1987. [PubMed] |
| 22. | Ishikawa M, Fjii M, Iuchi M, Miyauchi T, Tashiro S. Effect of intrahepatic omental implantation on angiogenesis in rat liver with hepatic artery ligation. Clin Exp Med. 2001;1:27-33. [PubMed] |
| 23. | Mahgoub MA, Ammar A, Fayez M, Edris A, Hazem A, Akl M, Hammam O. Neovascularization of the amniotic membrane as a biological immune barrier. Transplant Proc. 2004;36:1194-1198. [PubMed] |
| 24. | Cheng K, Fraga D, Zhang C, Kotb M, Gaber AO, Guntaka RV, Mahato RI. Adenovirus-based vascular endothelial growth factor gene delivery to human pancreatic islets. Gene Ther. 2004;11:1105-1116. [PubMed] |
| 25. | Okitsu T, Kobayashi N, Totsugawa T, Maruyama M, Noguchi H, Watanabe T, Matsumura T, Fujiwara T, Tanaka N. Lentiviral vector mediated gene delivery into non-dividing isolated islet cells. Transplant Proc. 2003;35:483. [PubMed] |