修回日期: 2006-08-30
接受日期: 2006-09-12
在线出版日期: 2006-11-08
目的: 研究暴发性肝衰竭小鼠大肠上皮细胞间紧密连接蛋白occludin表达的变化.
方法: BALB/c小鼠150只随机分为生理盐水对照组(n = 30)、内毒素(LPS)对照组(n = 30)、D-氨基半乳糖(D-GalN)对照组(n = 30)和暴发性肝衰竭(LPS+GalN)组(n = 60). 采用D-GalN和LPS联合ip制备暴发性肝衰竭小鼠动物模型. 应用免疫组织化学技术、Western blot及实时定量PCR检测暴发性肝衰竭进程中, 小鼠大肠上皮细胞间紧密连接蛋白occludin的定位、表达及mRNA的变化.
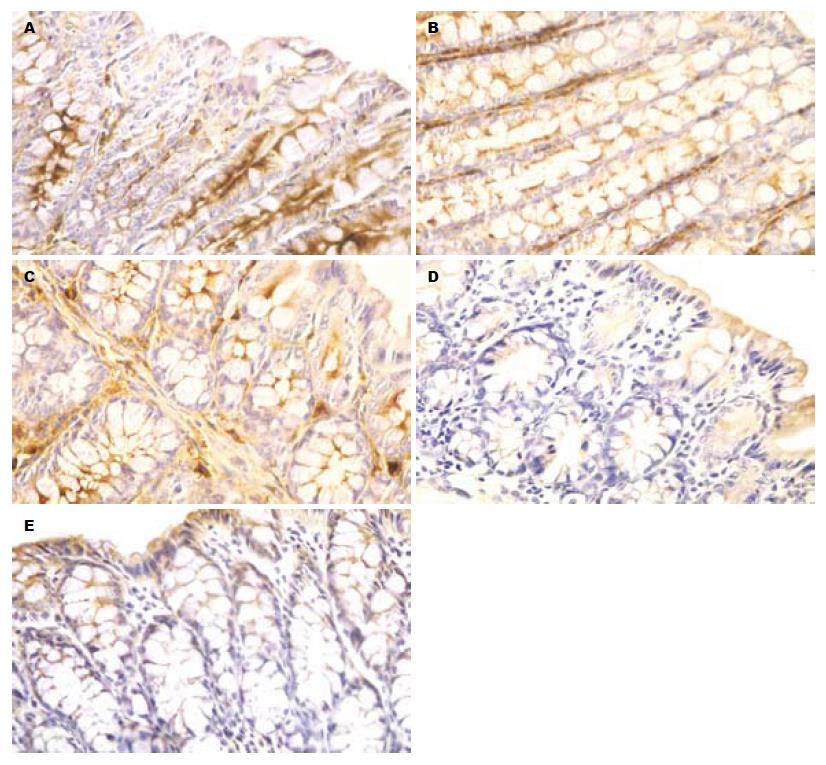
结果: occludin蛋白主要沿小鼠大肠黏膜上皮细胞膜的顶端呈线状分布, 在暴发性肝衰竭组小鼠, 6 h时occludin的阳性染色开始减少, 9 h时更为明显. Western blot结果与免疫组织化学结果相一致, 6 h时开始下降(0.48±0.07), 9 h达到最低值(0.36±0.05), 与生理盐水对照组(0.71±0.09)相比差异显著(P<0.05). 实时定量PCR结果显示, 暴发性肝衰竭小鼠2 h时occludin mRNA即开始下降(0.85±0.12), 6 h时达到最低值(0.72±0.04), 与生理盐水对照组(1.00±0.05)相比有明显差异(P<0.05), 9 h时有所恢复(0.93±0.10).
结论: 在暴发性肝衰竭过程中, 大肠上皮细胞间紧密连接蛋白occludin表达下降, 其mRNA也呈下调趋势.
引文著录: 崔巍, 马力, 闻颖, 刘沛. 暴发性肝衰竭时肠上皮细胞间紧密连接蛋白occludin表达下降. 世界华人消化杂志 2006; 14(31): 3008-3012
Revised: August 30, 2006
Accepted: September 12, 2006
Published online: November 8, 2006
AIM: To observe the changes of intestinal epithelial tight junction protein occludin in mice with fulminant hepatic failure (FHF), and explore the mechanisms of spontaneous bacterial peritonitis (SBP).
METHODS: A total of 150 male BALB/c mice were divided into group A, B, C and D. The mice in group D were intraperitoneally injected with lipopolysaccharide (LPS, 10 μg/kg) and D-galactosamine (GalN, 800 mg/kg) to induce the model of FHF, while the mice in group A, B and C were intraperitioncally injected normal saline, LPS, and GalN, respectively. At the end of the 2nd, 6th, and 9th h, the mice were killed for the collection of liver and intestinal specimens. Immunohistochemistry, Western blot and quantitative real time polymerase chain reaction (QRT-PCR) were used to detect the distribution and expression of intestinal epithelial tight junction protein occludin.
RESULTS: Tight junction protein occludin was localized along the apical region of the lateral plasma membrane representing the region of tight junctions in surface and crypt epithelial cells. In mucosal tissues from mice with FHF 6 and 9 h after injection, occludin-positive staining was gradually weakened. Western blot demonstrated consistent and significant reduction of occludin expression in mice with FHF at the 6th (0.48 ± 0.07) and 9th h (0.36 ± 0.05) (P < 0.05), which was significantly lower than that in group A (0.71 ± 0.09) (P < 0.05). Furthermore, the expression of occludin mRNA was decreased starting from the 2nd h (0.85 ± 0.12), and reached the lowest level at 6th h (0.72 ± 0.04), significantly lower than that in group A. At the 9th h, occludin mRNA expression almost restored (0.93 ± 0.10) to the normal level.
CONCLUSION: The expression of tight junction protein occludin is decreased at both protein and mRNA level in intestinal epithelial cells of mice with FHF.
- Citation: Cui W, Ma L, Wen Y, Liu P. Down-regulated expression of intestinal epithelial tight junction protein occludin in mice with fulminant hepatic failure. Shijie Huaren Xiaohua Zazhi 2006; 14(31): 3008-3012
- URL: https://www.wjgnet.com/1009-3079/full/v14/i31/3008.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i31.3008
自发性腹膜炎是暴发性肝衰竭(fulminant hepatic failure, FHF)时常见的并发症[2], 其发生与肠道黏膜屏障功能的损伤及细菌移位有关. 肠道黏膜屏障最重要的结构是肠上皮细胞间的紧密连接, 我们研究了暴发性肝衰竭小鼠肠上皮细胞间紧密连接蛋白occludin表达的变化, 以进一步揭示自发性腹膜炎的发病机制.
♂BALB/c小鼠150只, 6-8 wk, 体质量18-22 g, 由中国医科大学实验动物中心提供. D-氨基半乳糖(D-galactosamine, GalN), 内毒素LPS(Ecoli O127: B8), 美国Sigma公司; 兔抗occludin多克隆抗体, 美国Zymed公司; SP免疫组化试剂盒, 北京中杉金桥公司; RNA PCR试剂盒, T7体外转录试剂盒, quantitive Real time PCR试剂盒, 大连宝生物工程有限公司.
1.2.1 动物模型制备: 参照文献[1]制备FHF小鼠动物模型. 动物随机分为4组, 1组: 生理盐水对照组30只; 2组: LPS对照组30只; 3组: GalN对照组30只; 4组: 暴发性肝衰竭组(LPS+GalN)60只, 每组分为3个时间点(2 h, 6 h, 9 h), 每个时间点取10只小鼠断头处死, 取大肠组织部分置于甲醛中固定制备石蜡标本, 部分置于Eppendorf管中-80 ℃保存以提取蛋白, 部分置于TRIzol液中-80 ℃保存以提取RNA.
1.2.2 occludin免疫组织化学染色: 采用SABC法, 石蜡切片常规脱蜡至水, H2O2孵育, 胃蛋白酶K 37 ℃ 30 min抗原修复, 正常山羊血清封闭, 兔抗小鼠多克隆occludin抗体(1:50)4 ℃过夜, 生物素标记的羊抗兔-IgG抗体37 ℃ 20 min, SABC, 37 ℃ 20 min, DAB显色, 镜下控制显色时间, 苏木素复染, 常规脱水透明, 树胶封片. PBS液代替一抗做空白对照.
1.2.3 Western blot分析: 取大约100 mg大肠组织置于0.5 mL蛋白裂解液中, 于冰上超声波粉碎机下将组织粉碎, 匀浆置于4 ℃冰箱过夜, 12 000 g, 4 ℃, 离心1 h, 取上清即为膜蛋白. 采用BCA法对蛋白样品进行定量, 用蒸馏水将蛋白样品调成相同浓度, 加入相同体积上样缓冲液, 沸水煮5 min进行蛋白变性. 取50 μg总蛋白进行80 g/L SDS-PAGE凝胶电泳, 电压100 V, 90 min; 电泳后将蛋白转至硝酸纤维素膜上, 电压50 V, 2 h; 脱脂奶粉封闭2 h, 加入兔抗小鼠多克隆occludin抗体(1:1000)4 ℃过夜; 然后加入碱性磷酸酶标记的羊抗兔-IgG抗体(1:2000)室温2 h, BCIP/NBT显色液显色, 约10 min, 蒸馏水终止反应. 以β-actin作为内参. 结果通过天能图像分析系统进行分析, occludin蛋白含量 = 样本occludin蛋白灰度值/同一样本β-actin灰度值.
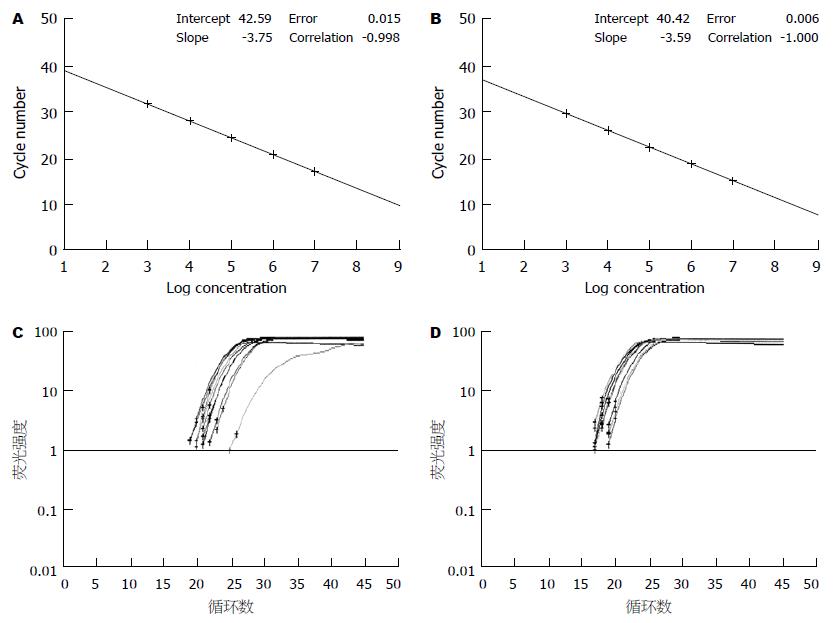
1.2.4 实时定量PCR: 用TRIzol一步法提取大肠组织RNA. 采用SYBR GreenⅠ荧光染料嵌合法检测occludin mRNA. 先构建目的基因(occludin基因)和管家基因(GAPDH)的RNA标准品, 制作标准曲线, 利用标准曲线对样品中的目的基因和管家基因分别进行定量. 通过管家基因的校正, 检测各组大肠组织中occludin目的基因的相对表达量. occludin mRNA的相对表达量 = occludin基因拷贝数/GAPDH基因拷贝数, 校正结果以生理盐水对照组为1, 其余组与之相比较. PCR反应体系的组成参照说明书进行, 反应条件为逆转录反应42 ℃ 10 min, 95 ℃ 2 min, PCR扩增95 ℃ 10 s, 1个循环, 95 ℃ 5 s, 60 ℃ 20 s, 45个循环. occludin和GAPDH引物序列如下: Ocln-F5'-GCTTATCTTGGGAGCCTGGACA-3'; Ocln-R5'-GTCATTGCTTGGTGCATA ATGATTG-3'; GAPDH-F5'-AAATGGTGAAGGTCGGTGTG-3'; GAPDH-R5'-TGAAGGGGTCGTTGATGG-3'. occludin产物片段108 bp, GAPDH产物片段144 bp.
统计学处理 以mean±SD表示, 应用SPSS 10.0对各组间数据进行方差分析.
本实验中暴发性肝衰竭组小鼠总死亡率达68% (34/50), 肝脏HE染色可见成片的出血坏死区, 内有较多炎细胞浸润, 证明本实验动物模型成功, 可以应用.
在第1, 2, 3组的大肠组织切片中, occludin主要沿肠黏膜上皮细胞膜的顶端分布, 呈表达很强的棕褐色线状信号, 在整张切片上均可见到. 在第4组, occludin的定位与前3组没有明显区别, 但6 h时可以发现棕褐色阳性信号开始减弱, 9 h时更为明显, 且阳性细胞数明显减少(图1).
各组在65 kDa处均可见特异性的蛋白条带(图2), 对各条带进行灰度分析发现第1, 2, 3组occludin的表达无明显差异, 第4组2 h时occludin表达与前3组差异不大, 6 h时occludin表达开始下降(0.48±0.07), 9 h时达到最低值(0.36±0.05), 与生理盐水对照组(0.71±0.09)相比有显著性差异(P<0.05).
第1, 2, 3组occludin的mRNA水平没有差异, 第4组2 h时occludin mRNA开始下降(0.85±0.12), 6 h时达到最低值(0.72±0.04), 与生理盐水对照组(1.00±0.05)相比有显著性差异(P<0.05), 9 h时有所恢复(0.93±0.10), 但仍低于对照组(图3).
自发性腹膜炎是FHF患者常见的并发症之一[2-4], 死亡率较高, 在48%-57%[5]. 但到目前为止, FHF并发自发性腹膜炎的机制仍不十分清楚, 多数学者认为细菌移位在SBP的发生中占据重要位置[6-11], 而其发生与肠黏膜屏障的损伤有着密切关系[12-14]. 大肠杆菌直径大约3 mm, 正常情况下由于肠黏膜上皮细胞间形成完整的连接复合体封锁住了细胞旁间隙[15-17], 使得大肠杆菌不能穿过肠壁进入腹膜腔, 但在病理情况下大肠杆菌可以穿过肠黏膜上皮层及固有层, 进入肠系膜淋巴结和肠外组织, 发生细菌移位. 但是这一过程是如何完成的并不清楚. 一般来说大分子物质穿过肠黏膜上皮细胞, 无外乎两种途径, 一种是通过上皮细胞的胞饮作用, 另一种是通过细胞旁间隙[18-19], 而后者的发生则依赖于细胞间连接完整性的破坏. 肠上皮细胞间的连接, 从顶端到基膜依次为紧密连接(TJ)、黏附连接、桥粒和缝隙连接. 其中TJ是构成肠黏膜机械屏障最重要的结构, 由Claudin蛋白、occludin蛋白、JAM、ZOs(zonula occludins)等结构蛋白及各类连接蛋白分子共同组成[20-22]. occludin蛋白是TJ中最重要的结构蛋白, 他不仅能通过外环以拉链式结合进而产生严密的细胞旁封闭, 还能与不同的分子结合, 参与TJ形成的信号调节[23-24]. 有研究表明, 缺乏occludin蛋白的成纤维细胞不能形成典型的TJ结构[25].
我们前期的研究观察到, 在电镜下暴发性肝衰竭小鼠肠黏膜上皮细胞间紧密连接发生断裂, 且断裂区域可以看到以囊胞形式存在的细菌. 因此我们推论FHF时, 肠黏膜上皮细胞间的紧密连接受到破坏, 大肠杆菌得以通过细胞旁间隙进入肠壁, 参与SBP的形成. 那么TJ的断裂是怎样发生的呢? 是否与紧密连接蛋白表达的异常有关? 为了证实这一问题, 我们从蛋白及mRNA水平观察了暴发性肝衰竭小鼠肠上皮细胞间紧密连接蛋白occludin表达的变化. 结果表明, FHF组小鼠6 h时免疫组织化学染色即发现大肠上皮细胞的occludin表达减少, 9 h时更为明显, Western blot结果与免疫组织化学结果相吻合, 且这一时间点也与我们前期观察到的细菌穿透肠壁的时间点一致. 这证实了FHF时, 大肠上皮细胞间的紧密连接蛋白occludin减少, 从而使紧密连接的完整性受到破坏, 为细菌的穿透提供了可能. 进一步我们从转录水平探讨了occludin mRNA表达的变化, 结果显示, FHF小鼠2 h时occludin mRNA即开始下降, 6 h时达到最低值, 9 h时有所恢复, 其变化的时间点要早于蛋白水平, 提示occludin蛋白的减少极可能是在转录水平进行调节的.
暴发性肝衰竭时存在肠黏膜屏障的损伤, 其机制不十分清楚. 肠上皮细胞间具有完整的紧密连接, 是肠黏膜屏障最重要的物质基础. 那么暴发性肝衰竭时肠黏膜屏障的损伤是否是由于紧密连接的破坏而造成的呢? 本文就这一问题研究了暴发性肝衰竭时肠上皮紧密连接中最重要的结构蛋白occludin表达的变化.
暴发性肝衰竭时肠黏膜屏障损伤已经证实, 但其发生机制是目前研究的热点, 而且, 其与细菌穿透的因果关系尚无定论.
目前关于暴发性肝衰竭时肠上皮细胞间紧密连接蛋白occludin表达变化的文章尚未见报道. 暴发性肝衰竭时肠黏膜屏障损伤的研究主要集中肠上皮细胞的凋亡, 其他原因引起的肠黏膜屏障损伤有报道LPS可引起紧密连接蛋白表达下降.
发现暴发性肝衰竭时肠上皮细胞间紧密连接蛋白occludin表达下降, 为进一步深入研究肠黏膜屏障损伤的机制提供了帮助.
紧密连接存在于各类上皮细胞及血管内皮细胞间的顶端, 形成一个顶端闭锁结构且发挥"屏障"和"防御"功能, 以控制细胞间的通透性和保持细胞的极性. 紧密连接由多种紧密连接蛋白组成, 包括Claudin, occludin以及ZO-1, ZO-2, Zo-3等, 在不同的组织结构, 各种紧密连接蛋白的表达亦存在差别.
本文探讨暴发性肝衰竭时肠上皮细胞间紧密连接蛋白occludin的定位和表达的水平, 发现在暴发性肝衰竭过程中, 大肠上皮细胞间紧密连接蛋白occludin表达下降, 其mRNA也呈下调趋势. 这是比较前沿的研究.
编辑: 王晓瑜 电编:张敏
| 2. | Poddar U, Thapa BR, Prasad A, Sharma AK, Singh K. Natural history and risk factors in fulminant hepatic failure. Arch Dis Child. 2002;87:54-56. [PubMed] |
| 3. | Thanopoulou AC, Koskinas JS, Hadziyannis SJ. Spontaneous bacterial peritonitis (SBP): clinical, laboratory, and prognostic features. A single-center experience. Eur J Intern Med. 2002;13:194-198. [PubMed] |
| 4. | Franca AV, De Souza JB, Silva CM, Soares EC. Long-term prognosis of cirrhosis after spontaneous bacterial peritonitis treated with ceftriaxone. J Clin Gastroenterol. 2001;33:295-298. [PubMed] |
| 5. | Dhiman RK, Makharia GK, Jain S, Chawla Y. Ascites and spontaneous bacterial peritonitis in fulminant hepatic failure. Am J Gastroenterol. 2000;95:233-238. [PubMed] |
| 6. | Garcia-Tsao G. Bacterial translocation: cause or consequence of decompensation in cirrhosis? J Hepatol. 2001;34:150-155. [PubMed] |
| 7. | Berg RD. Bacterial translocation from the gastroin-testinal tract. J Med. 1992;23:217-244. [PubMed] |
| 8. | Such J, Frances R, Munoz C, Zapater P, Casellas JA, Cifuentes A, Rodriguez-Valera F, Pascual S, Sola-Vera J, Carnicer F. Detection and identification of bacterial DNA in patients with cirrhosis and culture-negative, nonneutrocytic ascites. Hepatology. 2002;36:135-141. [PubMed] |
| 9. | Chiva M, Guarner C, Peralta C, Llovet T, Gomez G, Soriano G, Balanzo J. Intestinal mucosal oxidative damage and bacterial translocation in cirrhotic rats. Eur J Gastroenterol Hepatol. 2003;15:145-150. [PubMed] |
| 10. | Chang CS, Yang SS, Kao CH, Yeh HZ, Chen GH. Small intestinal bacterial overgrowth versus antimicrobial capacity in patients with spontaneous bacterial peritonitis. Scand J Gastroenterol. 2001;36:92-96. [PubMed] |
| 11. | Sola R, Soriano G. Why do bacteria reach ascitic fluid? Eur J Gastroenterol Hepatol. 2002;14:351-354. [PubMed] |
| 13. | Harari Y, Weisbrodt NW, Moody FG. Ileal mucosal response to bacterial toxin challenge. J Trauma. 2000;49:306-313. [PubMed] |
| 14. | Kiyono H, Kweon MN, Hiroi T, Takahashi I. The mucosal immune system: from specialized immune defense to inflammation and allergy. Acta Odontol Scand. 2001;59:145-153. [PubMed] |
| 16. | Yap AS, Mullin JM, Stevenson BR. Molecular analyses of tight junction physiology: insights and paradoxes. J Membr Biol. 1998;163:159-167. [PubMed] |
| 17. | Tsukita S, Furuse M, Itoh M. Multifunctional strands in tight junctions. Nat Rev Mol Cell Biol. 2001;2:285-293. [PubMed] |
| 18. | Nusrat A, Parkos CA, Liang TW, Carnes DK, Madara JL. Neutrophil migration across model intestinal epithelia: monolayer disruption and subsequent events in epithelial repair. Gastroenterology. 1997;113:1489-1500. [PubMed] |
| 19. | Nusrat A, Turner JR, Madara JL. Molecular physiology and pathophysiology of tight junctions. IV. Regulation of tight junctions by extracellular stimuli: nutrients, cytokines, and immune cells. Am J Physiol Gastrointest Liver Physiol. 2000;279:G851-857. [PubMed] |
| 21. | Furuse M, Fujita K, Hiiragi T, Fujimoto K, Tsukita S. Claudin-1 and -2: novel integral membrane proteins localizing at tight junctions with no sequence similarity to occludin. J Cell Biol. 1998;141:1539-1550. [PubMed] |
| 22. | Martin-Padura I, Lostaglio S, Schneemann M, Williams L, Romano M, Fruscella P, Panzeri C, Stoppacciaro A, Ruco L, Villa A. Junctional adhesion molecule, a novel member of the immunoglobulin superfamily that distributes at intercellular junctions and modulates monocyte transmigration. J Cell Biol. 1998;142:117-127. [PubMed] |
| 23. | Chen YH, Lu Q, Goodenough DA, Jeansonne B. Nonreceptor tyrosine kinase c-Yes interacts with occludin during tight junction formation in canine kidney epithelial cells. Mol Biol Cell. 2002;13:1227-1237. [PubMed] |
| 24. | Nusrat A, Chen JA, Foley CS, Liang TW, Tom J, Cromwell M, Quan C, Mrsny RJ. The coiled-coil domain of occludin can act to organize structural and functional elements of the epithelial tight junction. J Biol Chem. 2000;275:29816-29822. [PubMed] |
| 25. | Saitou M, Fujimoto K, Doi Y, Itoh M, Fujimoto T, Furuse M, Takano H, Noda T, Tsukita S. Occludin-deficient embryonic stem cells can differentiate into polarized epithelial cells bearing tight junctions. J Cell Biol. 1998;141:397-408. [PubMed] |