修回日期: 2005-08-20
接受日期: 2005-10-09
在线出版日期: 2006-11-08
目的: 研究外源质粒通过胃肠道途径吸收对小鼠肠道基因表达谱的影响.
方法: 给Balb/c小鼠灌胃质粒pcDNA3 200 μg, 在灌胃后4 h后分离空肠一段, 提取肠组织的总RNA. 利用寡核苷酸芯片对灌胃质粒pcDNA3后的Balb/c小鼠肠道进行基因表达谱研究.
结果: 灌胃外源质粒DNA后, 所检测的1 7667基因中有61条基因产生差异表达, 其中36条基因表达上调, 25条基因表达下调. 这些差异表达的基因主要涉及免疫应答、抗氧化及解毒功能、脂质代谢、阴离子转运蛋白、细胞凋亡及信号转导等过程.
结论: 外源质粒DNA通过胃肠道途径可广泛调控肠道多种基因表达.
引文著录: 刘建文, 乐国伟, 施用晖. 外源质粒DNA对小鼠肠道基因表达谱的影响. 世界华人消化杂志 2006; 14(31): 3002-3007
Revised: August 20, 2005
Accepted: October 9, 2005
Published online: November 8, 2006
AIM: To explore the influence of foreign plasmid DNA on the intestinal gene expression profile after absorption via the gastrointestinal tract in mice.
METHODS: Balb/c mice were orally administered with 200 μg plasmid pcDNA3 and a length of jejunum was isolated 4 h after oral administration. The total RNA was extracted from the intestine and the gene expression profile of Balb/c mice was analyzed using oligonucleotide array after oral administration of plasmid pcDNA3.
RESULTS: Among 17667 genes obtained from gene expression profile analysis, there were 61 genes differentially expressed from those in GenBank, of which 36 genes were up-regulated and 25 ones were down-regulated after oral administration of foreign plasmid DNA. The differentially expressed genes were mainly related to immune response, anti-oxidation, detoxification function, lipid metabolism, anion transport protein, apoptosis and signal transduction.
CONCLUSION: Foreign plasmid DNA, administered via the gastrointestinal tract, may widely modulate the expression of many genes in the intestine in mice.
- Citation: Liu JW, Le GW, Shi YH. Effect of foreign plasmid DNA on gene expression profile of the intestine in mice. Shijie Huaren Xiaohua Zazhi 2006; 14(31): 3002-3007
- URL: https://www.wjgnet.com/1009-3079/full/v14/i31/3002.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i31.3002
哺乳动物胃肠道是外源DNA进入机体的主要器官[1-3], 质粒DNA进入肠道后能够逐渐被肠道核酸酶降解成碎片形式[4-7]. 外源质粒DNA进入肠道后可能与细菌一样, 与肠道黏膜细胞存在着一种互作关系. 肠道是机体最大的免疫器官, 集中了体内大部分淋巴细胞, 外源质粒DNA可激活肠黏膜免疫细胞, 诱导肠黏膜免疫应答[8-10]. 外源质粒DNA可能进入细胞核内, 插入到哺乳动物基因组中, 引起基因组的缺失和重排, 宿主基因组会以改变DNA甲基化模式来抵抗外源质粒DNA的入侵[11-18]. 外源质粒DNA进入肠道到后, 势必会引起肠道生理功能发生相应的变化, 生理功能本质上受基因的表达调控. 我们采用基因芯片在mRNA水平上来考察外源质粒DNA对肠道基因表达谱的影响, 为进一步研究外源质粒DNA的胃肠道代谢及作用机制奠定基础.
T7-Oligo(dT)15(上海博亚生物技术有限公司), Superscript Ⅱ(Invitrogen), DNA Polymerase(Invitrogen), T4 DNA polymerase(Invitrogen), RNeasy Mini Kit(Qiagen), Random Primer DNA Labeling Kit (TaKaRa,), T7 RiboMAX Express Large Scale RNA Production System(Promega), 小鼠Oligo芯片(Qiagen). 6周龄Balbc/C♂小鼠(购自中科院上海实验动物中心)6只, 随机分成2组, 一组为实验对照组, 灌胃200 μL生理盐水, 另一组给小鼠灌胃1 g/L质粒pcDNA3生理盐水溶液200 μL, 灌胃后4 h, 眼球采血宰杀小鼠, 在超净台上迅速分离空肠一段, 同组3只小鼠的小肠合并在一起, 置于RNAlater中, 于4 ℃过夜, -20 ℃保存.
TRIzol试剂盒提取小鼠肠道总RNA, 电泳及分光光度计测A260/A280以鉴定总RNA质量. RNA定量, 反转录合成双链cDNA并进行纯化. 用T7 RiboMAX Express Large Scale RNA Production System(Promega)将双链cDNA进行体外转录合成cRNA. cRNA再次反转录成cDNA, Cy5-dCTP标记实验组cDNA, Cy3-dCTP标记实验组cDNA. 标记的DNA与芯片进行杂交洗涤, 并进行扫描.
统计学处理 采用GenePix Pro 4.0图像分析软件(Axon Instruments公司)对芯片图像进行分析, 把图像信号转化为数字信号; 最后以差异为两倍(Cy5/Cy3)的标准来确定差异表达基因, 其中Cy5/Cy3≥2表示表达显著上调, Cy5/Cy3≤0.5表示表达显著下调.
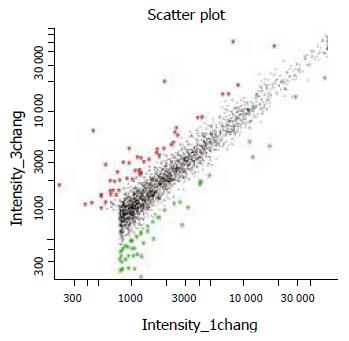
小肠组织芯片杂交, 结果显示在1 7667条基因中, 共有4196条基因表达, 其中明显差异表达的基因有61条(图1), 表达上调36条(表1), 表达下调25条(表2). 这些差异表达的基因主要涉及免疫应答、肠道抗氧化及解毒功能、脂质代谢、阴离子转运蛋白、细胞凋亡及信号转导等过程.
| GenBank accession | Cy5/Cy3 | Symbol | 基因名称 |
| NM_008638 | 2.3244 | MTHFD2 | 亚甲基四氢叶酸脱氢酶, 次甲基四氢叶酸环水解酶 |
| NM_019810 | 2.3264 | SLC5A1 | Solute carrier family 5, member 1 溶质载体家族 |
| NM_011150 | 2.3762 | LGALS3BP | Peptidylprolyl isomerase C-associated protein肽基脯氨酸异构酶C伴随蛋白 |
| NM_007885 | 2.4262 | SLC26A2 | Solute carrier family 26 (sulfate transporter), member 2 溶质载体家族 |
| AY008277 | 2.4573 | CLCA4 | Mus musculus calcium-activated chloride channel CLCA4 mRNA, complete cds |
| NM_021394 | 2.5322 | ZBP1 | Tumor stroma and activated macrophage protein DLM-1 肿瘤间质巨噬细胞蛋白 |
| NM_022331 | 2.7 | HERPUD1 | Homocysteine-inducible, endoplasmic reticulum stress-inducible, ubiquitin-like domain member 1 |
| NM_007672 | 2.7677 | CDR2 | Cerebellar degeneration-related 2 小脑退化基因 |
| NM_010501 | 2.9068 | IFIT3 | Interferon-induced protein with tetratricopeptide repeats 3 干扰素诱导蛋白 |
| BC013478 | 3.0711 | SLC30A2 | Mus musculus, clone IMAGE: 4239648, mRNA |
| NM_011036 | 3.1659 | PAP | Pancreatitis-associated protein胰腺炎相关蛋白 |
| BC005552 | 3.3969 | ASNS | Asparagine synthetase天冬酰胺合成酶 |
| AK002567 | 3.4149 | MT2 | Metallothionein 2金属硫蛋白2 |
| NM_011260 | 4.2078 | REG3G | Regenerating islet-derived 3 gamma再生基因 |
| AF027131 | 4.5115 | MUC3 | Mucin 3, intestinal黏蛋白 |
| BC007173 | 4.5371 | TPP2 | Mus musculus, clone IMAGE:3493127, mRNA, partial cds |
| NM_007769 | 4.6993 | DMBT1 | Crp-ductin候选肿瘤抑制基因 |
| NM_007679 | 4.7027 | CEBPD | CCAAT/enhancer binding protein (C/EBP), delta CCAT增强子结合蛋白 |
| NM_022411 | 5.3687 | SLC13A2 | Solute carrier family 13 (sodium-dependent dicarboxylate transporter), member 2 溶质载体家族 |
| NM_011470 | 6.2025 | SPRR2D | Small proline-rich protein 2D小脯氨酸富含蛋白 |
| AK019097 | 11.7085 | 2310057M21RIK | RIKEN cDNA 2310057M21 gene |
| AK016647 | 20.4069 | SLCO6C1 | RIKEN cDNA 4933404A18 gene |
| GenBank accession | Cy5/Cy3 | Symbol | 基因名称 |
| X78543 | 0.0829 | MCPT-PS1 | 肥大细胞蛋白酶 |
| NM_008339 | 0.1468 | CD79B | 免疫球蛋白基因 |
| AK008016 | 0.1705 | 2010001M09RIK | RIKEN cDNA 2010001M09 gene |
| NM_009696 | 0.2125 | APOE | Apolipoprotein E载脂蛋白E |
| NM_011402 | 0.2243 | SLC34A2 | Solute carrier family 34 (sodium phosphate), member 2溶质载体家族 |
| NM_013492 | 0.2466 | CLU | Clusterin簇集蛋白 |
| NM_007398 | 0.2932 | ADA | Adenosine deaminase腺苷脱氨酶 |
| NM_010382 | 0.2964 | H2-EB1 | Histocompatibility 2, class II antigen E beta主要组织相容性抗原基因II |
| NM_007489 | 0.3206 | ARNTL | Aryl hydrocarbon receptor nuclear translocator-like芳烃受体核移位因子 |
| NM_009042 | 0.3611 | REG1 | Regenerating islet-derived 1 再生基因 |
| BC021548 | 0.3644 | 0610039P13RIK | RIKEN cDNA 0610039P13 gene |
| AY030094 | 0.3734 | 4932416A11RIK | Mus musculus von Willebrand factor A-related protein (Warp) mRNA, complete cds |
| NM_011468 | 0.376 | SPRR2A | 富含脯氨酸小蛋白 |
| AK004658 | 0.39 | HSPCA | 热休克蛋白86 |
| BC007144 | 0.4201 | PSCDBP | Expressed sequence C80816 |
| NM_021520 | 0.4247 | SLC28A2 | 溶质载体家族28 |
| NM_019411 | 0.425 | PPP2CA | 蛋白磷酸酯酶 |
| BC011492 | 0.4303 | 9130020G10RIK | RIKEN cDNA 9130020G10 gene |
| M28739 | 0.4349 | TUBB2 | Tubulin, beta 2 微管蛋白 |
| NM_009825 | 0.4648 | SERPINH1 | 热休克蛋白47 |
| NM_130450 | 0.4711 | ELOVL6 | Expressed sequence C77826 |
| NM_009810 | 0.4712 | CASP3 | Caspase 3, apoptosis related cysteine protease |
| NM_009984 | 0.4725 | CTSL | 组织蛋白酶 |
| NM_023114 | 0.4757 | APOC3 | Apolipoprotein CIII载脂蛋白C III |
随着人类基因组计划进入后基因组时代, 研究重点也将由基因的发现转向基因的功能. 我们发现肠道中受外源质粒pcDNA3调控的基因有61条, 这些基因中功能较为明确的包括与免疫应答、肠道抗氧化及解毒、脂质代谢、离子转运、细胞凋亡和信号转导等相关基因, 以下就外源质粒pcDNA3调控这些基因的意义进行简要讨论. 许多与免疫应答基因表达发生变化, 其中表达上调的有胰腺炎蛋白(PAP)、淋巴细胞抗原6复合物(Ly6A, Ly6F)、干扰素刺激蛋白(G1P2)、干扰素γ诱导因子结合蛋白(IL18bp)、干扰素诱导蛋白3(IFIT3)、黏蛋白(Mucin 3). 表达下调的有肥大细胞蛋白酶(Mast cell protease, pseudogene 1)、免疫球蛋白基因(CD79B)、主要组织相容性抗原基因(H2-EB1)、热休克蛋白86、簇集蛋白、Regenerating islet-derived 3 gamma(Reg3g).
我们发现外源质粒DNA可上调微粒体谷胱甘肽硫转移酶(mGST)、谷胱甘肽过氧化物酶和金属硫蛋白2(MT)的表达. MT是富含半胱氨酸的小分子蛋白, 有使细胞免受氧化损伤的作用. 谷胱甘肽硫转移酶是生物体内的主要解毒系统[19], 与许多生理及异源物质的排泄有关. 还原型谷胱甘肽(GSH)是mGST主要作用底物. GSH与各种亲脂性和亲电子底物的第二相结合反应, 包括药物, 化疗剂, 致癌物, 致突变物, 氧化应激引起脂质过氧化损伤以及其他异生质(xenobiotic)产生的各种毒性代谢产物在微粒体上是由mGST催化解毒[20-22]. 谷胱甘肽过氧化物酶在清除细胞内过氧化物、保护细胞免受过氧化损伤过程中起重要作用. 谷胱甘肽过氧化物酶活性的强弱, 直接反映机体清除自由基的能力[23-24]. Ames(1981)[25]认为核酸及相关物质均可作为内源自由基清除剂和抗氧化剂, 具有VC作用, 由于其还原性大于VC, 还能避免VC氧化. 嘌呤的代谢产物尿酸是体内一些有害活性物质的有效清除剂, 其清除内源自由基和抗氧化的能力最强, 在生理浓度和各种pH条件下, 具有保护红细胞膜脂质过氧化及由过氧化损伤造成的红细胞破裂作用. 饮水中添加DNA能提高老年小鼠血中谷胱甘肽过氧化物酶(GSH-Px)的活性, 口服核苷制剂能够降低体内脂质过氧化物的含量. 外源质粒DNA在肠道中具有抗氧化酶活性, 实际上就是有清除机体内自由基的效果. 环境和食物成分在肠道中主要通过氧化和结合作用(conjugation)进行脱毒[26], 因此认为外源质粒在肠道中能够增强宿主代谢异生质(xenobiotic)和内源毒素的能力.
我们发现肠道中与脂质代谢相关的基因表达受到抑制, 包括载脂蛋白E、载脂蛋白C Ⅲ和簇集蛋白, 说明外源质粒DNA影响肠道脂蛋白的吸收. 簇集蛋白与HDL颗粒结合使细胞胆固醇外流, 起脂质运输作用, 并参与局部组织环境脂质平衡, 去除细胞凋亡及损伤时过多的脂质. ApoE主要存在于乳糜微粒和极低密度脂蛋白以及他们的残基和某些HDL亚型中, 作为脂蛋白的配体发挥作用, 通过受体介导途径参与机体脂质代谢的调节[27]. ApoE的生成与细胞内游离胆固醇含量相关, ApoE对巨噬细胞对脂质的聚集和动脉粥样硬化形成有关, 因此, 有人发现CpG可影响泡沫细胞和动脉粥样硬化的形成[28].
我们发现外源DNA可影响一些肠道阴离子转运蛋白的表达. 其中表达上调的有Solute carrier family 5, member 1、Solute carrier family 26、Solute carrier family 13; 表达下调的有Solute carrier family 34、Solute carrier family 28. 质粒pcDNA3是一种带有负电荷的阴性离子, 推测可能Solute carrier family作为外源质粒DNA在肠道中的转运蛋白介导质粒DNA的吸收. 这些阴离子转运蛋白在机体代谢中也发挥重要的作用. 如Solute carrier family 13(SLC13A2)是一种钠依赖二羧酸协同转运蛋白, 是一类介导琥珀酸、枸橼酸及α酮戊二酸等三羧酸循环中间产物转运的有机阴离子转运蛋白. 在正常肾脏、脑、肝脏及小肠等组织均有较高表达. SLC13A2可为肾脏细胞提供能量代谢的底物、参与氨基酸及神经递质的合成, 并可能参与机体酸碱平衡的调节, 与肾结石的形成和衰老有关.
实验发现Caspase 3表达下调. Caspases是一种与细胞凋亡关系极为密切的一组蛋白酶. 目前认为Caspases是细胞凋亡的执行者. 正常情况下他是以无活性的酶原形式存在. 在某些凋亡启动诱导因素的作用下, 在一定基因的调节下借助于细胞膜上的某些受体蛋白质使凋亡的信号传递至Caspases, 并使其层层激活-"瀑布式"激活. 当Caspase3活化后可直接切割并激活DNA断裂因子(一种45 kDa蛋白值)引起DNA降解. 由于Caspase3能活化一种碱性核酶, 后者能在DNA上识别一定序列并使其断裂, 致使琼脂糖凝胶电泳时呈现梯形条带. Daniel Rachmilewitaz(2002)[29]发现免疫刺激DNA序列可降低DSS诱导的结肠组织Caspase 3活性, 原因是ISS-ODN能够活化NF-κB, 诱导Bcl-xl基因的转录, 这些因素促成ISS-ODN活化DNA-PK, 从而在黏膜位点抑制细胞的凋亡. 本实验发现Caspase3基因表达下调, 说明外源质粒DNA可抑制肠黏膜细胞凋亡.
我们发现丝裂原激活蛋白激酶基因(MAP2K2)发生上调, 说明外源质粒DNA可能通过MAPK途径激活肠黏膜细胞. 丝裂原激活蛋白激酶(MAPK)是细胞内一类重要的信号分子. MAPK的激活由MAPKK(又名Mek)完成, 不同的Mek激活不同的MAPK, 而Mek的激活需在其Ser残基上磷酸化, 即需要MAPKKK催化激活. MAP2KKK、MeK、MAPK这一酶促级联反应系统构成哺乳动物多种信号传导途径中的共同通路, 介导了细胞生长、发育、分裂、死亡等多种生理反应过程. 除激活NF-κB外, CpG DNA还可激活不同的MAPK通路. 迄今, 通过CpG DNA刺激不同的免疫细胞, 已发现有3个MAPK超家族成员发生磷酸化: 细胞外信号调节蛋白激酶(extracellular-signal regulated protein kinase, ERK)、c-jun氨基末端激酶(JNK)和p38. MAP2K2催化MAPK激酶上的苏氨酸和酪氨酸残基, 使其磷酸化, 催化ERK1和ERK2激酶. MAPK的活化能将细胞生长因子等丝裂原信号传递到细胞核内诱导大多数真核细胞增生分化. 现在已经确定哺乳动物细胞中MAPKs途径大致分为4种: ERK1/2途径、ERK5途径、JNK途径、p38途径. 细胞外信号调节激酶(ERK1/2)为分裂原激活的MAPK通路, 主要介导细胞增生和分化的信号转导[30]. 因此说明外源质粒DNA通过ERK途径激活肠道免疫细胞.
总之, 本研究利用基因芯片技术发现灌胃质粒DNA 4 h后, 大量与免疫应答的基因表达发生变化, 说明外源质粒DNA进入胃肠道后首先引起肠道黏膜免疫应答, 质粒DNA的免疫刺激活性主要归因于非甲基化的CpG序列, 同时肠道的一些生理功能也发生相应的变化, 包括抗氧化、解毒功能、脂质代谢、离子转运、细胞凋亡及细胞转导等. 本研究为深入全面地探讨外源质粒DNA胃肠道吸收和作用机制提供了许多有价值的研究线索, 在此基础上对这些差异表达基因展开研究, 可望对外源质粒DNA胃肠道代谢机制有更深入的了解.
人和动物每天都要进食大量的食物, 因此外源DNA首先最有可能接触的是胃肠道. 外源质粒DNA进入肠道后可激活肠黏膜免疫细胞, 诱导肠黏膜免疫应答, 引起肠道生理功能发生相应的变化等. 我们采用基因芯片来考察外源质粒DNA对肠道基因表达谱的影响, 在基因水平上研究外源质粒DNA的胃肠道代谢及对肠道的作用机制.
生物技术的发展为人类健康与农业生产发展提供了新的契机, 将质粒DNA注射入体内达到基因治疗或免疫、代谢调控目的是1990年代才开始的一种新技术, 显示出良好的前景. 同时随着转基因作物、食品的增加, 外源质粒DNA的胃肠道吸收、作用及其基因转移对人类与动物健康可能产生的影响, 也值得研究者的关注.
外源质粒DNA引起肠道差异表达的基因主要涉及免疫应答、抗氧化及解毒功能、脂质代谢、阴离子转运蛋白、细胞凋亡及信号转导等过程. 肠道作为抵御外源质粒的第一道防线, 肠道基因表达的变化反映了肠道对外源质粒吸收所产生的宿主应答, 肠道基因表达的变化也初步反映外源质粒DNA在肠道的吸收机制.
谷胱甘肽硫转移酶(mGST): 是一类具有多种生理功能的同功酶, 他不仅是生物体内一种重要的Ⅱ相解毒酶, 而且具有抗氧化损伤作用;
丝裂原激活蛋白激酶(MAP2K2): 是细胞内的一类丝氨酸/苏氨酸蛋白激酶. 研究证实, MAPKs信号转导通路存在于大多数细胞内, 在将细胞外刺激信号转导至细胞及其核内, 并引起细胞生物学反应(如细胞增殖、分化、转化及凋亡等)的过程中具有至关重要的作用.
近几年, 随着生物技术的高速发展, 转基因食品越来越多, 其安全性问题始终是全球人们关注的问题. 因此本项目的立题不仅内有重要的应用意义, 并且具有较好的新颖性. 本论文采用基因芯片技术研究外源质粒DNA在肠道中的吸收机制及对肠道生理功能的影响, 方法先进, 技术路线合理, 是一篇优秀的论文.
编辑: 潘伯荣 电编:李琪
| 1. | Doerfler W. Foreign DNA in mammalian systems. New York: Wiley-VCH 2000; . |
| 2. | Doerfler W, Remus R, Muller K, Heller H, Hohlweg U, Schubbert R. The fate of foreign DNA in mammalian cells and organisms. Dev Biol (Basel). 2001;106:89-97; discussion 143-160. [PubMed] |
| 3. | Palka-Santini M, Schwarz-Herzke B, Hosel M, Renz D, Auerochs S, Brondke H, Doerfler W. The gastrointestinal tract as the portal of entry for foreign macromolecules: fate of DNA and proteins. Mol Genet Genomics. 2003;270:201-215. [PubMed] |
| 4. | Schubbert R, Renz D, Schmitz B, Doerfler W. Foreign (M13) DNA ingested by mice reaches peripheral leukocytes, spleen, and liver via the intestinal wall mucosa and can be covalently linked to mouse DNA. Proc Natl Acad Sci USA. 1997;94:961-966. [PubMed] |
| 6. | Schubbert R, Hohlweg U, Renz D, Doerfler W. On the fate of orally ingested foreign DNA in mice: chromosomal association and placental transmission to the fetus. Mol Gen Genet. 1998;259:569-576. [PubMed] |
| 7. | Hohlweg U, Doerfler W. On the fate of plant or other foreign genes upon the uptake in food or after intramuscular injection in mice. Mol Genet Genomics. 2001;265:225-233. [PubMed] |
| 8. | Watson JL, McKay DM. The immunophysiological impact of bacterial CpG DNA on the gut. Clin Chim Acta. 2006;364:1-11. [PubMed] |
| 10. | 刘 建文, 乐 国伟, 施 用晖. 外源质粒DNA经胃肠道途径对小鼠免疫基因的调控作用. 细胞与分子免疫学杂志. 2005;21:548-552. |
| 11. | Remus R, Kammer C, Heller H, Schmitz B, Schell G, Doerfler W. Insertion of foreign DNA into an established mammalian genome can alter the methylation of cellular DNA sequences. J Virol. 1999;73:1010-1022. [PubMed] |
| 12. | Doerfler W, Hohlweg U, Muller K, Remus R, Heller H, Hertz J. Foreign DNA integration-perturbations of the genome-oncogenesis. Ann NY Acad Sci. 2001;945:276-288. [PubMed] |
| 13. | Muller K, Heller H, Doerfler W. Foreign DNA integration. Genome-wide perturbations of methylation and transcription in the recipient genomes. J Biol Chem. 2001;276:14271-14278. [PubMed] |
| 14. | Beever DE, Kemp CF. Safety issues associated with the DNA in animal feed derived from genetically modified crops. A review of scientific and regulatory procedures. Nutri Abstr Rev. 2000;70:175-182. |
| 15. | Ledwith BJ, Manam S, Troilo PJ, Barnum AB, Pauley CJ, Griffiths TG 2nd, Harper LB, Schock HB, Zhang H, Faris JE, Way PA, Beare CM, Bagdon WJ, Nichols WW. Plasmid DNA vaccines: assay for integration into host genomic DNA. Dev Biol (Basel). 2000;104:33-43. [PubMed] |
| 16. | Ledwith BJ, Manam S, Troilo PJ, Barnum AB, Pauley CJ, Griffiths TG 2nd, Harper LB, Beare CM, Bagdon WJ, Nichols WW. Plasmid DNA vaccines: investigation of integration into host cellular DNA following intramuscular injection in mice. Intervirology. 2000;43:258-272. [PubMed] |
| 17. | Manam S, Ledwith BJ, Barnum AB, Troilo PJ, Pauley CJ, Harper LB, Griffiths TG 2nd, Niu Z, Denisova L, Follmer TT, Pacchione SJ, Wang Z, Beare CM, Bagdon WJ, Nichols WW. Plasmid DNA vaccines: tissue distribution and effects of DNA sequence, adjuvants and delivery method on integration into host DNA. Intervirology. 2000;43:273-281. [PubMed] |
| 18. | Wang Z, Troilo PJ, Wang X, Griffiths TG, Pacchione SJ, Barnum AB, Harper LB, Pauley CJ, Niu Z, Denisova L. Detection of integration of plasmid DNA into host genomic DNA following intramuscular injection and electroporation. Gene Ther. 2004;11:711-721. [PubMed] |
| 19. | 庞 战军, 陈 媛, 周 玫. 谷胱甘肽硫转移酶基因表达的调控. 生物化学与生物物理进展. 1997;24:401. |
| 20. | Andersson C, Mosialou E, Weinander R, Morgenstern R. Enzymology of microsomal glutathione S-transferase. Adv Pharmacol. 1994;27:19-35. [PubMed] |
| 21. | Peng RX, Wang H, Wang YS, Fu LS, Ding H. Glutathione-related enzyme activities in human fetal adrenal, liver, and kidney. Zhongguo Yao Li Xue Bao. 1998;19:167-171. [PubMed] |
| 22. | Jakobsson PJ, Mancini JA, Riendeau D, Ford-Hutchinson AW. Identification and characterization of a novel microsomal enzyme with glutathione-dependent transferase and peroxidase activities. J Biol Chem. 1997;272:22934-22939. [PubMed] |
| 23. | Morbitzer M, Herget T. Expression of gastrointestinal glutathione peroxidase is inversely correlated to the presence of hepatitis C virus subgenomic RNA in human liver cells. J Biol Chem. 2005;280:8831-8841. [PubMed] |
| 24. | Kasperczyk S, Kasperczyk A, Ostalowska A, Dziwisz M, Birkner E. Activity of glutathione peroxidase, glutathione reductase, and lipid peroxidation in erythrocytes in workers exposed to lead. Biol Trace Elem Res. 2004;102:61-72. [PubMed] |
| 25. | Ames BN, Cathcart R, Schwiers E, Hochstein P. Uric acid provides an antioxidant defense in humans against oxidant- and radical-caused aging and cancer: a hypothesis. Proc Natl Acad Sci USA. 1981;78:6858-6862. [PubMed] |
| 26. | Hooper LV, Wong MH, Thelin A, Hansson L, Falk PG, Gordon JI. Molecular analysis of commensal host-microbial relationships in the intestine. Science. 2001;291:881-884. [PubMed] |
| 27. | Ishibashi S, Yamada N, Shimano H, Mori N, Mokuno H, Gotohda T, Kawakami M, Murase T, Takaku F. Apolipoprotein E and lipoprotein lipase secreted from human monocyte-derived macrophages modulate very low density lipoprotein uptake. J Biol Chem. 1990;265:3040-3047. [PubMed] |
| 29. | Rachmilewitz D, Karmeli F, Takabayashi K, Hayashi T, Leider-Trejo L, Lee J, Leoni LM, Raz E. Immunostimulatory DNA ameliorates experimental and spontaneous murine colitis. Gastroenterology. 2002;122:1428-1441. [PubMed] |
| 30. | Lee KH, Hyun MS, Kim JR. Growth factor-dependent activation of the MAPK pathway in human pancreatic cancer: MEK/ERK and p38 MAP kinase interaction in uPA synthesis. Clin Exp Metastasis. 2003;20:499-505. [PubMed] |