修回日期: 2006-04-29
接受日期: 2006-05-11
在线出版日期: 2006-10-28
目的: 探讨缺氧环境下胰腺癌细胞胰腺癌肿瘤细胞株SW1990中缺氧诱导因子HIF-1α、血管生长因子VEGF、葡萄糖转运体GLUT1、和耐药基因MDR1的变化, 并阐明其中可能存在的分子调控机制.
方法: 将胰腺癌肿瘤细胞株SW1990分为常氧组和化学诱导缺氧组(CoCl2诱导), 分别采用RT-PCR方法和Western blot方法观察两组HIF-1α、VEGE、GLUT1及MDR1基因和蛋白的表达; 再分别将两组分为对照组、空白质粒转染组和HIF-1α/PCDNA3.0质粒转染组, 观察上述因子的基因和蛋白水平表达的变化.
结果: 化学诱导的缺氧能明显诱导细胞HIF-1α蛋白的表达(P = 0.0089), 但对其mRNA的表达没有明显影响(P = 0.057); 缺氧时胰腺癌肿瘤细胞株SW1990中的VEGF(P = 0.046, 0.039)、GLUT1(P = 0.0024, 0.036)、MDR1(P = 0.021, 0.038)基因和蛋白的表达水平都明显增高. 转染质粒的缺氧组与常氧组相比, HIF-1α、VEGF、GLUT1、MDR1的基因与蛋白水平都相应的有所增高.
结论: 缺氧时, 胰腺癌细胞通过上调HIF-1α的表达引起其下游的靶基因VEGF、GLUT1和MDR1的表达, 从而耐受缺氧并进一步恶性进展.
引文著录: 陈干涛, 白少华, 高志强. 缺氧诱导因子-1α在胰腺癌中的作用. 世界华人消化杂志 2006; 14(30): 2965-2970
Revised: April 29, 2006
Accepted: May 11, 2006
Published online: October 28, 2006
AIM: To study the level changes of hypoxia-inducible factor-1α (HIF-1α), vascular endothelial growth factor (VEGF), glucose transporter 1 (GLUT1) and multidrug resistance gene (MDR1) in pancreatic carcinoma cells SW1990 exposed to hypoxia, and to explore the possible molecular mechanism.
METHODS: CoCl2 was used to induce chemical hypoxia, and SW1990 cells were divided into normal oxygen group and hypoxia group. The expression of HIF-1α, VEGF, GLUT1 and MDR1 at the mRNA and protein levels were analyzed by reverse transcription-polymerase chain reaction (RT-PCR) and Western-blot, respectively, in the above groups 24 h after treatment with hypoxia and transfected with plasmid HIF-1α/PCDNA3.
RESULTS: Chemical hypoxia induced significant expression of HIF-1α protein (P = 0.0089), but not mRNA (P = 0.057). After exposure to hypoxia, the expression of VEGF (P = 0.046, 0.039), GLUT1 (P = 0.0024, 0.036) and MDR1 (P = 0.021, 0.038) were significantly increased at the mRNA and protein level. Furthermore, the mRNA and protein expression of HIF-1α, VEGF, GLUT1 and MDR1 were all elevated to some extent after transfection with plasmid HIF-1α/PCDNA3.
CONCLUSION: HIF-1α plays an important role in promoting the progression, relapse and resistance to chemotherapeutics of pancreatic carcinoma by up-regulating the expression of the related genes such as VEGF, GLUT1 and MDR1.
- Citation: Chen GT, Bai SH, Gao ZQ. Role of hypoxia-inducible factor-1α in pancreatic cancer. Shijie Huaren Xiaohua Zazhi 2006; 14(30): 2965-2970
- URL: https://www.wjgnet.com/1009-3079/full/v14/i30/2965.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i30.2965
实体肿瘤在发生、发展的过程中, 局部微环境最显著的变化是缺氧, 而肿瘤耐受缺氧并进一步恶性演变的调控分子为缺氧诱导因子HIF-1α[1]. 研究表明, 当环境氧含量低于30 mL/L时, 细胞的生理代谢会发生一系列的改变, 其中最主要的反应是机体通过增加葡萄糖转运体GLUT1来增加糖酵解提供必须的能源, 而局部组织则通过提高血管内皮细胞生长因子VEGF水平促进新生血管形成以改善局部的血液供应, 肿瘤细胞在缺氧的环境中, 同样会发生上述改变[2-3]. HIF-1α作为肿瘤演变的一个中枢环节, 在于他下游的40多个调控基因, 他们可以促进肿瘤血管的形成、无氧糖酵解、细胞增殖、抗凋亡、耐药等[4], 其中, 最常见且很重要的有VEGF、GLUT1、MDR1. 有研究表明, 胰腺癌组织中HIF-1α的含量和胰腺癌恶性生物学行为正相关[5-6], 虽然对于晚期胰腺癌目前在术前多配合化疗或者放疗, 但胰腺癌患者因为缺乏早期诊断的敏感指标而发现晚、目前有限的治疗方式效果差致使其预后普遍差, 这促使研究人员努力寻找有效的新的治疗方式. 目前, HIF-1α因为其与肿瘤的密切相关性而成为研究的热点, 且以HIF-1α为靶点的基因和药物治疗在实验阶段取得了很好的成绩, 胰腺癌发展过程中HIF-1α发挥作用的分子作用机制尚不明, 本研究利用CoCL2化学缺氧法制造体外培养胰腺癌细胞的缺氧环境, 观察体外低氧培养条件下的胰腺癌肿瘤细胞株SW1990中HIF-1α, VEGF, GLUT1, MDR1的基因和蛋白的表达, 并通过上调HIF-1α的表达观察VEGF, GLUT1, MDR1的表达情况, 来探讨胰腺癌细胞常氧和缺氧环境下血管新生和能量代谢的调控机制, 明确HIF-1α的功能, 以期为临床治疗胰腺癌提供可靠的分子靶点.
培养箱为三气培养箱(NU4950型)、美国NUAIRE公司出品; 人胰腺癌肿瘤细胞株SW1990购自美国典型物种保藏中心(ATCC); 化学诱导低氧组由150 mmol/L CoCl2美国Sigma公司; 脂质体lipofectamineTM 2000购自美国Invitrogen公司; 1640完全培养基购自美国sigma公司; TRIzol试剂、SupperScript逆转录试剂盒、PCR试剂盒等购自晶美生物公司; 引物由上海生工生物公司合成; 兔抗人HIF-1α抗体、鼠抗人VEGF抗体由武汉博士德公司购买; 兔抗人GLUT1抗体由福建迈新生物工程公司提供, 鼠抗人多药耐药相关蛋白P-GP多克隆抗体购自晶美生物公司, 羊抗兔IgG, 羊抗鼠IgG、国产胎牛血清购自北京中山生物技术公司; 其他各种化学试剂均为武汉博士德公司提供.
1.2.1细胞培养及分组: 人胰腺癌肿瘤细胞株SW1990培养于100 mL/L小牛血清RPMI-1640培养液中, 置于50 mL/LCO2、饱和湿度的培养箱中(含21 mL/L O2, 74 mL/L N2)为常氧组; 将150 mmol/L CoCl2加入培养基中, 余同常氧组, 为化学性低氧组, 24 h后分别快速提取细胞总的RNA和蛋白进行检测.
1.2.2 质粒转染: HIF-1α/PCDNA3.0质粒转染: 通过预实验, SW1990细胞融合达到70%-80%时, 按1 mg:6 mL比例混合HIF-1α/PCDNA3.0质粒和脂质体lipofectamineTM 2000, 滴加于细胞表面. 同时平行转染带有lacZ基因的PCDNA3.0质粒, 以x-gal为底物, 铁氰化钾和亚铁氰化钾染色确定转染效率. 转染5 h后更换含质粒的无血清1640培养基为含200 mL/L胎牛血清的1640培养基.
1.2.3 RT-PCR检测HIF-1α、VEGF、GLUT1和MDR1: mRNA用TRIzol试剂"一步法"提取细胞总RNA, 将RNA溶于0.1% DEPC处理水中, 紫外分光光度计测定样品在260 nm, 280 nm波长上的吸光度(A值), 估计RNA的纯度和浓度. 2 mg总RNA逆转录合成cDNA, PCR反应条件根据文献并稍加改进为: 94 ℃预变性1 min, 然后94 ℃变性30 s, 56 ℃退火30 s, 72 ℃延伸30 s, 扩增30个循环; 最后一次72 ℃延伸7 min. 别取5 mL PCR产物在20 g/L琼脂糖凝胶上进行电泳. 待测基因mRNA表达的半定量分析: 待测基因mRNA表达丰度的半定量是根据同一细胞株中待测基因与β-actin基因的RT-PCR产物进行比较, 从而判断待测基因mRNA在不同细胞中表达丰度的高低, 各待测基因与β-actin基因的RT-PCR在同一试管内进行. 总RNA提取参照TRIzol Reagent试剂盒说明书进行, 转录合成cDNA: 将RNA稀释为1 g/L, 在20 mL反应体积中用5 mg的RNA合成cDNA, 42 ℃水浴50 min. 15 min失活反应, 各待测基因的引物由上海生工生物公司合成且进行扩增时分别按各因子的引物说明要求进行退火温度的设定(见表1).
| 基因 | 引物 | t (℃) | 片段大小 (bp) |
| β-actin | 正义链 AAGAGAGGCATCCTCACCCT | 60 | 218 |
| 反义链 TACATGGCTGGGGTGTTGAA | |||
| HIF-1α | 正义链 TCAAAGTCGGACAGCCTCA | 53 | 460 |
| 反义链 CCCTGCAGTAGGTTTCTGCT | |||
| VEGF | 正义链 TCGGGCCTCCGAAACCATGA | 55 | 500 |
| 反义链 CCTGGTGAGAGATCTGGTTC | |||
| GLUT1 | 正义链 TCATCGTGGCTGAACTCTTCAG | 60 | 314 |
| 反义链 TCACACTTGGGAATCAGCCCC | |||
| MDR1 | 正义链 CATTGGTGTGGTGAGTCAGG | 58 | 174 |
| 反义链 CTCTCTCTCCAACCAGGGTG |
1.2.4 三去污剂法提取细胞总蛋白: 按文献方法[7]配制三去污剂, 临用前加入100 mg/L苯甲基磺酰氟(PMSF)和1 mg/L抑肽酶, 预冷后加入细胞表面(5 mL/cm2), 冰上作用30 min, 收集裂解液, 离心取上清, 置于-70 ℃备用.
1.2.5 Western blot检测相关因子蛋白水平的表达: 50 mg细胞蛋白SDS-PAGE凝胶电泳, 半干法电转移至硝酸纤维素膜, 丽春红染色证实转移成功, 一抗封闭过夜, 二抗孵育1 h, 化学发光法显色, 洗片. 一抗: HIF-1α抗体1:500稀释, 鼠抗人VEGF多克隆抗体, 兔抗人GLUT1抗体, 鼠抗人P-GP抗体0.15 mg/L, 羊抗兔、羊抗鼠IgG均以1:5000稀释(以上所有试验均重复3次, 结果取其均值).
统计学处理 所有统计学分析采用SPSS 10.0软件包, 结果以均数±标准差(mean±SD)表示, 数据比较采用方差分析和t检验.
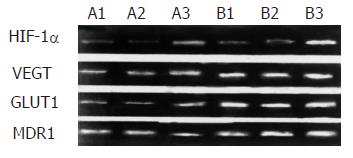
常氧组及化学诱导缺氧组分别于处理后24 h提取细胞总RNA和蛋白(表2, 表3, 图1, 图2)
| 分组 | HIF-1α | VEGF | GLUT1 | MDR1 |
| 常氧 (A1) | 0.121±0.098 | 0.189±0.043 | 0.095±0.113 | 0.117±0.082 |
| 常氧加空质粒转染 (A2) | 0.144±0.087 | 0.213±0.162 | 0.088±0.187 | 0.095±0.109 |
| 常氧加质粒转染 (A3) | 0.409±0.123c | 0.531±0.205c | 0.312±0.146c | 0.351±0.150c |
| 缺氧 (B1) | 0.135±0.086 | 0.468±0.157a | 0.413±0.095a | 0.399±0.069a |
| 缺氧加空质粒转染 (B2) | 0.143±0.047 | 0.518±0.094 | 0.526±0.049 | 0.402±0.105 |
| 缺氧加质粒转染 (B3) | 0.729±0.164e | 0.856±0.163e | 0.722±0.204e | 0.698±0.207e |
缺氧处理后HIF-1α的基因表达水平与常氧对照组无明显差异(P = 0. 057, >0.05), 而缺氧处理后HIF-1α的蛋白表达较常氧对照组明显升高(P = 0. 0089, <0.01); 缺氧处理后VEGF、GLUT1、MDR1的基因和相应蛋白水平都较常氧组有显著升高(两组VEGF的基因和蛋白P值分别为0.046和0.039, GLUT1的P值为0.0024和0.036 , MDR1的P值为0.021和0.038, 均小于0.05、有统计学意义).
常氧组转染HIF-1α/PCDNA3.0质粒后较转染空白质粒组和对照质粒组HIF-1α的基因和蛋白的表达水平明显升高(常氧组转染质粒与转染空质粒和未转染质粒HIF-1α的基因表达水平相比较, P值分别为0.034和0.041, 蛋白表达水平相比较P值分别为0.022和0.025, 均小于0.05), VEGF、GLUT1、MDR1的基因、相应蛋白表达水平也都随着明显升高(对于VEGF, 常氧组转染质粒后与转染空质粒以及未转染质粒基因表达比较, P值为0.025和0.032; 蛋白表达水平相比较P值为0.029和0.026, 均小于0.05; 同样, GLUT1的基因表达水平相比较P值分别为0.015和0.032, 蛋白相比较P值分别为0.023和0.034, 均小于0.05; MDR1的基因表达相比较后的P值分别为0.042和0.034, 蛋白表达相比较P值分别为0.044和0.038,均小于0.05、有统计学意义); 缺氧组转染HIF-1α/PCDNA3.0质粒后较转染空白质粒组和对照未转染质粒组HIF-1α的基因和蛋白的表达水平明显升高(转染组和转染空质粒组以及未转染组相比较, 转染组HIF-1α的基因表达明显增高, P值分别为0.019和0.024、均小于0.05, HIF-1α的蛋白表达也有统计学意义上的升高, P值分别为0.032和0.026、均小于0.05), VEGF、GLUT1、MDR1的基因、相应蛋白表达水平也都明显随着升高(转染组和转染空白质粒组以及未转染组的VEGF的基因表达比较后P值分别为0.013和0.031, 均小于0.05; 蛋白表达相比较, P值分别为0.019和0.032, 均小于0.05、有统计学意义. 同样, GLUT1基因比较后的P值分别为0.033和0.041, 蛋白比较后P值分别为0.046和0.031, 均小于0.05. MDR1的基因比较后P值分别为0.038和0.034, 蛋白比较后P值分别为0.024和0.029, 均小于0.05、有统计学意义); 缺氧组和常氧组转染HIF-1α/PCDNA3.0质粒后相比较, HIF-1α, VEGF, GLUT1, MDR1的基因、相应蛋白表达水平有升高(其中, 两组HIF-1α的基因和蛋白表达水平相比较, P值分别为0.025和0.039; 同样, VEGF的P值分别为0.038和0.041; GLUT1的P值分别为0.037和0.035; MDR1的P值分别为0.043和0.039, 均小于0.05、有统计学意义).
转染空白质粒组和未转染组相比较, HIF-1α, VEGF, GLUT1, MDR1的基因和蛋白水平在缺氧组和常氧组都无明显变化(两组HIF-1α的基因和蛋白表达水平相比较, P值分别为0.052和0.057, 均大于0.05; 同样, VEGF基因和蛋白表达后P值分别为0.054和0.061, 均大于0.05; GLUT1的P值分别为0.062和0.053, 均大于0.05; MDR1的P值分别为0.067和0.059, 均大于0.05, 都无统计学意义).
研究早已发现低氧是所有实体肿瘤的特征, 他与肿瘤的侵袭、血管生成及化疗耐药有关. 肿瘤在发生发展过程中不可避免的经历缺氧, 而HIF-1α是缺氧状态下一种最常见的中枢分子调控信号, 许多研究表明, HIF-1α是维持细胞和全身氧稳态的重要调节分子[8]. HIF-1由缺氧诱导的α亚基和组成型表达的β亚基组成, 所以, 缺氧时, HIF-1二聚体稳定性增加通过HIF-1α碳末端的入核信号诱导转位入核, 形成由HIF-1α/HIF-1β组成的异二聚体, 与DNA顺式作用元HRE(hypoxia response element, 缺氧反应元件)结合[9-10], 参与了缺氧早期组织的血管生成、糖酵解的增强和细胞增殖的调控. 而肿瘤为了对抗这种缺氧的微环境会发生一系列的适应性改变, 包括肿瘤细胞基因组和蛋白组学的变异, 表现出许多新的生物学性状, 如演进[11]、耐药[12]、无氧糖酵解[13]. 参与这些性状的许多分子为HIF-1α所上调, 他们包含一段共同的基因调控序列包含一段HRE增强子/启动子序列. 该HRE包括一个或多个HBS(HIF-binding site, HIF-1结合位点)和HBS附近的一个或多个辅助的顺式作用元件HAS(HIF-1 ancillary sequence, HIF-1辅序列). 目前已知的HIF-1α的作用方式有约3种: (1) HIF-1α直接与效应基因的5'端的顺式作用元件结合; (2)HIF-1α通过蛋白与蛋白之间的相互作用和其他与效应基因的顺式作用元件相结合的蛋白结合, 间接调节效应基因的表达; (3)HIF-1α可诱导其他促进效应基因转录的因子的表达[14-15]. 常氧下HIF-1α通过泛素-蛋白酶体途径很快降解, 缺氧或由于特定环境下如肿瘤状态由于一些基因例如MAPK[16]、AKT[17]等表达增加时, HIF-1α的泛素化急剧减少, 并从胞质转移至胞核, 与HIF-1β形成二聚体, 促进缺氧诱导基因转录, 而引起一系列细胞对缺氧的反应[18]. 浸润生长和远处转移是恶性肿瘤重要的生物学特征, VEGF参与肿瘤细胞的这种生物学行为, VEGF是一种肝素亲和的外分泌二聚体糖蛋白, 具有高度保守性, 相对分子质量为25444-58444, 其基因定位于第6对染色体长臂, 包括交替选择剪接的8个外显子和7个内含子. VEGF是刺激血管内皮细胞增殖和移行的重要因子, 并可影响血管的通透性, 也称为血管通透因子(VPF), 对血管内皮细胞的分裂、增殖、抑制凋亡、水解基底膜、迁移和血管构建的调控作用较强, 且特异性高, 在胚胎发育、创伤修复、侧支循环建立等病理生理过程中发挥重要作用. 在VEGF作用下, 内皮细胞增殖、迁移, 细胞外基质蛋白水解, 毛细血管管腔形成. 由于mRNA差异剪接所致, VEGF有4种氨基酸残基数目不同的变异体, 分别为VEGF121, VEGF165, VEGF189及VEGF206, 其中VEGF165活性最强, 分布范围广, VEGF165为分泌型蛋白质可作用于内皮细胞上的Flt-1, Flk/KDR受体发挥作用[19], 是体内发挥作用的主要形式, 因此, 我们选择VEGF165作为研究对象进行观察. 实体肿瘤在瘤体增大过程中经历无氧糖酵解. 葡萄糖经载体跨膜转运入细胞膜上GLUT-1数量的调节可能是组织对缺氧、缺血应激适应的一个重要机制, 环境和内在因素可在多个环节参与对GLUT-1蛋白表达的调控. GLUT-1受缺氧本身和缺氧导致的氧化磷酸化抑制的诱导, GLUT-1基因5'侧翼区的全长调控序列中有一个480 bp的SacⅠ/PstⅠ片段与CoCl2(模拟缺氧本身)诱导的GLUT-1 mRNA相关[20], 高表达GLUT1与肿瘤的预后呈负相关[21]. 恶性肿瘤耐药复发是临床医疗工作人员最感棘手的问题, 而多药耐药基因是恶性肿瘤抵御治疗、复发和恶化的主要原因, 参与多药耐药的这些基因是遗传缺陷还是肿瘤生长过程中受环境诱导出现尚不清楚[22], 多药耐药基因MDR1属于人类MDR基因家族, 是目前公认的肿瘤多药耐药机制之一, 其产生机制可能是化疗药物激活肿瘤细胞中MDR1的启动子, 通过调控的转录和翻译实现MDR1基因过表达, 出现多药耐药表型. P糖蛋白P-glycoprotein, P-gp)为MDR1基因的编码产物, MDR1基因的扩增导致其过量表达. 其对应的蛋白形式P-gp是一种跨膜蛋白, 可将进入癌细胞内的抗癌药物泵出癌细胞, 从而导致癌细胞耐药. 近年来, 基因工程技术因为其简洁、方便、高效的特点成为研究基因功能组学和基因治疗应用最广泛的一种方法, 本实验在CoCl2的化学诱导缺氧的基础上进一步导入外源基因HIF-1α, 上调HIF-1α的表达, 观察其对下游基因的效应去研究HIF的功能. 结果显示, 缺氧可以通过诱导HIF-1α的表达从而上调VEGF, GLUT1, MDR1的表达. HIF-1是一种异二聚体蛋白, 由α和b亚单位构成, β亚单位的表达较恒定, 而α亚单位的表达受多种因素调节, 其蛋白形式极不稳定. CoCl2作用于细胞后, 可以明显增加HIF-1α蛋白的表达,但对其mRNA的表达没有明显影响, 提示CoCl2可能是通过抑制HIF-1α蛋白的降解而使其蛋白表达增强, 而转染导入外源性的HIF-1α既能诱导HIF-1α蛋白的表达,又能上调RNA水平的表达, 这可能既与HIF-1α基因水平升高而在翻译为蛋白后胰腺癌细胞本身抑制HIF-1α蛋白降解的能力较强有关. 而在协同CoCl2的作用抑制HIF-1α蛋白的降解的基础上成功导入外源HIF-1α基因后, 可以发现: HIF-1α, VEGF, GLUT1, MDR1基因及其相应的蛋白的表达均明显较其他实验组升高. 这至少可以部分解释, 在胰腺癌发生发展过程中, 由于经历了缺氧微环境改变过程, 这种缺氧微环境的改变当然主要是由于瘤体增大速度超过血液供应速度以及伴随坏死造成的物理缺氧, 同时也可能是由于肿瘤中异常的起稳定或上调HIF-1α表达的因子表达增加, 于是伴随了HIF的分子水平的改变, 从而导致其下游基因的变化, 进一步导致了胰腺癌的恶行性演进, 并耐受化疗、放疗以及复发、远处转移. 因此, 干扰HIF的表达可以从血管生成、营养供应以及耐药几方面达到治疗胰腺癌的目的, 这一点国内外已经做了大量的研究工作[22-23], 本实验为胰腺癌的分子水平治疗进一步提供了可靠的靶点, 且证明其具有广阔的开发利用的前景.
本实验也存在明显不足之处, 如观察时间不长, 时间段的选取不多, 需进一步继续工作, 也可以进一步从以下几个方面加以改进: (1)可以观察在物理缺氧条件下HIF的改变; (2)在体胰腺瘤的发展中氧张力水平和HIF的关系改变; (3)通过基因敲除RNAi技术观察HIF降低后其下游基因的变化情况及胰腺癌细胞水平和动物模型上出现的效应性改变.
有关HIF-1α和恶性肿瘤关系的研究报道很多, 且开发了许多以HIF-1α为靶点的基因和药物治疗恶性肿瘤, 这些治疗作用目前在实验阶段已经取得了一定的成就. 胰腺癌因为缺乏敏感检测物发现晚、临床治疗效果差预后极差, 临床科研工作者都期盼能找到有效的方法控制胰腺癌. HIF-1α与胰腺癌的诊断、治疗、预后以及其他生物学行为也相关, 本研究目的不仅在于探讨HIF-1和胰腺癌的相关性, 更在于探讨HIF-1α作用于胰腺癌的具体机制, 为用抑制HIF-1α的表达从而达到控制甚至逆转胰腺癌的临床研究提供背景资料.
本研究虽然仅仅运用了RT-PCR和Western blot等较传统的半定量的方法, 相对一些大课题而言说服力略差, 但对于HIF-1α的下游因子如VEGF、GLUT1、MDR1等都做了研究, 对HIF-1, 在胰腺癌中的功能作用介绍的范围较广, 这在国内外研究中少见.
目前对以HIF-α为靶点的研究较为热门, 本研究可以为以HIF-α为靶点的药物用于治疗胰腺癌提供依据.
电编: 李琪 编辑:王晓瑜
| 1. | Moulder JE, Rockwell S. Tumor hypoxia: its impact on cancer therapy. Cancer Metastasis Rev. 1987;5:313-341. [PubMed] [DOI] |
| 4. | Teicher BA. Hypoxia and drug resistance. Cancer Metastasis Rev. 1994;13:139-168. [PubMed] [DOI] |
| 5. | Akakura N, Kobayashi M, Horiuchi I, Suzuki A, Wang J, Chen J, Niizeki H, Kawamura Ki, Hosokawa M, Asaka M. Constitutive expression of hypoxia-inducible factor-1alpha renders pancreatic cancer cells resistant to apoptosis induced by hypoxia and nutrient deprivation. Cancer Res. 2001;61:6548-6554. [PubMed] |
| 6. | Shibaji T, Nagao M, Ikeda N, Kanehiro H, Hisanaga M, Ko S, Fukumoto A, Nakajima Y. Prognostic significance of HIF-1 alpha overexpression in human pancreatic cancer. Anticancer Res. 2003;23:4721-4727. [PubMed] |
| 7. | Sambrook J, Fritsch EF, Maniatis T. Molecular Cloning: a laboratory manual. 3 rd ed. New York: Cold Sp ring HarborLaboratory Press 1989; . [PubMed] |
| 8. | Berra E, Benizri E, Ginouves A, Volmat V, Roux D, Pouyssegur J. HIF prolyl-hydroxylase 2 is the key oxygen sensor setting low steady-state levels of HIF-1αlpha in normoxia. EMBO J. 2003;22:4082-4090. [PubMed] [DOI] |
| 9. | Huang LE, Gu J, Schau M, Bunn HF. Regulation of hypoxia-inducible factor 1alpha is mediated by an O2-dependent degradation domain via the ubiquitin-proteasome pathway. Proc Natl Acad Sci USA. 1998;95:7987-7992. [PubMed] [DOI] |
| 10. | Qian D, Lin HY, Wang HM, Zhang X, Liu DL, Li QL, Zhu C. Normoxic induction of the hypoxic-inducible factor-1 alpha by interleukin-1 beta involves the extracellular signal-regulated kinase 1/2 pathway in normal human cytotrophoblast cells. Biol Reprod. 2004;70:1822-1827. [PubMed] [DOI] |
| 11. | Zagzag D, Zhong H, Scalzitti JM, Laughner E, Simons JW, Semenza GL. Expression of hypoxia-inducible factor 1alpha in brain tumors: association with angiogenesis, invasion, and progression. Cancer. 2000;88:2606-2618. [PubMed] [DOI] |
| 12. | Shannon AM, Bouchier-Hayes DJ, Condron CM, Toomey D. Tumour hypoxia, chemotherapeutic resistance and hypoxia-related therapies. Cancer Treat Rev. 2003;29:297-307. [PubMed] [DOI] |
| 13. | Chen J, Zhao S, Nakada K, Kuge Y, Tamaki N, Okada F, Wang J, Shindo M, Higashino F, Takeda K. Dominant-negative hypoxia-inducible factor-1 alpha reduces tumorigenicity of pancreatic cancer cells through the suppression of glucose metabolism. Am J Pathol. 2003;162:1283-1291. [PubMed] [DOI] |
| 14. | Sun X, Kanwar JR, Leung E, Lehnert K, Wang D, Krissansen GW. Gene transfer of antisense hypoxia inducible factor-1 alpha enhances the therapeutic efficacy of cancer immunotherapy. Gene Ther. 2001;8:638-645. [PubMed] [DOI] |
| 15. | Jaakkola P, Mole DR, Tian YM, Wilson MI, Gielbert J, Gaskell SJ, Kriegsheim Av, Hebestreit HF, Mukherji M, Schofield CJ, Maxwell PH, Pugh CW, Ratcliffe PJ. Targeting of HIF-alpha to the von Hippel-Lindau ubiquitylation complex by O2-regulated prolyl hydroxylation. Science. 2001;292:468-472. [PubMed] [DOI] |
| 16. | Richard DE, Berra E, Gothie E, Roux D, Pouyssegur J. p42/p44 mitogen-activated protein kinases phosphorylate hypoxia-inducible factor 1alpha (HIF-1αlpha) and enhance the transcriptional activity of HIF-1. J Biol Chem. 1999;274:32631-32637. [PubMed] [DOI] |
| 17. | Zundel W, Schindler C, Haas-Kogan D, Koong A, Kaper F, Chen E, Gottschalk AR, Ryan HE, Johnson RS, Jefferson AB. Loss of PTEN facilitates HIF-1-mediated gene expression. Genes Dev. 2000;14:391-396. [PubMed] |
| 18. | Watson CJ, Webb NJ, Bottomley MJ, Brenchley PE. Identification of polymorphisms within the vascular endothelial growth factor (VEGF) gene: correlation with variation in VEGF protein production. Cytokine. 2000;12:1232-1235. [PubMed] [DOI] |
| 19. | Behrooz A, Ismail-Beigi F. Dual control of glut1 glucose transporter gene expression by hypoxia and by inhibition of oxidative phosphorylation. J Biol Chem. 1997;272:5555-5562. [PubMed] [DOI] |
| 20. | Tohma T, Okazumi S, Makino H, Cho A, Mochizuki R, Shuto K, Kudo H, Matsubara K, Gunji H, Matsubara H. Overexpression of glucose transporter 1 in esophageal squamous cell carcinomas: a marker for poor prognosis. Dis Esophagus. 2005;18:185-189. [PubMed] [DOI] |
| 21. | Jiang EZ, Chang YJ, Lee JW, Lee WK, Kim JS, Sohn SK, Lee KB, Suh JS. Multi-drug resistance (MDR1) gene expression in de novo acute leukemia cells: correlations with CD surface markers and treatment outcome. J Korean Med Sci. 1998;13:617-622. [PubMed] [DOI] |
| 22. | Buchler P, Reber HA, Buchler MW, Friess H, Lavey RS, Hines OJ. Antiangiogenic activity of genistein in pancreatic carcinoma cells is mediated by the inhibition of hypoxia-inducible factor-1 and the down-regulation of VEGF gene expression. Cancer. 2004;100:201-210. [PubMed] [DOI] |
| 23. | Hanze J, Eul BG, Savai R, Krick S, Goyal P, Grimminger F, Seeger W, Rose F. RNA interference for HIF-1αlpha inhibits its downstream signalling and affects cellular proliferation. Biochem Biophys Res Commun. 2003;312:571-577. [PubMed] [DOI] |