修回日期: 2005-12-21
接受日期: 2005-12-31
在线出版日期: 2006-01-28
目的: 探讨回输CD4+CD25+调节性T细胞对大鼠肝移植急性排斥反应的影响.
方法: 免疫磁珠阴性加阳性分选Lewis大鼠脾脏、外周淋巴结内的CD4+CD25+调节性T细胞, 分离后的细胞与丝裂霉素C处理过的DA大鼠脾细胞混合培养3 d. 淋巴细胞增殖实验评价新鲜分离和体外培养后的CD4+CD25+调节性T细胞对CD4+CD25-T细胞增殖的抑制作用. 以DA大鼠为供体, Lewis大鼠为受体, 建立4组原位肝移植模型, 每组12例, 共48例. A组术后不进行任何干预; B组术后0-6 d FK506 0.2 mg/(kg•d)灌胃; C组、D组术前1 d经阴茎背静脉分别向受体回输新鲜分离、体外培养后的1×106的CD4+CD25+T细胞. 术后7 d每组随机处死6只, 收集血标本作血清天冬氨酸氨基转移酶(asparate transaminase, AST)、总胆红素(bilirubin, BIL)检测, 取肝脏标本作病理学检查, 每组各留6只观察生存期.
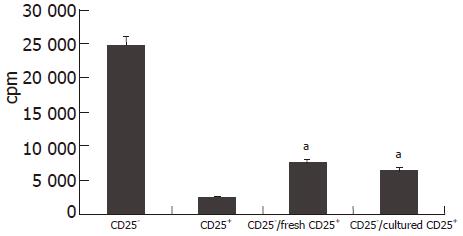
结果: 分选后的CD4+CD25+T细胞纯度为90.2%±1.8%(86%-93%, n=10), 淋巴细胞混合培养实验中新鲜分离和体外培养后的CD4+CD25+T细胞均可抑制CD4+CD25-T细胞的增殖(7 681.7±1 004.9, 6 573.3±1 722.7 cpm vs 24 918.7±2 276.3 cpm; P = 0.000, P = 0.000). 术后7 d, 新鲜细胞回输组以及体外培养细胞回输组AST低于对照组(8.1± 2.0 mkat/L vs 17.9±3.8 mkat/L, P = 0.000; 8.4±1.4 mkat/L vs 17.9 ± 3.8 mkat/L, P = 0.000), BIL亦低于对照组(45.8 ± 9.0 mmol/L vs 98.4±21.2 mmol/L, P = 0.000; 44.7±12.0 mmol/L vs 98.4±21.2 mmol/L, P = 0.000). 四组的Banff评分比较, 两组细胞回输组与对照组比较有统计学差异(P<0.05). 两组细胞回输组生存时间均大于对照组(21.7±1.7 d vs 12.8±0.5 d, P = 0.0001; 30.3±1.7 vs 12.8±0.5 d, P = 0.000 4), 体外培养细胞回输组生存时间大于新鲜细胞回输组(30.3±1.7 d vs 21.7±1.7 d, P = 0.0017).
结论: 回输新鲜分离/经供体抗原体外激活的受体CD4+CD25+调节性T细胞, 可以明显减轻大鼠肝脏移植的急性排斥反应, 延长生存期; 其中经供体抗原体外激活的CD4+CD25+调节性T细胞的作用更持久.
引文著录: 浦立勇, 李相成, 王学浩, 张峰, 姚爱华, 俞悦, 吕凌, 李国强. CD4+CD25+调节性T细胞回输对大鼠肝移植急性排斥反应的影响. 世界华人消化杂志 2006; 14(3): 261-266
Revised: December 21, 2005
Accepted: December 31, 2005
Published online: January 28, 2006
AIM: To investigate the effect of infusing ex vivo isolated CD4+CD25+ regulatory T cells on the rejection model of DA-Lewis rat liver transplantation.
METHODS: CD4+CD25+ regulatory T cells were isolated from Lewis (RT11) rat splenocytes and peripheral lymph nodes by magnetic cell sorting system (negative selection and positive selection), and co-cultured with mitomycin-C (MMC) treated dark agouti (RT1a, DA) rat splenocytes for 3 d. The suppressive efficiency of fresh or ex vivo stimulated CD4+CD25+ regulatory T cells on the proliferation of CD4+CD25- T cells was evaluated by cell proliferation assay. Four groups (12 rats for each) of orthotopic liver transplants (OLT, DA into Lewis) were established by modified Kamada two-cuff technique. Group A: without any treatment after transplantation. Group B: lavaged with FK506 [0.2 mg/(kg•d)] from 0 to 6 d after transplantation. Group C and group D: fresh or ex vivo stimulated CD4+CD25+ regulatory T cells were injected intravenously into the penile vein of each Lewis rat, respectively. Six recipients were sacrificed 7 d after transplantation in each group, and the blood and graft samples were collected for serum biochemical (asparate transaminase and bilirubin, AST and BIL) and histological evaluation. The other six recipients were left in each group to observe the survival time.
RESULTS: The purity of isolated CD4+CD25+ T cells was 90.2%±1.8% (86%-93%, n = 10), and both the fresh and ex vivo stimulated CD4+CD25+ regulatory T cells significantly suppressed the proliferation of CD4+CD25- T cells in mixed lymphocyte culture (7 681.7 ± 1 004.9, 6 573.3 ± 1 722.7 cpm vs 24 918.7 ± 2 276.3 cpm; P = 0.000, P = 0.000). The serum concentrations of AST and BIL 7 d after transplantation in group C and D were respectively lower than that in group A (AST: 8.1 ± 2.0, 8.4 ± 1.4 μkat/L vs 17.9 ± 3.8 μkat/L; P = 0.000, P = 0.000; BIL: 45.8 ± 9.0, 44.7 ± 12.0 μmol/L vs 98.4 ± 21.2 μmol/L; P = 0.000, P = 0.000). The Banff scores of grafts in group C and D were lower than that in group A (P <0.05). The rats in group C and D survived longer than those in group A did (21.7 ± 1.7, 30.3 ±1.7 d vs 12.8 ± 0.5 d; P = 0.000 1, P = 0.000 4). Furthermore, the rats in group D survived longer than those in group B did (P = 0.001 7).
CONCLUSION: Both the fresh isolated and ex vivo stimulated CD4+CD25+ regulatory T cell have the potency to alleviate the acute rejection and prolong the survival time in the rejection model of rat liver transplantation, and the ex vivo stimulated CD4+CD25+ regulatory T cells are superior to fresh isolated CD4+CD25+ regulatory T cells.
- Citation: Pu LY, Li XC, Wang XH, Zhang F, Yao AH, Yu Y, Lv L, Li GQ. Effect of infusing CD4+CD25+ regulatory T cell on the rejection model of DA-Lewis rat liver transplantation. Shijie Huaren Xiaohua Zazhi 2006; 14(3): 261-266
- URL: https://www.wjgnet.com/1009-3079/full/v14/i3/261.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i3.261
肝脏移植是治疗肝脏终末期疾病的唯一有效手段, 但移植后的免疫排斥反应仍是影响移植后疗效的主要障碍, 因此实现对移植肝的免疫耐受是肝脏移植的最终目标. 近10 a来, CD4+CD25+调节性T细胞(CD4+CD25+ regulatory T cell)已被证明在维持外周免疫耐受中起着重要的作用[1-3], 随着对其体内、体外功能的研究逐渐深入, 它所具备的对效应性T细胞的抑制功能, 使得人们设想运用该细胞来抑制器官移植后的排斥反应、诱导器官移植后的免疫耐受[4-8]. 2002年, Cohen et al[5]和Taylor et al[6]报道运用CD4+CD25+调节性T细胞回输治疗骨髓移植后的移植物排宿主反应, 此后运用该类细胞干预器官移植后的排斥反应的报道逐渐增加, 尤其在骨髓移植、胰岛细胞移植、皮肤移植等领域[9,10]. 近年来在大鼠肝移植耐受模型研究中发现, 调节性T细胞在维持肝脏移植耐受中起重要的作用, 且该类细胞维持耐受的功能需要持续的移植抗原的刺激[11,12]. 我们报道回输经体外供体抗原激活的CD4+CD25+调节性T细胞对大鼠肝移植急性排斥反应的影响.
12周龄雄性近交系DA大鼠(RT1a, 体质量230-250 g)为供体, 购于哈尔滨医科大学动物中心. 8周龄近交系Lewis大鼠(RT11, 体质量200-220 g)为受体, 购于北京维通利华实验动物有限公司. 饲养于江苏省实验动物中心清洁级实验室. 受体术前12 h禁食, 不禁水, 术后不禁食水. 主要试剂有单克隆抗体(均购自BD Pharmingen). 鸡尾酒(cock tail)抗体[13]包括: OX-7(CD90.1, IgG1), OX-8(CD8a,IgG1), OX-42(CD11b/c,IgG2a), OX-33(CD45RA,IgG1), 10/78(NKR-P1A, IgG1). 荧光抗体: 抗CD4-FITC (IgG2a), 抗CD25-PE(IgG1). 抗CD3 单抗(G4.18/G1, IgG1). 细胞磁分离系统(购自Miltenyi Biotec): Goat anti-mouse IgG(H+L) Microbead, anti-PE microbead, MidiMACS 分选器, LD、MS 分选柱. 细胞培养基为完全RPMI-1640, 含100 mL/L胎牛血清(FBS, Hyclone), 50 mmol/L 2-巯基乙醇, 1.5 mmol/L L-谷氨酰胺, 100 kU/L青霉素, 100 g/L链霉素(购自Sigma), 重组大鼠IL-2 200 kU/L (Recombinant Rat IL-2, rR IL-2 , 购自Cytolab). 丝裂霉素C (MMC, 购自Sigma).
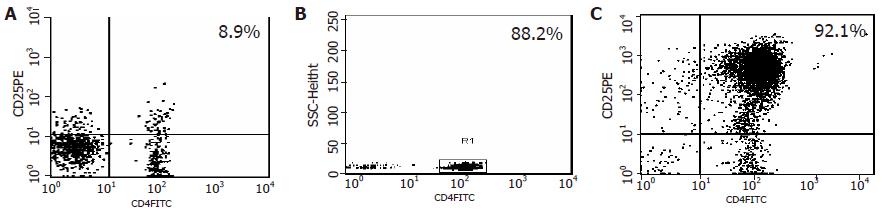
无菌条件下分离大鼠脾脏、腋下及腹股沟淋巴结, 加入缓冲液PBS溶液(pH7.2, 含5 mL/L FBS和2 mmol/L EDTA), 研磨制成细胞悬液, Ficoll-Hypaque(1.083)密度梯度离心得到单个核细胞. 单个核细胞悬液首先用"鸡尾酒"抗体标记后加入Goat anti mouse IgG磁珠,经LD分离柱收获阴性选择后的CD4+ T细胞, 取104用抗CD4-FITC标记后, 流式细胞仪检测分离纯度. 获得的CD4+T淋巴细胞, 抗CD25-PE抗体标记后加入抗PE磁珠, 经MS分离柱分离, 分别收获CD4+CD25+T细胞和CD4+CD25- T细胞. 取104用抗 CD4-FITC标记, 流式细胞仪中检测双阳性细胞的纯度. 以2 mL/L台盼蓝对获得的细胞进行染色, 观察细胞存活率. 将收集到的CD25+ T细胞调整到5.0×109/L的浓度后, 每孔100 L置入圆底96孔板中, 每孔加入5.0×109/L MMC处理的DA鼠的脾细胞100 L, 共培养3 d. 培养结束后, 以PBS溶液洗3遍, 每1×106重悬于1 mL 的PBS中, 于移植前1 d经阴茎静脉回输受体体内. 采用混合淋巴细胞培养实验, 对新鲜分离和体外培养后的细胞体外抑制CD4+CD25- T细胞(效应性T细胞)增殖的能力进行鉴定. 将2×104 CD4+CD25- T细胞加入圆底96孔培养板中, 加入可溶性抗CD3单抗(5 mg/L)和1.0×105经MMC处理的脾细胞, 分别加入2×104的新鲜分离或体外培养的CD4+CD25+T细胞, 每份标本设3复孔, 结果取其平均值. 各组的阴性对照组同样设3个复孔. 各组加样后置于含50 mL/L CO2 的37℃孵箱中培养3 d, 每孔加入1Ci 3H-TdR, 继续培养18 h后使用玻璃纤维滤纸收集细胞,干燥后用液闪仪(Beckman LS 600)测定cpm值. 采用改良Kamada双袖套法建立大鼠原位肝移植模型[14,15]. 术中和术后3 d 内死亡按技术原因处理, 不做统计. 供受体随机分为四组: A组(对照组, n = 12)术后不用免疫抑制剂, B组(FK506处理组, 普乐可复, Fujisawa公司, n = 12)术后0-6 d用FK506 0.2 mg/(kg·d)灌胃, C组(新鲜分离细胞回输组, n = 12)和D组(体外培养后细胞回输组, n = 12)术前1 d经阴茎静脉回输1×106 CD4+CD25+T细胞. 术后7 d每组随机处死6只, 收集血标本作血清AST、BIL浓度检测, 取新鲜肝组织一份以40 g/L中性甲醛固定作病理学检查, 评估排斥情况. 病理学诊断标准参照人肝移植排斥反应Banff标准[16-18]. 每组各留6只观察生存期.
统计学处理 数据用统计软件STATA 7.0软件进行统计学处理. 细胞增殖实验中的cpm值, 血清ALT值、BIL值的比较用秩变换检验, Scheffe法分析组间差异; 各组病理学急性排斥反应Banff评分的比较采用秩和检验, 采用Nemenyi法进行两两比较; 生存分析用乘积极限法(Kaplan-Meier 法)作生存曲线, 用Log-rank法进行显著性检验, 检验水准alpha = 0.05.
Lewis大鼠脾脏及外周淋巴结中的单个核细胞, 经细胞磁分离系统(magic cell sorting system, MACS)阴性加阳性两次分选后, 获得的CD4+CD25+T细胞纯度为90.2%±1.8% (86%-93%, n = 10), 图1为其中一次流式细胞仪检测结果. 细胞增殖实验中, 新鲜分离和体外培养后的CD4+CD25+T细胞均可明显抑制CD4+CD25-T细胞的增殖(24 918.7±2 276.3 cpm vs 7 681.7±1 004.9 cpm, P=0.000<0.01; 24 918.7±22 76.3 cpm vs 6 573.3±1 722.7 cpm, P = 0.000<0.01)(图2).
| 组别 | n | AST ( μkat/L ) | BIL (μmol/L ) | ||
| means ± SD | 95%可信区间 (%) | means±SD | 95%可信区间 (%) | ||
| 对照组 | 6 | 17.9 ± 3.8 | 13.9-21.9 | 98.4±21.2 | 75.9-120.9 |
| FK506组 | 6 | 7.1 ± 1.1 | 5.9-8.2 | 6.8±0.8 | 6.0-7.6 |
| 新鲜细胞回输组a | 6 | 8.1± 2.0a | 5.9-10.2 | 45.8±9.0a | 36.3-55.2 |
| 培养细胞回输组ab | 6 | 8.4±1.4ab | 6.9-9.8 | 44.7±12.0ab | 32.1-57.3 |
术后7 d, 新鲜细胞回输组以及体外培养细胞回输组AST低于对照组(17.9 ± 3.8 mkat/L vs 8.1 ± 2.0 mkat/L, P = 0.000<0.01; 17.9±3.8 mkat/L vs 8.4 ±1.4 mkat/L, P = 0.000<0.01), BIL亦低于对照组(98.4±21.2 mmol/L vs 45.8±9.0 mmol/L, P = 0.000<0.01; 98.4±21.2 mmol/L vs 44.7±12.0 mmol/L, P = 0.000<0.01).
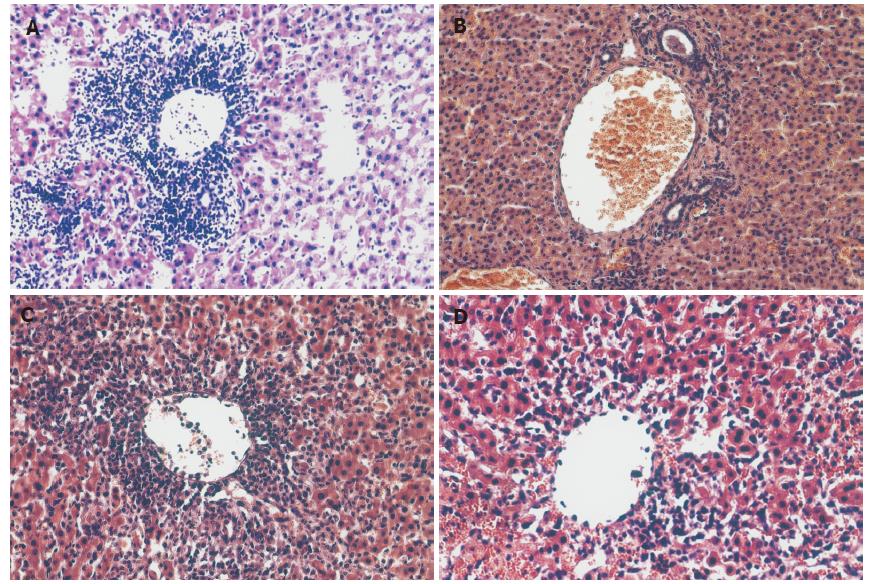
对照组术后7 d病理表现为汇管区大量单个核细胞浸润, 并累及胆管、血管, 肝小叶结构消失, 伴有局灶性的出血、坏死. FK506处理组的汇管区出现少量的单核细胞浸润, 但未侵及肝实质, 未累及胆管和血管. 两组回输组的病理学表现介于对照组与FK506处理组之间(图3). 四组的Banff 评分比较(表2), 两组细胞回输组与对照组比较均有统计学差异(P<0.05).
实现对移植物的特异性耐受, 即受体对移植物产生类似于自身耐受的状态, 是器官移植的最终目标. 1995年Sakaguchi [1]报道CD4+CD25+T细胞在维持周围耐受中起重要的作用. 随后, 在器官移植的耐受模型中也证实该细胞在维持移植免疫耐受中起重要作用[12,19]. 目前的研究认为CD4+CD25+调节性T细胞对于自身抗原或同种异体抗原激活的CD4+、CD8+ T细胞有明确的抑制功能[3,7,20]. 在器官移植动物模型中, 肝脏是唯一在不同的大鼠品系组合中, 既存在排斥模型, 又存在耐受模型的器官[21]. 如: DA→Lewis组合是急性排斥模型, 而Lewis→DA组合则是自然耐受模型. 在Lewis→DA模型中发现, 在移植前用一定剂量的放射线照射Lewis大鼠, 再将其肝脏移植给DA大鼠, 移植肝被排斥. 而回输长期存活的Lewis→DA受体的脾细胞可逆转这种排斥, 从而提示调节性T细胞在诱导肝脏免疫耐受中起着一定的作用[11,12]. 基于以上的报道, 我们在DA→Lewis急性排斥模型中, 采用经供体脾细胞共培养激活的CD4+CD25+调节性T细胞, 在移植前1 d 输入受体的体内, 设想被移植物抗原激活的效应性T细胞, 可被CD4+CD25+调节性T细胞识别为自身反应性T细胞, 因而被抑制. 同时在受体体内获得长期存在的, 针对移植抗原的记忆性CD4+CD25+调节性T细胞, 形成类似于自身耐受的耐受模式, 从而诱导受体的长期存活[22-24]. 然而本组的结果显示: 虽然新鲜分离和体外激活的细胞, 在混合淋巴细胞培养中均有抑制CD4+CD25- T细胞增殖的作用, 回输后可以在一定程度上减轻移植排斥反应, 延长移植物的存活时间, 但和放射线处理的Lewis→DA排斥模型中的结果相比, 两组均不能在自然排斥模型中诱导受体的长期存活, 其主要原因可能是: (1)调节性T细胞主要通过抑制间接识别途径(indirect allo-recognition)来实现移植物的耐受[8,22,24], 而在急性排斥反应的早期, 由过路细胞(passage cell)介导的直接识别途径(direct allo-recognition)是诱发急性排斥反应的主要机制, 随着移植物内过路细胞逐渐为宿主的抗原递呈细胞(antigen presenting cell, APC)所替代, 间接识别模式才逐渐发挥主要的作用. 在放射线处理的排斥模型中, 移植物内的过路细胞被放射线清除, 回输调节性T细胞可使移植物长期存活. 而本组的调节性T细胞回输后, 在急性排斥反应的早期, 虽然可通过非特异性的免疫抑制作用来抑制效应性T细胞的激活, 但是其抑制作用有限; 在急性反应的中后期(>7 d), 则可特异性抑制宿主APC激活的效应性T细胞. 因此在移植术后7 d, 两组细胞回输组肝功能、病理学评分的比较中无统计学差异, 而在生存期的观察中, 经体外供体抗原激活的调节性T细胞回输组的存活期长于新鲜细胞回输组, 这可能与经体外激活的细胞的免疫抑制功能, 较新鲜分离的细胞更特异, 更持久有关[11]. (2) CD4+CD25+调节性T细胞功能发挥是通过细胞间的直接接触实现的[20,22,23], 体外的研究证明其抑制功能在一定的范围内与其数量成正相关, 因此要达到理想的干预效果需要一定的数量. 目前常用的调节性T细胞回输的数量级一般都在106以上, 而获得该数量级的CD4+CD25+ T细胞一般需要牺牲一只受体, 因此寻找理想的扩增条件, 实现该细胞体外功能性扩增,是运用此类细胞进行干预性研究的关键[25,26]. 在本组的研究基础上, 增加回输细胞的数量级, 是否可以进一步延长受体的生存期, 为此本组对该细胞的体外扩增进行了初步的探索. 我们用MMC处理后的供体脾细胞, 联合大剂量的重组大鼠IL-2 (rR IL-2, 200 kU/L)的方法对CD4+CD25+T细胞进行活化、扩增. 该细胞在体外增长的速度与CD4+CD25-T细胞相比要慢得多, 从活化到彻底静息所需时间比CD4+CD25-T细胞要长. 在4 w的培养时间内反复刺激4 次,每次1/1 扩孔. 最终的扩增效率在16倍以上, 扩增后的细胞具有稳定的细胞表型和免疫功能(数据待发表). 由于目前对调节性T细胞回输后的生物学行为的了解还很有限, 回输后的细胞是否能在体内进一步扩增? 是否可以保留一部分记忆性T细胞? 回输后的细胞是否有一定的半衰期, 是否需要连续回输这样的细胞, 需多长时间回输一次[5]? 联合运用免疫抑制剂是否可以协同该细胞的免疫调节功能? 是否可以在减少免疫抑制剂剂量的基础上使得移植物实现长期存活? 这些问题现在尚未得到解决, 因此在探索回输调节性T细胞诱导移植物免疫耐受的过程中, 还需更广泛深入的研究.
南京医科大学第一附属医院动物实验中心杨定国主任, 中国活体肝脏移植研究所高云硕士、邓蕾硕士, 南京医科大学公共卫生学院王璐硕士, 江苏大学病理学教研室王永忠副教授在本研究过程中给予了极大的帮助, 在此表示衷心感谢.
目前, 运用调节性T细胞诱导免疫耐受, 在骨髓移植, 胰岛移植和皮肤移植的研究中已有较多的文献报道, 在实质性器官移植(如心脏、肾脏)中亦有报道, 然而在肝脏移植中报道较少. 已有研究发现, 回输自然耐受模型(Lewis→DA)中长期存活的大鼠脾细胞, 可使排斥模型(放射线处理后的Lewis→DA)中的受体长期存活, 从而提示调节性T细胞可能在诱导肝脏免疫耐受中起一定的作用.
本研究首次报道在肝脏自然排斥模型(DA→Lewis)中, 回输经供体抗原激活的CD4+CD25+调节性T细胞对急性排斥反应的影响, 研究的对象更具体, 采用的模型更加接近肝移植排斥反应的真实情况.
本研究的结果和经放射线处理的排斥模型中的结果相比, 仍有较大的差距, 说明在运用调节性T细胞诱导肝移植免疫耐受的研究中, 还有许多问题需要解决, 仍需要更广泛更深入的探索.
1 Asakura H, Takayashiki T, Ku G, Flye MW. The persistence of regulatory cells developing after rat spontaneous liver acceptance. Surgery 2005; 138: 329-334
2 Asakura H, Ku G, Kataoka M, Flye MW. Regulatory cells develop after the spontaneous acceptance of rat liver allografts. Surgery 2004; 136: 532-536
本文的探索性较强, 有一定的创新性, 特别是体内实验部分, 意义更为突出. 不足之处是CD4+CD25+调节性T细胞的作用已有较多报道. 本文中其对肝移植排斥反应的作用有限, 特别是与FK506组相比, 文中需进一步阐述.
编辑: 张海宁 电编: 张勇
| 1. | Sakaguchi S, Sakaguchi N, Asano M, Itoh M, Toda M. Immunologic self-tolerance maintained by activated T cells expressing IL-2 receptor alpha-chains (CD25). Breakdown of a single mechanism of self-tolerance causes various autoimmune diseases. J Immunol. 1995;155:1151-1164. [PubMed] |
| 2. | Takahashi T, Kuniyasu Y, Toda M, Sakaguchi N, Itoh M, Iwata M, Shimizu J, Sakaguchi S. Immunologic self-tolerance maintained by CD25+CD4+ naturally anergic and suppressive T cells: induction of autoimmune disease by breaking their anergic/suppressive state. Int Immunol. 1998;10:1969-1980. [PubMed] |
| 3. | Suri-Payer E, Amar AZ, Thornton AM, Shevach EM. CD4+CD25+ T cells inhibit both the induction and effector function of autoreactive T cells and represent a unique lineage of immunoregulatory cells. J Immunol. 1998;160:1212-1218. [PubMed] |
| 4. | Ermann J, Szanya V, Ford GS, Paragas V, Fathman CG, Lejon K. CD4(+)CD25(+) T cells facilitate the induction of T cell anergy. J Immunol. 2001;167:4271-4275. [PubMed] |
| 5. | Cohen JL, Trenado A, Vasey D, Klatzmann D, Salomon BL. CD4(+)CD25(+) immunoregulatory T Cells: new therapeutics for graft-versus-host disease. J Exp Med. 2002;196:401-406. [PubMed] |
| 6. | Taylor PA, Lees CJ, Blazar BR. The infusion of ex vivo activated and expanded CD4(+)CD25(+) immune regulatory cells inhibits graft-versus-host disease lethality. Blood. 2002;99:3493-3499. [PubMed] |
| 7. | Camara NO, Sebille F, Lechler RI. Human CD4+CD25+ regulatory cells have marked and sustained effects on CD8+ T cell activation. Eur J Immunol. 2003;33:3473-3483. [PubMed] |
| 8. | Taylor PA, Noelle RJ, Blazar BR. CD4(+)CD25(+) immune regulatory cells are required for induction of tolerance to alloantigen via costimulatory blockade. J Exp Med. 2001;193:1311-1318. [PubMed] |
| 9. | Feng NH, Wu HF, Wu J, Zhang W, Sui YG, He HG, Zhang CL, Zheng JS. Transplantation tolerance mediated by regulatory T cells in mice. Chin Med J. 2004;117:1184-1189. [PubMed] |
| 10. | Zeng D, Lan F, Hoffmann P, Strober S. Suppression of graft-versus-host disease by naturally occurring regulatory T cells. Transplantation. 2004;77:S9-S11. [PubMed] |
| 11. | Asakura H, Takayashiki T, Ku G, Flye MW. The persistence of regulatory cells developing after rat spontaneous liver acceptance. Surgery. 2005;138:329-334. [PubMed] |
| 12. | Asakura H, Ku G, Kataoka M, Flye MW. Regulatory cells develop after the spontaneous acceptance of rat liver allografts. Surgery. 2004;136:532-536. [PubMed] |
| 13. | Stephens LA, Barclay AN, Mason D. Phenotypic characterization of regulatory CD4+CD25+ T cells in rats. Int Immunol. 2004;16:365-375. [PubMed] |
| 14. | 孙 倍成, 王 学浩, 胡 建平, 张 浩, 李 相成. 大鼠肝移植技术改进及免疫排斥初步观察. 南京医科大学学报(自然科学版). 2001;21:282-283. |
| 15. | Kamada N, Calne RY. Orthotopic liver transplantation in the rat. Technique using cuff for portal vein anastomosis and biliary drainage. Transplantation. 1979;28:47-50. [PubMed] |
| 17. | Racusen LC, Halloran PF, Solez K. Banff 2003 meeting report: new diagnostic insights and standards. Am J Transplant. 2004;4:1562-1566. [PubMed] |
| 18. | Banff schema for grading liver allograft rejection: an international consensus document. Hepatology. 1997;25:658-663. [PubMed] |
| 19. | Graca L, Cobbold SP, Waldmann H. Identification of regulatory T cells in tolerated allografts. J Exp Med. 2002;195:1641-1646. [PubMed] |
| 20. | Nakamura K, Kitani A, Strober W. Cell contact-dependent immunosuppression by CD4(+)CD25(+) regulatory T cells is mediated by cell surface-bound transforming growth factor beta. J Exp Med. 2001;194:629-644. [PubMed] |
| 21. | Kamada N. The immunology of experimental liver transplantation in the rat. Immunology. 1985;55:369-389. [PubMed] |
| 22. | Blazar BR, Taylor PA. Regulatory T cells. Biol Blood Marrow Transplant. 2005;11:S46-S49. [PubMed] |
| 23. | Walsh PT, Taylor DK, Turka LA. Tregs and transplantation tolerance. J Clin Invest. 2004;114:1398-1403. [PubMed] |
| 24. | Strom TB. Is transplantation tolerable? J Clin Invest. 2004;113:1681-1683. [PubMed] |