修回日期: 2006-08-01
接受日期: 2006-08-10
在线出版日期: 2006-10-18
目的: 探讨survivin反义寡核苷酸对胰腺癌荷瘤裸鼠的治疗作用.
方法: 构建胰腺癌荷瘤裸鼠模型, 采用瘤内注射方式, 每只注射survivin反义寡核苷酸(ASODN) 40 g/200 L, 对裸鼠进行干预治疗. 观测裸鼠肿瘤生长情况及瘤体质量、病理形态; 应用RT-PCR检测肿瘤的survivin mRNA变化; 应用caspase-3试剂盒检测caspase-3活性; 免疫组织化学法检测肿瘤增殖指数(PI)和微血管密度(MVD).
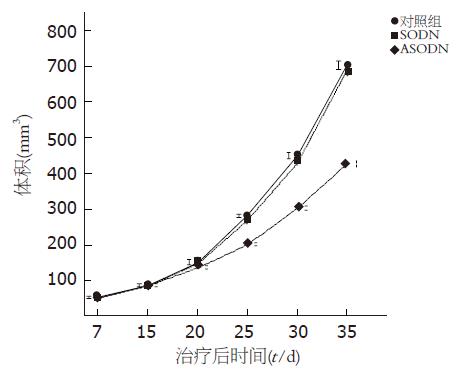
结果: 治疗20 d后, survivin ASODN治疗组的平均体积(427.34±12.44 mm3)明显小于对照组(703.56±12.51 mm3)和正义组(687.59±12.44 mm3)(P<0.01); 治疗组瘤重(0.57±0.06 g)也显著低于对照组(1.16±0.12 g)和正义组(1.07±0.10 g)(P<0.01), 抑瘤率为50.86%. survivin ASODN治疗组survivin mRNA与对照组和正义组相比降低了约50%; survivin ASODN治疗组肿瘤的caspase-3相对活性明显高于对照组和正义组(0.040±0.018 vs 0.006±0.001, 0.007±0.002, P<0.01); survivin ASODN治疗组的PI(28.33±2.16)明显低于对照组(35.17±3.71)和正义组(34.33±3.27)(P<0.01); survivin ASODN组MVD(15.50±3.08)明显低于对照组(21.33±2.94)和正义组(20.67±2.16)(P<0.01); 而对照组和正义组PI和MVD均无显著性差异(P<0.05).
结论: survivin ASODN可显著抑制荷胰腺癌裸鼠的肿瘤生长, 其作用机制可能是通过提高caspase-3活性来诱导细胞凋亡, 通过抑制肿瘤细胞的增殖和新生血管的形成来发挥抗肿瘤效应.
引文著录: 刘江伟, 张永久, 皇甫清风, 李开宗, 张东, 雷涛. survivin反义寡核苷酸对胰腺癌荷瘤裸鼠的治疗作用. 世界华人消化杂志 2006; 14(29): 2838-2843
Revised: August 1, 2006
Accepted: August 10, 2006
Published online: October 18, 2006
AIM: To investigate the therapeutic effects of survivin antisense oligonucleotide (ASODN) on nude mice bearing human pancreatic carcinoma xenograft.
METHODS: The nude mouse model of pancreatic cancer was established using human pancreatic cancer cell line BxPC-3. The mice bearing tumor were intratumorally injected with survivin ASODN (40 g/200 L per mouse). The tumor size and volume were measured before and after injection. The pathological changes of tumor tissues were observed. The expression level of survivin mRNA was measured by reverse transcription-polymerase chain reaction (RT- PCR), and the activity of caspase-3 was evaluated using a caspase-3 assay kit. The expression of proliferating cell nuclear antigen (PCNA) and microvessel density (MVD) were detected by immunohistochemistry.
RESULTS: Twenty days after injection, the tumor volume and weight were significantly decreased in survivin ASODN group as compared with those in the control and SODN group (427.34 ± 12.44 mm3vs 703.56 ± 12.51, 687.59 ± 12.44 mm3, P < 0.01; 0.57 ± 0.06 g vs 1.16 ± 0.12, 1.07 ± 0.10 g, P < 0.01), and the tumor inhibition rate was 50.86%. The expression of survivin mRNA was decreased by 50%, while the caspase-3 activity was significantly higher in survivin ASODN group than that in the control and SODN group (0.040 ± 0.018 vs 0.006 ± 0.001, 0.007 ± 0.002, P < 0.01). The expression of PCNA and MVD were significantly lower in survivin ASODN group than those in the control and SODN group (28.33 ± 2.16 vs 35.17 ± 3.71, 34.33 ± 3.27, P < 0.01; 15.50 ± 3.08 vs 21.33 ± 2.94, 20.67 ± 2.16, P < 0.01). However, both expression of PCNA and MVD had no significant difference between the control and SODN group (P > 0.05).
CONCLUSION: Survivin ASODN can inhibit the growth of human pancreatic carcinoma xenograft in nude mouse through activating caspase-3 to induce apoptosis, and suppressing the proliferation of pancreatic cancer cells as well as the angiogenesis of carcinoma.
- Citation: Liu JW, Zhang YJ, Huangfu QF, Li KZ, Zhang D, Lei T. Therapeutic effects of survivin antisense oligonucleotide on nude mice bearing human pancreatic carcinoma xenograft. Shijie Huaren Xiaohua Zazhi 2006; 14(29): 2838-2843
- URL: https://www.wjgnet.com/1009-3079/full/v14/i29/2838.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i29.2838
在中国, 胰腺癌在肿瘤引起的死亡中占第6位, 胰腺癌的5年生存率不到4%, 而且, 近年来胰腺癌的发病率在中国呈上升趋势[1-2]. 因胰腺癌起病隐匿, 发展迅猛, 缺乏有效的早期诊断工具, 在胰腺确诊时大部分患者已经出现转移, 只有20%的患者有手术切除的机会, 但术后预后较差, 另一方面胰腺癌对放疗和化疗存在着不敏感性, 因此, 对胰腺癌的治疗面临着巨大的挑战[3]. 近年来随着对肿瘤分子学机制研究的不断深入, 以某些肿瘤基因作为靶点的基因治疗可能为胰腺癌的治疗提供新的有效方法[4-5]. survivin是近年发现的一种凋亡抑制基因, 属于凋亡抑制蛋白(inhibitor of apoptosis protein, IAP)家族的新成员, survivin选择性的表达于胚胎发育组织和大多数肿瘤组织, 其表达与肿瘤患者的病程恶性进展、预后差、肿瘤的复发和耐药性密切相关[6-12]. 我们先前的研究表明, survivin在胰腺癌组织中高表达, 而在正常组织中不表达, 其表达与胰腺癌的细胞增殖、凋亡和血管生成密切相关, 并且survivin反义寡核苷酸(antisense oligonucleotides)可诱导胰腺癌BxPC-3细胞增殖、诱导细胞凋亡并增加BxPC-3细胞对吉西他滨化疗敏感性[13-16]. 本研究进一步探讨survivin ASODN对胰腺癌荷瘤裸鼠的治疗作用.
胰腺癌BxPC-3细胞系购自第四军医大学口腔生物细胞培养库. ASODN序列[16-17]为5'-CCCAGCCTTCCAGCTCCTTG-3', 正义寡核苷酸(SODN)序列为: 5'-CAAGGAGCTGGAAGGCTGGG-3', 二者均经硫代磷酸化修饰, 以及survivin和内参β-actin引物均由上海生工生物工程公司合成. 阳离子脂质转染剂转染(LipofectAMINETM2000)系Gibco公司产品; RNA提取液(TRIzol)购自Life Technologies公司; RT-PCR购自TaKaRa公司; 鼠抗人PCNA mAb为北京中山公司产品; 兔抗人FⅧ-RAg多克隆抗体和Envision二步法免疫组化试剂盒系DAKO公司产品; caspase-3比色检测试剂盒系Calbiochem公司产品. 所用BALB/C nu/nu遗传背景的裸鼠购于第四军医大学动物中心, 选用4-6周龄、体质量18-22 g的♀裸鼠21只, 在兰州军区乌鲁木齐总医院动物中心SPF级条件下饲养.
1.2.1 细胞培养及裸鼠荷瘤模型的建立: 胰腺癌BxPC-3以含100 mL/L的新生小牛血清(56 ℃, 灭活30 min)、100 kU/L青霉素、100 mg/L链霉素的RPMI 1640培养基(Gibco公司), 在37 ℃, 50 mL/L CO2饱和湿度条件下培养, 每2-3 d换液传代, 取对数期生长的细胞实验. 至对数生长期的细胞用2.5 g/L胰酶消化后, 收集制成1011个/L的细胞悬液备用. 将胰腺癌BxPC-3细胞107混以0.1 mL PBS皮下注射于裸鼠背部, 建立肿瘤模型. 每只裸鼠取1个注射点, 接种后每天观察有无肿瘤形成及注射点有无破溃红肿, 按规定时间测量肿瘤体积, 经过3-7 d潜伏期, 可见接种部位皮下出现灰白色结节, 并逐渐长大, 呈圆形或椭圆形, 突出于体表, 以肿瘤直径0.5 cm为成瘤.
1.2.2 实验分组及处理: 皮下接种15 d后, 有19只裸鼠成瘤, 将其中18只裸鼠随机分为3组, 每组6只. 正常对照组: 注射lipofectin 10 μg+转染液(无血清无抗生素培养液), 总量200 μL; 正义治疗组: 注射survivin SODN 40 μg+lipofectin 10 μg+转染液总量200 μL; 反义治疗组: survivin ASODN 40 μg+lipofectin 10 μg+转染液总量200 μL. 各组均同时于第15, 20, 25, 30天瘤内多点注射试剂200 μL, 注射前脂质体先于室温下溶于转染液中45 min, 再与寡核苷酸包裹并室温下静置15 min.
1.2.3 检测指标和检测方法: 每次在转染开始前用游标卡尺测量肿瘤大小1次, 每5 d 1次, 连续观测20 d, 期间未出现裸鼠死亡, 于第35天拉颈处死裸鼠, 剥离皮下肿瘤, 测量肿瘤长、短径, 称瘤质量m. 肿瘤体积按公式V = 3.14/6×a×b2计算, 其中a为肿瘤的长径, b为短径, 单位为毫米(mm). 抑瘤率 = (对照组m-实验组m/对照组m)×100%, 肿瘤标本部分快速投入液氮罐中, -80 ℃保存, 部分组织用40 g/L中性甲醛固定, 石蜡包埋, 连续切片, 厚度4 µm, 以备免疫组化染色和HE染色用. 取肿瘤组织50 mg, 用RNA提取液TRIzol提取总RNA. 用RT-PCR试剂盒方法, 取1 µg总RNA用于逆转录合成cDNA, 10 µL cDNA用于PCR反应, 加入survivin的引物序列为: 5'-GTGAATTTTTGAAACTGGACAG-3'(F)和5'-CCTTTCCTAAGACATTGCTAAG-3'(R), 243 bp; 内参β-actin引物序列为: 5'-CTTCTACAATGAGCTGCGTG-3'(F)和5'-TCATGAGGTAGTCAGTCAGG-3'(R), 309 bp; 经过变性后进入循环. PCR产物5 µL在20 g/L琼脂糖上电泳(含0.5 mg/L溴化乙锭), 经凝胶图像分析仪分析结果, 将survivin和β-actin的比值做为survivin表达的参数, 对survivin的PCR产物进行相对定量. 实验取未处理的BxPC-3细胞做对照.
1.2.4 caspase-3活性测定: 取肿瘤组织20 mg, 将组织团块加入1 mL冰裂解液(50 mmol/L HEPES, 1 mmol/L DTT, 0.1 mmol/L EDTA, 10 g/L CHAPS, pH 7.4)中10 min, 4 ℃; 13 000 g离心10 min, 取上清液; 用Coomassie Reagent(Pierce)进行蛋白定量; 100 µg蛋白用裂解液稀释到40 µL; 加入40 µL反应缓冲液(100 mmol/L NaCl, 50 mmol/L HEPES, 10 mmol/L DTT, 1 mmol/L EDTA, 10 g/L CHAPS, 100 mL/L丙三醇, pH 7.4) 和20 µL比色标记的caspase-3底物(Ac-DEVD-pNA), 使终浓度为200 µmol/L, 放入50 mL/L CO2孵箱, 37 ℃, 4 h; 用酶标免疫测定仪测定波长405 nm下的吸光度值来反映caspase-3相对活性的吸光度. 实验重复两次, caspase-3相对活性用mean±SD表示.
1.2.5 增殖细胞核抗原(proliferating cell nuclear antigen, PCNA)的检测: 采用免疫组化SP法染色. 鼠抗人PCNA mAb工作浓度1:50. PCNA蛋白表达以细胞核出现棕黄色颗粒为阳性细胞, 每例切片计数至少10个400倍视野, 以平均每1000个细胞中所含阳性细胞的个数作为增殖指数(proliferating index, PI).
1.2.6 肿瘤微血管密度(microvessel density, MVD): 采用免疫组化SP法染色, 兔抗人FⅧ-RAg多克隆抗体工作浓度1:100. 光镜下进行微血管计数并取其均值, 方法如下: 每张切片先在低倍镜下(100倍)全面观察, 确定5个血管密度最高热点, 再在高倍镜下(<200倍)进行微血管计数. 记录5个热点视野的微血管数, 取其均值作为该标本的MVD.
统计学处理 采用SPSS 10.0, 进行作图和统计分析, 均数比较用t检验.
应用经典的胰腺癌皮下移植瘤方法建立胰腺癌裸鼠模型, 1 wk后可见裸鼠胰腺癌移植瘤成功率90.47%, 种植肿瘤15 d开始进行治疗(图1), 在接种肿瘤的第25天(即治疗开始的第10天), survivin ASODN治疗组的肿瘤的体积明显小于对照组和正义组, 到第35天, 对照组、正义组和survivin ASODN组肿瘤的平均体积分别为703.56±12.51, 687.59±12.44, 427.34±12.44 mm3, survivin ASODN治疗组的平均体积明显小于对照组和正义组(P<0.01), 而对照组、正义组之间差异无显著性(P>0.05)(图1), 3组的平均瘤质量分别为1.16±0.12, 1.07±0.10, 0.57±0.06 g, survivin ASODN治疗组的平均瘤重明显小于对照组和正义组(P<0.01), 而对照组、正义组之间差异无显著性(P>0.05). survivin ASODN组的平均抑瘤率为50.86%. 在饲养期间未发现裸鼠死亡及出现其他躯体的毒性反应.
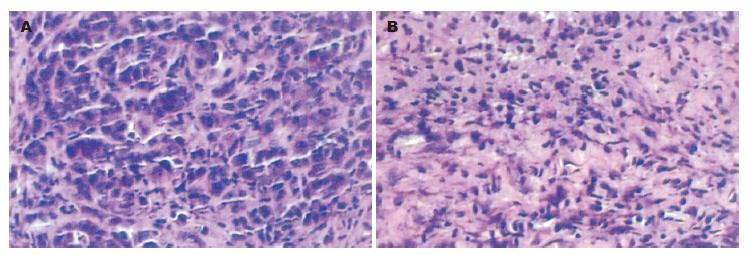
对照组组织切片HE染色可见, 肿瘤细胞为导管上皮细胞, 肿瘤细胞在部分区域呈实性巢状排列, 许多瘤细胞排列松散, 亦偶可见呈游离状态的瘤细胞, 间有小腺腔样结构, 肿瘤细胞异型性明显, 瘤巨细胞及多核瘤细胞可见. 治疗组组织切片发现, 肿瘤细胞出现坏死区, 可见淋巴浸润细胞(图2).
RT-PCR产物电泳显示对照组和处理组在243 bp处均出现特异性的survivin条带, ASODN组survivin mRNA的表达明显低于对照组, 经凝胶图像分析仪分析结果显示, 对照组、正义组和survivin反义寡核苷酸组的平均survivin/β-actin mRNA分别为0.87±0.05, 0.84±0.04和0.44±0.06, survivin ASODN组与对照组和正义组之间均具有显著性差异(P<0.01). survivin ASODN组survivin与对照组相比下降了约50%.
对照组、正义组和survivin ASODN组肿瘤的caspase-3相对活性分别为0.006±0.001, 0.007±0.002和0.040±0.018, survivin ASODN组与对照组和正义组之间均具有显著性差异(P<0.01).
surviving ASODN组肿瘤的PCNA PI(28.33±2.16)明显低于对照组(35.17±3.71)和正义组(34.33±3.27), 差异具有显著性(P<0.01). 对照组、正义组和survivin ASODN组肿瘤的MVD分别为21.33±2.94, 20.67±2.16, 15.50±3.08, survivin ASODN组的MVD明显低于对照组和正义组, 均具有显著性差异(P<0.01), 而对照组和正义组PI和MVD均无显著性差异(表1).
survivin是IAP家族的新成员, 是目前发现的最强的凋亡抑制因子, survivin的组织分布特征具有明显的选择性, 其表达于胚胎和发育的胎儿组织, 但不见于终末分化的成人组织(胸腺、生殖腺除外), 而表达于大多数的肿瘤组织中[18-19]. survivin具有抑制凋亡和调节细胞分裂的双重功能, 他参与细胞增生、分裂、细胞周期及细胞凋亡的调控, 与肿瘤的发生密切相关, 研究表明, survivin能够通过杆状病毒IAP重复序列(BIR)作用于caspase-3, caspase-7来抑制细胞凋亡[20-21], survivin的高表达可以使肿瘤细胞免受各种凋亡信号的刺激而帮助细胞存活[22-23]. 一些研究表明, survivin的高表达与肿瘤的预后差和耐药性有关[24-26]. survivin的过表达与胰腺癌的发生、发展密切相关[27]. 本研究结果显示, survivin ASODN作用于荷瘤裸鼠瘤体20 d后, survivin ASODN治疗组的平均体积明显小于对照组和正义组, 而对照组、正义组之间差异无显著性. survivin ASODN治疗组的平均瘤重明显小于对照组和正义组, 而对照组、正义组之间差异无显著性. survivin ASODN组的平均抑瘤率为50.86%. 在饲养期间未发现裸鼠死亡及出现其他躯体的毒性反应. survivin ASODN组survivin mRNA与对照组相比下降了约50%. 这充分表明, survivin ASODN对荷瘤裸鼠体内靶基因表达和肿瘤生长确有一定抑制作用. 同时发现, survivin ASODN治疗组肿瘤的caspase-3相对活性明显高于对照组和正义组. caspase是细胞凋亡的核心机制, survivin直接作用于caspase, 主要抑制caspase-3和caspase-7的活性, 阻断细胞凋亡过程[21]. caspase-3主要通过以下途径促进凋亡: 裂解DNA修复相关分子; 裂解凋亡抑制蛋白等; 裂解细胞外基质蛋白及骨架蛋白; 裂解其他相关分子[28]. caspase-3对底物的切割不仅特异, 而且高效. 在凋亡发生的过程中, caspase-3既可作为凋亡的启动者, 也可作为凋亡的效应物, 从而形成瀑布式连锁反应, 促使凋亡得以完成[29]. 研究证明, 利用反义核酸技术干扰survivin的表达或抑制其功能的发挥可抑制有丝分裂并促进自发的细胞凋亡[30]. 使肿瘤生长速度延缓, 瘤重量减轻. 我们的实验数据显示, survivin ASODN组肿瘤的PCNA PI明显低于对照组和正义组, 具有显著性差异. survivin ASODN组的MVD明显低于对照组和正义组, 均具有显著性差异, 表明survivin ASODN对肿瘤的抑制作用是通过抑制细胞增殖和血管生成来实现. survivin在肿瘤血管新生调节中是至关重要的, 正常血管内皮细胞不表达survivin, 而体内外研究证明, 肿瘤血管内皮细胞过度表达survivin, 使得肿瘤血管内皮细胞凋亡减少, 有利于肿瘤生长. 因此, 反义survivin能够拮抗肿瘤血管内皮因子的保护作用, 从而抑制肿瘤血管的新生, 促进肿瘤内皮细胞凋亡, 最后导致肿瘤生长受到抑制, 达到治疗肿瘤的目的[31].
肿瘤的基因治疗在实验室阶段取得了瞩目的进步, 肿瘤的反义基因治疗是应用反义核酸在转录和翻译水平阻断某些异常基因的表达, 以阻断瘤细胞内的异常信号传导, 使瘤细胞进入正常分化轨道或引起细胞凋亡的一种治疗手段, 由于survivin基因表达的特异性, 可能成为基因治疗的有效靶点, 在临床上具有广阔的应用前景.
胰腺癌因恶性程度高, 手术切除率低, 同时存在对放疗和化疗的不敏感性, 在临床上对胰腺癌的治疗面临着巨大的挑战, 近年来, 以某些肿瘤基因作为靶点的基因治疗可能为胰腺癌的治疗提供新的有效方法. survivin是近年发现的一种凋亡抑制基因, 属于凋亡抑制蛋白(inhibitor of apoptosis protein, IAP)家族的新成员, 是目前发现的最强的凋亡抑制因子, 因其在肿瘤组织表达的特异性而成为研究的热点.
本研究在先前研究的基础上, 建立胰腺癌裸鼠模型, 应用survivin反义寡核苷酸, 从荷胰腺癌裸鼠模型的体内实验进一步证明靶向survivin的基因治疗可抑制肿瘤细胞的增殖、抑制血管生成, 通过提高caspase-3的活性来诱导细胞凋亡, 在临床上有广阔的应用前景.
本文内容丰富, 实验设计合理, 数据处理准确, 结论较为明确, 是一篇较好的实验研究文稿.
电编: 张敏 编辑:王晓瑜
| 1. | Guo X, Cui Z. Current diagnosis and treatment of pancreatic cancer in China. Pancreas. 2005;31:13-22. [PubMed] [DOI] |
| 2. | Wang L, Yang GH, Li H, Lu XH. The changing pancreatic cancer mortality in China (1991-2000). Zhonghua Nei Ke Za Zhi. 2005;44:509-513. [PubMed] |
| 3. | Rodriguez JA, Li M, Yao Q, Chen C, Fisher WE. Gene overexpression in pancreatic adenocarcinoma: diagnostic and therapeutic implications. World J Surg. 2005;29:297-305. [PubMed] [DOI] |
| 4. | Okusaka T, Matsumura Y, Aoki K. New approaches for pancreatic cancer in Japan. Cancer Chemother Pharmacol. 2004;54 Suppl 1:S78-82. [PubMed] [DOI] |
| 5. | Blasco F, Penuelas S, Cascallo M, Hernandez JL, Alemany C, Masa M, Calbo J, Soler M, Nicolas M, Perez-Torras S. Expression profiles of a human pancreatic cancer cell line upon induction of apoptosis search for modulators in cancer therapy. Oncology. 2004;67:277-290. [PubMed] [DOI] |
| 6. | Altieri DC. The molecular basis and potential role of survivin in cancer diagnosis and therapy. Trends Mol Med. 2001;7:542-547. [PubMed] [DOI] |
| 10. | 高 思海, 赵 金平, 潘 铁成, 李 军. 凋亡抑制基因survivin 在食管鳞癌中的表达及其与p53基因表达相关性研究. 世界华人消化杂志. 2004;12:1468-1470. [DOI] |
| 12. | 苏 琪, 吴 硕东, 殷 红专, 韩 霞, 陈 春生, 冯 勇, 刘 恩卿. 直肠癌旁移行黏膜中Survivin基因表达的意义. 世界华人消化杂志. 2004;12:2201-2202. [DOI] |
| 16. | 刘 江伟, 李 开宗, 窦 科峰, 苏 明权, 于 文彬, 张 福琴. Survivin反义寡核苷酸诱导胰腺癌细胞凋亡并增加吉西他滨的化疗敏感性. 中华普通外科杂志. 2004;19:401-403. |
| 17. | Olie RA, Simoes-Wust AP, Baumann B, Leech SH, Fabbro D, Stahel RA, Zangemeister-Wittke U. A novel antisense oligonucleotide targeting survivin expression induces apoptosis and sensitizes lung cancer cells to chemotherapy. Cancer Res. 2000;60:2805-2809. [PubMed] |
| 18. | Tong QS, Zheng LD, Chen FM, Zeng FQ, Wang L, Dong JH, Lu GC. Selection of optimal antisense accessible sites of survivin and its application in treatment of gastric cancer. World J Gastroenterol. 2005;11:634-640. [PubMed] [DOI] |
| 19. | Altieri DC. Survivin, versatile modulation of cell division and apoptosis in cancer. Oncogene. 2003;22:8581-8589. [PubMed] [DOI] |
| 20. | Zhu XD, Lin GJ, Qian LP, Chen ZQ. Expression of survivin in human gastric carcinoma and gastric carcinoma model of rats. World J Gastroenterol. 2003;9:1435-1438. [PubMed] [DOI] |
| 21. | Johnson AL, Langer JS, Bridgham JT. Survivin as a cell cycle-related and antiapoptotic protein in granulosa cells. Endocrinology. 2002;143:3405-3413. [PubMed] [DOI] |
| 22. | Tamm I, Wang Y, Sausville E, Scudiero DA, Vigna N, Oltersdorf T, Reed JC. IAP-family protein survivin inhibits caspase activity and apoptosis induced by Fas (CD95), Bax, caspases, and anticancer drugs. Cancer Res. 1998;58:5315-5320. [PubMed] |
| 23. | Conway EM, Pollefeyt S, Steiner-Mosonyi M, Luo W, Devriese A, Lupu F, Bono F, Leducq N, Dol F, Schaeffer P. Deficiency of survivin in transgenic mice exacerbates Fas-induced apoptosis via mitochondrial pathways. Gastroenterology. 2002;123:619-631. [PubMed] [DOI] |
| 24. | Ikeguchi M, Kaibara N. survivin messenger RNA expression is a good prognostic biomarker for oesophageal carcinoma. Br J Cancer. 2002;87:883-887. [PubMed] [DOI] |
| 25. | Chakravarti A, Noll E, Black PM, Finkelstein DF, Finkelstein DM, Dyson NJ, Loeffler JS. Quantitatively determined survivin expression levels are of prognostic value in human gliomas. J Clin Oncol. 2002;20:1063-1068. [PubMed] [DOI] |
| 26. | Zaffaroni N, Pennati M, Colella G, Perego P, Supino R, Gatti L, Pilotti S, Zunino F, Daidone MG. Expression of the anti-apoptotic gene survivin correlates with taxol resistance in human ovarian cancer. Cell Mol Life Sci. 2002;59:1406-1412. [PubMed] [DOI] |
| 27. | Qiao JG, Zhang YQ, Yin YC, Tan Z. Expression of Survivin in pancreatic cancer and its correlation to expression of Bcl-2. World J Gastroenterol. 2004;10:2759-2761. [PubMed] [DOI] |
| 28. | Grutter MG. Caspases: key players in programmed cell death. Curr Opin Struct Biol. 2000;10:649-655. [PubMed] [DOI] |
| 29. | Budd RC. Activation-induced cell death. Curr Opin Immunol. 2001;13:356-362. [PubMed] [DOI] |
| 30. | Xia C, Xu Z, Yuan X, Uematsu K, You L, Li K, Li L, McCormick F, Jablons DM. Induction of apoptosis in mesothelioma cells by antisurvivin oligonucleotides. Mol Cancer Ther. 2002;1:687-694. [PubMed] |
| 31. | O'Connor DS, Schechner JS, Adida C, Mesri M, Rothermel AL, Li F, Nath AK, Pober JS, Altieri DC. Control of apoptosis during angiogenesis by survivin expression in endothelial cells. Am J Pathol. 2000;156:393-398. [PubMed] [DOI] |