修回日期: 2006-07-18
接受日期: 2006-08-10
在线出版日期: 2006-09-28
目的: 探讨三氧化二砷(As2O3)体外逆转人肝癌细胞多药耐药性的作用及机制.
方法: MTT法检测As2O3的细胞毒作用和处理前后耐药细胞对化疗药物的敏感性, 用流式细胞仪检测细胞内阿霉素浓度, 通过RT-RCR检测MDR1基因的表达.
结果: As2O3在0.25 mg/L剂量以下时对HepG2和HepG2/ADM耐药细胞株的抑制率均小于15%, 半数抑制率(IC50)分别为1.02和1.34 mg/L, 无细胞毒剂量0.2 mg/L的As2O3能部分逆转HepG2/ADM细胞对阿霉素、顺铂(CDDP)、丝裂霉素(MMC)、5-氟尿嘧啶(5-FU)的耐药性, 逆转倍数分别为2.92, 3.09, 2.13, 2.60倍. 同时无细胞毒剂量0.2 mg/L的As2O3能使HepG2/ADM细胞内阿霉素浓度明显增加, MDR1表达下降.
结论: As2O3具有体外逆转人肝癌细胞多药耐药性的作用, 可能与下调MDR1表达、增加细胞内药物积累有关.
引文著录: 李贺, 熊茂明, 孟翔凌, 耿小平. 三氧化二砷逆转肝癌细胞株HepG2/ADM多药耐药的作用. 世界华人消化杂志 2006; 14(27): 2691-2694
Revised: July 18, 2006
Accepted: August 10, 2006
Published online: September 28, 2006
AIM: To explore the reversing effect of arsenic trioxide (As2O3) on the multidrug resistance (MDR) of human hepatocellular carcinoma HepG2/ADM cells in vitro and its potential mechanism.
METHODS: MTT assay was used to test the toxicity of As2O3 and the chemosensitivity to chemotherapeutics in As2O3-treated HepG2 and HepG2/ADM cells. Flow cytometry was used to determine the concentration of intracellular adriamycin (ADM). The expression of MDR1 was measured by reverse transcription-polymerase chain reaction (RT-PCR).
RESULTS: The inhibitory rates of HepG2 and HepG2/ADM cells caused by As2O3 were lower than 15% under the dose of 0.25 mg/L, and the IC50 were 1.02 and 1.34 mg/L, respectively. As2O3 at 0.2 mg/L partly overcame the MDR of HepG2/ADM cells. The reverse efficiencies (multiples) to ADM, cisplatin (CDDP), mytomycin (MMC), 5-fluororacil (5-FU) were 2.92, 3.09, 2.13 and 2.60, respectively. Furthermore, after exposure to 0.2 mg/L As2O3, the concentration of ADM was significantly increased while MDR1 expression was partially decreased in HepG2/ADM cells.
CONCLUSION: As2O3 can reverse the multidrug resistance of human hepatocellular carcinoma cells in vitro, and the possible mechanism is related to the down-regulated expression of MDR1 and raised concentration of drug inside the cells.
- Citation: Li H, Xiong MM, Meng XL, Geng XP. Reversing effect of arsenic trioxide on multidrug resistance of human hepatocellular carcinoma HepG2/ADM cells. Shijie Huaren Xiaohua Zazhi 2006; 14(27): 2691-2694
- URL: https://www.wjgnet.com/1009-3079/full/v14/i27/2691.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i27.2691
肝癌是我国常见的恶性肿瘤之一, 虽然近年来治疗技术有了很大提高, 但手术切除率及5 a生存率都较低, 在各种综合性治疗中化疗仍是很重要的手段, 然而肝癌细胞多药耐药(multidrug resistance, MDR)的存在常使化疗失败. 因此寻找多药耐药逆转剂成为解决肝癌MDR的有效途径之一. 我们选用中药砒霜的有效成分-三氧化二砷(As2O3)体外逆转肝癌耐药细胞株HepG2/ADM的耐药性, 以期寻求一种具有临床应用价值的逆转新药, 从而优化化疗方案, 提高临床疗效.
人肝癌细胞株HepG2、人肝癌细胞耐药株HepG2/ADM由华中科技大学附属同济医院肝脏外科中心陈孝平教授建立并惠赠. As2O3(哈尔滨伊达药业有限公司产品), 阿霉素(ADM, 法玛西亚公司), 顺铂(CDDP, 山东齐鲁制药), 丝裂霉素(MMC, 浙江海正药业), 5-氟尿嘧啶(5-FU, 旭东海普公司), 维拉帕米(VER, 上海天禾制药), TRIzol Resgeant试剂盒(Gibco公司), P170-PE鼠抗人mAb(Coulter公司), RT-PCR试剂盒(TaKaRa产品).
1.2.1 As2O3细胞毒性实验[1]: 将对数生长期HepG2, HepG2/ADM细胞制成1×106/L单细胞悬液, 分别接种于96孔板, 每孔加细胞悬液100 μL, 培养24 h, 按分组情况分别加入4.0, 2.0, 1.0, 0.5, 0.25 mg/L的As2O3, 每个浓度设5个复孔, 每孔终体积200 μL, 培养48 h后, 每孔加入MTT (5 g/L) 20 μL, 继续培养4 h, 吸弃培养液, 每孔加入DMSO 150 μL, 充分振荡10 min, 于酶标仪上检测490 nm处吸光度值(A值), 计算细胞抑制率, 细胞抑制率 = [1-(AX-A)/(A0-A)]×100%, AX为加药孔吸光度值, A为只加培养液不加细胞悬液对照组吸光度值, A0为只加细胞悬液不加药孔的吸光度值.
1.2.2 MTT实验: 将细胞分成HepG2, HepG2+As2O3, HepG2/ADM, HepG2/ADM+As2O3和HepG2/ADM+VER五组(以VER作逆转效能阳性对照, As2O3浓度根据As2O3细胞毒性实验结果, 选取无细胞毒剂量0.2 mg/L), 按上述方法接种于96孔板, 培养24 h, 分别加入ADM, CDDP, MMC, 5-FU, 每种药物设6组浓度, 每组浓度5个复孔; 继续培养48 h, 进行MTT测定, 计算半数抑制率(IC50). 耐药倍数(RI) = 耐药株IC50/亲本株IC50; 逆转倍数 = 耐药株IC50/加As2O3后IC50; 相对逆转效率 = (逆转前IC50-逆转后IC50)/(逆转前IC50-亲本株IC50)×100%. 实验在不同日重复3次.
1.2.3 流式细胞仪检测细胞内药物浓度和细胞膜转运蛋白(Pgp)的表达: 取对数生长期的HepG2, HepG2/ADM制备成单细胞悬液(5×105/L), 实验组以无细胞毒剂量的As2O3, 即0.2 mg/L As2O3分别联合1.2, 2.4, 4.8 mg/L的ADM共培养4 h, 对照组仅含1.2, 2.4, 4.8 mg/L的ADM, 冷PBS (4℃, 0.01 mol/L, pH 7.4)洗涤2次, 再重悬于冷PBS中, 4℃保存至上样行流式细胞仪(Beckman Coulter, EPICS-XL-4)检测(λex = 488 nm, λem = 575 nm)细胞内阿霉素荧光强度. 将细胞分成HepG2/ADM和HepG2/ADM+As2O3 (0.2 mg/L)组, 作用48 h后, 调整细胞浓度为1×106/L, 取1 mL离心, 弃上清, 加P170-PE鼠抗人mAb 5 μL, 室温下20 min, 加PBS 1 mL离心, 除去未结合的荧光抗体, 最后加入PBS 0.5 mL待测, λex = 488 nm, λem = 575 nm, Pgp含量以Pgp荧光强度表示.
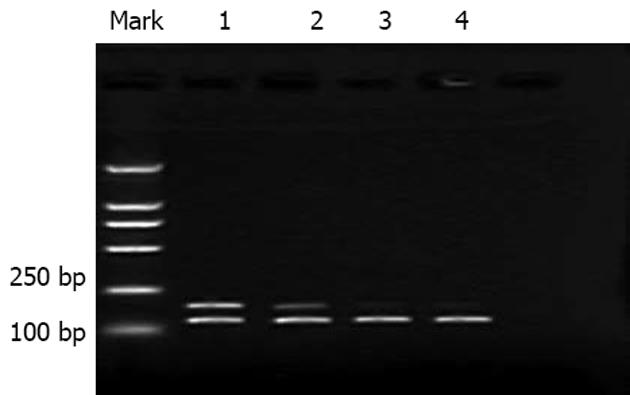
1.2.4 RT-PCR检测MDR1表达: 取对数生长期细胞1×107用TRIzol一步法提取总RNA, 紫外分光光度计检测总RNA含量. 取0.5 μg细胞总RNA, 0.5 μL的逆转录酶AMV, 在Oligo dT-Adaptor Primer存在下建立10 μL反应体系, 操作步骤严格按照试剂盒说明进行. PCR扩增MDR1上游引物: 5'CCC ATC ATT GCA ATA GCA GG, 下游引物: 5'GTT CAA ACT TCT GCT CCT GA; β2-mg上游引物: 5'ACC CCC ACT GAA AAA GAT GA, 下游引物: 5'ATC TTC AAA CCT CCA TGA TG. 按试剂盒说明建立反应体系, 94℃变性30 s, 52℃退火30 s, 72℃延伸4 min, 共35个循环, 得到157 bp的MDR1和121 bp的β2-mg扩增产物. 扩增产物于25 g/L琼脂糖凝胶电泳进行检测, EB染色, 用凝胶成像系统(Tanon GIS-2010)进行分析.
统计学处理 数据以mean±SD表示, 结果用SPSS 12.0统计软件进行t检验和方差分析.
As2O3在0.25 mg/L时对HepG2, HepG2/ADM细胞无明显毒性, 超过此浓度呈剂量效应关系, As2O3对HepG2, HepG2/ADM的IC50分别为1.02 mg/L, 1.34 mg/L(表1).
| As2O3(mg/L) | 抑制率 (%) | |
| HepG2 | HepG2/ADM | |
| 0.25 | 12±0.2 | 7±0.4 |
| 0.5 | 33±0.6 | 22±0.3 |
| 1 | 49±0.4 | 44±0.2 |
| 2 | 66±0.3 | 57±0.6 |
| 4 | 87±0.4 | 81±0.5 |
使用0.2 mg/L浓度As2O3后ADM, CDDP, MMC和5-FU对HepG2/ADM的IC50明显降低(表2). As2O3对HepG2/ADM不同化疗药物耐药性的逆转倍数分别为: ADM 2.92倍、CDDP 3.09倍、MMC 2.13倍、5-FU 2.60倍(表3).
| 分组 | ADM | CDDP | MMC | 5-FU |
| 耐药倍数 | 12.34 | 5.74 | 2.48 | 3.81 |
| 逆转倍数 | 2.92 | 3.09 | 2.13 | 2.60 |
| 相对逆转效率 | 71.6% | 81.9% | 86.8% | 83.4% |
实验组ADM与无细胞毒性的As2O3合用, 与对照组单用ADM比较, 细胞内ADM的累积量明显提高(P<0.01, 表4).
HepG2/ADM细胞的Pgp表达(细胞内平均荧光强度: 7.22±0.23)较HepG2细胞(3.26±0.24)高, As2O3作用于HepG2/ADM细胞后, 其Pgp表达降低(5.65±0.03). RT-PCR结果显示: HepG2细胞的MDR1表达明显弱于HepG2/ADM细胞, 且As2O3作用后无显著变化; 而HepG2/ADM经0.2 mg/L As2O3作用48 h后, 强度明显下降, 但仍高于HepG2细胞(图1).
砒霜是中国的传统中药, 作为药物应用已有2000多年历史. 1970年哈尔滨医科大学首先使用As2O3治疗急性早幼粒细胞性白血病获得显著的临床效果. 随后的研究发现, As2O3对许多实体组织肿瘤耐药细胞如人乳腺癌耐药细胞株MCF-7/ADM[2]有逆转作用, 韩冰 et al[3]研究发现, As2O3能降低人肺腺癌细胞A594 MDR1基因的表达. 史立军 et al[4]研究发现, As2O3可能通过抑制凋亡抑制因子survivin基因的表达, 促进胰腺癌PC2细胞凋亡. 何景利 et al[5]研究发现, As2O3与顺铂联合应用能够降低人结肠癌细胞株colon26的Bcl-2蛋白表达, 从而促进细胞凋亡. 有关As2O3作用与肝癌细胞的实验研究也有报道, 刘连新 et al[6]研究发现, As2O3可通过诱导肝癌细胞株凋亡而抑制肝癌细胞生长, 其诱导凋亡机制可能是通过半胱氨酸蛋白酶-3起作用. 但目前尚未有As2O3直接作用与肝癌多药耐药细胞株的研究报道.
肿瘤细胞在化疗过程中会产生多药耐药性, 目前对MDR的研究主要集中在MDR的发生机制和寻找有临床应用价值的MDR逆转剂两方面. 我们以中药砒霜的有效成分As2O3体外逆转人肝癌耐药细胞株HepG2/ADM的耐药性. 本组实验结果显示, 当As2O3剂量达到0.5 mg/L时, 对HepG2, HepG2/ADM细胞毒性明显增强. 而小剂量As2O3 (0.2 mg/L), 可明显增加ADM在HepG2/ADM细胞内的蓄积浓度, 同时能有效逆转HepG2/ADM细胞对ADM, cDDP, MMC, 5-FU的耐药, 逆转倍数分别为2.92倍、3.09倍、2.13倍、2.60倍. MDR产生的最大原因是肿瘤细胞化疗后细胞内Pgp的过度表达[7]. 本组流式细胞术结果表明, As2O3可部分抑制HepG2/ADM细胞Pgp的表达, RT-PCR结果显示, As2O3可使HepG2/ADM细胞MDR1表达降低. 以上结果表明, As2O3在体外逆转肝癌耐药主要是通过抑制MDR1表达, 阻断Pgp蛋白表达, 抑制Pgp泵功能, 从而提高HepG2/ADM细胞内的化疗药物浓度, 增强对耐药细胞的杀伤力. As2O3在体外表现出较强的逆转肝癌多药耐药性作用, 为临床肝癌的化疗提供了一条新的途径.
多药耐药是肿瘤细胞免受化疗药物攻击的最重要的细胞防御机制,因此如何逆转多药耐药成为目前对肿瘤化疗最需解决的问题, 而寻找多药耐药逆转剂成为解决问题的关键. MDR1基因被认为是使肿瘤细胞产生多药耐药性的最主要基因, Pgp是其表达产物, 而Pgp能够降低化疗药物在肿瘤细胞内的蓄积.
本文证实三氧化二砷体外能够有效逆转肝癌耐药细胞株H e p G 2 /ADM的耐药性,为肝癌的临床治疗开辟了一条新的途径, 临床应用前景广阔.
多药耐药(multidrugresistance,MDR): 是指肿瘤细胞接触某一种化疗药物, 不仅对此种药物产生抗药性, 而且还可对其他结构和功能不同的多种化疗药物产生交叉耐药性. MDR细胞的存在不仅大大降低了化疗效果,而且是肿瘤复发转移的重要原因.
逆转MDR的研究是目前的热点之一, 特别是用中药作为逆转剂, 本文选题具有先进性. 科研方案设计严谨合理, 方法先进, 结果可信. 文字流畅, 表达简洁准确.
电编: 张敏 编辑:张焕兰
| 1. | Yu DS, Ma CP, Chang SY. Establishment and characterization of renal cell carcinoma cell lines with multidrug resistance. Urol Res. 2000;28:86-92. [PubMed] [DOI] |
| 4. | 史 立军, 闫 彬彬, 李 双星, 孟 艳玲, 马 珊珊, 刘 铁夫, 李 呼伦. As2O3对胰腺癌细胞株的抑制作用及其机制的初步探讨. 中国病理生理杂志. 2005;21:1572-1574. |
| 7. | Huesker M, Folmer Y, Schneider M, Fulda C, Blum HE, Hafkemeyer P. Reversal of drug resistance of hepatocellular carcinoma cells by adenoviral delivery of anti-MDR1 ribozymes. Hepatology. 2002;36:874-884. [PubMed] [DOI] |