修回日期: 2006-04-25
接受日期: 2006-05-08
在线出版日期: 2006-08-28
目的: 通过多媒体显微镜对肝硬化和肝癌患者手指血干血滴镜下活性氧毒性物(ROTS)形态和内含物的观察, 探讨其在肝癌诊断中的价值.
方法: 选择临床确诊肝癌患者28例, 肝硬化患者43例, 其他癌症患者38例. 制备手指血干血滴片, 进行计算机扫描, 应用高清晰度彩色病理图文分析系统(HPIAS-1000)对ROTS块的形状、内含物的情况进行观察比较.
结果: 肝癌患者28例中, 有20例出现ROTS块的增大, 其中15例在增大的ROTS块内可见到特异性刺突或者透明小体. 肝硬化患者43例中, 有16例出现ROTS块增大, 其中8例出现刺突或者透明小体改变. 以特异性刺突和/或透明小体为阳性标志, 肝癌阳性率为53.6%, 肝硬化阳性率为18.6%, χ2检验前者阳性率显著高于后者(P = 0.0038). 观察其他癌症患者手指血涂片, 均未见上述阳性改变. 进一步研究发现, 在肝癌患者中ROTS阳性和阴性患者血清唾液酸和AFP水平无显著性差异. ROTS阳性改变与患者年龄、转氨酶水平及肝功能Child-Pugh评分均无相关性.
结论: 肝癌患者手指血ROTS块在多媒体显微镜下呈现刺突和透明小体特异性改变, 根据形态改变可以用以区分肝癌和肝硬化患者.
引文著录: 贾克东, 石淑仙, 阮幼冰. 末梢血活性氧毒性物在肝癌诊断中的价值. 世界华人消化杂志 2006; 14(24): 2406-2410
Revised: April 25, 2006
Accepted: May 8, 2006
Published online: August 28, 2006
AIM: To observe the morphology and inclusion body of reactive oxygen toxic species (ROTS) of finger blood dot in hepatocellular carcinoma (HCC) and liver cirrhosis (LC) by multimedia microscopy and explore its value in the diagnosis of HCC.
METHODS: The finger blood dots were prepared from 28 patients with HCC, 43 patients with LC, 38 patients with other carcinomas. The blood dots were scanned and the morphology and inclusion body of ROTS were analyzed by high-vivid color pathology image analysis system (HPIAS-1000) between different groups of patients.
RESULTS: The enlarged ROTS was detected in 20 of 28 patients with HCC and 16 of 43 patients with LC. Fifteen patients with HCC were found to have pricks, something like nails, or transparent body inside the enlarged ROTS, but only 8 patients with LC and no patients with other carcinomas showed ROTS morphological changes above. Regarding the pricks or transparent body as positive mark, the positive rate of HCC was 53.6%, significantly higher than that of LC (18.6%) (P = 0.0038). Further study indicated that the levels of serum sialic acid and alpha-fetoprotein (AFP) in ROTS-positive patients with HCC were not significant higher than those of ROTS-negative ones. The ages of patients, the levels of alanine aminotransferase (ALT) and Child-Pugh grades for liver function were not significantly different between ROTS-positive and negative patients, either.
CONCLUSION: ROTS of finger blood dots in HCC patient shows morphological changes of pricks and transparent body by multimedia microscopy, which can be used to differentiate most HCC from LC patients.
- Citation: Jia KD, Shi SX, Ruan YB. Values of reactive oxygen toxic species of finger blood dot in the diagnosis of hepatocellular carcinoma. Shijie Huaren Xiaohua Zazhi 2006; 14(24): 2406-2410
- URL: https://www.wjgnet.com/1009-3079/full/v14/i24/2406.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i24.2406
人体血液循环中自由基和血细胞相互作用形成一种活性氧毒性物(reactive oxygen toxic species, ROTS), 他的形成是全身各系统新陈代谢失调和机体应激和疾病状态的反映, 在干燥的血滴点片中, 呈现白色和多种形态, 其大小、形态、分布及其内含物的情况可以为临床诊断提供有意义的线索. 肿瘤患者自由基足迹增多, 形成特异性构象. 有研究发现恶性肿瘤患者呈现ROTS块增大、内含物出现等特点, 根据ROTS区域的性状、颜色甚至可以区分恶性肿瘤的来源, 如肺癌ROTS块为铬黄色, 肝癌出现黑色光环、倒刺、针状体等变化[1-3]. 我们对肝硬化及肝癌患者进行了观察, 并对其在诊断肝癌中的价值进行了研究.
肝硬化患者44例, 男38例, 女6例, 年龄20-68(平均43)岁, 肝硬化伴腹水12例, 肝硬化伴食管下端静脉曲张破裂出血5例, Child-Pugh评分A级2例, B级18例, C级24例. 肝癌患者28例, 其中男23例, 女5例, 年龄24-71(平均50)岁, 均经临床影像学、血清学或经手术后病理切片证实. 弥漫全肝1例, 浸润半肝1例, 2个以上结节4例, 其余均为单发结节, 肿瘤直径超过10 cm的6例. 其他癌症患者38例, 包括直肠癌5例, 胃癌5例, 贲门癌3例, 食管癌10例, 壶腹周围癌1例, 肺癌10例, 宫颈癌3例, 胰腺癌1例, 均由病理组织学诊断.
消毒手指末端, 自然干燥后, 应用一次性采血针迅速刺破指端皮肤, 待血液自然流出(不挤压), 快速点于事先准备好的玻片上, 每片7点. 自然干燥后, 进行计算机扫描, 应用高清晰度彩色病理图文分析系统(HPIAS-1000, 同济医科大学前屏影像工程公司), 对ROTS块的形状、内含物的情况进行观察. AFP测定应用中国原子能科学研究院同位素所(北京)生产的AFP同位素测定试剂盒, 曲线范围为10-1600 mg/L. 测定采用竞争放射免疫分析法. 血清唾液酸(SA)的测定方法按海海军医学研究所生物技术中心说明书进行, SA含量 = (A样本/A标准)×500 mg/L.
统计学处理 肝硬化与肝癌患者阳性率的比较应用χ2检验, 血清SA水平、年龄、肝功能Child-Pugh积分比较应用两独立样本的t检验; 血清AFP, ALT比较应用SPSS非参统计方法.
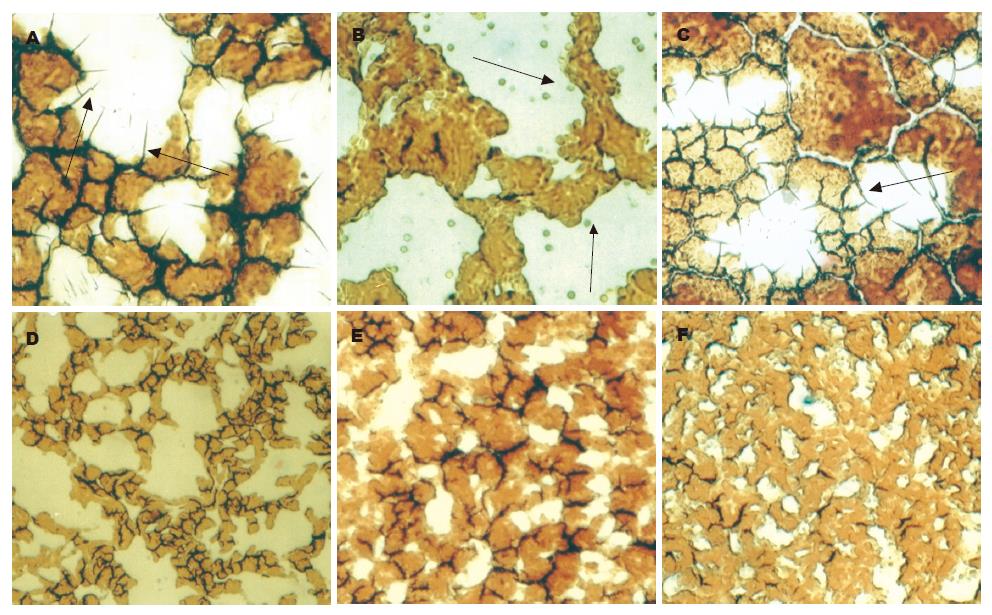
应用HPIAS-1000多媒体显微镜观察发现(图1), 大多数的肝癌患者出现ROTS块的增大, 部分内部可见到特异性的透明小体及程度不同的刺突样改变. 在28例肝癌患者中, 有20例出现ROTS块增大, 以透明小体及刺突样改变为阳性标志, 有15例患者出现上述改变, 阳性率为53.6%. 在43例肝硬化患者中, 有8例患者出现上述改变, 但程度较轻, 阳性率为18.6%. χ2检验肝癌患者阳性率显著高于肝硬化患者(P = 0.0038). 在以透明小体及刺突状改变判定为阴性的36例肝硬化患者手指血滴片中, 尚有8例患者出现单纯的ROTS块增大的改变, 虽未出现肝癌的特征性改变, 但与正常人和其他肿瘤患者手指血图像不同. 观察其他癌症患者, 仅少数病例手指血滴片出现ROTS块增大外, 均未见内部透明小体及刺突样改变.
手指血ROTS呈现阳性异常改变的肝癌和肝硬化患者血清SA的含量均高于相应的未改变患者, 但除肝硬化患者统计学检验显示显著性差异外(P<0.05), 肝癌患者未见显著性差异(P>0.05). ROTS改变阳性和阴性的患者中, 肝癌患者SA的含量显著高于肝硬化患者(P<0.05; P<0.01)(表1).
手指血ROTS呈现阳性异常改变的肝癌和肝硬化患者血清AFP的含量均低于相应的ROTS改变阴性患者(表1), 其中ROTS呈现阳性改变的肝硬化患者低于ROTS阴性患者(P<0.05), 而肝癌患者差异尚未达到统计学标准(P>0.05). ROTS改变阳性和阴性的患者中, 肝癌患者AFP的含量均显著高于肝硬化患者(P<0.05, P<0.01).
分别对8例ROTS阳性和35例ROTS阴性的肝硬化患者肝功能情况及年龄、转氨酶水平和肝功能Child-Pugh评分进行统计学分析, 结果显示ROTS阳性改变与患者年龄、转氨酶水平及肝功能Child-Pugh评分均无显著性差异(P = 0.8, 0.18, 0.26).
HCC是世界上最常见的五种恶性肿瘤之一, 不仅在我国具有较高的发病率, 在西方国家近年来发病率也在逐年上升, 其5年的累积生存率不足10%, 严重的威胁着人类健康[4]. 由于肝癌发病比较隐匿, 早期常常没有明显的临床症状, 及至出现症状并被诊断, 多数已至晚期, 而此时一些有效的治疗方法如手术、介入治疗及化疗等均不能奏效, 因此多数患者预后极差, 早期发现肝癌并及时采取有效治疗措施可以使肝癌治疗效果大大改善[5-8].
肝硬化的自然病程中, 肝癌每年的发病率为3%-10%, 因此肝硬化患者是肝癌发生的高危人群. 长期以来围绕肝癌的早期诊断研究人员进行了大量的工作, 并取得了一系列的进展, 其中尽早确立高危人群, 通过血清标志物和影像学如B超的定期检查是实现肝癌早期诊断的重要手段[9-12]. 但是血清学标志物的检测常常受到检测灵敏性、特异性和患者肝脏肿瘤的大小及同时存在的炎症状况的影响[13]. 超声波虽然是一种有效的检测手段, 由于方法的改进, 可使近76%的患者在肝癌的早期阶段得以确诊, 但超声波诊断本身缺乏特异性, 即使配合血清AFP的检测, 仍会造成漏诊和误诊, 因此在肝硬化患者肝癌的筛查过程中, 需要一种更敏感、更特异的诊断手段[14-16].
生理情况下, 在细胞生物氧化呼吸链电子传递过程中可以产生超氧离子(O2-•), 体内其他物质代谢(如黄嘌呤)氧化也产生O2-•, O2-•可以进一步生成H2O2和羟基自由基(•OH), 统称为活性氧类(reactive oxygen species, ROS), ROS化学性质活泼, 既可与细胞DNA、蛋白质、脂质和细胞膜作用, 引起细胞毒或者突变性损伤, 又可使磷脂分子中不饱和脂肪酸生成过氧化脂质对细胞膜产生损伤作用, 由此构成各种疾病发生的病理生理基础[17-18].
正常情况下产生的ROS可分别被细胞液中以Cu2+和Zn2+为辅基的超氧化物歧化酶(superoxide dismutase, SOD)及线粒体内以Mn2+为辅基的SOD分解, 生成的H2O2可进一步被活性更强的过氧化氢酶分解, 从而使正常机体免受ROS的破坏[19]. Valgimigli et al[20]通过对102例肝脏活检标本应用电子顺磁共振法(electron paramagnetic resonance, EPR)的测定, 结果发现肝病患者肝组织内ROS含量显著高于正常肝组织, 分别为5×10-6 mol/g和3×10-11 mol/g, 进一步观察发现ROS的含量在慢性肝炎中与炎症活动有关, 与肝细胞的增殖率、脂肪变性及转氨酶的水平无明显相关性. 分析慢性肝病患者自由基产生显著增多原因, 一方面可能与慢性肝病患者肝脏功能的下降, 使生理状态下, 在肝脏、中性粒细胞和小肠黏膜细胞中大量存在的与ROS代谢密切相关的过氧化氢酶及过氧化物酶活性下降有关, 另一方面肝病患者肝脏血液循环障碍导致细胞生物氧化不良, 从而导致大量ROS的产生[21].
近年来研究发现, ROS在细胞内信号传导过程中具有重要的作用, 与细胞的许多生命活动有关, 其中肝病患者大量产生的ROS与肝癌的发生关系密切, Liu et al[22]体外研究发现, 应用H2O2(1-10 mmol/L)对细胞进行处理, 或者细胞转化超氧化物岐化酶的反义核苷酸, 能够显著促进7721株人肝癌细胞的增殖. 进一步研究发现活性氧促进肿瘤细胞增殖的作用是通过蛋白激酶B(PKB)通路, 调控c-fos和c-jun基因的表达, 因而与肝癌的发生有关, 有可能为肝癌发生的研究提供一个新的途径.
全身各系统新陈代谢失调和机体在应激状态下或者疾病状态下均可能造成大量ROS的产生, 根据美国Brodford[1]理论, 血液中大量的ROS与血细胞相互作用, 在干血滴显微镜下可以观察到多形态白色的区域, 称为ROTS. 多媒体显微镜下通过对ROTS块形态、大小及其内含物的观察可以为临床疾病的诊断提供有益的线索. 有关手指血ROTS在肝癌诊断中的应用目前尚未见相关正式报道, 本研究应用自由基学说的理论, 受多媒体显微诊断仪及Bradford理论的启发, 在初步实验的基础上对肝硬化和肝癌患者的手指血镜下ROTS的形状进行了观察, 结果在大多数的肝癌患者发现ROTS块的增大, 内部可见到特异性的透明小体及程度不同的刺突样改变, 以透明小体及刺突样改变为阳性标志, 28例肝癌患者中, 有15例出现上述改变, 阳性率为53.6%, 观察43例肝硬化患者, 有8例出现程度较轻的上述改变, 假阳性率为18.6%. 另外尚有8例肝硬化患者仅出现ROTS块面积的增大, 但未出现上述特征性改变. 同时观察直肠癌5例、胃癌5例、贲门癌3例、壶腹周围癌1例、食管癌 10例、肺癌10例、宫颈癌3例、胰癌 1例, 除观察到少数病例手指血滴片出现ROTS块增大外, 均未见内部透明小体及刺突样改变, 证明上述改变具有一定程度的特异性.
有资料介绍肝癌患者手指血干血滴滴片中所见到的透明小体为SA颗粒, SA是神经氨酸的酰基化合物, 在哺乳动物体内广泛分布, 作为细胞膜糖蛋白与糖脂糖基链非还原末端的主要成分, 研究显示恶性肿瘤细胞表面的糖蛋白和糖脂存在唾液酸含量的变化, 肿瘤细胞表面糖蛋白和糖脂中糖基成分的变化与恶性肿瘤细胞-细胞间识别、细胞黏附、抗原性和亲袭性等特点有关[23]. 已经发现血清SA在包括恶性黑色素瘤[24]、结肠癌[25]、口腔癌[26]等多种肿瘤患者中升高, 并以晚期肿瘤含量最高. 由于本研究前期工作已经证实肝癌患者血清SA含量明显升高, 如果镜下所见透明小体确实为SA形成, 可以解释肝癌患者ROTS块中透明小体出现的现象[8]. 基于上述思考, 为探讨肝癌患者ROTS形态出现特异性改变的原因, 本研究对ROTS阳性和阴性的肝癌患者及肝硬化患者分别进行了血清唾液酸和血清AFP的测定, 结果显示ROTS阳性与肝癌和肝硬化患者SA水平的升高有关, 肝癌患者和肝硬化患者均显示较高的SA水平, 其中肝硬化患者差别最明显(P<0.01), 此结论支持上述关于ROTS区透明小体为SA珠的观点; 而ROTS阳性与肝癌和肝硬化患者AFP水平下降有关, 其具体原因有待进一步研究. 为探讨引起ROTS形态改变的其他原因, 我们对ROTS阳性和阴性的肝癌和肝硬化患者的年龄、血清转氨酶水平及肝功能Child-Pugh评分进行了比较, 结果均未发现有显著性差异.
总之, 应用多媒体显微镜观察患者手指血干血滴片在肝癌患者中所见到的ROTS块的增大、刺突形成和透明小体的出现均有一定程度的肝癌特异性, 与肝癌患者血清SA含量的升高有关, 初步观察认为对肝癌的诊断具有一定的价值, 由于该方法简便、经济, 结果判断直观, 值得进一步研究和开发.
通过末梢血干血滴自由基轨迹诊断疾病起源于80年代美国学者Bradford自由基理论, 该理论认为人体全身各系统新陈代谢失调和机体应激状态下可以产生大量自由基, 自由基和体细胞相互作用, 在点滴干血片中镜下呈现白色多形性, 即活性氧毒性物(ROTS), 不同疾病ROTS大小、内含物的形态和颜色等特点不同. 根据此理论, 国内近年来已有多家公司生产出布氏显微镜, 并进行了一些诊断学方面的探索, 初步证明在诊断肿瘤、亚健康状态方面具有一定的价值.
本文初步发现肝癌患者与肝硬化患者ROTS的形态有一定的差别, 特别是在肝癌患者中发现ROTS块呈现刺突样改变具有一定的临床诊断意义.
文章对末梢血ROTS形态诊断肝癌的价值进行了初步研究, 有一定的科学性、创新性.
电编: 张焕兰 编辑:潘伯荣
| 2. | 顾 丽贞, 白 永泉, 王 彦云, 陈 朝, 段 绍谨. 克感利咽口服液对流感病毒感染诱导ROTS块形成和白细胞吞噬功能下降的调节-布氏显微镜在中药药理中的应用实例. 中国中医药科技. 2001;8:17-18. |
| 4. | Schurr R, Stolzel U, Schuppan D, Schwertner C, Steinberg J, Scherubl H. Increased incidence of hepatocellular and intrahepatic cholangiocellular cancer in the Northeast of Germany. Dtsch Med Wochenschr. 2006;131:1649-1655. [PubMed] |
| 5. | Bruix J, Hessheimer AJ, Forner A, Boix L, Vilana R, Llovet JM. New aspects of diagnosis and therapy of hepatocellular carcinoma. Oncogene. 2006;25:3848-3856. [PubMed] |
| 6. | Nakamura S, Nouso K, Sakaguchi K, Ito YM, Ohashi Y, Kobayashi Y, Toshikuni N, Tanaka H, Miyake Y, Matsumoto E. Sensitivity and Specificity of Des-Gamma-Carboxy Prothrombin for Diagnosis of Patients with Hepatocellular Carcinomas Varies According to Tumor Size. Am J Gastroenterol. 2006;. [PubMed] |
| 7. | 贾 克东, 石 淑仙, 阮 幼冰. 血清标志物在肝炎肝硬化患者中诊断肝癌的价值. 胃肠病学和肝病学杂志. 2004;13:58-62. |
| 9. | Wu GC, Zhou WP, Zhao YR, Guo SH, Wang ZY, Zou SB, Zhang QH, Ren H, Huang AL, Zhang DF. The natural history of chronic hepatitis B: a retrospective study. Hepatobiliary Pancreat Dis Int. 2003;2:566-570. [PubMed] |
| 10. | Kim YS, Um SH, Ryu HS, Lee JB, Lee JW, Park DK, Kim YS, Jin YT, Chun HJ, Lee HS. The prognosis of liver cirrhosis in recent years in Korea. J Korean Med Sci. 2003;18:833-841. [PubMed] |
| 11. | Miyazawa K, Moriyama M, Mikuni M, Matsumura H, Aoki H, Shimizu T, Yamagami H, Kaneko M, Shioda A, Tanaka N. Analysis of background factors and evaluation of a population at high risk of hepatocellular carcinoma. Intervirology. 2003;46:150-156. [PubMed] |
| 14. | Chen TH, Chen CJ, Yen MF, Lu SN, Sun CA, Huang GT, Yang PM, Lee HS, Duffy SW. Ultrasound screening and risk factors for death from hepatocellular carcinoma in a high risk group in Taiwan. Int J Cancer. 2002;98:257-261. [PubMed] |
| 15. | Giannini EG. Review: MRI is more sensitive but less specific than ultrasonography or spiral CT for diagnosis of hepatocellular carcinoma. ACP J Club. 2006;145:21. [PubMed] |
| 16. | Bhosale P, Szklaruk J, Silverman PM. Current staging of hepatocellular carcinoma: imaging implications. Cancer Imaging. 2006;6:83-94. [PubMed] |
| 17. | Joseph JW, Koshkin V, Saleh MC, Sivitz WI, Zhang CY, Lowell BB, Chan CB, Wheeler MB. Free fatty acid-induced beta-cell defects are dependent on uncoupling protein 2 expression. J Biol Chem. 2004;279:51049-51056. [PubMed] |
| 18. | Tao F, Gonzalez-Flecha B, Kobzik L. Reactive oxygen species in pulmonary inflammation by ambient particulates. Free Radic Biol Med. 2003;35:327-340. [PubMed] |
| 19. | Parlakpinar H, Tasdemir S, Polat A, Bay-Karabulut A, Vardi N, Ucar M, Acet A. Protective role of caffeic acid phenethyl ester (cape) on gentamicin-induced acute renal toxicity in rats. Toxicology. 2005;207:169-177. [PubMed] |
| 20. | Valgimigli M, Valgimigli L, Trere D, Gaiani S, Pedulli GF, Gramantieri L, Bolondi L. Oxidative stress EPR measurement in human liver by radical-probe technique. Correlation with etiology, histology and cell proliferation. Free Radic Res. 2002;36:939-948. [PubMed] |
| 21. | Jessup JM, Battle P, Waller H, Edmiston KH, Stolz DB, Watkins SC, Locker J, Skena K. Reactive nitrogen and oxygen radicals formed during hepatic ischemia-reperfusion kill weakly metastatic colorectal cancer cells. Cancer Res. 1999;59:1825-1829. [PubMed] |
| 22. | Liu SL, Lin X, Shi DY, Cheng J, Wu CQ, Zhang YD. Reactive oxygen species stimulated human hepatoma cell proliferation via cross-talk between PI3-K/PKB and JNK signaling pathways. Arch Biochem Biophys. 2002;406:173-182. [PubMed] |
| 23. | Akcay F, Taysi S, Uslu C, Dogru Y, Gumustekin K. Levels of soluble intercellular adhesion molecule-1 and total sialic acid in serum of patients with laryngeal cancer. Jpn J Clin Oncol. 2001;31:584-588. [PubMed] |
| 24. | Ros-Bullon MR, Sanchez-Pedreno P, Martinez-Liarte JH. Serum sialic acid in malignant melanoma patients: an ROC curve analysis. Anticancer Res. 1999;19:3619-3622. [PubMed] |
| 25. | Sebzda T, Saleh Y, Gburek J, Warwas M, Andrzejak R, Siewinski M, Rudnicki J. Total and lipid-bound plasma sialic acid as diagnostic markers in colorectal cancer patients: correlation with cathepsin B expression in progression to Dukes stage. J Exp Ther Oncol. 2006;5:223-229. [PubMed] |
| 26. | Rajpura KB, Patel PS, Chawda JG, Shah RM. Clinical significance of total and lipid bound sialic acid levels in oral pre-cancerous conditions and oral cancer. J Oral Pathol Med. 2005;34:263-267. [PubMed] |