修回日期: 2006-06-12
接受日期: 2006-06-14
在线出版日期: 2006-08-28
目的: 探讨西咪替丁对大鼠非乙醇性脂肪性肝炎(nonalcoholic steatohepatitis, NASH)的治疗作用及其可能的作用机制.
方法: 将30只♂SD大鼠随机分为对照组(n = 10)、模型组(n = 10)和治疗组(n = 10), 模型组和治疗组给予高脂饮食喂养, 治疗组给予西咪替丁200 mg/(kg•d)灌胃, 12 wk后处死大鼠取血测定ALT、AST、血糖、胰岛素和透明质酸含量, 观察肝脏组织学变化并测定肝组织CYP450及CYP2E1含量. 光镜下观察肝组织病理学变化, 进行肝组织炎症活动计分.
结果: 与对照组比较, 模型组大鼠ALT、AST、血糖、胰岛素和透明质酸水平以及CYP450和CYP2E1含量升高, 而治疗组ALT (t = 5.16, P<0.05), AST (t = 5.45, P<0.05), CYP450 (t = 3.91, P<0.05), CYP2E1 (t = 1.95, P<0.05), 肝湿质量(t = 9.24, P<0.05)及透明质酸(T = 55, P<0.05)均显著低于模型组, 治疗组肝组织炎症活动度计分显著低于模型组(6.40±5.85 vs 7.80±4.60, t = 2.59, P<0.05), 血糖、胰岛素与模型组比较无显著差异(P>0.05).
结论: 西咪替丁能显著减轻NASH大鼠肝脏功能及形态损伤, 可能是通过抑制肝细胞微粒体CYP450和CYP2E1的表达发挥作用.
引文著录: 闻勤生, 徐辉, 王旭霞, 常青, 张亚飞, 李军. 西咪替丁治疗大鼠非乙醇性脂肪性肝炎. 世界华人消化杂志 2006; 14(24): 2377-2381
Revised: June 12, 2006
Accepted: June 14, 2006
Published online: August 28, 2006
AIM: To investigate the efficacy and mechanism of cimetidine in the treatment of rat nonalcoholic steatohepatitis (NASH).
METHODS: Thirty male Sprague Dawley rats were randomly and averagely divided into group A, B and C. High-fat diet was given to the rats in group A and B to induce NASH model, and those in group C served as normal controls. Moreover, the rats in group B were intragastrically treated with cimetidine (200 mg/d) for 12 wk. The levels of cytochrome P450 (CYP450), CYP2E1 and the damages of liver tissues, as well as the level changes of alanine aminotransferase (ALT), aspartate aminotransferase (AST), blood glucose, insulin, and hyaluronic acid (HA) were measured. The pathological changes of liver tissues were observed under light microscope.
RESULTS: After modeling, the serum levels of ALT, AST, blood glucose, insulin, and HA, and the tissue contents of CYP450 and CYP2E1 were elevated. However, after cimetidine treatment, the levels of ALT (t = 5.16, P < 0.05), AST (t = 5.45, P < 0.05), and HA (T = 55, P < 0.05), the contents of CYP450 (t = 3.91, P < 0.05) and CYP2E1 (t = 1.95, P < 0.05), and the wet weight of liver (t = 9.24, P < 0.05), as well as the histological activity index (6.40 ± 5.85 vs 7.80 ± 4.60, t = 2.59, P < 0.05) were decreased significantly. The serum levels of blood glucose and insulin were not significantly different between group A and B (P > 0.05).
CONCLUSION: Cimetidine can lessen the damages of hepatocytes through inhibiting the expression of CYP450 and CYP2E1.
- Citation: Wen QS, Xu H, Wang XX, Chang Q, Zhang YF, Li J. Experimental study on cimetidine in treatment of nonalcoholic steatohepatitis in rats. Shijie Huaren Xiaohua Zazhi 2006; 14(24): 2377-2381
- URL: https://www.wjgnet.com/1009-3079/full/v14/i24/2377.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i24.2377
非乙醇性脂肪性肝炎(nonalcoholic steatohepa-titis, NASH)具有隐匿地向肝纤维化、肝硬化发展的特点[1-5], 目前对于NASH尚无明确有效的治疗方法. 有学者研究发现, NASH动物肝组织内细胞色素P450 (CYP450)和其同功酶CYP2E1明显升高, 认为CYP450及CYP2E1与NASH发病有一定关系[6-11]. 另有研究发现, H2受体拮抗剂西咪替丁具有抑制CYP450及CYP2E1生成的功能[12-14]. 为此, 我们制备NASH动物模型, 观察西咪替丁对NASH的干预作用并探讨其作用机制.
健康♂成年SD大鼠30只, 体质量200±20 g, 由第四军医大学动物中心提供. 高脂饲料配方: 猪油10%, 胆固醇2%, 基础饲料88%. 西咪替丁由山东方明药业股份有限公司生产. 透明质酸(hyaluronic acid, HA)放射免疫分析试剂盒购自上海海研医学生物技术中心, 胰岛素放射免疫分析试剂盒购自华西糖尿病科技开发研究所. FJ-2008PS型g放免计数仪, 西安核仪器厂生产. 日立SBA-300型全自动生化分析仪.
1.2.1 动物模型制备: SD大鼠30只, 随机分为3组, 每组10只, 对照组给予正常饮食喂养, 模型组和治疗组每只大鼠每天给予25 g高脂饲料喂养, 其余以普通饲料补足, 模型组给予生理盐水灌胃, 治疗组给予200 mg/(kg•d)西咪替丁灌胃, 每日1次, 实验时间共为12 wk. 期间动物自由饮水, 饲养于20 ℃±2 ℃明暗各12 h的清洁级动物的实验室. 12 wk末前夜禁食, 麻醉状态下断头取血处死大鼠, 称取大鼠体质量、肝湿质量, 常规制作血清标本和肝脏标本, 保存于-70 ℃冰箱内待测.
1.2.2 血清标本各指标及CYP450和CYP2E1检测: 用日立SBA-300型全自动生化分析仪测定ALT, AST和血糖. HA及血清胰岛素含量测定按试剂盒说明操作, 使用FJ-2008PS型g计数仪进行测定. CYP450及CYP2E1测定按文献[15]所示方法操作.
1.2.3 病理学观察: 40 g/L甲醛溶液固定肝标本, 石蜡切片进行HE染色, 光镜下评估肝脂肪变性和炎症活动情况. 炎症活动度计分标准参考1981年Knodell et al[16]提出的慢性肝炎组织学活动指数(HAI), 并结合王泰龄et al[17]提出的慢性肝炎炎症活动计分方案, 分为汇管区炎症(P)、小叶内炎症(L)、碎片状坏死(PN)及桥接坏死(BN)4项, 每项依病变程度分别计为1, 2, 3, 4分, 因为BN, PN的严重度与预后直接相关, 故其计分2倍于其他病变, 计分公式为P+L+2 (PN+BN, 表1).
| 计分 | 汇管区炎症(P) | 小叶内炎症(L) | 碎片状坏死(PN) | 桥接坏死(BN) |
| 0 | 无 | 无 | 无 | 无 |
| 1 | 部分汇管区少量炎细胞浸润 | 变性及少数点状坏死 | 局限PN | 偶见BN |
| 2 | 介于1-3之间 | 介于1-3之间 | 介于1-3之间 | 介于1-3之间 |
| 3 | 多数汇管区较多炎细胞浸润 | 多数坏死灶 | 多数汇管区PN达周长50% | 少数BN |
| 4 | 汇管区扩大, 炎细胞集聚, 淋巴滤泡形成 | 坏死灶融合成片 | PN广泛大于周长50%达小叶中带 | BN范围广, 小叶结构失常或多小叶坏死 |
统计学处理 采用SPSS 10.0统计软件处理, 实验数据以mean±SD表示, 组间比较采用t检验, HA比较采用等级资料的Wilcoxon法检验, P<0.05为差别有统计学意义.
模型组大鼠体质量、肝湿质量明显增加, 符合脂肪肝表现, 与对照组相比有显著差异(t体质量 = 29.07, t肝湿质量 = 20.11, P<0.05). 治疗组给予西咪替丁后显著降低了大鼠肝湿质量的增长速度, 肝湿质量值显著低于模型组(t肝湿质量 = 9.24, P<0.05). 与模型组比较, 治疗组血清ALT, AST均显著低于模型组(tALT = 5.16, tAsT = 5.45, P<0.05). 与对照组比较, 模型组血糖、胰岛素均明显升高, 模型组与治疗组的血糖、胰岛素水平无显著差异(t胰岛素 = 0.43, t血糖 = 0.12, P>0.05)(表2). 与对照组比较, 模型组大鼠CYP450及CYP2E1显著升高(tcyp450 = 6.24, tCYP2E1 = 1.79, P<0.05), 经西咪替丁治疗后, CYP450及CYP2E1含量显著低于模型组(tcyp450 = 3.91, tCYP2E1 = 1.95, P<0.05), 但仍高于对照组(表3).
将HA测定值从小到大分为5级, 数值在400-500间的为"-", 500-600间的为"+", 600-700间的为"++", 700-800间的为"+++", >800的为"++++", g = 10-1 = 9, 采用等级资料处理方法, 用SPSS 10.0软件计算, 与对照组比较, 模型组HA含量显著升高(P<0.05), 治疗组HA含量较模型组降低(Wilcoxon符号秩检验, T = 55, P<0.05)(表4).
| HA含量 | 对照组 | 模型组 | 治疗组 |
| - | 7 | 0 | 0 |
| + | 3 | 0 | 0 |
| ++ | 0 | 0 | 1 |
| +++ | 0 | 0 | 3 |
| ++++ | 0 | 10 | 6 |
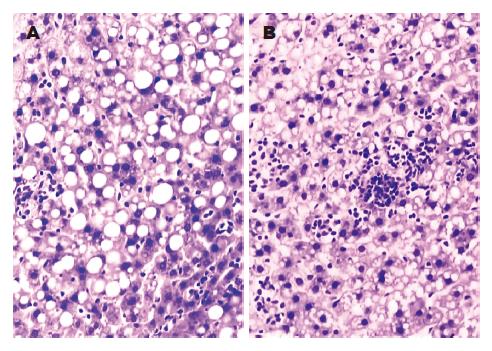
模型组大鼠肝脏明显肿大, 表面不光滑, 包膜紧张, 边缘圆钝, 颜色奶黄色, 切面油腻. 治疗组大鼠肝脏肿大, 表面尚光滑, 包膜紧张, 边缘圆钝, 颜色奶黄色, 切面油腻. 对照组肝脏无肿大, 表面光滑, 颜色紫红色. 在光镜下, 治疗组与模型组均出现明显的肝细胞脂肪变性, 几乎所有肝细胞内都有明显的脂肪滴, 数量上无明显差别, 但治疗组肝细胞内脂滴体积明显小于模型组. 模型组所有大鼠肝组织均出现程度不同的弥漫性肝细胞气球样变, 肝细胞极度肿胀呈圆形, 体积较正常明显增加, 胞质疏松呈网状、透明, 肝窦狭窄. 100%存在小叶内炎症, 90%(9/10)出现汇管区炎症, 还有点状坏死, 并有2例出现碎片状坏死, 肝组织炎症细胞浸润以单核细胞为主, 并伴中性粒细胞浸润. 治疗组大鼠几乎所有肝细胞内都有明显脂滴, 数量上无明显差别, 但肝细胞体积正常, 胞质未见疏松化改变(图1). 治疗组(6.40±5.85)和模型组(7.80±4.60)炎症计分均高于对照组(0.33±0.10), 治疗组计分显著低于模型组(t =2.59, P<0.05).
关于NASH的发病机制, 目前被大多数学者认可的是"二次打击学说"[18-20]. 第一次打击指正常肝脏变成脂肪肝, 这主要是胰岛素抵抗的结果. 肥胖、糖尿病、高胰岛素血症和高脂血症等代谢综合征几乎普遍存在胰岛素抵抗现象. 具体表现为肝摄取游离脂肪酸增加、外周脂肪动员增强、肝细胞脂肪转运出肝能力受损, 结果引起肝细胞内脂肪堆积. 第二次打击即氧应激、脂质过氧化及由此诱导的活性氧产物增加和线粒体功能不全, 使单纯性脂肪肝向NASH、肝纤维化发展. 本实验成功地制备了NASH动物模型. 结果表明, 模型组血糖及胰岛素水平均高于对照组, 提示存在胰岛素抵抗, 模型组的ALT, AST, HA及炎症计分均显著高于对照组, 表明发生了肝组织损伤及纤维化.
肝CYP450系统是定位于胞质滑面内质网上的一组混合功能氧化酶系, 他与进入体内的外源性物质代谢有关. 人类中确定的CYP450同功酶有20多种, CYP2E1是最主要的同功酶, 是微粒体中脂质过氧化的主要催化剂, 许多外源性物质既是CYP2E1的诱导剂, 也是其作用的底物. 随着CYP2E1的表达增强, 脂质过氧化反应的终产物丙二醛的含量亦随之升高. 在正常情况下, 细胞内存在着自由基清除剂即抗氧化剂, 如超氧化物歧化酶、谷胱甘肽、维生素E等, 他们均是细胞内重要的自由基清除剂, 可以随时清除不断生成的有害自由基, 阻断自由基的链式放大反应, 从而起到保护细胞的作用[21-24]. 但是, 一旦氧化抗氧化机制失去平衡, 则对机体产生不利的影响. 因此, 测定CYP450及CYP2E1水平可反映机体内脂质过氧化的程度, 间接反映肝细胞损伤程度. 本研究结果表明, 模型组的CYP450及CYP2E1均显著高于对照组, 提示可能与肝功能与肝组织结构损害有关.
西咪替丁是一种H2受体拮抗剂, 在临床上被广泛用于治疗胃酸分泌过多的相关疾病. 有研究发现他能够抑制CYP450及CYP2E1表达, 但未见有关西咪替丁防治NASH的临床及实验研究报道. 本研究观察到, 应用西咪替丁后, 虽然治疗组大鼠的体质量、空腹血糖及胰岛素与模型组相比无显著差异, 但治疗组的肝湿质量、ALT、AST、HA、CYP450、CYP2E1及肝组织炎症计分均显著低于模型组, 表明西咪替丁对高脂饮食引起的肝功能及肝组织损害有一定防护作用, 可能与抑制CYP450及CYP2E1的表达有关, 但治疗组的肝湿质量、HA、CYP450、CYP2E1及肝组织炎症计分仍显著高于对照组, 提示NASH的发病机制是复杂的.
随着人们生活水平的提高, NASH的发病率会逐渐增高, 因此需要加强对NASH发病机制及防治的研究. 西咪替丁价格低廉, 使用方便, 可作为NASH的防治方法之一, 但需进一步研究其作用机制, 亦需注意观察西咪替丁本身对肝脏的毒副作用. 此外, 合用降脂药物及抗氧化药物(如维生素E)是否会增强西咪替丁疗效还需进一步深入研究.
NASH是临床常见病, 发病机制尚未完全明确, 亦缺乏有效的防治方法. 有研究发现, NASH肝脏CYP450及其主要同功酶CYP2E1增高, 可能与NASH发病有关. 另有研究发现, 西咪替丁具有抑制CYP450及CYP2E1表达的作用.
本研究制备NASH动物模型, 从肝脏功能及形态学等方 面 和肝组织CYP450及CYP2E1含量变化等方面观察西咪替丁对NASH的干预作用, 国内外未见类似报道.
西咪替丁对高脂饮食引起的肝功能及肝组织损害有一定防护作用, 但仍需深入研究, 进一步探讨西咪替丁防治NASH的作用机制. 西咪替丁价格低廉, 应用方便, 可试用于临床.
西咪替丁已试用于治疗乙醇性肝病, 疗效尚在评估之中. 该药是否对非乙醇性脂肪性肝炎也有效, 尚未有这方面的报道.本文内容尚重要, 信息尚充足, 有一定的新颖性.
电编: 张敏 编辑:潘伯荣
| 1. | Poordad FF. Nonalcoholic fatty liver disease: a review. Expert Opin Emerg Drugs. 2005;10:661-670. [PubMed] |
| 2. | Kunde SS, Lazenby AJ, Clements RH, Abrams GA. Spectrum of NAFLD and diagnostic implications of the proposed new normal range for serum ALT in obese women. Hepatology. 2005;42:650-656. [PubMed] |
| 3. | Marchesini G, Marzocchi R, Agostini F, Bugianesi E. Nonalcoholic fatty liver disease and the metabolic syndrome. Curr Opin Lipidol. 2005;16:421-427. [PubMed] |
| 4. | Villanova N, Moscatiello S, Ramilli S, Bugianesi E, Magalotti D, Vanni E, Zoli M, Marchesini G. Endothelial dysfunction and cardiovascular risk profile in nonalcoholic fatty liver disease. Hepatology. 2005;42:473-480. [PubMed] |
| 5. | Feldstein AE, Gores GJ. Apoptosis in alcoholic and nonalcoholic steatohepatitis. Front Biosci. 2005;10:3093-3099. [PubMed] |
| 6. | Emery MG, Fisher JM, Chien JY, Kharasch ED, Dellinger EP, Kowdley KV, Thummel KE. CYP2E1 activity before and after weight loss in morbidly obese subjects with nonalcoholic fatty liver disease. Hepatology. 2003;38:428-435. [PubMed] |
| 7. | Chalasani N, Gorski JC, Asghar MS, Asghar A, Foresman B, Hall SD, Crabb DW. Hepatic cytochro-me P450 2E1 activity in nondiabetic patients with nonalcoholic steatohepatitis. Hepatology. 2003;37:544-550. [PubMed] |
| 8. | Robertson G, Leclercq I, Farrell GC. Nonalcoholic steatosis and steatohepatitis. II. Cytochrome P-450 enzymes and oxidative stress. Am J Physiol Gastrointest Liver Physiol. 2001;281:G1135-1139. [PubMed] |
| 9. | Lieber CS, Leo MA, Mak KM, Xu Y, Cao Q, Ren C, Ponomarenko A, DeCarli LM. Model of nonalcoho-lic steatohepatitis. Am J Clin Nutr. 2004;79:502-509. [PubMed] |
| 10. | Lieber CS, Leo MA, Mak KM, Xu Y, Cao Q, Ren C, Ponomarenko A, DeCarli LM. Acarbose attenuates experimental non-alcoholic steatohepatitis. Biochem Biophys Res Commun. 2004;315:699-703. [PubMed] |
| 11. | Feher J, Lengyel G. A new approach to drug therapy in non-alcoholic steatohepatitis (NASH). J Int Med Res. 2003;31:537-551. [PubMed] |
| 12. | Park EJ, Cho HY, Lee YB. Effect of Cimetidine and Phenobarbital on metabolite kinetics of Omeprazole in rats. Arch Pharm Res. 2005;28:1196-1202. [PubMed] |
| 13. | Peng FC, Chen PC, Jeng YJ, Edwards RJ. Metaboli-sm of territrem B and C in liver microsomes from 14-wk-old Wistar rats is catalyzed by cytochrome P-450 3A. J Toxicol Environ Health A. 2005;68:299-314. [PubMed] |
| 14. | Strakowski SM, Keck PE Jr, Wong YW, Thyrum PT, Yeh C. The effect of multiple doses of cimetidine on the steady-state pharmacokinetics of quetiapine in men with selected psychotic disorders. J Clin Psychopharmacol. 2002;22:201-205. [PubMed] |
| 15. | 朱 曼, 王 睿, 张 永青, 梁 蓓蓓. 大鼠肝微粒体细胞色素P450酶系检测方法学研究. 中国临床药理学与治疗学. 2004;9:500-503. |
| 16. | Knodell RG, Ishak KG, Black WC, Chen TS, Craig R, Kaplowitz N, Kiernan TW, Wollman J. Formulation and application of a numerical scoring system for assessing histological activity in asymptomatic chronic active hepatitis. Hepatology. 1981;1:431-435. [PubMed] |
| 18. | Chitturi S, Farrell GC. Etiopathogenesis of nonalco-holic steatohepatitis. Semin Liver Dis. 2001;21:27-41. [PubMed] |
| 19. | Leclercq IA, Farrell GC, Field J, Bell DR, Gonzalez FJ, Robertson GR. CYP2E1 and CYP4A as microsomal catalysts of lipid peroxides in murine nonalcoholic steatohepatitis. J Clin Invest. 2000;105:1067-1075. [PubMed] |
| 20. | Zou Y, Li J, Lu C, Wang J, Ge J, Huang Y, Zhang L, Wang Y. High-fat emulsion-induced rat model of nonalcoholic steatohepatitis. Life Sci. 2006;79:1100-1107. [PubMed] |
| 21. | Nobili V, Pastore A, Gaeta LM, Tozzi G, Compar-cola D, Sartorelli MR, Marcellini M, Bertini E, Piemonte F. Glutathione metabolism and antioxi-dant enzymes in patients affected by nonalcoholic steatohepatitis. Clin Chim Acta. 2005;355:105-111. [PubMed] |
| 22. | Laurent A, Nicco C, Tran Van Nhieu J, Borderie D, Chereau C, Conti F, Jaffray P, Soubrane O, Calmus Y, Weill B. Pivotal role of superoxide anion and beneficial effect of antioxidant molecules in murine steatohepatitis. Hepatology. 2004;39:1277-1285. [PubMed] |
| 23. | Oliveira CP, Faintuch J, Rascovski A, Furuya CK Jr, Bastos Mdo S, Matsuda M, Della Nina BI, Yahnosi K, Abdala DS, Vezozzo DC, Alves VA, Zilberstein B, Garrido AB Jr, Halpern A, Carrilho FJ, Gama-Rodrigues JJ. Lipid peroxidation in bariatric candi-dates with nonalcoholic fatty liver disease (NAFLD) - preliminary findings. Obes Surg. 2005;15:502-505. [PubMed] |
| 24. | Koruk M, Taysi S, Savas MC, Yilmaz O, Akcay F, Karakok M. Oxidative stress and enzymatic antioxidant status in patients with nonalcoholic steatohepatitis. Ann Clin Lab Sci. 2004;34:57-62. [PubMed] |