修回日期: 2006-05-22
接受日期: 2006-06-05
在线出版日期: 2006-07-28
目的: 建立人大肠癌多药耐药细胞株HCT-8/5-FU及并对其耐药机制进行探讨.
方法: 先采用较大剂量间歇诱导法进行筛选, 再采用浓度梯度递增法作用, 历时7 mo, 至HCT8细胞可长期在5-FU浓度为2.0 mg/L的细胞培养液中稳定生长. 电镜、HE染色观察2种细胞形态结构差异. 体外细胞毒性实验观察他对5-FU, ADM, DDP的耐药性. 绘制亲本细胞和耐药细胞的体外生长曲线. 罗丹明染色法检测其两种细胞P-gp功能表达.
结果: HCT-8细胞株经7 mo诱导, 可在5-FU 2.0 g/L的培养液中稳定增殖, 具有多药耐药性, 命名为HCT-8/5-FU, 该细胞株对5-FU的耐药指数为16.6, 并对ADM, DDP有交叉耐药性. 该细胞株体外群体倍增时间与亲本细胞差别不显著. HE染色观察耐药细胞胞体较亲本细胞大, 细胞核不规则, 可见双核、多形核, 细胞形态不规则, 呈多角形、细长形改变, 可见巨核细胞. 透射电镜下耐药细胞胞质内线粒体、内质网、溶酶体增多. 流式细胞仪罗丹明染色法观察荧光强度曲线左移, 提示耐药细胞有过度P-gp表达.
结论: 成功建立HCT-8/5-FU多药耐药细胞株. 先采用较大剂量间歇诱导进行筛选, 再采用浓度梯度递增法作用是诱导大肠癌耐药细胞株的较好方式. HCT-8/5-FU细胞株的耐药机制与P-糖蛋白表达有关.
引文著录: 布立民, 孙淑红, 华建平, 韩英, 赖靖, 鲍文漪. 人大肠癌HCT-8/5-FU耐药细胞株的建立及P-gp测定. 世界华人消化杂志 2006; 14(21): 2082-2086
Revised: May 22, 2006
Accepted: June 5, 2006
Published online: July 28, 2006
AIM: To develop HCT-8/5-fluorouracil multidrug resistant cell line and explore the mechanism its drug resistance.
METHODS: High concentration of 5-FU was used in the beginning to induce drug resistance of HCT-8 cell line, and thereafter, the concentration of 5-FU was increased in gradient. About 7 mo later, the cells could stably grow in 2.0 mg/L 5-FU, which was named HCT-8/5-FU multidrug resistant cell line. The resistant index of HCT-8/5-FU cells to 5-FU, adriamycin (ADM), and cisplatin (DDP) was examined with MTT assay, and growth curve was drawn. The morphological changes were observed by both light and electron microscopy. The function of P-glycoprotein (P-gp) was detected by flow cytometry using rhodamine staining.
RESULTS: The resistant index of HCT-8/5-FU cells to 5-FU is 16.6, and a cross-resistance to ADM and DDP was also noticed. In comparison with that of the parental cells, the growth rate of HCT-8/5-FU cells did not changed significantly, but the morphology of the cells was remarkably changed. Irregular nucleus, double nucleus and polymorphic nucleus appeared in HCT-8/5-FU cells, and the cells shaped as polygon-like and leptosomatic. The numbers of mitochondria, endoplasmic reticulum and lysosome were increased, and over-expression of P-gp was observed in HCT-8/5-FU cells.
CONCLUSION: HCT-8/5-FU multidrug resistant cell line is successfully developed. The drug-resistance mechanism of HCT-8/5-FU cell line may be related to the over-expression of P-gp.
- Citation: Bu LM, Sun SH, Hua JP, Han Y, Lai J, Bao WY. Preparation of HCT-8/5-fluorouracil multidrug resistant cell line and detection of P-glycoprotein. Shijie Huaren Xiaohua Zazhi 2006; 14(21): 2082-2086
- URL: https://www.wjgnet.com/1009-3079/full/v14/i21/2082.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i21.2082
随着国民生活水平的提高, 饮食结构的改变, 大肠癌的发病率正逐年升高, 其发病率仅次于胃癌、食道癌、肺癌等恶性肿瘤之后, 居第4-6位[1]. 近年来, 虽然现代外科学手术方法取得改进及非手术方法取得了一定进展, 但是对术后复发或转移尚缺乏有效手段. 肿瘤细胞耐药性限制了疗效提高[2-3]. 建立大肠癌耐药细胞株为临床研究肿瘤细胞多药耐药(MDR)机制提供了实验基础, 因此研究MDR机制和逆转MDR的方法是肿瘤临床亟待解决的问题[4-5]. 国内对人大肠癌多药耐药细胞株报道较少, 我们用5-氟尿嘧啶(5-fluorouracid, 5-FU)对人大肠癌细胞株HCT-8进行诱导, 建立大肠癌MDR细胞株, 并探讨其生物学特性, 为进一步寻找逆转剂的研究打好基础.
RPMI 1640为Gibco公司产品; 噻唑兰(MTT)、罗丹明123 (Rhodamine 123)、10 g/L锇酸溶液、环氧树脂等均为美国Sigma公司产品; 5-FU, 天津氨基酸公司产品; 顺铂(cisplatin, DDP), 阿毒素(adriamycin, ADM), 齐鲁制药厂产品. 大肠癌细胞株HCT-8由中国医学科学院药物研究所提供, 为大肠腺癌细胞, 在含100 mL/L胎牛血清的RPMI 1640培养液, 37℃, 50 mL/L CO2饱和湿度的细胞培养箱中培养.
细胞铺满瓶底约90%时, 先用50 mg/L 5-FU的培养液作用约24 h, 观察有70%细胞死亡时, 停止药物作用, PBS缓冲液冲洗2次, 此时瓶中仅有10%-20%细胞贴壁生长, 用含100 mL/L胎牛血清的RPMI 1640培养液培养, 约1 mo时, 细胞已铺满瓶底80%, 继续用含5-FU的培养液作用约24 h, 改用含胎牛血清的RPMI 1640培养液继续培养, 待细胞进入对数生长期时, 分瓶传代, 以梯度增加方式, 在5-FU终浓度为0.5, 1.0, 1.5, 2.0 g/L的RPMI 1640培养液中培养, 历时7 mo, 至HCT-8细胞可长期在2.0 g/L的5-FU培养液中稳定生长, 表明HCT-8/5-FU耐药细胞株建立. 取对数生长期HCT-8和HCT-8/5-FU细胞, 胰酶消化, 充分吹打悬浮, 接种于6孔培养板, 使每孔含细胞数为1×104, 每孔加培养液3 mL, 每株每24 h计数3孔, 取其均值, 共计数6 d, 绘制细胞生长曲线.
1.2.1 细胞形态学观察: 取6孔培养板先加入经高温蒸气消毒的盖玻片, 每孔3-4片, 与培养板底壁贴牢固定, 再加入细胞数为1×108/L的亲本HCT-8细胞和HCT-8/5-FU细胞悬液, 3 mL/孔. 待细胞呈对数生长期时, 取出盖玻片行HE染色后光学树脂封片并照相. 另取对数生长期的HCT-8亲本细胞和HCT-8/5-FU细胞各一瓶, 用细胞刮子轻轻刮下, 离心去上清, 细胞团块用25 g/L戊二醛前固定, 10 g/L锇酸后固定, 丙酮梯度脱水, 环氧树脂包埋, 切片机进行超薄切片, 用醋酸-铀双染色, TECNAI透射电镜观察并摄片.
1.2.2 耐药指数测定: 对数生长期的HCT-8细胞和HCT-8/5-FU细胞, 胰酶消化, 充分吹打成细胞悬液, 100 μL/孔接种于96孔板, 使每孔细胞数为1×104, 并设空白对照, 阴性对照, 于CO2孵箱中适应性培养24 h后, 加入稀释后的抗肿瘤药物(每种药物设5种浓度), 对照组加入等量的PBS溶液, 对照组及各浓度组均设4孔, 继续培养48 h. 快速翻转并弃去孔中液体, 在每孔中加入1 g/L的MTT 30 μL, 继续培养4 h, 小心吸去孔中上清液, 在每孔中加入DMSO 100 μL, 振荡培养板10 min, 使孔中沉淀完全溶解, 以490 nm为检测波长, 560 nm为参考波长, 测各孔吸光度值(A值), 以平均A值对药物浓度的对数作图, 从图上求出杀死半数细胞的药物浓度即ID50, 依据耐药细胞和亲本细胞对某一药物的ID50比值, 求得耐药指数, 耐药指数(RI) = ID50耐药细胞/ID50亲本细胞.
1.2.3 细胞内P-gp的检测: 亲本细胞和耐药细胞同时应用, 充分消化, 分散程度要高, 将培养细胞用RPMI 1640培养液漂洗1次, 制成2×109/L细胞悬液, 计数; 每管加入终浓度达5 g/L的罗丹明; 37℃保温30 min, 1500 r/min离心2 min, 去除培养液, 再用新培养液洗去细胞外的罗丹明染料; 在37℃保温10 min, 使P-gp糖蛋白功能得以发挥, 能把药物泵出; 再用RPMI 1640培养液洗1次, 异博定(10 g/L终浓度)终止泵出功能, 放在冰冷的新RPMI 1640培养液中待检测; 流式细胞仪用488 nm的激发光, 测试细胞荧光强度.
统计学处理 应用STATA 7.0软件进行统计学处理, 采用t检验, P<0.05为差异有显著性.
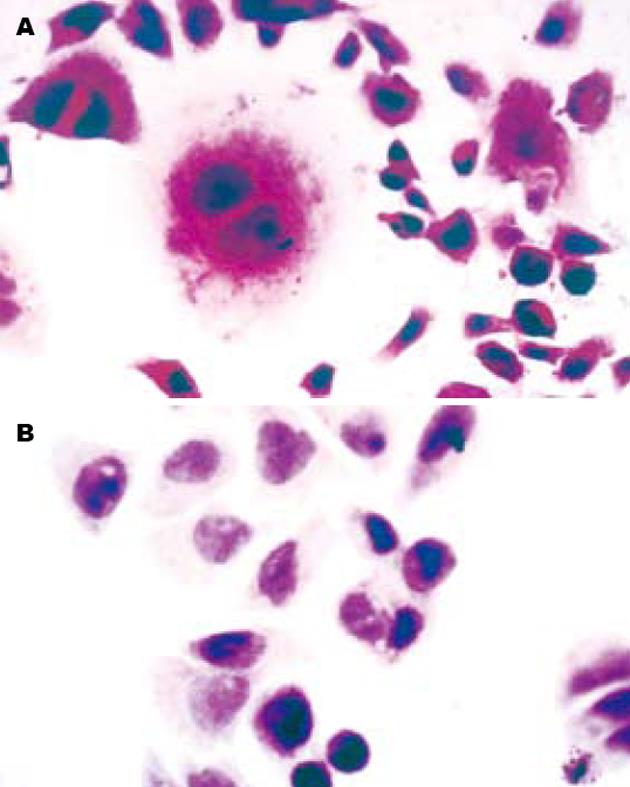
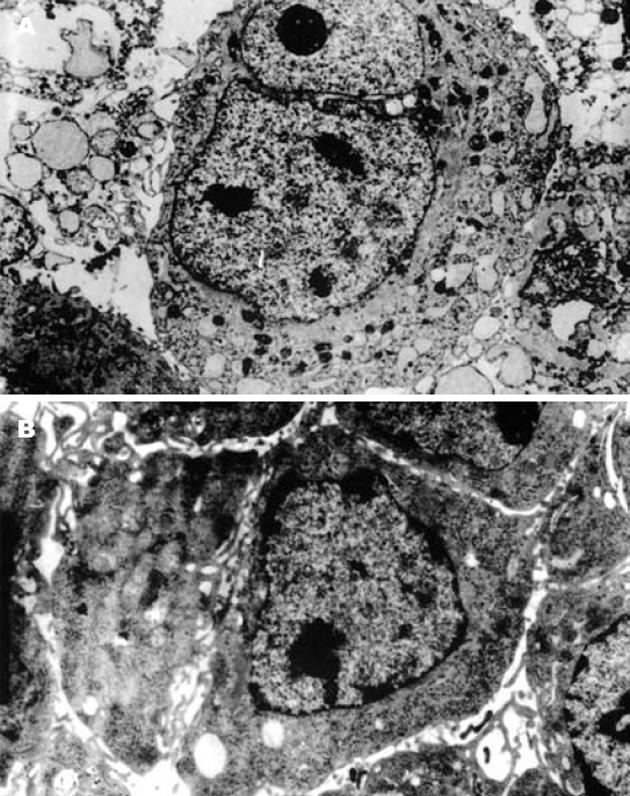
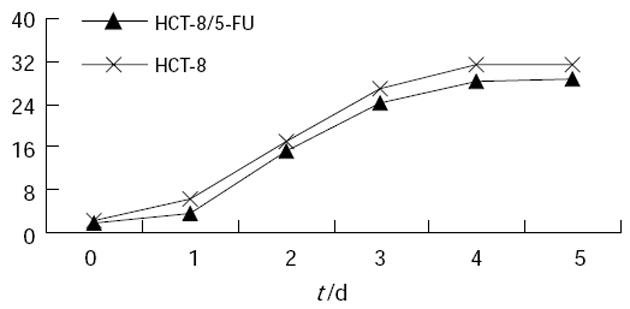
HE染色观察耐药细胞胞体较亲本细胞大, 细胞核不规则, 可见双核、多形核, 细胞形态不规则, 呈多角形、细长形改变, 可见巨核细胞. 而亲本细胞胞核相对较大, 胞质少, 细胞形态与耐药细胞相比较规则(图1). 透射电镜下可见两种细胞超微结构的差异, 与亲本细胞相比, 耐药细胞胞质内可见丰富线粒体及内质网, 部分内质网扩张为囊泡状, 部分耐药细胞胞质内可见大量溶酶体及酶性颗粒分泌、不规则空泡及脂滴(图2). 两株细胞在贴壁后第6天均达到对数生长期, 图3提示耐药细胞和亲本细胞体外增殖速度相似, 但倍增时间较亲本细胞延长.
HCT-8不但对5-FU产生耐药性, 而且对大肠癌的常用化疗药物ADM, DDP也产生一定程度的交叉耐药性(表1).
| HCT-8 | HCT-8/5-FU | 耐药指数 | |
| 5-FU | 0.40±0.02 | 7.14±0.46 | 16.6 |
| DDP | 1.20±0.67 | 4.72±0.23 | 3.93 |
| ADM | 0.83±0.02 | 5.21±0.13 | 6.26 |
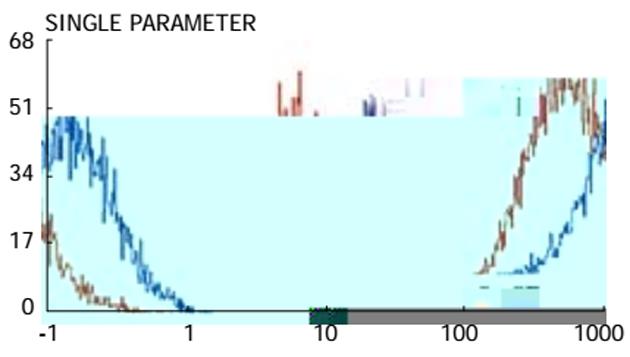
罗丹明的结构与众多抗癌药物的结构有许多相似之处, 可作为积累在细胞内的抗癌药物的代表. 他能有效地被P-gp蛋白排出胞外, 并且有强荧光性, 容易测定. 图4说明亲本细胞由于没有或很少P-gp蛋白, 不能将进入细胞中的罗丹明排出, 在细胞中积累大量罗丹明, 故荧光强度很大, 曲线右移; 而耐药细胞有P-gp过度表达, 使进入细胞的罗丹明有效地排出, 故荧光强度低, 曲线左移.
大肠癌是消化道常见恶性肿瘤之一, 早期诊断, 成功的根治性手术切除及手术为主的综合治疗是提高大肠癌患者治愈率的关键[6]. 但临床就诊时多数患者已是中晚期, 术后5年生存率一直徘徊在50%左右, 其主要原因之一是化疗的失败. 化疗失败的主要原因是肿瘤对分子结构不同、作用机制各异的抗肿瘤药物产生交叉耐药, 即MDR的产生[7-8]. 所以建立耐药细胞株, 通过对MDR发生机制的研究, 以指导临床医生选择合理的化疗方案和化疗药物具有重要意义. 肿瘤细胞与抗癌药物接触后, 不仅对其所用药物产生耐药性, 对其他结构和功能不同的药物也产生耐药性, 这种交叉耐药性通常与所用诱导药物的耐受程度呈正比[9-10]. 已往建立的耐药细胞系, 多采用逐步增加化疗药物浓度持续作用方式体外诱导, 或者恒定药物浓度周期作用方式获得. 前者所需时间较长, 一般为9-12 mo, 而恒定药物周期作用方式因浓度选择较困难, 浓度过高会使诱导失败, 而浓度较低, 细胞的耐药性不明显, 诱导周期较长, 均有一定不足[11-13]. 本实验先用恒定浓度的化疗药物短时间接触法, 筛选出对5-FU耐药性较强的细胞, 并在此基础上逐步增加化疗药物浓度持续作用, 在7 mo内成功诱导出HCT-8耐药细胞株, 命名为HCT-8/5-FU. 耐药细胞株对5-FU的相对耐受度提高了约16倍, 并对ADM, DDP也产生一定程度耐药. 与亲代细胞相比, 耐药细胞生长速度较慢, 倍增时间延长. 形态学上, 耐药细胞体积增大, 胞质空泡及颗粒增多, 不规则形态细胞增多. 电镜下观察两种细胞的超微结构, 可见耐药细胞胞质中有丰富内质网、线粒体, 部分线粒体扩张, 胞质内还可见到大量溶酶体及酶性颗粒分泌及不规则空泡及脂滴存在, 内质网增生及溶酶体与细胞的解毒功能、吞噬外来物质作用相关, 而线粒体增多与脂滴存在也提示细胞器功能增强, 提示随着HCT-8/5-FU细胞耐药性增强, 其生物学特性已发生变化. 已往的大肠癌耐药细胞株采用ADM, 丝裂霉素等[14], 因5-FU对肿瘤细胞敏感, 诱导较困难, 报道不多. HCT-8/5-FU细胞株对大肠癌的首选药物5-FU产生耐药, 并与ADM, DDP等常用大肠癌化疗药产生交叉耐药, 是研究大肠癌MDR机制和寻找逆转剂的理想模型, 对临床应用有较大指导意义.
过去对有关耐药细胞株和恶性肿瘤的耐药机制进行了深入的研究, 肿瘤细胞根据耐药谱不同, 其耐药类型可分为原药耐药(PDR)和多药耐药(MDR)[15-16]. 化疗失败的主要原因是肿瘤多药耐药性(MDR)的产生. 国内外对MDR进行了广泛、深入实验和临床研究, 证明其机制包括: 多药耐药基因(mdr1基因)及其编码的P-糖蛋白(P-gp)过度表达; 多药耐药相关蛋白(MRP)表达增加; 谷胱甘肽(GSH)依赖性解毒酶系统活性增加; 蛋白激酶C变化; DNA修复机制增强; DNA拓扑异构酶含量减少或性质发生改变等[7,17-18]. P-gp能使肿瘤细胞对多种化疗药物不敏感, 他是多药耐药基因(multidrug resistant gene)的表达产物[19]. 多数学者认为, P-gp是一种ATP能量依赖泵, 能够将药物由细胞内排出, 其结果导致相应细胞毒药物在细胞内蓄积减少, 致使抗癌效应丧失, 这是耐药细胞产生耐药的重要途径[8,20-21]. 故任何降低其外流的物质可使细胞内药物聚集增加, 从而有效杀伤大肠癌细胞[22-23].
目前已建立了数种不同敏感性和特异性的多药耐药检测方法, 用于确定恶性肿瘤不同的耐药机制. 在RNA水平上的检测方法有Northern blot, Slot blot, RT-PCR, RNAse protection assay和原位杂交. 而免疫组化, Western blot和流式细胞术可用于耐药蛋白的检测[24-25]. 另外功能性检测方法如罗丹明123的摄取和抗癌药物在细胞内的积聚可用于确定不同耐药蛋白的功能活性[26]. 这些方法有的用于大体肿瘤标本的检测, 有的用于细胞株研究. 通过罗丹明活细胞染色证明HCT-8/5-FU细胞能够有效地将细胞内化疗药物排出胞外, 提示HCT-8/5-FU细胞的耐药机制与P-gp过度表达有关[27]. 但如上所述, 肿瘤细胞产生耐药性的机制是多方面的, HCT-8/5-FU细胞的多药耐药机制除P-gp过度表达外, 还有待于进一步研究.
国内人大肠癌多药耐药细胞株报道较少, 本文用5-FU对人大肠癌细胞株HCT-8进行诱导, 建立大肠癌多药耐药细胞株, 并探讨耐药机制. 通过间歇诱导法, 浓度梯度递增法建立的大肠癌MDR有一定科学性, 对P-pg的测定有助于了解大肠癌术后化疗差机制.
本文阐述癌细胞多药耐药机制, 并寻找逆转其耐药机制的对策, 是一项有意义的研究. 文章设计科学, 方法先进, 结论客观, 虽然所作工作是初步的, 但其研究思路有一定的启示性.
电编: 张敏 编辑:潘伯荣
| 1. | Burden C, Rose D, Daniels IR. Bowel cancer: the outcome is improving. J R Soc Health. 2005;125:255-258. [PubMed] [DOI] |
| 3. | Goldberg RM. Advances in the treatment of metastatic colorectal cancer. Oncologist. 2005;10 Suppl 3:40-48. [PubMed] [DOI] |
| 4. | Fojo AT, Menefee M. Microtubule targeting agents: basic mechanisms of multidrug resistance (MDR). Semin Oncol. 2005;32:S3-S8. [PubMed] [DOI] |
| 5. | Luqmani YA. Mechanisms of drug resistance in cancer chemotherapy. Med Princ Pract. 2005;14 Suppl 1:35-48. [PubMed] [DOI] |
| 6. | Rougier P, Lepere C. Metastatic colorectal cancer: first- and second-line treatment in 2005. Semin Oncol. 2005;32:15-20. [PubMed] [DOI] |
| 7. | Molnar J, Gyemant N, Tanaka M, Hohmann J, Bergmann-Leitner E, Molnar P, Deli J, Didiziapetris R, Ferreira MJ. Inhibition of multidrug resistance of cancer cells by natural diterpenes, triterpenes and carotenoids. Curr Pharm Des. 2006;12:287-311. [PubMed] [DOI] |
| 8. | Hait WN, Yang JM. Clinical management of recurrent breast cancer: development of multidrug resistance (MDR) and strategies to circumvent it. Semin Oncol. 2005;32:S16-21. [PubMed] [DOI] |
| 9. | Aronica E, Gorter JA, Redeker S, van Vliet EA, Ramkema M, Scheffer GL, Scheper RJ, van der Valk P, Leenstra S, Baayen JC. Localization of breast cancer resistance protein (BCRP) in microvessel endothelium of human control and epileptic brain. Epilepsia. 2005;46:849-857. [PubMed] [DOI] |
| 10. | Qian F, Wei D, Zhang Q, Yang S. Modulation of P-glycoprotein function and reversal of multidrug resistance by (-)-epigallocatechin gallate in human cancer cells. Biomed Pharmacother. 2005;59:64-69. [PubMed] [DOI] |
| 11. | Ishiguro A, Shitara K, Munakata M, Saitoh S, Sakata Y. Recent progress of chemotherapy for colorectal cancer. Gan To Kagaku Ryoho. 2005;32:2017-2023. [PubMed] |
| 12. | Golfinopoulos V, Pentheroudakis G, Pavlidis N. Treatment of colorectal cancer in the elderly: a review of the literature. Cancer Treat Rev. 2006;32:1-8. [PubMed] [DOI] |
| 13. | Bruch HP, Esnaashari H, Schwandner O. Current status of laparoscopic therapy of colorectal cancer. Dig Dis. 2005;23:127-134. [PubMed] [DOI] |
| 14. | Sultan-Amar V, Fabre-Guillevin E, Piedbois P. Progresses in the medical treatment of advanced colorectal cancer. Rocz Akad Med Bialymst. 2005;50:97-100. [PubMed] |
| 15. | Thomas H, Coley HM. Overcoming multidrug resistance in cancer: an update on the clinical strategy of inhibiting p-glycoprotein. Cancer Control. 2003;10:159-165. [PubMed] |
| 16. | Andrus MB. Polyene multi-drug resistance reversal agents. Curr Opin Drug Discov Devel. 2004;7:823-831. [PubMed] |
| 17. | Mizutani T, Hattori A. New horizon of MDR1 (P-glycoprotein) study. Drug Metab Rev. 2005;37:489-510. [PubMed] [DOI] |
| 18. | Cortes-Selva F, Jimenez IA, Munoz-Martinez F, Campillo M, Bazzocchi IL, Pardo L, Ravelo AG, Castanys S, Gamarro F. Dihydro-beta-agarofuran sesquiterpenes: a new class of reversal agents of the multidrug resistance phenotype mediated by P-glycoprotein in the protozoan parasite Leishma-nia. Curr Pharm Des. 2005;11:3125-3139. [PubMed] [DOI] |
| 19. | Tsuruo T. Molecular cancer therapeutics: recent progress and targets in drug resistance. Intern Med. 2003;42:237-243. [PubMed] [DOI] |
| 20. | Johnson WW. P-glycoprotein-mediated efflux as a major factor in the variance of absorption and distribution of drugs: modulation of chemotherapy resistance. Methods Find Exp Clin Pharmacol. 2002;24:501-514. [PubMed] [DOI] |
| 21. | Swerts K, De Moerloose B, Dhooge C, Laureys G, Benoit Y, Philippe J. Prognostic significance of multidrug resistance-related proteins in childhood acute lymphoblastic leukaemia. Eur J Cancer. 2006;42:295-309. [PubMed] [DOI] |
| 22. | Breier A, Barancik M, Sulova Z, Uhrik B. P-glycoprotein-implications of metabolism of neoplastic cells and cancer therapy. Curr Cancer Drug Targets. 2005;5:457-468. [PubMed] [DOI] |
| 23. | Vaidyanathan G, Zalutsky MR. Imaging drug resistance with radiolabeled molecules. Curr Pharm Des. 2004;10:2965-2979. [PubMed] [DOI] |
| 24. | Salama NN, Eddington ND, Payne D, Wilsonb TL, Scott KR. Multidrug resistance and anticonvulsants: new studies with some enaminones. Curr Med Chem. 2004;11:2093-2113. [PubMed] [DOI] |
| 25. | Varma MV, Ashokraj Y, Dey CS, Panchagnula R. P-glycoprotein inhibitors and their screening: a perspective from bioavailability enhancement. Pharmacol Res. 2003;48:347-359. [PubMed] [DOI] |
| 26. | Kitagawa S. Inhibitory effects of polyphenols on p-glycoprotein-mediated transport. Biol Pharm Bull. 2006;29:1-6. [PubMed] [DOI] |
| 27. | Richaud-Patin Y, Vega-Boada F, Vidaller A, Llorente L. Multidrug resistance-1 (MDR-1) in autoimmune disorders IV. P-glycoprotein overfunction in lymphocytes from myasthenia gravis patients. Biomed Pharmacother. 2004;58:320-324. [PubMed] [DOI] |