修回日期: 2006-05-02
接受日期: 2006-05-22
在线出版日期: 2006-07-18
目的: 研究胃黏膜内癌淋巴结微转移的发生率、病理学特征及其临床意义.
方法: 胃黏膜内癌患者84例手术切除淋巴结2526枚进行连续超薄切片, 分别进行HE染色及抗Cytokeratin (CK; CAM5.2)免疫组化研究, 并与临床病理资料进行对比分析.
结果: 在84例中16例患者具有淋巴结受累(19%); 2526枚淋巴结中45枚淋巴结受累(1.8%; 45/2526), 显著高于HE染色的1.2% (1/84; P<0.05), 淋巴结微转移率为18% (15/84). 尽管没有显著统计学差异, 微转移在大于1.0 cm的肿瘤(15/72; 21%)较小于或等于1.0 cm的肿瘤(1/12; 8%)更为多见(P = 0.307). 大于2.0 cm的肿瘤, 淋巴结的微转移均为淋巴结内多发散在或聚集状态的肿瘤细胞.
结论: 胃黏膜内癌具有较高的淋巴结微转移率, 内镜下黏膜切除术不宜用于直径大于1.0 cm的胃黏膜内癌.
引文著录: 阎庆辉, 刘津, 史利克, 王凤安, 蔡建辉, 池口正英. 胃黏膜内癌淋巴结微转移的临床意义. 世界华人消化杂志 2006; 14(20): 2026-2029
Revised: May 2, 2006
Accepted: May 22, 2006
Published online: July 18, 2006
AIM: To study the micrometastasis in the lymph nodes of mucosal gastric cancer.
METHODS: We examined 2526 lymph nodes from 84 patients with mucosal gastric cancer. Two consecutive sections were prepared, for simultaneous staining with hematoxylin and eosin and immunostaining with CAM 5.2 monoclonal antibody against cytokeratin (CK), respectively. A clinicopathological comparison was performed between patients with and without lymph node involvement.
RESULTS: Lymph node involvement was detected in 45 of 2526 (1.8%) lymph nodes. The incidence of nodal involvement was significantly increased, from 1.2% (1/84 patients) with hematoxylin and eosin staining, to 19% (16/84 patients) with CK immunostaining. Although no significant difference was found, micrometastasis to lymph nodes was more frequently detected in the tumors larger than 1.0 cm (15/72 patients, 21%) than in those less than or equal to 1.0 cm (1/12 patients, 8%, P = 0.307) in diameter. However, discrete CK-positive cancer cells or clusters of CK-positive cancer cells were detected only in the tumors larger than 2.0 cm in diameter.
CONCLUSION: Mucosal gastric cancer of more than 1.0 cm in superficial diameter may indicate a risk of micrometastasis to lymph nodes, so endoscopic mucosal resection is not recommended for these patients.
- Citation: Yan QH, Liu J, Shi LK, Wang FA, Cai JH, Ikeguchi M. Clinical significance of micrometastasis in lymph nodes of mucosal gastric cancer. Shijie Huaren Xiaohua Zazhi 2006; 14(20): 2026-2029
- URL: https://www.wjgnet.com/1009-3079/full/v14/i20/2026.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i20.2026
胃癌患者的淋巴结转移是影响预后的最重要因素, 淋巴结清扫可以有效提高患者术后的生存率[1]. 近来对于早期胃癌倾向于施行低侵袭性手术以提高患者的生活质量[2]. 最近已有研究报道通过Cytokeratin (CK)免疫组织化学染色的方法可以发现过去HE常规染色无法发现的淋巴结微转移, 而这些微转移和患者预后密切相关[3]. 低侵袭性手术或内镜下胃黏膜切除术最初被应用于胃黏膜内癌[4], 但胃黏膜内癌淋巴结被累及的情况尚未明了, 为了评定内镜下胃黏膜切除术或胃低侵袭性手术对胃黏膜内癌的实际意义, 我们通过CK免疫染色的方法来研究胃黏膜内癌的淋巴结累及情况.
1986-1991年日本鸟取大学第一外科行胃癌根治性切除患者84(男46, 女38)例, 年龄37-82(平均63)岁, 其中全胃切除6例(7%), 远端和近端胃次全切除分别为71例(85%)和7例(8%); 58例行标准D2根治术, 26例行D2根治加部分第三组淋巴结清扫(肝十二指肠韧带, 肝总动脉周围, 胰头后或肠系膜根部). 临床病理资料按日本胃癌协会(JRSGC)胃癌治疗规范第13版[5]标准, 将胃等分为上、中和下1/3, 肿瘤大小的测定基于其表面的最大直径, 大体病理类型0-Ⅰ为隆起型, 0-Ⅱa为表面隆起型, 0-Ⅱb为平坦型, 0-Ⅱc为表面凹陷型, 0-Ⅲ为凹陷型.
共检测84例患者的2526枚淋巴结, 每例患者被检测的淋巴结数目10-61枚, 平均30枚, 所有标本用甲醛固定和石蜡包埋, 并分别制备2张4 mm厚的连续切片, 其中1张行HE染色, 另1张行CK免疫组织化学染色, HE染色证实的8枚转移淋巴结作为阳性对照, 15例良性胃溃疡患者的40枚胃周淋巴结作为阴性对照, 用标准ABC免疫组织化学染色法[6]进行CK染色. 首先将切片于二甲苯中脱蜡, 然后在乙醇中脱水, 再在30 mL/L双氧水甲醇溶液中孵化20 min以封闭内生性过氧化物酶的活性后, 放入柠檬酸缓冲液中于700 W微波炉内加热12 min以暴露抗原, 室温下冷却后放入0.5 g/L Tween 20 (pH 7.0)中30 min, 以磷酸盐缓冲液(PBS)清洗3次, 再用100 mL/L正常山羊血清孵育20 min以减少非特异性抗原抗体的结合, 再次用PBS清洗后以鼠抗人CAM5.2mAb(25 mg/L, 美国新泽西Becton Dickinson实验室)作为第1抗体[7]4 ℃环境中孵育过夜, 再次以PBS清洗后将抗鼠免疫球蛋白生物素抗体作为第2抗体孵育45 min后PBS清洗, 再加ABC溶液孵育30 min (Vectastain ABC标准免疫组织化学染色试剂盒, 美国Vector实验室), 再次以PBS清洗3次, 然后以二氨基联苯胺作为显影剂对切片进行着色, 再以苏木精进行复染作为对照染色, 在乙醇中脱水, 最后用二甲苯固定并盖片观察. 首先由有经验的病理科医师在不知晓诊断结果及临床病理资料的情况下通过显微镜在200倍视野下对经HE染色的切片进行转移情况的评估, 然后再检测CK免疫染色的切片, 将结果进行比较, 在常规HE染色未能在淋巴结内发现癌细胞而CK免疫染色却可以见到癌细胞的情况下, 则认为此淋巴结有微转移存在.
统计学处理 以χ2检验评价CK免疫染色与原发瘤临床病理资料间的关系, P<0.05被认为具有显著统计学意义.
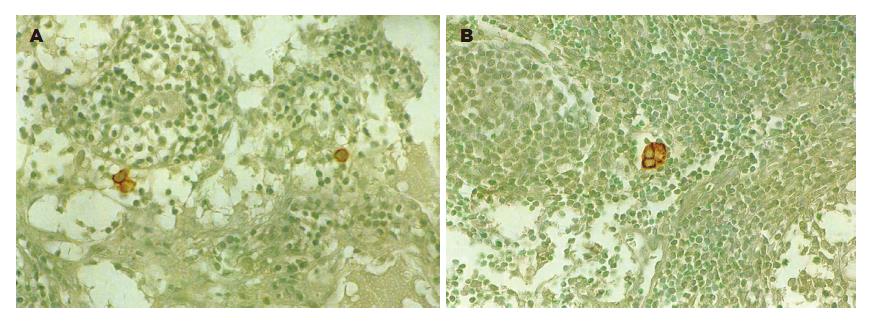
通过常规HE染色确定的淋巴结转移只有1例患者的8个淋巴结, 这8个淋巴结CK免疫组织化学染色均为阳性, 而在同一患者的另外9个HE染色阴性的淋巴结内却发现了CK染色阳性的癌细胞, 在另外15例患者的28个淋巴结内发现了微转移的存在, 而这些淋巴结的HE染色结果均为阴性, 使淋巴结的累及率由HE染色的0.3% (8/2526)上升到了CK染色时的1.8% (45/2526; P<0.001). 同时, 全部84例患者的淋巴结受累情况也由HE染色时的1.2% (1/84)上升到了CK染色时的19% (16/84; P<0.05). CK染色发现16例淋巴结受累, 在这16例患者中, 有9例只检测到1个癌细胞(56%), 2例检测到了2个或2个以上的分散存在的癌细胞(13%; 图1A), 5例检测到了聚集的癌细胞(31%; 图1B). 在HE染色阳性的那例患者的转移淋巴结内, 可以见到大量聚集成团的癌细胞位于髓质和淋巴窦的边缘. 通过对比发现, CK染色发现发生微转移的淋巴结内癌细胞多以单个细胞, 分散态的细胞或者小的聚集成团的细胞的形式在淋巴窦的边缘部位出现.
11例患者只有第1站淋巴结受累, 其中8例患者只在其淋巴结内发现了1个癌细胞; 5例患者出现了第2或第3站淋巴结受累, 其中4例患者受累淋巴结内的癌细胞或分散出现, 或聚集成团, 2例患者的微转移只累及了第3站淋巴结, 而第1和第2站淋巴结却未见受累, 其中1例患者的肿瘤位于胃的中1/3小弯侧, 仅在8p淋巴结发现了单个的CK染色阳性细胞, 另1例患者的肿瘤位于胃的中1/3大弯侧, 在第2组和4sa淋巴结分别可见到聚集成团的CK染色阳性细胞, 我们将前者的第3, 1, 7和8a组淋巴结, 以及后者的第4sb, 3和4d组淋巴结增加了10张切片再进行CK染色, 但没有发现阳性细胞. 在15例胃良性溃疡患者的40枚淋巴结内也没有发现CK染色阳性的细胞(阴性对照).
我们将16例有淋巴结受累患者的临床病理资料与68例没有受累患者的资料进行了对比, 发现淋巴结的受累更常出现在直径大于1.0 cm的肿瘤(21%), 更多见于大体病理类型是凹陷型或平坦凹陷型的患者(Ⅱc和Ⅲ, 23%)以及溃疡形成的患者(36%), 但他们之间的差别没有统计学意义. 9例淋巴结内只有单个癌细胞的患者中有6例肿瘤直径小于或等于2.0 cm, 而全部7例淋巴结内出现多个分散或聚集存在的癌细胞的肿瘤直径均大于2.0 cm (P<0.05); 5例第2或第3站淋巴结受累患者的肿瘤直径也都大于2.0 cm (P<0.05); 另外, 直径大于2.0 cm的肿瘤淋巴结受累数量也高于直径小于或等于2.0 cm者(P<0.05). 84例患者中有1例死于术后腹膜播散, 我们在其第2站淋巴结发现微转移以聚集成团的癌细胞形式出现, 而其他没有淋巴结受累的患者则未见有术后复发的出现.
传统的D2根治术已被应用于早期胃癌患者. 从组织学角度来讲, 报道过的胃黏膜内癌淋巴结转移率在1.3%-5.0%. 最近有研究称直径小于2.0 cm的分化好的或大体病理类型为隆起型的胃黏膜内癌没有淋巴结转移, 对于这样的患者内镜下胃黏膜切除术或限制性淋巴结清扫术(limited lymphadenectomy)已经被广泛接受[2], 但这些患者是否存在淋巴结微转移的问题尚未被深入讨论. 众所周知淋巴结转移是影响胃癌预后的最重要原因之一[8], Bjelovic et al[3]和Nitti et al[8]报告淋巴结内有微转移的出现往往预示着预后不良. 我们过去有关进展期胃癌[10]和黏膜下胃癌[11]的研究也证实了淋巴结微转移的出现与患者的不良预后存在联系. 本研究通过CK免疫组织化学染色的方法检测了84例胃黏膜内癌患者的大量淋巴结(2526枚), 发现那些经常规HE染色未能发现癌细胞的病例中有18%的患者存在淋巴结微转移, 说明CK免疫染色在确定早期胃癌患者是否出现淋巴结转移方面较之传统的HE染色更具有诊断价值.
在区域淋巴结内出现一个CK染色阳性的癌细胞是否具有临床病理价值尚未可知, 但在HE染色阳性的淋巴结内却随处可见分散的或聚集的CK染色阳性的癌细胞. 通过对比发现, 在15例CK染色发现微转移的患者中有9例在淋巴结内只有一个单个的癌细胞, 且这9例患者除1例以外, 其他8例的微转移均出现在第1站淋巴结, 这些微转移似乎预示着肿瘤正处于向淋巴结侵袭的最早阶段. 通过组织学的研究业已显示胃黏膜内癌患者有着非常低的术后复发率[12], 那么发生微转移的单个癌细胞是否能够被机体的免疫防御机制所清除则还有待于进一步的研究[9]. 肿瘤的大小是淋巴结转移的高危因素之一[11]. 我们发现当肿瘤的直径超过2.0 cm时淋巴结内的微转移往往以多个癌细胞分散或聚集的形式出现, 而且更易于向第2甚至第3站淋巴结侵袭, 这些发现预示着直径超过2.0 cm的胃黏膜内癌有可能在距离原发灶较远的淋巴结内发生微转移, 本研究还显示直径在1.0-2.0 cm的小的胃黏膜内癌同样具有发生淋巴结微转移的危险, 提示对于那些直径在1.0 cm以上的肿瘤, 也应充分考虑到其淋巴结受累的可能性.
虽然已有报道称早期胃癌可以发生远隔淋巴结的跳跃式转移, 但更多的研究主要还是针对胃黏膜内癌和黏膜下胃癌的胃旁淋巴结[13]. 本研究中有2例患者显示了第3站淋巴结存在微转移, 而其第1和第2站淋巴结却没有发现微转移的存在, 虽然我们对这2例患者的1, 2站淋巴结增加切片进行详细研究, 但依然没有能够发现癌细胞, 说明这2例患者发生了远隔淋巴结的跳跃式微转移, 而这2例分化不良的肿瘤直径均在4.5 cm以上. 通过CK染色发现的胃黏膜内癌跳跃式远隔淋巴结转移远较HE染色为多[14]. 近来, 虽然内镜下胃黏膜切除术或限制性淋巴结清扫术被广泛应用于胃黏膜内癌患者, 但由于存在淋巴结微转移的危险, 我们建议内镜下胃黏膜切除术不适用于直径大于1.0 cm的黏膜内癌.
胃癌淋巴结转移是影响预后的最重要因素, 淋巴结清扫可以有效提高患者生存率. 通过Cytokeratin(CK)免疫组化染色可发现过去HE染色无法发现的淋巴结微转移. 低侵袭性手术或内镜下胃黏膜切除术最初被应用于胃黏膜内癌, 但胃黏膜内癌淋巴结被累及的情况尚未明了, 有必要通过进一步的研究评定内镜下胃黏膜切除术或胃低侵袭性手术对胃黏膜内癌的实际意义.
本研究发现通过CK染色发现的胃黏膜内癌的微转移或跳跃式远隔淋巴结转移远较HE染色为多, 虽然内镜下胃黏膜切除术或限制性淋巴结清扫术被广泛应用于胃黏膜内癌患者, 但由于存在淋巴结微转移的危险, 建议内镜下胃黏膜切除术不适用于直径大于1.0 cm的黏膜内癌.
虽然内镜下胃黏膜切除术或限制性淋巴结清扫术被广泛应用于胃黏膜内癌患者, 但由于存在淋巴结微转移的可能, 所以本文建议内镜下胃黏膜切除术不适用于直径大于1.0 cm的黏膜内癌, 应改行D2根治术.
微转移: 单个或散在或聚集的癌细胞出现在原发灶以外的组织或脏器, 有进一步形成转移灶的可能, 这些已转移的细胞以常规HE染色等方法常不能被发现.
电编: 张敏 编辑:潘伯荣
| 1. | Skoropad V, Berdov B, Zagrebin V. Clinicopatho-logical features and outcome of surgical treatment of 149 patients with early (pT1) gastric cancer. Onkologie. 2005;28:247-252. [PubMed] |
| 2. | Park DJ, Lee HK, Lee HJ, Lee HS, Kim WH, Yang HK, Lee KU, Choe KJ. Lymph node metastasis in early gastric cancer with submucosal invasion: feasibility of minimally invasive surgery. World J Gastroenterol. 2004;10:3549-3552. [PubMed] [DOI] |
| 3. | Bjelovic M, Pesko P, Micev M, Todorovic V, Stojak-ov D, Sabljak P, Simic A, Ebrahimi K, Velickovic D, Spica B. The significance of lymphonodal microme-tastasis in the patients with gastric adenocarcinoma. Acta Chir Iugosl. 2005;52:21-24. [PubMed] [DOI] |
| 4. | Endo K, Kohnoe S, Okamura T, Haraguchi M, Nishiyama K, Toh Y, Baba H, Maehara Y. Evaluation of endoscopic mucosal resection and nodal micrometastasis in pN0 submucosal gastric cancer. Oncol Rep. 2005;13:1059-1063. [PubMed] [DOI] |
| 5. | Aikou T, Hokita S, Natsugoe S. Japanese Classifi-cation of Gastric Carcinoma (the 13th edition, June 1999): points to be revised. Nippon Rinsho. 2001;59 Suppl 4:159-165. [PubMed] |
| 6. | Hsu SM, Raine L, Fanger H. The use of antiavidin antibody and avidin-biotin-peroxidase complex in immunoperoxidase technics. Am J Clin Pathol. 1981;75:816-821. [PubMed] [DOI] |
| 7. | Turner RR, Nora DT, Trocha SD, Bilchik AJ. Colorectal carcinoma nodal staging. Frequency and nature of cytokeratin-positive cells in sentinel and nonsentinel lymph nodes. Arch Pathol Lab Med. 2003;127:673-679. [PubMed] |
| 8. | Nitti D, Marchet A, Mammano E, Ambrosi A, Belluco C, Mencarelli R, Maino M, Marconato G, Farinati F, Lise M. Extended lymphadenectomy (D2) in patients with early gastric cancer. Eur J Surg Oncol. 2005;31:875-881. [PubMed] [DOI] |
| 9. | Lee E, Chae Y, Kim I, Choi J, Yeom B, Leong AS. Prognostic relevance of immunohistochemically detected lymph node micrometastasis in patients with gastric carcinoma. Cancer. 2002;94:2867-2873. [PubMed] [DOI] |
| 10. | Cai J, Ikeguchi M, Maeta M, Kaibara N, Sakatani T. Clinicopathological value of immunohistochemical detection of occult involvement in pT3N0 gastric cancer. Gastric Cancer. 1999;2:95-100. [PubMed] [DOI] |
| 11. | Cai J, Ikeguchi M, Maeta M, Kaibara N. Micrometas-tasis in lymph nodes and microinvasion of the muscularis propria in primary lesions of submuco-sal gastric cancer. Surgery. 2000;127:32-39. [PubMed] [DOI] |
| 12. | Lee HJ, Kim YH, Kim WH, Lee KU, Choe KJ, Kim JP, Yang HK. Clinicopathological analysis for recurrence of early gastric cancer. Jpn J Clin Oncol. 2003;33:209-214. [PubMed] [DOI] |
| 13. | Tuech JJ, Cervi C, Pessaux P, Villapadierna F, Bergamaschi R, Ronceray J, Arnaud JP. Early gastric cancer: univariate and multivariate analysis for survival. Hepatogastroenterology. 1999;46:3276-3280. [PubMed] |
| 14. | Cai J, Ikeguchi M, Tsujitani S, Maeta M, Liu J, Kaibara N. Significant correlation between micrometastasis in the lymph nodes and reduced expression of E-cadherin in early gastric cancer. Gastric Cancer. 2001;4:66-74. [PubMed] [DOI] |