修回日期: 2006-05-02
接受日期: 2006-05-22
在线出版日期: 2006-07-18
目的: 探讨方剂槲芪散(HQS)及其君药槲寄生提取物多糖和总碱对人肝癌细胞SMMC-7721生长的抑制作用及细胞内活性氧(reactive oxygen species, ROS)浓度的影响.
方法: 采用MTT法测定药物槲芪散(0.3125, 0.625, 1.25 g/L), 槲寄生多糖(0.625, 1.25, 2.5, 5 g/L)及槲寄生总碱(3, 6, 12 g/L)作用48, 72及96 h对细胞(密度1×108/L)增殖的体外抑制作用; 利用流式细胞仪分析细胞周期、凋亡; 利用激光共聚焦显微镜测定细胞内活性氧浓度.
结果: MTT结果显示HQS及槲寄生提取物有较好的抑制肿瘤细胞增殖的作用, 呈现出时间-剂量依赖性, 高剂量组除了HQS和槲寄生总碱48 h时间点外, A值均较对照组明显降低(HQS 72 h: 1.022±0.13 vs 1.207±0.04, P<0.01; 96 h: 1.235±0.20 vs1.602±0.05, P<0.01; 槲寄生多糖48 h: 0.570±0.03 vs 0.744±0.01, P<0.01; 72 h: 0.803±0.04 vs 1.207±0.04, P<0.01; 96 h: 0.860±0.13 vs 1.602±0.05, P<0.01; 槲寄生总碱72 h: 0.919±0.14 vs 1.233±0.04, P<0.01; 96 h: 0.701±0.07 vs1.819±0.04, P<0.01). 流式细胞仪检测发现, 与对照组相比, 经药物作用72 h后, 槲寄生多糖及总碱组G1期细胞比例增加(81.0%, 86.9% vs 70.0%, P<0.01), S期(5.9%, 7.4% vs 13.5%, P<0.01)和G2期(13.1%, 5.7% vs 16.4%, P<0.01)比例降低, HQS组G1期细胞比例无明显变化, S期比例降低(1.5% vs 13.5%, P<0.01), G2期比例增加(28.2% vs 16.4%, P<0.01); 三者均使细胞凋亡增加(HQS: 14.8% vs 6.0%, P<0.01; 槲寄生多糖: 11.7% vs 6.0%, P<0.01; 总碱: 6.7% vs 6.0%, P<0.05). 激光共聚焦显微镜检测发现, 当细胞内荧光强度呈现不断升高趋势时, 加入3种药物后, 荧光强度瞬间下降, 然后稳定在一低水平, 未见明显波动. 当荧光开始稳定在一基线时, 加入槲寄生总碱, 荧光强度陡然增强后又迅速下降到低水平, 并维持一段时间, 而加入HQS及槲寄生多糖未见此变化.
结论: HQS、槲寄生多糖和总碱均能抑制肝癌细胞增殖并促进凋亡.
引文著录: 李霞, 丰平, 文朝阳, 朱淼, 刘树红, 王学江. 方剂槲芪散及君药槲寄生提取物对人肝癌细胞生长的抑制作用. 世界华人消化杂志 2006; 14(20): 1963-1969
Revised: May 2, 2006
Accepted: May 22, 2006
Published online: July 18, 2006
AIM: To probe the effect of Chinese herbs, Huqi San (HQS) and its principal drug mistletoe extracts on the growth of human hepatocar-cinoma cell line SMMC-7721 and the levels of intracellular reactive oxygen species (ROS).
METHODS: The proliferation of SMMC-7721 cells inhibited by HQS (0.3125, 0.625, 1.25 g/L), mistletoe polysaccharides (0.625, 1.25, 2.5, 5 g/L) and total alkaloid of mistletoe (3, 6, 12 g/L) at 48, 72 and 96 h were observed by MTT assay. The cell cycle and apoptosis rate of SMMC-7721 cells were examined by flow cytometry. The fluorescent intensity of ROS was observed by laser scanning confocal microscopy.
RESULTS: Both HQS and mistletoe extracts inhibited the proliferation of SMMC-7721 cells in a time- and dose-dependence manner, and the numeric value of absorbance in high-dose group decreased markedly as compared with that in the control group (HQS 72 h: 1.022 ± 0.13 vs 1.207 ± 0.04, P < 0.01; 96 h: 1.235 ± 0.20 vs 1.602 ± 0.05, P < 0.01; mistletoe polysaccharides 48 h: 0.570 ± 0.03 vs 0.744 ± 0.01, P < 0.01; 72 h: 0.803 ± 0.04 vs 1.207 ± 0.04, P < 0.01; 96 h: 0.860 ± 0.13 vs 1.602 ± 0.05, P < 0.01; total alkaloid of mistletoe 72 h: 0.919 ± 0.14 vs 1.233 ± 0.04, P < 0.01; 96 h: 0.701 ± 0.07 vs 1.819 ± 0.04, P < 0.01), expect that at 48 h in HQS and total alkaloid of mistletoe group. After treatment with the drugs for 72 h, the cell populations in the group of mistletoe polysaccharides and total alkaloid of mistletoe increased in G1 phase (81.0%, 86.9% vs 70.0%, P < 0.01) and decreased in G2 and S phase (13.1%, 5.7% vs 16.4%, P < 0.01; 5.9%, 7.4% vs 13.5%, P < 0.01), in comparison with those in the controls. In the group of HQS, the proportion of S-phase cells decreased (1.5% vs 13.5%, P < 0.01) while that of G2-phase ones increased (28.2% vs 16.4%, P < 0.01). However, there was no obvious change in the numbers of G1-phase cells. In addition, all of the three drugs enhanced the apoptosis of SMMC-7721 cells (HQS: 14.8% vs 6.0%, P < 0.01; mistletoe polysaccharides: 11.7% vs 6.0%, P < 0.01; total alkaloid of mistletoe: 6.7% vs 6.0%, P < 0.05). Confocal microscopy showed that the fluorescent intensity declined suddenly and then maintained at a low level almost without fluctuating when the three kinds of drugs were added. However, after the fluorescent intensity was stabile at a baseline, it increased instantly as the total alkaloid of mistletoe was added. Thereafter, it decreased rapidly and maintained at a low level for a period of time. But this phenomenon was not observed when the cells were treated with HQS and mistletoe polysaccharides.
CONCLUSION: HQS, mistletoe polysaccharides and total alkaloid of mistletoe can inhibit the proliferation and promote the apoptosis of SMMC-7721 cells.
- Citation: Li X, Feng P, Wen ZY, Zhu M, Liu SH, Wang XJ. IGrowth inhibition of human hepatocarcinoma cells induced by Chinese herbs Huqi San and its principal drug mistletoe extracts. Shijie Huaren Xiaohua Zazhi 2006; 14(20): 1963-1969
- URL: https://www.wjgnet.com/1009-3079/full/v14/i20/1963.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i20.1963
原发性肝癌是我国常见的恶性肿瘤, 在各种恶性肿瘤的发病率和死亡率中为第3位. 积极探求治疗的有效药物, 成为肿瘤研究的重点. 槲芪散系钱英教授沿用多年的验方, 已证实其在治疗肝纤维化, 阻断/逆转肝癌前病变方面疗效显著[1-4]. 该方君药槲寄生的抗癌作用受到国内外医药学界的重视, 已从多种槲寄生植物中提取到具有抗癌活性的凝集素, 毒肽, 植物糖蛋白和生物碱[5-11]. 我们比较了HQS及君药槲寄生提取物多糖和总碱对人肝癌细胞SMMC-7721生长的抑制作用及细胞内活性氧浓度的影响, 初步探讨其抗癌机制.
人肝癌细胞株SMMC-7721购自北京市肿瘤防治研究所细胞库. 方剂槲芪散由槲寄生, 黄芪, 郁金, 丹参等8味中药组成, 所用中药1次备齐, 经鉴定符合药典用药规定, 由首都医科大学中医药学院制剂室制成无糖颗粒备用. 槲寄生总碱及多糖由北京市中医研究所提取. RPMI 1640培养基、标准胎牛血清, Gibco产品; H2DCFHDA荧光探针和PI, 均为美国Biotium产品; 羟乙基哌嗪乙硫磺酸(HEPES)、胰蛋白酶(trypsin)、噻唑蓝(MTT)、二甲基亚砜(DMSO)、乙二胺四乙酸二钠(EDTA)和RNaseA均为Sigma公司产品; 5-FU为上海旭东海普药业有限公司产品. CO2培养箱REVCO; 酶标仪SA1000奥地利Digiscan; 流式细胞仪EPICS XL型, 美国Coulter公司; 超净工作台DL-CJ-2F, 哈东联; 激光共聚焦显微镜, 为日本Olympus公司产品.
人肝癌细胞株SMMC-7721用含100 mL/L胎牛血清, 青霉素100 kU/L, 链霉素100 mg/L的RPMI 1640培养基在37 ℃, 50 mL/L CO2条件下培养, 隔天换液, 2-3 d传代.
1.2.1 MTT比色法测定细胞增殖: 将密度为1×108/L细胞接种于96孔培养板中, 每孔200 mL. 待细胞贴壁后, 无血清过夜, 吸弃培养液, 分别加入不同浓度的HQS (0.3125, 0.625, 1.25 g/L), 槲寄生多糖(0.625, 1.25, 2.5, 5 g/L)及槲寄生总碱(3, 6, 12 g/L)药物, 每个浓度6个复孔, 设空白(完全1640培养液)及阳性对照药物5-FU(50 mmoL/L)对照孔, 每孔200 mL(所加药物用完全1640培养液配制), 置37 ℃, 50 mL/L CO2条件下培养至48, 72, 96 h, 每孔加入MTT贮液(5 g/L) 20 mL, 37 ℃继续温育4 h, 吸弃上清液, 每孔加入二甲基亚砜150 mL, 震荡10 min, 溶解微小结晶. 于全自动酶标仪波长570 nm处测定各孔吸光度值(A值), 共重复三次. 抑制率 = (1-药物组A值/对照组A值)×100%.
1.2.2 流式细胞仪测细胞周期和凋亡: 将密度为1×108/L细胞接种于6孔培养板中, 待贴壁后, 无血清过夜, 分别加入HQS (1.25 g/L), 槲寄生多糖(5 g/L)及槲寄生总碱(12 g/L), 设空白对照(完全1640培养液), 培养72 h后, 收集1×106细胞700 mL/L冷乙醇固定, 4 ℃过夜. 测试前用PBS液洗去乙醇, 加入RNA酶、Trition-100和碘化丙啶混合液, 避光染色30 min, 流式细胞仪检测. 实验重复3次.
1.2.3 激光共聚焦检测细胞内活性氧浓度: 取对数生长期细胞, 经消化、吹散、重悬于100 mL/L胎牛血清RPMI 1640培养液, 调整细胞浓度接种于特制的petri小碟中. 培养24 h后, 弃去原培养液, HEPES液洗两遍, 加入5 mmoL/L的H2DCFHDA荧光染料100 mL, 37 ℃避光负载30 min. HEPES洗两遍, 弃去后加HEPES待测. 将负载H2DCFHDA的细胞置于激光扫描共聚焦显微镜载物台上, 选定观察目标, 待荧光强度稳定后, 加药, 动态观察细胞内荧光强度变化.
统计学处理 数值以mean±SD表示, 应用SPSS 11.0统计软件, 采用F检验和χ2检验, P<0.05认为有统计学意义.
倒置显微镜下观察, 正常SMMC-7721细胞呈多角形, 核大, 有3-5个核仁, 胞质丰富, 细胞彼此之间相接触. 用药后发现, HQS高剂量组细胞变圆, 胞膜有泡状突起; 槲寄生多糖组细胞较正常小, 细胞数量明显减少, 并可见较多的细胞碎片; 槲寄生总碱组随着剂量的增加细胞变长, 细胞间非紧密接触, 出现空隙, 且核周边颜色较深, 有颗粒状物浓集. 撤药后换正常培养液继续培养24 h, 细胞形态恢复正常, 多数细胞有2-3个胞核, 处于分裂期, 增殖旺盛.
除槲寄生总碱中低浓度48 h时间点外, 细胞生长受到抑制, 抑制率随着药物浓度的升高及时间的延长呈升高趋势, 呈现出时间-剂量依赖性, 高剂量组除了HQS和槲寄生总碱48 h时间点外, A值均较对照组明显降低(P<0.01, 表1).
| 药物 (g/L) | 48 h | 72 h | 96 h | |||
| A值 | 抑制率(%) | A值 | 抑制率(%) | A值 | 抑制率(%) | |
| 对照组 | 0.744±0.01 | 1.207±0.04 | 1.602±0.05 | |||
| HQS | ||||||
| 0.3125 | 0.742±0.04 | 0.2 | 1.129±0.04 | 6.4 | 1.470±0.16 | 8.3 |
| 0.625 | 0.725±0.04 | 2.6 | 1.127±0.04 | 6.6 | 1.444±0.11a | 9.8 |
| 1.25 | 0.651±0.05a | 12.6 | 1.022±0.13a | 15.2 | 1.235±0.20a | 22.9 |
| 槲寄生多糖 | ||||||
| 0.625 | 0.724±0.02 | 2.8 | 1.056±0.09b | 12.4 | 1.282±0.16b | 20.0 |
| 1.25 | 0.677±0.02b | 8.9 | 0.994±0.06b | 17.6 | 1.078±0.16b | 32.7 |
| 2.5 | 0.631±0.01b | 15.2 | 0.937±0.03b | 22.3 | 1.019±0.18b | 36.4 |
| 5 | 0.570±0.03b | 23.8 | 0.803±0.04b | 33.4 | 0.860±0.13b | 46.3 |
| 5-FU (50 μmoL/L) | 0.446±0.04b | 40.0 | 0.492±0.03b | 59.1 | 0.581±0.04b | 68.7 |
| 对照组 | 0.844±0.05 | 1.233±0.04 | 1.819±0.04 | |||
| 槲寄生总碱 | ||||||
| 3 | 1.056±0.02b | -22.6 | 1.181±0.13 | 4.3 | 1.683±0.24 | 7.2 |
| 6 | 0.907±0.08 | -5.3 | 1.032±0.08a | 16.2 | 1.229±0.15b | 32.3 |
| 12 | 0.804±0.06 | 6.6 | 0.919±0.14b | 19.7 | 0.701±0.07b | 61.4 |
| 5-FU (50 μmoL/L) | 0.844±0.03b | 26.4 | 0.605±0.05b | 51.0 | 0.581±0.04b | 68.0 |
经药物作用72 h后, 槲寄生多糖及总碱组G1期细胞比例增加, S期和G2期比例降低, 细胞凋亡增加; HQS组G1期细胞比例无明显变化, S期比例降低, G2期比例增加, 细胞凋亡增加(表2).
| 药物 (g/L) | 时相 | |||
| G1 | S | G2 | Ap | |
| 对照组 | 70.0 | 13.5 | 16.4 | 6.0 |
| HQS (1.25) | 70.2 | 1.5b | 28.2b | 14.8b |
| 槲寄生多糖 (5) | 81.0b | 5.9b | 13.1b | 11.7b |
| 槲寄生总碱 (12) | 86.9b | 7.4b | 5.7b | 6.7a |
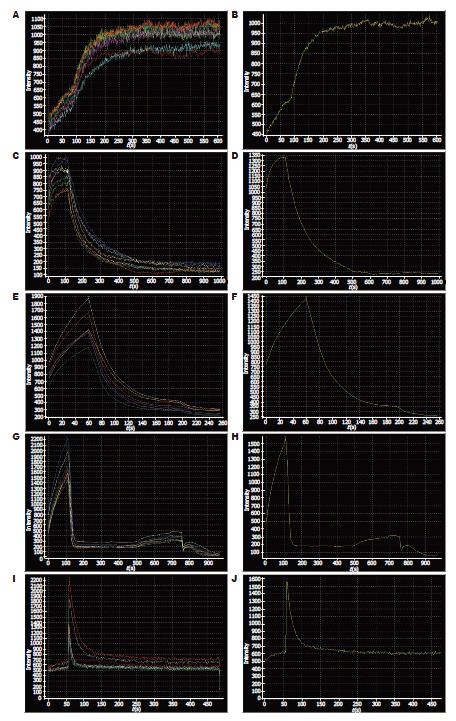
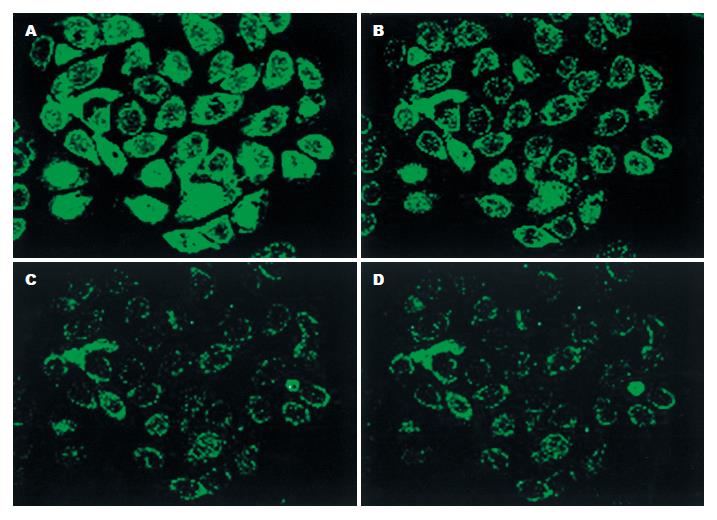
当激光照射细胞后, 细胞内荧光强度不能稳定到一水平线, 呈上升趋势(图1A-B); 加入HQS(1.25 g/L)时, 荧光强度瞬时下降, 并维持至一低水平, 未见明显波动(图1C-D); 加入槲寄生多糖(5 g/L)后, 荧光强度下降到几乎接近基线水平(图1E-F); 当加入槲寄生总碱(12 g/L)后, 细胞内荧光陡然下降, 在接近基线水平又出现轻微波动, 总体呈下降趋势(图1G-H).当细胞内荧光强度起始维持在一基线时, 加入槲寄生总碱, 荧光强度瞬时增强后又迅速下降至初始水平, 并维持在此水平, 无明显波动(图1IJ). 槲寄生多糖作用于细胞后, 细胞内荧光强度的动态变化图与HQS及槲寄生总碱的图像类似(图2A-D).
原发性肝癌是常见的恶性肿瘤之一, 其治疗是肿瘤研究的重点. 恶性肿瘤细胞具有无限制性增殖的特点, 这是区别于正常细胞最显著的生物学特征, 因此, 抑制肿瘤细胞增殖, 诱导其凋亡成为肿瘤治疗的最终目的. 方剂槲芪散在治疗肝纤维化, 阻断逆转肝癌前病变方面疗效显著[1-4]. 其君药槲寄生是一味传统中药, 其性平, 味苦, 具有强筋骨、安胎、祛风湿、益血、补肝肾等功能. 近年来, 槲寄生的抗癌作用受到国内外医药学界的广泛重视[12-13]. 我们比较了HQS及槲寄生提取物多糖和总碱对肝癌细胞SMMC-7721的作用, 发现3者均能抑制肝癌细胞增殖, 且呈时间-剂量依赖性, 高剂量组除了HQS和槲寄生总碱48 h时间点外, A值均较对照组明显降低(P<0.01).
细胞分裂增殖是通过细胞不断经历细胞周期来实现的, 当细胞周期发生障碍时, 细胞增殖将受到抑制. 我们发现槲寄生多糖和总碱作用后, 可以将细胞阻滞在G1期(DNA合成前期), 而HQS可将细胞阻滞在G2期(分裂末期), 均引起细胞增殖受阻, 同时三种药物均引起细胞凋亡增加, 流式细胞仪检测呈现亚二倍体核型峰, 即凋亡峰(Ap)的特征, 表明将肿瘤细胞阻滞于G1期或G2期, 抑制细胞增殖, 诱导肿瘤细胞凋亡是3者抗肿瘤活性的重要形式之一. ROS是细胞有氧呼吸过程中产生的一些小分子物质, 包括超氧阴离子自由基(O2-)、羟自由基(OH)、过氧化氢(H2O2)以及氢氧根离子(OH-)等[14]. 低浓度的活性氧是细胞维持生存和生长不可或缺的因子[15], 高浓度的ROS又与增生抑制、细胞周期阻滞有关, 进一步升高ROS水平则可以通过损伤DNA,影响信号传导以及参与基因表达调控等途径介导细胞凋亡引发凋亡进而坏死[16-17], 是细胞凋亡的信号之一[18-23]. 大量实验证明[24-27]活性氧在细胞凋亡中的作用. 然而ROS并非是细胞凋亡必不可少的. ROS也能通过抑制凋亡信号传导途径中caspase-3/7的活性抑制凋亡的发生[28]. 王晓华et al[29]报道在SeO2引起的白血病细胞诱导凋亡过程中涉及细胞内ROS下降.
活性氧特异性荧光探针2', 7'-二氢二氯荧光素乙二脂(H2DCFH-DA)是一种可以自由穿过细胞膜的非荧光化合物, 在细胞内可以由酯酶水解生成不能透过细胞膜的离子DCFH (2', 7'-二氯氢化荧光素). 细胞内的活性氧可以氧化无荧光的DCFH, 生成有荧光的DCF. 由于活性氧自由基的含量与荧光探针的荧光强度呈正比, 因此通过DCF的荧光强度来表征胞内ROS含量的变化. 我们观察到, 负载荧光探针的细胞经激光照射后, 细胞内荧光强度呈现不断升高趋势, 当加入3种药物后, 荧光强度瞬间下降, 然后稳定在低水平, 未见明显波动. 当荧光开始稳定在一基线时, 加入槲寄生总碱, 荧光强度陡然增强后又迅速下降到低水平, 并维持一段时间, 而加入HQS及槲寄生多糖未见此变化. 由此分析, 槲寄生总碱引起的细胞凋亡可能与细胞内活性氧浓度升高有关. 有报道[30]槲寄生的有效成分可以降脂, 而且通过提高SOD的活性, 加强清除过氧化物自由基能力, 使过氧化脂质含量降低, 保护生物膜, 对动物粥样硬化等多种疾病起到预防和治疗作用, 但在肿瘤细胞方面未见相关报道.
HQS及槲寄生多糖作用于肝癌细胞未引起活性氧浓度的升高, 可能其抗癌机制并非活性氧的增高. 在我们的同期实验中, 发现2者可引起胞内钙超载, 这可能是其抗癌机制之一. 我们发现负载活性氧探针的肝癌细胞经激光光源照射后, 细胞的荧光呈不断增强趋势, 在所示的动态曲线上呈上升趋势, 可能是由于激光照射激发了肝癌细胞, 使胞内活性氧浓度不断升高所致, 但出现此现象的具体机制尚不清楚. 我们探讨了方剂槲芪散及槲寄生提取物多糖和总碱对肝癌细胞SMMC-7721的作用, 发现3者能抑制肿瘤细胞增殖, 促其凋亡; 同时可推测槲寄生是方剂槲芪散的有效成分之一, 并且初步认为槲寄生总碱致胞内活性氧浓度的升高是其诱导肝癌细胞凋亡的机制之一, 而槲芪散及槲寄生多糖的抗肿瘤机制可能不在于活性氧的升高, 还有待进一步探讨.
感谢北京市中医研究所李萍教授及各位老师给予的帮助.
阻断肝癌前病变是防治肝癌的理想目标, 寻找有效中草药的研究工作受到高度重视. 在证实了中药方剂"槲芪散"(HQS)具有抗氧化、清除自由基、阻断肝癌前病变作用的基础上, 本文比较了HQS及君药槲寄生提取物多糖、总碱对人肝癌细胞SMMC-7721生长的抑制作用及细胞内活性氧浓度的影响, 从细胞水平初步探讨其抗癌机制及方剂中的有效成分. 本实验为今后我们更深入探讨其抗癌具体机制奠定了一定的基础.
本实验为今后更深入探讨其抗癌具体机制奠定了一定的基础.
HQS、槲寄生多糖和总碱均能抑制肝癌细胞增殖并促进凋亡.
电编: 张敏 编辑:潘伯荣
| 6. | 朱 吉, 乔 晓洪, 周 健, 柏 峻, 张 继英, 余 奇文, 李 宁丽, 张 冬青. 槲寄生凝集素提取及其增强gd-T细胞抗瘤作用的实验性研究. 诊断学理论与实践. 2005;4:300-303. |
| 9. | Galm O, Fabry U, Efferth T, Osieka R. Synergism between rViscumin and cisplatin is not dependent on ERCC-1 expression. Cancer Lett. 2002;187:143-151. [PubMed] [DOI] |
| 10. | Li SS. Mistletoe lectins: telomerase inhibitors in alternative cancer therapy. Drug Discov Today. 2002;7:896-897. [PubMed] [DOI] |
| 11. | Lyu SY, Park WB, Choi KH, Kim WH. Involvement of caspase-3 in apoptosis induced by Viscum album var. coloratum agglutinin in HL-60 cells. Biosci Biotechnol Biochem. 2001;65:534-541. [PubMed] [DOI] |
| 15. | Wedgwood S, Dettman RW, Black SM. ET-1 stimulates pulmonary arterial smooth muscle cell proliferation via induction of reactive oxygen species. Am J Physiol Lung Cell Mol Physiol. 2001;281:L1058-1067. [PubMed] |
| 16. | Phillips DC, Allen K, Griffiths HR. Synthetic ceramides induce growth arrest or apoptosis by altering cellular redox status. Arch Biochem Biophys. 2002;407:15-24. [PubMed] [DOI] |
| 17. | Chung YW, Jeong DW, Won JY, Choi EJ, Choi YH, Kim IY. H(2)O(2)-induced AP-1 activation and its effect on p21(WAF1/CIP1)-mediated G2/M arrest in a p53-deficient human lung cancer cell. Biochem Biophys Res Commun. 2002;293:1248-1253. [PubMed] [DOI] |
| 18. | Bauer G. Reactive oxygen and nitrogen species: efficient, selective, and interactive signals during intercellular induction of apoptosis. Anticancer Res. 2000;20:4115-4139. [PubMed] |
| 19. | Martindale JL, Holbrook NJ. Cellular response to oxidative stress: signaling for suicide and survival. J Cell Physiol. 2002;192:1-15. [PubMed] [DOI] |
| 20. | Arimura T, Kojima-Yuasa A, Watanabe S, Suzuki M, Kennedy DO, Matsui-Yuasa I. Role of intracellular reactive oxygen species and mitochondrial dysfunction in evening primrose extract-induced apoptosis in Ehrlich ascites tumor cells. Chem Biol Interact. 2003;145:337-347. [PubMed] [DOI] |
| 21. | Ka H, Park HJ, Jung HJ, Choi JW, Cho KS, Ha J, Lee KT. Cinnamaldehyde induces apoptosis by ROS-mediated mitochondrial permeability transition in human promyelocytic leukemia HL-60 cells. Cancer Lett. 2003;196:143-152. [PubMed] [DOI] |
| 22. | Chu CY, Liu YL, Chiu HC, Jee SH. Dopamine-induced apoptosis in human melanocytes involves generation of reactive oxygen species. Br J Dermatol. 2006;154:1071-1079. [PubMed] [DOI] |
| 23. | Lin J, Wang Y, Wang G. Salt stress-induced progra-mmed cell death in tobacco protoplasts is mediated by reactive oxygen species and mitochondrial permeability transition pore status. J Plant Physiol. 2006;163:731-739. [PubMed] [DOI] |
| 24. | 刘 佳, 李 爱萍, 李 春平, 张 正东, 周 建伟. 活性氧在4-HPR诱导膀胱癌细胞T24凋亡中的作用. 中华劳动卫生职业病杂志. 2005;23:191-195. |
| 26. | 肖 晓岚, 向 姝霖, 彭 军, 黄 幼生, 唐 国华, 周 秀田, 黄 琛, 谢 娜, 葛 玲, 苏 琦. 二烯丙基三硫诱导人胃癌细胞凋亡与活性氧之间的关系. 中国肿瘤临床. 2006;33:374-377. |
| 28. | Ibuki Y, Goto R. The antiapoptotic effect of low-dose UVB irradiation in NIH3T3 cells involves caspase inhibitions. Photochem Photobiol. 2003;77:276-283. [PubMed] [DOI] |