修回日期: 2005-11-11
接受日期: 2005-11-24
在线出版日期: 2006-01-18
目的: 通过观察全反式维甲酸对慢性酒精性肝损伤大鼠肝脏TGF-β1、CTGF和Col1a1表达的影响, 探讨该药物对酒精性肝纤维化形成的作用.
方法: 大鼠24只随机分为3组: 酒精组(J组), 给予酒精-玉米油混悬液灌胃; 治疗组(A组), 给予上述混悬液灌胃8 wk后加用0.15 mg/(kg·d)的全反式维甲酸灌胃; 对照组(N组), 给予等量的生理盐水和玉米油灌胃. 16 wk后处死大鼠. 光、电镜下观察肝组织病理改变, 高压液相色谱法(HPLC)测肝组织中维甲酸的含量, 免疫组化法检测肝组织中转化生长因子β1(TGF-β1)和结缔组织生长因子(CTGF)的蛋白水平, 逆转录聚合酶链反应(RT-PCR)检测肝组织中TGF-β1、CTGF和Ⅰ型胶原前胶原a1(Col1a1)的mRNA水平.
结果: 光镜下酒精组及治疗组均呈不同程度的酒精性肝炎改变, 电镜下酒精组肝细胞线粒体肿胀, 内质网扩张, 脱颗粒, 而治疗组改变轻于酒精组. 肝组织中维甲酸含量: 酒精组低于正常组, 治疗组接近对照组水平. Col1a1的mRNA表达在酒精组中较对照组明显增高(0.18±0.03 vs 0.10±0.02, P<0.01), 治疗组较酒精组表达下降(0.14±0.03 vs 0.18±0.03, P <0.05). TGF-β1的mRNA及蛋白表达在酒精组中增高(0.53±0.17 vs 0.34±0.05, 105.93±10.12 vs 149.27±10.17, P<0.01), 治疗组相对于酒精组有所下降(0.41±0.06 vs 0.53±0.17, 130.80±6.23 vs 105.93±10.12, P<0.05). CTGF的mRNA及蛋白表达在酒精组中增高(0.41±0.13 vs 0.17±0.05, 130.84±5.72 vs 158.37±6.64, P<0.05), 治疗组对于酒精组有所下降(0.30±0.04 vs 0.41±0.13, 149.23±6.65 vs 130.84±5.72, P<0.05)
结论: 小剂量全反式维甲酸通过降低慢性酒精性肝损伤大鼠肝脏致纤维化因子TGF-β1, CTGF和Col1a1的表达抑制早期酒精性肝纤维化的形成.
引文著录: 付妤, 但自力, 唐望先, 晏维, 潘志红, 熊章鄂. 全反式维甲酸对慢性酒精性肝损伤大鼠肝脏 TGF-β1、CTGF 和 Col1a1 表达的影响. 世界华人消化杂志 2006; 14(2): 179-183
Revised: November 11, 2005
Accepted: November 24, 2005
Published online: January 18, 2006
AIM: To investigate the role of all-trans retinoic acid (ATRA) in the early stage of alcoholic liver fibrosis in rats, by observing its effect on the expression of transforming growth factor β1 (TGF-β1), connective tissue growth factor (CTGF) and pro alpha 1 (Ⅰ) collagen (Col1a1).
METHODS: Twenty-four rats were randomly and averagely divided into three groups, named J, A, and N. The rats in group J was given the mixture of ethanol and corn oil, and those in group A were added ATRA [0.15 mg/(kg.d)] after treatment with the same mixture for 8 wk. The animals in group N served as the controls, treating with the same amount of normal saline plus corn oil. All the mixtures were given intragastrically. All the animals were killed after 16 weeks. The histological changes of liver tissues were observed under light and electron microscope. The concentration of hepatic retinoic acid was examined using high-performance liquid chromatography (HPLC). The expression of TGF-β1, CTGF and Col1a1 mRNA were measured by reverse transcription-polymerase chain reaction (RT-PCR). The protein expression of TGF-β1 and CTGF were detected by immunohistochemistry.
RESULTS: Ethanol intake led to alcoholic hepatitis. The swelling mitochondria and expanding endoplasmic reticulum were observed under electron microscope in the rats of group J. The damage was partially alleviated in group A. The concentration of hepatic retinoic acid was significantly decreased in group J than that in group N and A (76.7 ± 29.1 pmol/g vs 182.6 ± 37.2, 182.8 ± 273.8 pmol/g, P < 0.05), while it was not markedly different between group A and N. The expression of Col1a1 mRNA was 0.10 ± 0.02, 0.18 ± 0.03, and 0.14 ± 0.03 in group N, J and A, respectively, and significant difference existed between either two groups (P < 0.05 or P < 0.01). Ethanol treatment elevated the protein and mRNA expression of TGF-β1 (gray level: 105.9 ± 10.1 vs 149.3 ± 10.2, P < 0.01; mRNA: 0.53 ± 0.17 vs 0.34 ± 0.05, P < 0.01) and CTGF (gray level: 130.8 ± 5.7 vs 158.4 ± 6.6, P < 0.05; mRNA: 0.41 ± 0.13 vs 0.17 ± 0.05, P < 0.05) markedly, but up-regulated expression were decreased after ATRA treatment (TGF-β1 gray level: 130.8 ± 6.2, mRNA: 0.41 ± 0.06; CTGF gray level: 149.2 ± 6.6, mRNA: 0.30 ± 0.04)(P < 0.05).
CONCLUSION: Small amount of ATRA can interfere the development of the ethanol-induced liver fibrosis in the early stage through suppressing the expression of TGF-β1, CTGF and Col1a1.
- Citation: Fu Y, Dan ZL, Tang WX, Yan W, Pan ZH, Xiong ZE. Effect of all-trans retinoic acid on expression of TGF-β1, CTGF and Col1a1 in chronic alcoholic liver disease in rats. Shijie Huaren Xiaohua Zazhi 2006; 14(2): 179-183
- URL: https://www.wjgnet.com/1009-3079/full/v14/i2/179.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i2.179
长期过量的酒精摄入会导致不同程度的肝损伤并逐步向肝纤维化、肝硬化发展. 在肝损伤早期可观察到肝组织中维甲酸含量下降[1-3]. 维甲酸含量的降低可影响肝星状细胞的激活[4], 从而影响TGF-β等一系列致纤维化因子的释放[5]. 目前, 对维甲酸在酒精性肝病中的作用研究的结果不一. 我们通过补充小剂量维甲酸, 观察其对慢性酒精性肝损伤中TGF-β1, CTGF和Col1a1的影响, 以探讨维甲酸在酒精性肝纤维化形成早期的作用及可能的机制.
Wistar♂大鼠(清洁级)24只, 体质量180-200 g, 购自同济医学院实验动物中心. 无水乙醇(上海振兴化工一厂). 金龙鱼牌玉米油(南海油脂公司). 维甲酸原药(山东良福制药有限公司). 美国产Waters 2690高效液相色谱仪及996-二极管阵列检测器, Millennium 3.20色谱软件. 色谱柱: Eurospher C18反相色谱柱(德国KNAUER公司). 抗大鼠TGF-β1和CTGF多克隆抗体(武汉博士德生物制品公司), SP免疫组化试剂盒(武汉凌飞试剂公司), ECL发光试剂(武汉众一试剂公司). M-MLV逆转录酶(Promega公司), TaqDNA聚合酶(北京鼎国公司). 引物均由上海生工合成.
大鼠正常喂养1 wk后随机分为3组: 对照组(N组)、酒精组(J组)、治疗组(A组), 每组8只. 生理盐水和无水乙醇配成500 mL/L乙醇. J组给予7 g/(kg·d)酒精及2 g/(kg·d)玉米油混悬液每日1次灌胃. A组以同样的方法灌胃8 wk后, 再将0.15 mg/(kg·d)的维甲酸溶于酒精-玉米油混悬液中灌胃. N组给予等量的玉米油和生理盐水灌胃. 实验期间正常饮食饮水, 16 wk末处死大鼠. 肝组织部分液氮速冻后-80℃贮存, 部分投入100 g/L中性甲醛固定, 石蜡包埋, 常规HE染色. 另40 g/L戊二醛固定标本, 树脂包埋, 透射电镜观察.
1.2.1 HPLC测肝组织中维甲酸含量: 方法参照Wang et al[2]. 取0.3 g肝组织在体积比为2:1的冰HEPES: 甲醇混合液中匀浆, 取1 mL匀浆液加入内标视黄醇醋酸酯后用正己烷抽提2次, N2吹干, 溶于无水乙醇中进样. 反向梯度HPLC的流动相为甲醇: 水(体积比70:30, 水中含10 g/L醋酸铵, 溶剂A)和甲醇(溶剂B). 梯度过程如下(流速1 mL/min): 1 000 mL/L溶剂A冲洗8 min后10 min线性梯度至300 mL/L溶剂A和700 mL/L溶剂B, 20 min的线性梯度至1 000 mL/L溶剂B, 并保持20 min, 再以2 min的线性梯度至1 000 mL/L溶剂A. 检测波长340 nm. 维甲酸的量通过内标的峰面积进行半定量.
1.2.2 免疫组织化学检测TGF-β1和CTGF蛋白: 采用免疫组织化学SP法, 操作步骤按试剂盒说明. TGF-β1﹑CTGF抗体稀释度均为1:200, 用PBS代替一抗作阴性对照. 采用Mias-2000图像分析系统分析结果: 每张切片任意选取10个区域, 在200倍物镜下测定阳性物质平均灰度值.
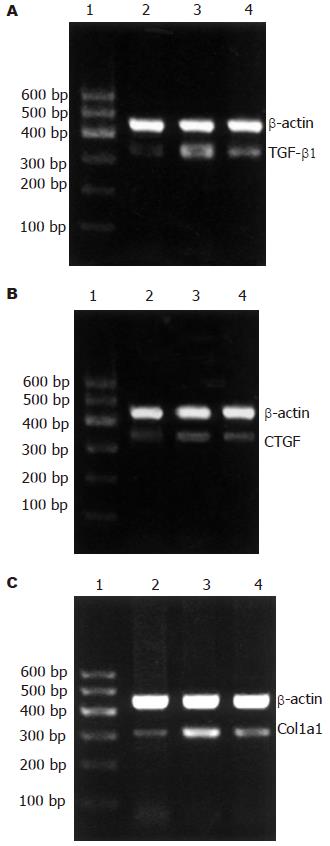
1.2.3 RT-PCR检测TGF-β1、CTGF和Col1a1: 采用半定量RT-PCR法检测, 以β-actin为内参照. 总RNA提取: 取50-100 mg肝组织剪碎后加Trizol于匀浆器中匀浆, 再用氯仿抽提, 异丙醇、乙醇沉淀, 最后溶于焦碳酸二乙酯处理过的水中. 取2 mg RNA进行逆转录, 步骤参照逆转录酶所附说明进行. 大鼠Col1a1的引物序列: 上游5'GTCCTATGGCTATGATGAGAAATC 3', 下游5'CACCATCCAAACCACTGAAAC 3'(335 bp); 大鼠TGF-β1的引物序列: 上游5'CCGCAACAACGCAATCTATG 3', 下游5'GCCCTGTATTCCGTCTCCTT 3'(304 bp); 大鼠CTGF 的引物序列: 上游5'CGGGAAATGCTGTGAGGAGT 3', 下游5'CAGGCTTGGCAATTTTAGGC 3'(326 bp); 大鼠β-actin的引物序列: 上游5'TGTGCTATGTTGCCCTAGACT 3', 下游5'TCGTACTCCTGCTTGCTGAT 3'(442 bp). PCR产物经琼脂糖凝胶电泳后用GDS-8000型凝胶成像系统照像并用自带的图像分析系统计算基因相对表达值. 目的基因相对表达值 = (目的基因条带灰度值) /(β-actin基因条带灰度值).
统计学处理 数据经SPSS 12.0软件处理, 采用t检验进行统计分析, 用mean±SD表示, 以P<0.05为显著性差异, P<0.01为极显著差异的检验标准.
试验过程中共有4只大鼠死亡, J组、A组各死亡2只. 其中2只死于误灌, 1只死于胃大出血, 1只死于胃扩张.
HE染色示J组肝组织切片呈大、小泡性脂肪变, 以大泡性为主. 病变在中央静脉周围及肝包膜下更为明显, 伴有点、灶状坏死, 炎性细胞浸润. A组中脂肪变、坏死及炎性改变较J组减轻. N组无上述改变. 电镜下J组细胞肿胀较明显, 胞质内线粒体轻度肿胀, 基质密度增高, 嵴模糊不清. 粗面内质网数量减少, 扩张, 大部分多聚核蛋白体从粗面内质网上脱落(脱颗粒). 滑面内质网扩张成囊状. 另可见少量肝细胞坏死, 细胞膜破裂, 肿胀的细胞器游离于细胞核周围, 核不规则改变, 染色质凝集. 胞质内可见散在分布的脂滴. A组肝细胞轻度肿胀, 线粒体基质密度稍增高, 嵴模糊不清. 粗面内质网数量无明显改变, 轻度扩张, 无明显脱颗粒现象. 滑面内质网轻度扩张. N组超微结构均正常.
J组与N组比较维甲酸含量明显下降(P<0.05). A组维甲酸含量接近N组水平(P>0.05)(表1).
TGFβ1在N组中仅少量表达于肝组织的间质细胞内, 在J组中表达增多, 分布于窦周细胞、炎性细胞、脂肪变性肝细胞胞膜及少数肝细胞胞质, 以肝小叶中央静脉和汇管区更为明显. CTGF在N组无表达或仅在汇管区基质及间质细胞胞质内有少量表达. 在J组中于窦周细胞、炎性细胞以及少数肝细胞也可见表达, 主要见于在胞质内, 胞膜上也有少量表达. 两种蛋白在A组中表达较J组减少(表1).
慢性过量的酒精摄入会导致肝组织中维甲酸含量的下降, 其可能的机制有: (1)维甲酸合成减少 肝组织中的维甲酸主要由VitA转化而来, 而乙醇与VitA的转化具有相似的通路, 都要经过乙醇脱氢酶代谢为相应的醛类, 因此乙醇可通过与VitA竞争性利用乙醇脱氢酶来抑制VitA向维甲酸的转化[6]. 同时乙醇还可促进VitA向肝外组织的转移, 从而减少维甲酸的合成[7]; (2)维甲酸代谢增加 细胞色素P4502E1可催化维甲酸代谢为极性产物, 而慢性的乙醇摄入可诱导细胞色素P450的合成, 加快维甲酸的代谢[8,9]. 维甲酸具有类似甲状腺素的作用机制, 可通过细胞核内DNA结合蛋白调节有关基因的表达从而发挥一系列生物效应[10]. Davis et al[11]发现维甲酸可抑制星状细胞的活化, 调节TGF-β1的产生. 目前, 国外对维甲酸在肝纤维化中的作用的研究结论不一. 有人发现维甲酸或其类似物可加重纤维化[12,13], 也有人发现他们可减轻肝纤维化[11,14]. 其原因可能与维甲酸种类、剂量不同以及模型和实验方法的不一致有关. 我们通过观察小剂量维甲酸对酒精性肝损伤大鼠肝脏中促纤维化因子的影响, 发现小剂量维甲酸具有抑制早期纤维化因子表达的作用. 其机制可能为维甲酸抑制TGF-β1表达从而减少CTGF及Col1a1的表达来发挥其抑制纤维化作用. 维甲酸受体RARa、RXRa与激活蛋白-1(AP-1)有相互拮抗作用[15,16], 增加维甲酸及其受体的含量可减少AP-1驱动的TGF-β1的产生[17]. CTGF属即刻早期基因, 在CTGF基因启动子序列中存在TGF-β的顺式调控元件(TGF-β RE), 位于启动序列-168 bp和-128 bp之间[18]. 机体损伤和纤维化发生时CTGF高表达并作为TGF-β的下游介质介导细胞外基质的生成[19]. Col1a1是Ⅰ型胶原a1链的编码基因, 其mRNA的转录亦受TGF-β的调控[20,21]. 维甲酸可能通过减少TGF-β1的表达来影响其介导的纤维化生成.
我们仅研究了小剂量维甲酸对酒精性肝损伤及肝纤维化的影响, 而不同剂量维甲酸对不同原因所致肝损伤及纤维化的作用还有待进一步研究.
华中科技大学附属同济医院病理科吴翠环教授对本实验病理学方面提供的支持, 山东良福制药有限公司提供维甲酸原药.
类维生素A与肝纤维化的关系一直是人们关心的课题. HSC是VitA的主要储存细胞, 人体大约90%的VitA储存在HSC中. 当HSC活化时, VitA含量明显减少, 因此我们猜测VitA含量与HSC的激活存在关联. 现在国外实验也证明小剂量VitA具有抗纤维化作用, 而大剂量则有促纤维化作用. VitA主要通过其代谢产物全反式维甲酸和其同分异构体9-顺式维甲酸及核内受体RAR/RXR起作用, 从而影响HSC的生理活动. 因此我们用维甲酸体外干预酒精性肝损伤观察他对肝纤维化早期的影响, 以了解维甲酸用于治疗肝纤维化的前景.
本文目的和创新点明确, 方法规范, 统计学结果可信, 有一定学术价值.
编辑: 潘伯荣 审读: 张海宁 电编: 张敏
| 1. | Senoo H. Structure and function of hepatic stellate cells. Med Electron Microsc. 2004;37:3-15. [PubMed] |
| 2. | Wang XD, Liu C, Chung J, Stickel F, Seitz HK, Russell RM. Chronic alcohol intake reduces retinoic acid concentration and enhances AP-1 (c-Jun and c-Fos) expression in rat liver. Hepatology. 1998;28:744-750. [PubMed] |
| 3. | Wang XD. Chronic alcohol intake interferes with retinoid metabolism and signaling. Nutr Rev. 1999;57:51-59. [PubMed] |
| 4. | Mann DA, Smart DE. Transcriptional regulation of hepatic stellate cell activation. Gut. 2002;50:891-896. [PubMed] |
| 5. | Li H, Zhang JS, Huang GC, Zhang N, Chen Q, Zhang XR. Effect of RAR-beta transfection on the proliferation and phenotype of rat hepatic stellate cells. Zhonghua Ganzangbing Zazhi. 2002;10:297-300. [PubMed] |
| 6. | Han CL, Liao CS, Wu CW, Hwong CL, Lee AR, Yin SJ. Contribution to first-pass metabolism of ethanol and inhibition by ethanol for retinol oxidation in human alcohol dehydrogenase family-implications for etiology of fetal alcohol syndrome and alcohol-related diseases. Eur J Biochem. 1998;254:25-31. [PubMed] |
| 7. | Mobarhan S, Seitz HK, Russell RM, Mehta R, Hupert J, Friedman H, Layden TJ, Meydani M, Lan-genberg P. Age-related effects of chronic ethanol intake on vitamin A status in Fisher 344 rats. J Nutr. 1991;121:510-517. [PubMed] |
| 8. | Liu C, Russell RM, Seitz HK, Wang XD. Ethanol en-hances retinoic acid metabolism into polar metabo-lites in rat liver via induction of cytochrome P4502E1. Gastroenterology. 2001;120:179-189. [PubMed] |
| 10. | Mark M, Ghyselinck NB, Chambon P. Function of Retinoid Nuclear Receptors: Lessons from genetic and pharmacological dissections of the retinoic acid signalling pathway during mouse embryoge-nesis. Annu Rev Pharmacol Toxicol. 2005;. [PubMed] |
| 11. | Davis BH, Kramer RT, Davidson NO. Retinoic acid modulates rat Ito cell proliferation, collagen, and transforming growth factor beta production. J Clin Invest. 1990;86:2062-2070. [PubMed] |
| 12. | Okuno M, Moriwaki H, Imai S, Muto Y, Kawada N, Suzuki Y, Kojima S. Retinoids exacerbate rat liver fibrosis by inducing the activation of latent TGF-beta in liver stellate cells. Hepatology. 1997;26:913-921. [PubMed] |
| 13. | Vollmar B, Heckmann C, Richter S, Menger MD. High, but not low, dietary retinoids aggravate mani-festation of rat liver fibrosis. J Gastroenterol Hepatol. 2002;17:791-799. [PubMed] |
| 14. | Hellemans K, Verbuyst P, Quartier E, Schuit F, Rombouts K, Chandraratna RA, Schuppan D, Geerts A. Differential modulation of rat hepatic stellate phenotype by natural and synthetic retinoids. Hepatology. 2004;39:97-108. [PubMed] |
| 15. | Benkoussa M, Brand C, Delmotte MH, Formstecher P, Lefebvre P. Retinoic acid receptors inhibit AP1 activation by regulating extracellular signal-regulated kinase and CBP recruitment to an AP1-responsive promoter. Mol Cell Biol. 2002;22:4522-4534. [PubMed] |
| 16. | DiSepio D, Sutter M, Johnson AT, Chandraratna RA, Nagpal S. Identification of the AP1-antagonism domain of retinoic acid receptors. Mol Cell Biol Res Commun. 1999;1:7-13. [PubMed] |
| 17. | Salbert G, Fanjul A, Piedrafita FJ, Lu XP, Kim SJ, Tran P, Pfahl M. Retinoic acid receptors and retinoid X receptor-alpha down-regulate the transforming growth factor-beta 1 promoter by antagonizing AP-1 activity. Mol Endocrinol. 1993;7:1347-1356. [PubMed] |
| 18. | Grotendorst GR, Lau LF, Perbal B. CCN proteins are distinct from, and should not be considered members of, the insulin-like growth factor-binding protein superfamily. J Clin Endocrinol Metab. 2001;86:944-945. [PubMed] |
| 19. | Abou-Shady M, Friess H, Zimmermann A, di Mola FF, Guo XZ, Baer HU, Buchler MW. Connective tissue growth factor in human liver cirrhosis. Liver. 2000;20:296-304. [PubMed] |
| 20. | Lindahl GE, Chambers RC, Papakrivopoulou J, Dawson SJ, Jacobsen MC, Bishop JE, Laurent GJ. Activation of fibroblast procollagen alpha 1(I) trans-cription by mechanical strain is transforming growth factor-beta-dependent and involves increased binding of CCAAT-binding factor (CBF/NF-Y) at the proximal promoter. J Biol Chem. 2002;277:6153-6161. [PubMed] |
| 21. | Falanga V, Zhou L, Yufit T. Low oxygen tension stimulates collagen synthesis and COL1A1 transcri-ption through the action of TGF-beta1. J Cell Physiol. 2002;191:42-50. [PubMed] |