修回日期: 2006-05-02
接受日期: 2006-05-11
在线出版日期: 2006-07-08
目的: 建立大鼠肝肠联合整体移植模型, 研究移植肝是否对移植小肠具有免疫保护作用.
方法: 选用封闭群SD大鼠和近交系Wistar大鼠. 实验分5组: 同基因小肠移植组、同基因肝移植组、异基因小肠移植组、异基因肝移植组、肝肠联合移植组. 同基因移植供受体均为Wistar大鼠, 异基因小肠移植、肝移植和肝肠联合移植供受体分别选用SD和Wistar大鼠. 肝肠联合移植在切取移植物后, 利用供体胸段下腔静脉在门静脉侧壁建立一袖套, 并安置套管. 受体手术时, 将此门静脉侧壁袖套与受体门静脉残端套管法吻合. 供体肠系膜上动脉与受体右肾动脉吻合. 免疫保护作用通过术后5, 7, 14 d从各组随机取出4只大鼠的移植物普通病理检查及细胞凋亡检测评估.
结果: 肝肠联合移植模型建立手术成功率73.3% (22/30). 同基因移植组术后仅表现为缺血-再灌注损伤所致的轻度组织损伤及炎症反应, 移植物细胞凋亡数逐渐减少. 异基因移植术后均出现急性排斥, 移植物细胞凋亡数递增, 并且较同基因移植多, 差别有显著性. 小肠移植术后5, 7, 14 d分别表现为轻度、中度和重度排斥. 而肝肠联合移植的小肠移植物术后5, 7, 14 d分别表现为轻度、轻度和中度排斥, 且14 d时小肠细胞凋亡数较异基因小肠移植组少, 差别具有显著性(16.9±4.3 vs 20.5±6.3, P<0.05). 术后各时间点异基因肝移植和肝肠联合移植的移植肝排斥反应严重程度相同, 细胞凋亡数比较无显著差异.
结论: 此法建立大鼠肝肠联合移植模型可行. 肝肠联合移植时肝对小肠具有免役保护作用.
引文著录: 肇毅, 陆森, 成峰, 华一兵, 吴文溪, 王学浩. 大鼠肝肠联合移植后肝对小肠的免疫保护作用. 世界华人消化杂志 2006; 14(19): 1878-1883
Revised: May 2, 2006
Accepted: May 11, 2006
Published online: July 8, 2006
AIM: To develop a new combined transplan-tation model of liver and small bowel in rats, and to investigate the protective effect of trans-planted liver on transplanted small bowel.
METHODS: Closed colony Sprague Dawley rats and inbred Wistar rats were included in this study. Five groups were designed: isogene small bowel transplant group (A), isogene liver transplant group (B), xenogene small bowel transplant group (C), xenogene liver transplant group (D), combined transplant of liver and small bowel group (E). Only Wistar rats were used in group A and B, while SD and Wistar rats were used as donors and recipients respectively in group C, D and E. During the combined transplantation of liver and small bowel (CTLS) for the donors, inferior vena cava in chest was cut to construct a muff in the lateral wall of portal vein and cuff was placed. During the operation for the recipients, portal veins of the donors and recipients were connected using cuff technique, and re-arterialization was completed by anastomosing the superior mesenteric artery of graft with the right kidney artery of the recipients. Randomly selected 4 rats from each group were sacrificed on postoperative days (POD) 5, 7 and 14, and grafts were sampled. The rejection of graft was investigated through histopathological analysis, and the apoptosis of the cells of graft were evaluated by TUNEL.
RESULTS: The survival rate of CTLS was 73.3% (22/30). The pathological changes of ischemia and reperfusion injury were observed in group A and B, and the numbers of apoptotic cells in the grafts were decreased with the prolonging of time. However, acute rejection after transplantation appeared in group C and D, and there were more apoptotic cells in the grafts. Mild, moderate and severe acute rejection occurred on POD 5, 7 and 14, respectively in group C, while only mild or severe acute rejection appeared in group E. Furthermore, the number of apoptotic cells in the grafts of group E was markedly decreased on POD 14 in comparison with that of group C (16.9 ± 4.3 vs 20.5 ± 6.3, P < 0.05). The degrees of acute rejection after transplantation and cell apoptosis of the grafts were not significantly different between group D and E.
CONCLUSION: The technique used in this study is feasible for establishment of CTLS model, and the transplanted liver can protect the transplanted intestinal graft from rejection in CTLS.
- Citation: Zhao Y, Lu S, Cheng F, Hua YB, Wu WX, Wang XH. Immuno-protective effect of liver on small bowel in combined transplantation of liver and small bowel. Shijie Huaren Xiaohua Zazhi 2006; 14(19): 1878-1883
- URL: https://www.wjgnet.com/1009-3079/full/v14/i19/1878.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i19.1878
短肠综合征合并终末期肝病常需进行肝肠联合移植, 但由于有限的临床病例数, 导致肝肠联合移植在临床应用过程中仍存在着许多不足之处, 尚有许多疑问有待于进一步研究[1-6], 所以成功建立动物模型并进行相关的机制研究非常重要. 我们利用供体下腔静脉在供体门静脉侧壁上预置袖套的方法建立大鼠肝肠联合整体移植模型, 通过组织病理学观察大鼠移植小肠及移植肝排斥反应发生情况, 并通过原位末端标记法(TUNEL)检测移植肝和移植小肠的细胞凋亡情况, 以了解大鼠肝肠联合整体移植后, 肝对小肠是否具有免疫保护作用.
♂封闭群SD大鼠(南京医科大学提供)和近交系Wistar大鼠(河南医科大学提供), 体质量250-280 g. TUNEL试剂盒购自Promega公司. 实验分5组: 同基因小肠移植组: Wistar→Wistar; 同基因肝移植组: Wistar→Wistar; 异基因小肠移植组: SD→Wistar; 异基因肝移植组: SD→Wistar; 异基因肝肠联合移植组: SD→Wistar. 同基因移植组每组各20对大鼠, 异基因移植组每组各30对大鼠. 所有大鼠术前禁食12 h. 清洁手术, 显微外科操作, 麻醉采用氯胺酮ip (100 mg/kg).
1.2.1 小肠移植模型及肝移植模型的建立: 小肠异位移植, 肠系膜上动脉和肾下腹主动脉端侧吻合, 门静脉和受体下腔静脉端侧吻合, 供肠两端腹壁造口. 肝移植模型的建立采用Kamada的标准双套管法[7]. 术后经阴茎静脉输注动脉血2-3 mL(由Wistar大鼠提供)和生理盐水2 mL, 禁食12 h后恢复正常饮食. 术后应用抗生素3 d, 各组均不用免疫抑制剂.
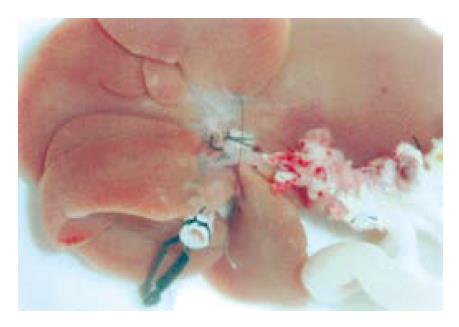
1.2.2 肝肠联合整体移植模型的建立: 供体手术: 游离肠系膜上动、静脉, 门静脉, 肝下下腔静脉. 分离肝周各韧带, 游离胆管并插管, 结扎切断肝动脉. 全身肝素化后阻断肠系膜上动脉开口近侧腹主动脉, 从肾下腹主动脉插管灌注. 灌注结束后, 打开胸腔, 剪取约1 cm长的下腔静脉胸段. 在门静脉左前壁幽门静脉水平将胸段下腔静脉和门静脉行端侧吻合(9-0尼龙线, 连续缝合), 吻合后预置自制聚乙烯套管, 预置肝下下腔静脉套管. 在靠近腹主动脉处剪断肠系膜上动脉, 选定灌注效果好的空肠段约8 cm, 两端离断, 肠腔冲洗后将移植物放在4 ℃乳酸钠林格液中保存(图1). 受体手术: 切除右肾, 并游离右肾动脉. 离断肝周韧带, 切除肝脏. 将供肝按Kamada双套管法原位置入(肝上下腔静脉采用对端缝合, 肝下下腔静脉以及供受体门静脉套管法吻合). 暂时阻断套管远端的供体肠系膜上静脉以防血液返流入供肠. 恢复肝血流, 结束无肝期. 供体肠系膜上动脉和受体右肾动脉端端吻合, 开放血流后见供肠迅速变红, 肠系膜血管搏动有力, 将胆管插管插入受体胆总管, 丝线结扎固定. 供肠处理同前述小肠移植, 术后处理同前.
1.2.3 大鼠移植肝及移植小肠术后组织病理学检查: 于术后5, 7, 14 d从存活的各组大鼠中随机取出4只处死, 并切取小肠和肝脏进行组织病理学检查(HE染色). 依据Schmid et al[8]介绍的病理诊断标准判定大鼠小肠移植排斥反应的程度: 轻度: 肠黏膜绒毛轻度畸形, 间质有少量炎症细胞浸润; 中度: 肠绒毛畸形更加明显, 黏膜上皮开始有脱落, 细胞浸润加重; 重度: 肠绒毛结构消失, 上皮脱落, 肠壁变薄并有坏死, 间质大量炎细胞浸润, 血管炎明显. 依据Williams et al[9]介绍的病理诊断标准判定大鼠肝移植排斥反应的程度: 0级: 无排斥证据; Ⅰ级: 轻度排斥, 轻度汇管区单核细胞浸润及血管内皮炎. Ⅱ级: 中度排斥, 汇管区较重单核细胞浸润伴肝细胞局灶坏死, 但无桥接坏死. Ⅲ级: 严重排斥, 汇管区显著单核细胞浸润, 肝实质桥接坏死.
1.2.4 TUNEL法检测移植肝和移植小肠细胞凋亡: 标本用40 g/L中性甲醛固定, 石蜡包埋; 切片经二甲苯脱蜡, 逐级在乙醇中水化; 切片加TdT和DIG-dUTP, 置样品于湿盒中, 37 ℃孵育3 h; TBS洗涤3次后, 加封闭液50 µL/片, 室温30 min, 甩掉封闭液, 不洗; 用封闭液1:100稀释生物素化地高辛抗体, 加至标本上, 置样品于湿盒中, 37 ℃反应30 min; TBS洗涤3次, 每次2 min; 加SABC至切片, 37 ℃反应30 min; TBS洗涤5次, 每次2 min; 显色10-30 min, 水洗, DAB显色; 苏木素轻度复染, 蒸馏水洗涤; 脱水, 透明, 甘油明胶封闭, 显微镜观察. 阳性结果判断: 凋亡细胞染色定位于细胞核, 呈黄褐色. 凋亡细胞计数: 每片10个高倍视野下计凋亡细胞数, 取平均值, 根据细胞形态学特征计算移植物细胞凋亡数.
统计学处理 术后3 d内死亡列为技术性并发症, 术后存活3 d以上者为手术成功, 纳入手术成功率的计算. 各组数据以mean±SD表示, 采用t检验, 用统计软件包SPSS 12.0处理.
小肠移植总手术时间约90 min, 其中供体手术时间约38 min, 受体手术时间约52 min. 肝移植总手术时间约96 min, 其中供体手术时间约42 min, 受体手术时间约54 min, 其中无肝期17 min. 肝肠联合移植总手术时间平均165 min, 供体平均手术时间90 min, 受体平均手术时间75 min, 其中无肝期平均17 min. 同基因小肠移植组、同基因肝移植组、异基因小肠移植组、异基因肝移植组及肝肠联合移植组的手术成功率分别为90.0% (18/20), 85.0% (17/20), 83.3% (25/30), 80.0% (24/30)及73.3% (22/30). 常见死亡原因包括: 失血性休克、静脉血栓形成及不明原因.
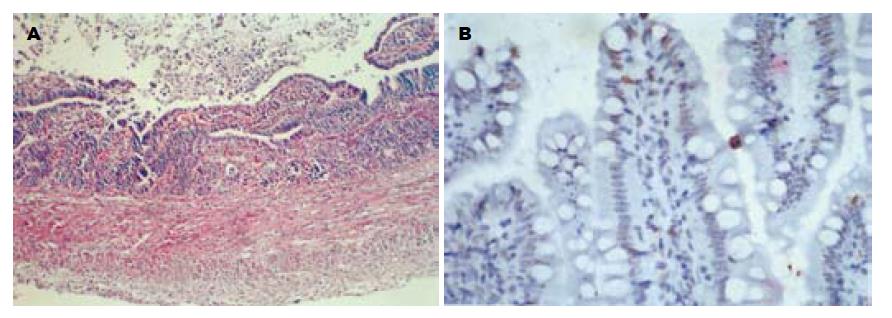
依据Schmid et al[8]介绍的判定大鼠小肠移植排斥反应(图2A)程度病理诊断标准以及Williams et al[9]介绍的判定大鼠肝移植排斥反应程度病理诊断标准, 各组移植物排斥反应的程度不一(表1).
| 分组 | 5 d | 7 d | 14 d |
| 同基因小肠移植 | 无 | 无 | 无 |
| 同基因肝移植 | 无 | 无 | 无 |
| 异基因小肠移植 | 轻度 | 中度 | 重度 |
| 异基因肝移植 | 轻度 | 轻度 | 中度 |
| 肝肠联合移植 (肠) | 轻度 | 轻度 | 中度 |
| 肝肠联合移植 (肝) | 轻度 | 轻度 | 中度 |
同基因、异基因肝移植组及肝肠联合移植组, 术后均出现肝细胞凋亡. 同基因肝移植组细胞凋亡数随时间推移而逐渐减少, 异基因肝移植组及肝肠联合移植组术后凋亡细胞数随时间推移而呈上升趋势. 术后各时间点, 肝肠联合移植组、异基因肝移植组与同基因肝移植组在肝细胞凋亡方面比较均有显著差异(P<0.05), 而肝肠联合移植组与异基因肝移植组之间比较无显著差异(表2). 同基因、异基因小肠移植组及肝肠联合移植组的小肠移植物术后均出现小肠黏膜上皮细胞凋亡(图2B). 同基因小肠移植组小肠黏膜上皮细胞凋亡数随术后时间的延长而逐渐减少, 异基因小肠移植组、肝肠联合移植组小肠黏膜上皮细胞凋亡数随术后时间的延长而递增, 且术后各时间点小肠黏膜上皮细胞凋亡数均多于同基因小肠移植组, 差别有显著性(P<0.01). 肝肠联合移植组及异基因小肠移植组术后5, 7 d, 肠黏膜上皮细胞凋亡数两组无显著差异; 术后14 d, 肝肠联合移植组小肠黏膜上皮细胞凋亡数显著低于异基因小肠移植组(P<0.05, 表2).
提高肝肠联合移植模型手术成功率的关键是尽量缩短无肝期, 尽量减轻对血流动力学的影响[10-16], 本研究中模型的构建法正是顺应了该要求. 我们事先利用胸段下腔静脉预置门静脉侧壁袖套并安置套管, 这样门静脉吻合时只要将套管插入受体门静脉并结扎即可, 无疑会比缝合法节省时间(约7-8 min), 缩短无肝期使之与Kamada的标准"双套管法"大鼠原位肝移植无肝期相同, 这种方法文献中尚未见报道. 利用胸段下腔静脉有以下几个优点: (1)该段血管本身就是游离的, 不需分离; (2)长度足够, 口径适当; (3)无血管侧枝. 动脉重建采用建立小肠移植模型的动脉吻合方式[17], 即切除一侧肾脏, 将肠系膜上动脉和肾动脉端端吻合, 这样不需阻断腹主动脉, 减轻了对血流动力学的影响. 既往研究提示肝移植常可诱导特异性免疫耐受. 单独肝脏移植与其他单独器官移植相比, 肝移植物可通过直接产生免疫耐受而更易被受体接受; 另一方面, 肝与其他器官联合移植时常可使其他移植物免受排斥或减轻排斥反应[18-21]. 为了进一步探讨肝肠整体移植后, 肝对小肠是否具有免疫保护作用, 本研究将同基因单独小肠、肝移植作为空白对照以排除缺血-再灌注损伤的影响, 以异基因单独小肠、肝移植为对照, 研究了肝肠联合移植术后移植小肠和移植肝的组织病理学改变及细胞凋亡情况.
组织病理检查是判断移植术后排斥反应是否发生及其严重程度的最客观的指标之一. 本研究中同基因单独小肠、肝移植组织学检查一直未出现排斥反应, 仅表现为缺血-再灌注损伤所致的轻度组织损伤及炎症反应. 异基因肝移植组及肝肠联合移植组的肝脏术后排斥反应出现的时间及严重程度类似, 提示肝肠联合移植并未增加对移植肝的免疫排斥. 与异基因小肠移植组相比, 肝肠联合移植组虽然手术成功率略低于前者(主要考虑与多脏器移植术创伤较大相关), 但术后发生排斥反应的程度则显著降低: 异基因小肠移植术后5 d呈轻度排斥, 7 d呈中度, 14 d出现重度排斥反应, 而肝肠联合移植术后5, 7 d表现为轻度排斥反应, 14 d时仅表现为中度排斥, 提示肝肠联合移植术后, 移植肝可减轻对移植肠的排斥或延缓排斥反应出现的时间.
器官移植后, 免疫系统常可通过多种途径导致移植物细胞凋亡, 从而进一步导致移植后排斥反应的发生[22-27]. 在本研究中同基因单独小肠、肝移植中细胞凋亡考虑与一过性的缺血-再灌注损伤相关, 随着损伤的迅速缓解, 细胞凋亡数亦相应减少. 与同基因移植组相比, 术后5, 7, 14 d异基因单独小肠、肝移植组及肝肠联合移植组细胞凋亡数均明显高于前者, 提示此时细胞凋亡的发生除因缺血-再灌注损伤所致外, 主要应与术后排斥反应的发生相关. 与异基因小肠移植组相比, 肝肠联合移植组术后14 d细胞凋亡数显著低于前者, 这进一步提示移植肝可减轻机体对移植肠的排斥或延缓排斥反应出现的时间. 和组织病理学结果类似, 本研究中肝肠联合移植组与异基因肝移植组相比, 术后细胞凋亡数无显著性差异, 提示肝肠联合移植术后肝对小肠发挥免疫保护作用的同时, 其自身免疫原性并没有增加.
总之, 采用此预置门静脉侧壁袖套的方法建立大鼠肝肠联合移植模型是可行的, 肝肠联合移植时肝对小肠具有免疫保护作用.
短肠综合征合并终末期肝病常需进行肝肠联合移植, 而对于肝肠联合移植时移植肝是否对移植小肠具有免疫保护作用目前仍存在争论.
肝肠联合移植手术方式的优化, 肝肠联合移植时移植肝诱导对移植小肠免疫耐受的机制, 仍然是当前研究热点.
德国学者Meye采用与本文类似的方法建立肝肠联合整体移植大鼠模型, 即供受体门静脉缝合法吻合, 肠系膜上动脉和受体肾下腹主动脉端侧吻合.
本文首次采用在供体门静脉侧壁上预置袖套的方法建立大鼠肝肠联合移植模型, 在国内外未见报道.
本文提供了一种理想的建立肝小肠联合整体移植大鼠模型的方法, 为肝肠联合移植的基础研究提供了一种理想模型.
本文通过技术改进成功建立大鼠肝肠联合整体移植模型, 并研究移植肝是否对移植小肠具有免疫保护作用, 有一定的新颖性和可读性.
电编: 张敏 编辑:潘伯荣
| 1. | Kelly DA. Intestinal failure-associated liver disease: what do we know today? Gastroenterology. 2006;130:S70-S77. [PubMed] [DOI] |
| 2. | Testa G, Holterman M, John E, Kecskes S, Abcarian H, Benedetti E. Combined living donor liver/small bowel transplantation. Transplantation. 2005;79:1401-1404. [PubMed] [DOI] |
| 3. | Grant D, Abu-Elmagd K, Reyes J, Tzakis A, Langnas A, Fishbein T, Goulet O, Farmer D. 2003 report of the intestine transplant registry: a new era has dawned. Ann Surg. 2005;241:607-613. [PubMed] [DOI] |
| 4. | Horslen SP, Sudan DL, Iyer KR, Kaufman SS, Iverson AK, Fox IJ, Shaw BW, Langnas AN. Isolated liver transplantation in infants with end-stage liver disease associated with short bowel syndrome. Ann Surg. 2002;235:435-439. [PubMed] [DOI] |
| 5. | Herlenius G, Friman S, Backman L, Krantz M, Saalman R, Ascher H, Nilsson O, Mjornstedt L, Ostraat O, Lindner P. Initial experience with multivisceral, cluster, and combined liver and small bowel transplantation in Sweden. Transplant Proc. 2002;34:865. [PubMed] [DOI] |
| 6. | Nishida S, Levi D, Kato T, Nery JR, Mittal N, Hadjis N, Madariaga J, Tzakis AG. Ninety-five cases of intestinal transplantation at the University of Miami. J Gastrointest Surg. 2002;6:233-239. [PubMed] [DOI] |
| 7. | Kamada N, Calne RY. A surgical experience with five hundred thirty liver transplants in the rat. Surgery. 1983;93:64-69. [PubMed] |
| 8. | Schmid T, Oberhuber G, Korozsi G, Klima G, Margreiter R. Histologic pattern of small bowel allograft rejection in the rat. Mucosal biopsies do not provide sufficient information. Gastroenterology. 1989;96:1529-1532. [PubMed] [DOI] |
| 9. | Williams JW, Peters TG, Vera SR, Britt LG, van Voorst SJ, Haggitt RC. Biopsy-directed immunosu-ppression following hepatic transplantation in man. Transplantation. 1985;39:589-596. [PubMed] [DOI] |
| 10. | Gao W, Lemasters JJ, Thurman RG. Development of a new method for hepatic rearterialization in rat orthotopic liver transplantation. Reduction of liver injury and improvement of surgical outcome by arterialization. Transplantation. 1993;56:19-24. [PubMed] [DOI] |
| 11. | Yin ZY, Ni XD, Jiang F, Li N, Li YS, Wang XM, Li JS. Auxiliary en-bloc liver-small bowel transplantation with partial pancreas preservation in pigs. World J Gastroenterol. 2004;10:1499-1503. [PubMed] [DOI] |
| 12. | Jiang F, Yin ZY, Ni XD, Li YS, Li N, Li JS. Modifica-tions in combined liver-small bowel transplantation in pigs. World J Gastroenterol. 2003;9:2125-2127. [PubMed] [DOI] |
| 13. | Yin ZY, Ni XD, Jiang F, Li N, Li YS, Li JS. Modified technique for combined liver-small bowel transplantation in pigs. World J Gastroenterol. 2003;9:1625-1628. [PubMed] [DOI] |
| 14. | Sudan DL, Iyer KR, Deroover A, Chinnakotla S, Fox IJ Jr, Shaw BW Jr, Langnas AN. A new technique for combined liver/small intestinal transplantation. Transplantation. 2001;72:1846-1848. [PubMed] [DOI] |
| 15. | Chen YX, Sato M, Watanabe Y, Kashu Y, Kikkawa H, Suzuki H, Kohtani T, Miyauchi K, Kito K, Kawachi K. Surgical technique for combined intestine-auxiliary liver transplantation in rats: development of a new microsurgical model. Microsurgery. 2001;21:1-5. [PubMed] [DOI] |
| 16. | Gondolesi GE, Rodriguez-Davalos M, Soltys K, Florman S, Kaufman S, Fishbein T. End-to-end portocaval shunt for venous drainage of the native foregut in combined liver-intestinal transplantation. Pediatr Transplant. 2006;10:98-100. [PubMed] [DOI] |
| 17. | Wallander J, Holtz A, Larsson E, Gerdin B, Lackgren G, Tufveson G. Small-bowel transplantation in the rat with a nonsuture cuff technique. Technical and immunological considerations. Transpl Int. 1988;1:135-139. [PubMed] [DOI] |
| 18. | Zhang WJ, Liu DG, Ye QF, Sha B, Zhen FJ, Guo H, Xia SS. Combined small bowel and reduced auxiliary liver transplantation: case report. World J Gastroenterol. 2002;8:956-960. [PubMed] [DOI] |
| 19. | Jugie M, Canioni D, Le Bihan C, Sarnacki S, Revillon Y, Jan D, Lacaille F, Cerf-Bensussan N, Goulet O, Brousse N. Study of the impact of liver transplantation on the outcome of intestinal grafts in children. Transplantation. 2006;81:992-997. [PubMed] [DOI] |
| 20. | Buchman AL, Iyer K, Fryer J. Parenteral nutrition-associated liver disease and the role for isolated intestine and intestine/liver transplantation. Hepatology. 2006;43:9-19. [PubMed] [DOI] |
| 21. | Goulet O, Damotte D, Sarnacki S. Liver-induced immune tolerance in recipients of combined liver-intestine transplants. Transplant Proc. 2005;37:1689-1690. [PubMed] [DOI] |
| 22. | Fayyazi A, Schlemminger R, Gieseler R, Peters JH, Radzun HJ. Apoptosis in the small intestinal allograft of the rat. Transplantation. 1997;63:947-951. [PubMed] [DOI] |
| 23. | Meyer D, Baumgardt S, Loeffeler S, Czub S, Otto C, Gassel HJ, Timmermann W, Thiede A, Ulrichs K. Apoptosis of T lymphocytes in liver and/or small bowel allografts during tolerance induction. Transplantation. 1998;66:1530-1536. [PubMed] [DOI] |
| 24. | Meyer D, Baumgardt S, Loffeler S, Gassel HJ, Czub S, Ulrichs K, Thiede A. Apoptosis in combined liver/small bowel transplantation. Transplant Proc. 1998;30:2588. [PubMed] [DOI] |
| 25. | Cailhier JF, Laplante P, Hebert MJ. Endothelial apoptosis and chronic transplant vasculopathy: recent results, novel mechanisms. Am J Transplant. 2006;6:247-253. [PubMed] [DOI] |
| 26. | Gomez L, Raisky O, Chalabreysse L, Verschelde C, Bonnefoy-Berard N, Ovize M. Link between immune cell infiltration and mitochondria-induced cardiomyocyte death during acute cardiac graft rejection. Am J Transplant. 2006;6:487-495. [PubMed] [DOI] |