修回日期: 2006-05-01
接受日期: 2006-05-11
在线出版日期: 2006-06-28
目的: 探讨T84.66单链抗体的原核表达及对6种胃癌细胞系及胃癌组织的特异性亲和力.
方法: 将抗CEA单链抗体T84.66的cDNA插入噬菌粒载体pCANTAB5E, 获得噬菌粒载体T84.66-scFv-pCANTAB5E. 将后者转化入E.coli HB2151, 经β, D异丙基硫代半乳糖苷(IPTG)诱导表达. 采用细胞培养及免疫细胞/组织化学方法, 检测胃癌细胞中及石蜡包埋的胃癌组织中的癌胚抗原表达.
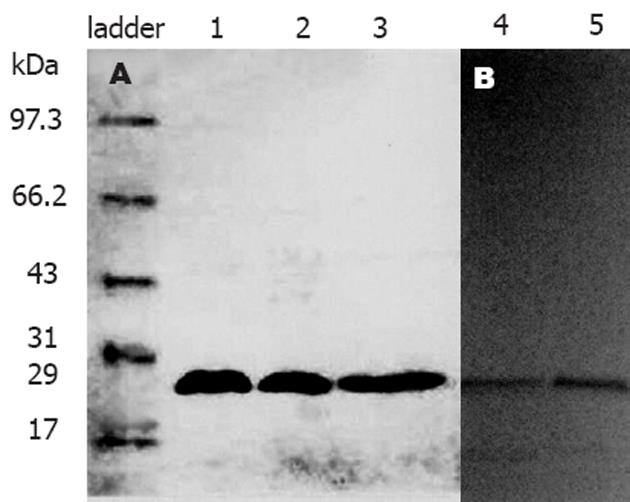
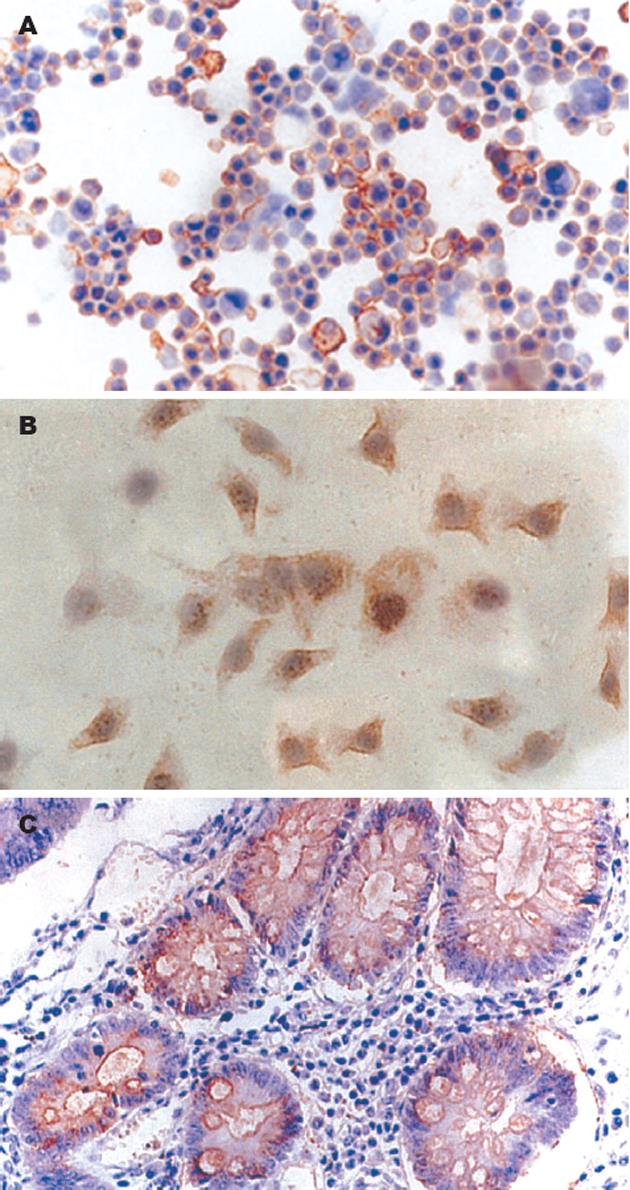
结果: SDS-PAGE及Western blot证实, T84.66单链抗体蛋白分子正确表达. T84.66单链抗体可结合KATOⅢ, HGC-27和MKN45, 表明这3种细胞表达了特异性肿瘤抗原; 单链抗体不能结合SGC7901, GC803, BGC823. 42例胃癌组织癌胚抗原阳性率早期和进展期分别为55%(6/11)和61%(19/31), 在正常胃黏膜组织标本中无表达, 二者之间存在显著性差异 (P<0.05).
结论: KATOⅢ等胃癌细胞系可表达癌胚抗原. 后者在胃癌组织表达水平较高, 而正常胃组织不表达.
引文著录: 徐宏勇, 徐立, 高建宏, 杨建军, 李开宗, 窦科峰. 抗癌胚抗原单链抗体的原核表达及对人胃癌的检测. 世界华人消化杂志 2006; 14(18): 1780-1784
Revised: May 1, 2006
Accepted: May 11, 2006
Published online: June 28, 2006
AIM: To study the prokaryotic expression of the anti-carcinoembryonic antigen (CEA) single-chain fragment variable (scFv) antibody T84.66 and its specific affinity to gastric cancer cell lines and tissues.
METHODS: The cDNA of anti-CEA scFv antibody was inserted into pCANTAB5E to obtain phage vector T84.66-scFv-pCANTAB5E, and then the vector was transferred into E. coli HB2151. Isopropyl-β-D-thiogalactoside (IPTG) was used to induce the expression of anti-CEA scFv antibody. SDS-PAGE and Western blot were used identify the anti-CEA scFv antibody. Human gastric cancer cells were cultured, and CEA was determined with the obtained scFv by immunohistochemistry in the cells and paraffin-embedded gastric carcinoma tissues.
RESULTS: SDS-PAGE and Western blot showed that the anti-CEA scFv antibody T84.66 was successfully expressed. T84.66 could bind to gastric carcinoma cell lines KATOⅢ, MKN45 and HGC-27, but not to SGC7901, GC803 and BGC823, suggesting that KATOⅢ, MKN45 and HGC-27 cells expressed CEA. For the 42 cases gastric carcinoma tissues, the positive rate of CEA in the early and progressive stage was 55% (6/11) and 61% (19/31), respectively, but no CEA expression was found in the 10 normal cases. CEA expression was significantly different between gastric cancer and normal tissues (P < 0.05).
CONCLUSION: The prokaryotic expression of anti-CEA scFv antibody T84.66 is successfully achieved, and can be used to identify CEA. CEA is highly expressed in gastric cancer, but not in normal mucosa.
- Citation: Xu HY, Xu L, Gao JH, Yang JJ, Li KZ, Dou KF. Prokaryotic expression of anti-carcinoembryonic single-chain variable fragment and its value in detection of gastric carcinoma cells. Shijie Huaren Xiaohua Zazhi 2006; 14(18): 1780-1784
- URL: https://www.wjgnet.com/1009-3079/full/v14/i18/1780.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i18.1780
癌胚抗原(CEA)是在胃肠道肿瘤的发生、发展过程中, 细胞表面及细胞内产生的一种正常细胞不能产生的肿瘤标志物[1-2]. CEA的出现是胃肠道肿瘤的一个重要生物学特性, 通过对其进行检测就可判断肿瘤的性质及预后. 针对CEA获得的单克隆抗体/单链抗体在对肿瘤的诊治中的作用不容忽视[3]. 我们用原核表达得到T84.66单链抗体[4], 分别对6种胃癌细胞和胃癌组织进行检测, 以期初步明确抗CEA单抗对胃癌细胞组织的特异性识别, 并结合情况为进一步利用该抗体进行重组制备胃癌特异性杀伤淋巴细胞奠定基础[5].
胃癌细胞系KATOⅢ, HGC-27, SGC7901, GC803, MKN45和BGC823均购自上海细胞生物研究所. KATOⅢ为悬浮生长, HGC-27, SGC7901, GC803, MKN45和BGC823均为贴壁生长. 上述细胞系均培养于含胎牛血清的RPMI 1640培养液中, 37℃, 50 mL/L CO2, 饱和湿度条件下, 在其对数生长期传代. KATOⅢ细胞传代后将其经甩干机甩干载玻片, 其他细胞贴壁于载玻片后用固定液固定20 min, 晾干备染. 胃癌与正常胃黏膜标本, 均取自第四军医大学西京医院2000/2003手术切除, 并经病理学检查证实的组织. 42例胃癌按国际病理学分级, 高、中和低分化型分别为7例、17例和18例. 患者按胃癌的临床分期, 早期和进展期分别为11例和31例. 同时, 取10例正常胃黏膜组织为活检后证实组织, 切片均经40 g/L甲醛固定, 常规石蜡包埋, 5 μm连续切片, 贴于已经APES防脱片胶处理的载玻片上备染. 抗CEA特异性T84.66单链抗体由Anna Wu教授提供[6-7]. 抗E-tag mAb/HRP购自Pharmacia公司.
T84.66单抗的原核表达. 将抗CEA单链抗体T84.66的cDNA插入噬菌粒载体pCANTAB5E, 下游接有E-tag DNA序列, 得到噬菌粒载体T84.66-scFv-pCANTAB5E. 将后者转化入E.coli HB2151, 经β, D异丙基硫代半乳糖苷(IPTG)诱导表达, 单链抗体表达于细菌的胞质中[8]. 经过冻干、纯化后, 用SDS-PAGE电泳, 可获得含E-tag的抗CEA scFv融合蛋白, 通过蛋白的原核表达, 并通过SDS-PAGE及Western blot检测E-tag分子标签(用抗E-tag mAb/HRP为抗体), 证实抗CEA单链抗体T84.66的蛋白分子的表达. 免疫组织化学方法操作步骤按文献[9]所述, 稍有改动. 将二抗用抗E-tag mAb/HRP替代, 阳性对照为已知CEA表达阳性的大肠癌, 空白对照用PBS代替一抗, 阴性对照用无关抗体(抗乙脑病毒mAb)代替一抗. 将细胞贴壁并经固定的载玻片经PBS振洗3次后, 加入抗CEA scFv为一抗, 其他操作相同. 结果判定: 标本中细胞染色呈棕黄色, 且阳性细胞多于10%者为阳性; 无阳性细胞或阳性细胞少于10%, 或背景同空白对照者均判为阴性.
将在原核表达的抗CEA单链抗体T84.66蛋白粗提物经冻干纯化后, 得到抗CEA scFv-E-tag融合蛋白. 在SDS-PAGE电泳显示分子质量为29 kDa, 与理论值相符. 经过Western blot检测E-tag的表达, 证实位于E-tag分子标签上游的CEA特异性T84.66单链抗体蛋白分子得以正确表达(图1).
胃肠道肿瘤发病率很高, 早期胃癌的手术切除率低, 辅助化疗疗效不满意[10], 对CEA[11-12], AFP[13], CA199[14], CA125[15]和TAG-72[16]等肿瘤特异性抗原的检测已广泛应用于临床诊治和判断肿瘤预后. 抗CEA mAb有包括来源于杂交瘤T84.66等数种[17-18]. 将单克隆抗体进一步小型化将更利于生物工程改造, 或者可以得到抗CEA的diabody[19], 这些T84.66单链抗体都避免了应用单克隆抗体的种属间过敏反应, 保持了mAb的Fab段, 具有分子小、穿透力强等特点, 尤其在放射诊治方面显示了优点[20-22]. 嵌合微型抗体cT84.66是分子质量80 kDa的二价生物工程抗体, 对CEA的亲和力为4×1010 m-1[23]. 将cT84.66进行同位素标记已经用于Ⅰ期临床, 以治疗CEA阳性的原发癌及转移癌患者[24-25]. 通过用CEA抗原锚定肿瘤细胞, 用免疫细胞以杀伤肿瘤是一种新的免疫治疗方案[26]. 我们通过基因工程原理已构建了靶向性癌胚抗原T84.66的scFv融合基因的真核表达载体[5], 为便于检测其表达, 通过单链抗体的原核表达, 往往在其cDNA分子下游有6×His[27]或E-tag分子标签, 我们得到的重组抗体通过检测E-tag可以明确T84.66 scFv的表达. 为明确T84.66单链抗体的亲和力及识别胃癌细胞及组织的阳性结合率, 通过用原核表达获得的T84.66单链抗体对6种胃癌细胞的亲和力鉴定, 证实可以和MKN45, KATOⅢ, HGC-27特异性结合, 即上述几种胃癌细胞分化过程中产生了T84.66单链抗体可识别的CEA抗原, 证明胃癌细胞系中表达CEA阳性率较高, 这同时为胃癌的研究获取了宝贵的实验数据. 同时发现, T84.66单链抗体在胃癌中有较好的阳性率, 较高的亲合力, 而在胃黏膜正常组织不会结合, 即具有肿瘤识别特异性, 表明在胃癌组织和细胞中有较高的阳性率, 可望应用于临床实践.
通过构建单链抗体我们获取了表达的方法, 证实后者在胃癌等多种消化道肿瘤中有良好的表达, 这为我们构建的肿瘤特异性真核表达载体[5]并制备特异性杀伤T细胞奠定了基础.
癌胚抗原(CEA)是胃肠道恶性肿瘤产生的一种肿瘤标志物. 人们通过检测CEA以判断肿瘤的性质及预后, 也可通过获取CEA单抗治疗肿瘤. 本文采用抗CEA单抗筛选胃癌细胞, 检测胃癌组织, 进而为进一步胃癌的治疗奠定基础.
癌胚抗原的研究一直是肿瘤学的热点问题. 单克隆抗体的使用由于受排异问题的影响受到限制, 对其改造不但解决了过敏反应, 而且保持了mAb的Fab段, 具有分子小、穿透力强等特点, 并且可以进行基因工程改造. 但目前易出现亲和力下降、特异性差的问题, 因而使抗体扬长避短是十分重要的问题.
本文使用T84.66单链抗体获取有效的表达方法, 证明表达产物的生物活性, 并对多种胃癌细胞、组织进行检测.
证实单链抗体的活性对基因工程改造十分关键. 人们可以在此基础上通过创造性的引用治疗消化道肿瘤.
该研究起点与层面较高, 研究内容有特色, 结论有启示性, 有一定的学术价值.
电编: 张敏 编辑:潘伯荣
| 1. | Chau I, Allen MJ, Cunningham D, Norman AR, Brown G, Ford HE, Tebbutt N, Tait D, Hill M, Ross PJ. The value of routine serum carcino-embryonic antigen measurement and computed tomography in the surveillance of patients after adjuvant chemotherapy for colorectal cancer. J Clin Oncol. 2004;22:1420-1429. [PubMed] [DOI] |
| 2. | Wichmann MW, Lau-Werner U, Muller C, Hornung HM, Stieber P, Schildberg FW. Carcinoembryonic antigen for the detection of recurrent disease following curative resection of colorectal cancer. Anticancer Res. 2000;20:4953-4955. [PubMed] |
| 3. | Li L, Yazaki PJ, Anderson AL, Crow D, Colcher D, Wu AM, Williams LE, Wong JY, Raubitschek A, Shively JE. Improved biodistribution and radioimmunoimaging with poly(ethylene glycol)-DOTA-conjugated anti-CEA diabody. Bioconjug Chem. 2006;17:68-76. [PubMed] [DOI] |
| 4. | Yazaki PJ, Sherman MA, Shively JE, Ikle D, Williams LE, Wong JY, Colcher D, Wu AM, Raubitschek AA. Humanization of the anti-CEA T84.66 antibody based on crystal structure data. Protein Eng Des Sel. 2004;17:481-489. [PubMed] [DOI] |
| 6. | Carmichael JA, Power BE, Garrett TP, Yazaki PJ, Shively JE, Raubischek AA, Wu AM, Hudson PJ. The crystal structure of an anti-CEA scFv diabody assembled from T84.66 scFvs in V(L)-to-V(H) orientation: implications for diabody flexibility. J Mol Biol. 2003;326:341-351. [PubMed] [DOI] |
| 7. | Olafsen T, Cheung CW, Yazaki PJ, Li L, Sundaresan G, Gambhir SS, Sherman MA, Williams LE, Shively JE, Raubitschek AA. Covalent disulfide-linked anti-CEA diabody allows site-specific conjugation and radiolabeling for tumor targeting applications. Protein Eng Des Sel. 2004;17:21-27. [PubMed] [DOI] |
| 8. | 金 冬雁, 黎 孟枫. 分子克隆实验指南. 第2版. 北京: 科学出版社 2002; 49-56. |
| 10. | Chong G, Cunningham D. Gastrointestinal cancer: recent developments in medical oncology. Eur J Surg Oncol. 2005;31:453-460. [PubMed] [DOI] |
| 11. | Vernava AM 3rd, Longo WE, Virgo KS, Coplin MA, Wade TP, Johnson FE. Current follow-up strategies after resection of colon cancer. Results of a survey of members of the American Society of Colon and Rectal Surgeons. Dis Colon Rectum. 1994;37:573-583. [PubMed] [DOI] |
| 12. | Yazaki PJ, Wu AM, Tsai SW, Williams LE, Ikler DN, Wong JY, Shively JE, Raubitschek AA. Tumor targeting of radiometal labeled anti-CEA recombinant T84.66 diabody and t84.66 minibody: comparison to radioiodinated fragments. Bioconjug Chem. 2001;12:220-228. [PubMed] [DOI] |
| 13. | Cillo U, Navaglia F, Vitale A, Molari A, Basso D, Bassanello M, Brolese A, Zanus G, Montin U, D'Amico F. Clinical significance of alpha-fetoprotein mRNA in blood of patients with hepatocellular carcinoma. Clin Chim Acta. 2004;347:129-138. [PubMed] [DOI] |
| 14. | Takeda M, Sakuragi N, Okamoto K, Todo Y, Minobe S, Nomura E, Negishi H, Oikawa M, Yamamoto R, Fujimoto S. Preoperative serum SCC, CA125, and CA19-9 levels and lymph node status in squamous cell carcinoma of the uterine cervix. Acta Obstet Gynecol Scand. 2002;81:451-457. [PubMed] [DOI] |
| 15. | Gadducci A, Cosio S, Carpi A, Nicolini A, Genazza-ni AR. Serum tumor markers in the management of ovarian, endometrial and cervical cancer. Biomed Pharmacother. 2004;58:24-38. [PubMed] [DOI] |
| 16. | 徐 宏勇, 徐 立, 李 开宗, 窦 科峰, 付 由池, 刘 彦仿. 靶向性肿瘤相关抗原TAG-72的scFv-CD28融合基因的真核表达载体的构建. 中国普外基础与临床杂志. 2002;9:398-401. |
| 17. | Pavoni E, Flego M, Dupuis ML, Barca S, Petronzelli F, Anastasi AM, D'Alessio V, Pelliccia A, Vaccaro P, Monteriu G. Selection, affinity maturation, and characterization of a human scFv antibody against CEA protein. BMC Cancer. 2006;6:41. [PubMed] [DOI] |
| 18. | Kenanova V, Olafsen T, Crow DM, Sundaresan G, Subbarayan M, Carter NH, Ikle DN, Yazaki PJ, Chatziioannou AF, Gambhir SS. Tailoring the pharmacokinetics and positron emission tomography imaging properties of anti-carcinoembryonic antigen single-chain Fv-Fc antibody fragments. Cancer Res. 2005;65:622-631. [PubMed] |
| 19. | Perez L, Ayala M, Pimentel G, Bell H, Canaan-Haden L, Bequet M, Gonzalez LJ, Miranda M, Ravelo R, Roque L. A multivalent recombinant antibody fragment specific for carcinoembryonic antigen. Biotechnol Appl Biochem. 2006;43:39-48. [PubMed] [DOI] |
| 20. | Wu AM, Yazaki PJ, Tsai S, Nguyen K, Anderson AL, McCarthy DW, Welch MJ, Shively JE, Williams LE, Raubitschek AA. High-resolution microPET imaging of carcinoembryonic antigen-positive xenografts by using a copper-64-labeled engineered antibody fragment. Proc Natl Acad Sci USA. 2000;97:8495-8500. [PubMed] [DOI] |
| 21. | Yazaki PJ, Shively L, Clark C, Cheung CW, Le W, Szpikowska B, Shively JE, Raubitschek AA, Wu AM. Mammalian expression and hollow fiber bioreactor production of recombinant anti-CEA diabody and minibody for clinical applications. J Immunol Methods. 2001;253:195-208. [PubMed] [DOI] |
| 22. | Williams LE, Wu AM, Yazaki PJ, Liu A, Raubitschek AA, Shively JE, Wong JY. Numerical selection of optimal tumor imaging agents with application to engineered antibodies. Cancer Biother Radiopharm. 2001;16:25-35. [PubMed] [DOI] |
| 23. | Wong JY, Chu DZ, Williams LE, Yamauchi DM, Ikle DN, Kwok CS, Liu A, Wilczynski S, Colcher D, Yazaki PJ. Pilot trial evaluating an 123I-labeled 80-kilodalton engineered anticarcinoembryonic antigen antibody fragment (cT84.66 minibody) in patients with colorectal cancer. Clin Cancer Res. 2004;10:5014-5021. [PubMed] [DOI] |
| 24. | Wong JY, Shibata S, Williams LE, Kwok CS, Liu A, Chu DZ, Yamauchi DM, Wilczynski S, Ikle DN, Wu AM. A Phase I trial of 90Y-anti-carcinoembryonic antigen chimeric T84.66 radioimmunotherapy with 5-fluorouracil in patients with metastatic colorectal cancer. Clin Cancer Res. 2003;9:5842-5852. [PubMed] |
| 25. | Wong JY, Chu DZ, Williams LE, Liu A, Zhan J, Yamauchi DM, Wilczynski S, Wu AM, Yazaki PJ, Shively JE. A phase I trial of (90)Y-DOTA-anti-CEA chimeric T84.66 (cT84.66) radioimmunotherapy in patients with metastatic CEA-producing malignancies. Cancer Biother Radiopharm. 2006;21:88-100. [PubMed] [DOI] |
| 26. | Arakawa F, Shibaguchi H, Xu Z, Kuroki M. Target-ing of T cells to CEA-expressing tumor cells by chimeric immune receptors with a highly specific single-chain anti-CEA activity. Anticancer Res. 2002;22:4285-4289. [PubMed] |
| 27. | Wu AM, Wu JH, Singh T, Chu KC, Peumans WJ, Rouge P, Van Damme EJ. A novel lectin (Morniga M) from mulberry (Morus nigra) bark recognizes oligomannosyl residues in N-glycans. J Biomed Sci. 2004;11:874-885. [PubMed] [DOI] |