修回日期: 2006-04-10
接受日期: 2006-04-13
在线出版日期: 2006-05-28
目的: 模拟人类不良饮食结构建立家兔不同程度脂肪肝模型, 进行肝脏背向散射积分(integrated backscatter, IBS)和图像灰阶平均强度(gray scale, GS)测定, 并结合临床研究, 探讨具有病理基础的脂肪肝无创性超声量化诊断标准.
方法: 选用纯种新西兰家兔40只, 采用高脂高糖饲料及乙醇饮料建立不同程度脂肪肝模型三组(每组n = 10), 设立对照组(n = 10); 临床病例同步进行肝组织病理学及超声检测. 病理组织学检测采用苏丹Ⅳ, HE和Masson三色染色; 应用HP Sonos 5500超声诊断仪实时检测肝脏IBS, 包括图像平均强度(average image intensity, AII)、峰-峰强度及图像强度标准差; 采用Photo shop 7.0直方图分析超声图像GS. 所得数据采用SAS8.2进行统计学分析.
结果: 肝脏AII随脂肪变加重呈递增趋势, 正常肝<轻度脂肪肝<中度脂肪肝<重度脂肪肝, 尤以近区各组间差异显著(P<0.0001); 同等程度肝脂肪变AII随炎症的发生而增大. 临床研究显示, IBS对脂肪肝诊断率及与病理组织学符合率(85.7%)较常规超声检测(57.1%)明显增高, 重度脂肪肝AII显著高于轻度脂肪肝(P<0.0001, 0.001或0.05). 肝脏GS与AII相关, 于肝左、右叶近区二者随病变加重呈一致性增高趋势(r1 = 0.442 21, P1 = 0.0012; r2 = 0.335 73, P2 = 0.0160). 中重度脂肪肝伴炎症GS显著高于正常肝及轻度脂肪肝(P<0.05).
结论: 高营养及乙醇联合喂养家兔可快速建立不同程度脂肪性肝病模型; 肝脏超声IBS及GS强度可反映肝脂肪变、炎症和纤维化的病变程度, 为脂肪肝无创性量化诊断提供可靠依据.
引文著录: 姚希贤, 南月敏, 王莹, 李凤林, 郭瑞军. 高脂高糖、饮酒建立家兔脂肪肝模型及超声量化诊断. 世界华人消化杂志 2006; 14(15): 1481-1486
Revised: April 10, 2006
Accepted: April 13, 2006
Published online: May 28, 2006
AIM: To explore the non-invasive, quantitative ultrasonic diagnostic criteria of fatty liver diseases by establishing a rabbit model of hepatic steatosis and measuring ultrasonic integrated backscatter (IBS) and gray scale (GS).
METHODS: Forty healthy New Zealand rabbits were randomly divided into normal control and three experimental groups. Hepatic steatosis was induced by high fat and sugar diet plus drinking water containing five percent of ethanol. Seven patients with mild or severe hepatic steatosis were also recruited in the study. The steatosis, inflammation, and fibrosis of the rabbits' and patients' liver were evaluated by several histological staining methods including Sudan IV, H&E, and Masson's Trichrome staining. Hepatic steatosis was graded as simple steatosis, steatohepatitis, fibrosis and cirrhosis. Liver IBS including average image intensity (AII) and peak-peak intensity, and GS were measured using HP Sonos 5500 image system. The data were analyzed with one-way ANOVA.
RESULTS: Hepatic AII was associated with the aggravated hepatic steatosis in near areas of the rabbit liver, i.e., normal control < mild fatty liver < moderate fatty liver < severe fatty liver (P < 0.0001). Significant differences were observed between AII of steatohepatitis and simple hepatic steatosis. In the patients, IBS was more accurate in the reflection the severity of the liver pathology than routine ultrosonic examination (85.7% vs 57.1%, P < 0.05), and significant differences of AII were observed between mild and severe hepatic steatosis (P < 0.0001, 0.001 or 0.05). The liver GS were markedly increased in the moderate and severe fatty liver as compared with that in normal control and mild fatty liver. Correlation analysis showed that GS and AII were consistently increased as the disease aggravated in the near area of the left and right liver lobes of the animals (r1 = 0.442 21, P1 = 0.0012; r2 = 0.335 73, P2 = 0.0160).
CONCLUSION: Rabbit fatty liver models can be developed in a short time by high fat and sugar diet plus alcohol. Hepatic IBS and GS intensity can reflect the grades of hepatic steatosis, inflammation and fibrosis, so they may serve as reliable non-invasive tools for the quantitative diagnosis of fatty liver disease.
- Citation: Yao XX, Nan YM, Wang Y, Li FL, Guo RJ. Establishment of experimental hepatic steatosis model in rabbits and non-invasive quantitative ultrasonic diagnosis of fatty liver disease. Shijie Huaren Xiaohua Zazhi 2006; 14(15): 1481-1486
- URL: https://www.wjgnet.com/1009-3079/full/v14/i15/1481.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i15.1481
脂肪肝患病率呈逐年上升趋势, 发病年龄趋于年轻化, 而其发病隐匿, 一旦发现, 往往伴有不同程度的炎症、坏死及纤维化[1-6]. 如果早期诊治, 可阻止病情进展, 甚至使其逆转. 当前临床沿用超声检查为主的影像学诊断方法, 主要依据灰阶级别肉眼判断有无病变及病变程度, 缺乏统一的量化诊断标准, 更乏具有病理基础的对照研究, 因而, 对同一脂肪肝患者的诊断(有无脂肪肝与程度)不一. 为此, 我们首先对35只正常家兔肝脏进行了二维超声图像平均灰阶强度(gray scale, GS)直方图分析和实时背向散射积分(integrated backscatter, IBS)检测, 表明本法可较准确的反映肝组织结构的变化[7], 进一步模拟目前人类不良饮食方式(高营养+乙醇)建立不同程度脂肪肝模型, 进行肝脏超声图像GS和IBS测定, 以探讨有病理基础的脂肪肝无创性超声量化诊断指标.
选用纯种新西兰家兔40只, 河北医科大学动物实验研究中心提供, 雌雄各半, 体质量1.5-2.5(平均2.2±0.3) kg. 实验家兔正常喂养1 wk随机分成对照组(普通饲料及水喂养6 wk)和实验1, 2, 3组[高脂高糖饲料(普通饲料加20 g/kg胆固醇、50 g/kg蔗糖、100 g/kg猪油)及50 mL/L酒精饮料分别喂养3, 4, 5和6 wk]. 于实验动物造模结束、完成超声检测后, 采用氯胺酮(12 mg/kg)臀部im, 动物麻醉后开腹取出肝脏, 分别留取左、右肝叶冰冻切片和100 g/kg甲醛固定标本; 实验2, 3组分别于3-5 wk同步进行超声检测及肝穿刺病理组织学检查. 另选择肝胆外科因肝脏良性肿瘤或胆结石手术治疗的患者7例, 男2例, 女5例, 年龄50-80(平均57.2±6.3)岁. 其中胆囊结石5例, 肝血管瘤2例. 手术前后进行常规超声及IBS检测, 手术中采取肝组织标本.
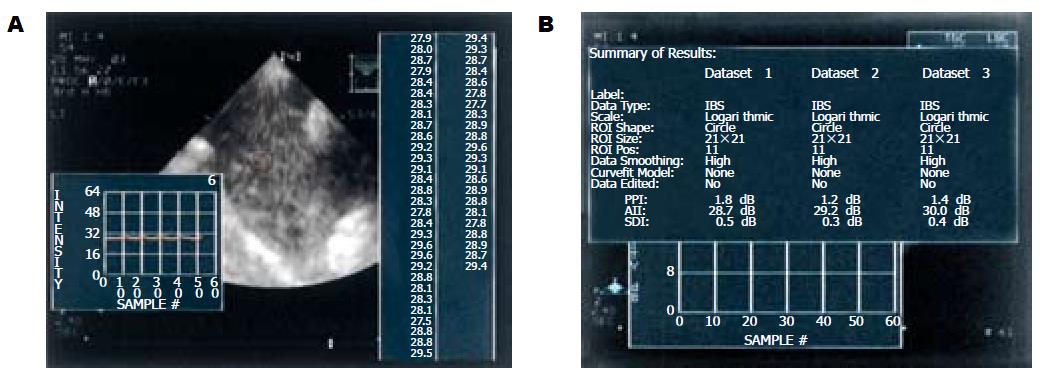
冰冻切片进行苏丹Ⅳ脂肪染色, 100 g/kg甲醛固定标本切片进行HE和Masson三色染色. 根据低倍显微镜下肝细胞脂变面积将脂肪肝分为轻度(1/3-1/2)、中度(1/2-2/3)和重度(2/3以上); 根据肝小叶及/或汇管区炎症和纤维化的有无分为单纯性脂肪肝和脂肪性肝炎. 各组实验动物于空腹8-12 h、胸腹部脱毛后, 取仰卧位, 采用HP Sonos 5500超声诊断仪(美国惠普公司, 配备IBS图像采集和声学定量分析软件)进行肝脏超声检测, 首先观察肝左叶、右叶及尾叶, 在图像显示最佳时, 左、右肝分别选取胃旁并显示腹主动的断面和肝肾断面, 采取超声图像, 采用Photo shop 7.0图像分析系统, 图像灰度等级0-255, 21×21圆形像素取样框, 于距左、右肝表面1.5-2 cm, 2.5-3 cm, 3.5-4 cm取感兴趣区, 各测量3次, 取平均值进行半定量分析; 同步进行实时IBS测定: 调出AD-IBS状态, 探头频率2-4 mHz, 侧向增益补偿曲线设置前后一致, 调整时间增益补偿(TGC)曲线得到良好的IBS图像, 取样方法同GS分析, 描记IBS曲线并记录所测得图像平均强度(average image intensity, AII)(图1).
临床研究: 于手术前、后7-10 d, 空腹8 h后进行肝脏超声检测, 分别于肝左、右叶近、远声场取感兴趣区, 测定方法同动物实验. 为缩小因TGC调整对图像的影响, 采用TGC对所测得的IBS值进行标化. 将实验采用的所有TGC值合计并计算均值, 标化IBS = 实测IBS×TGC均值 /自身(所在深度)TGC值[7].
统计学处理 采用SAS 8.2版, 多组均数差异的比较采用单因素方差分析, 两组均数差异的比较采用Fisher's LSD法,P<0.05差异有统计学意义.
39只家兔完成实验, 腹泻死亡1只, 正常对照组9只, 轻度脂肪肝10只, 中度脂肪肝11只, 重度脂肪肝9只. 将肝穿刺活检与完成实验处死家兔病理学与超声结果一并分析, 轻、中、重度脂肪肝模型数依次为: 13, 20, 10只. 轻度脂肪肝中单纯性脂肪肝7只, 伴发脂肪性肝炎6只; 中度中单纯性脂肪肝7只, 伴发脂肪性肝炎13只; 10只重度脂肪肝均有炎症. 肝脂肪变特点: 以小泡性脂肪变为主, 轻度见于腺泡Ⅲ带, 苏丹Ⅳ染色肝细胞内散在大小较均匀的鲜红色脂滴; 中度1/2以上肝细胞脂肪变, 随脂质的积累, 脂滴可有融合, 胞核偏位或脂滴围绕细胞核形成"梅花样"改变; 重度者全小叶布满脂滴, 肝细胞胀大、窦间隙变窄, 细胞核和细胞器被脂滴挤压移位至细胞边缘呈"印戒样", 细胞内结构不能辨认, 多伴发脂肪性肝炎或不同程度纤维化. 正常肝左叶AII高于右叶, 差异具有显著性意义(F = 3.08, P = 0.0111), 同侧肝叶不同部位AII差异无显著性意义. 脂肪肝AII明显高于正常肝, 并随脂肪变程度的加重、炎症的有无, 左肝近、中、远三区及右肝近区AII值呈递增趋势(表1).
2.1.1 单纯性脂肪肝和脂肪性肝炎AII的比较: 为确定炎症病变对IBS的影响, 根据肝细胞变性、坏死、气球样变、炎症细胞浸润和纤维化等有无分为单纯性脂肪肝和脂肪性肝炎. 同等程度脂肪变, 脂肪性肝炎AII较单纯脂肪肝增高; 中、重度脂肪肝伴炎症者AII均显著高于其余病变组(表2).
| 分组 | n | 肝左叶近区 | 肝左叶中区 | 肝左叶远区 | 肝右叶近区 | 肝右叶中区 | 肝右叶远区 |
| 对照组 | 9 | 25.6±3.4 | 25.4±2.8 | 26.5±2.9 | 23.9±2.5 | 24.7±2.6 | 24.3±2.7 |
| 单纯轻度脂肪肝 | 7 | 26.4±1.8 | 25.5±3.1 | 23.6±2.0 | 25.6±1.5 | 24.0±3.1 | 22.8±1.8 |
| 轻度脂肪肝伴炎症 | 6 | 27.7±1.6 | 26.4±1.6 | 24.7±0.8 | 26.6±2.0 | 24.2±2.5 | 22.3±2.2 |
| 单纯中度脂肪肝 | 7 | 28.2±1.7 | 26.3±2.4 | 23.4±2.3 | 26.5±2.0 | 23.4±1.9 | 22.8±1.3 |
| 中度脂肪肝伴炎症 | 13 | 31.9±3.1 | 28.2±1.8 | 26.2±1.7c | 28.6±2.9a | 25.8±3.7a | 24.3±4.3a |
| 重度脂肪肝伴炎症 | 10 | 33.1±1.8 | 30.4±2.7a | 28.1±1.3a | 30.4±2.4a | 25.7±1.6a | 24.2±1.9a |
2.1.2 不同程度脂肪肝GS比较: 单纯轻度脂肪肝与正常肝GS无明显差异, 随脂肪变加重和炎症发生, 图像回声信号强度逐渐增强, 尤以中、重度脂肪肝伴炎症GS增高明显(表3). 对正常家兔及不同程度脂肪肝家兔肝脏GS与AII进行相关性分析, 结果左、右肝近区二者间呈正相关, 分别为r = 0.442 21, P = 0.0012和r = 0.335 73, P = 0.0160. 由于衰减方式的不同, 二者中、远区无明显相关性. 肝AII与GS联合检测诊断脂肪肝与病理组织学符合率为85.2%.
| 分组 | n | 肝左叶近区 | 肝左叶中区 | 肝左叶远区 | 肝右叶近区 | 肝右叶中区 | 肝右叶远区 |
| 对照组 | 9 | 38.1±6.2 | 37.2±5.9 | 36.4±5.6 | 35.4±6.1 | 34.4±6.1 | 33.5±6.0 |
| 单纯轻度脂肪肝 | 7 | 38.9±7.5 | 36.9±6.7 | 35.3±6.5 | 35.6±4.4 | 33.6±3.3 | 31.7±3.5 |
| 轻度脂肪肝伴炎症 | 6 | 42.2±5.9 | 39.6±6.0 | 37.3±5.4 | 39.5±4.9 | 37.3±4.7 | 35.2±3.8 |
| 单纯中度脂肪肝 | 7 | 50.7±8.8a | 48.3±7.9a | 45.7±8.9 | 37.2±4.2 | 37.0±4.0 | 35.3±3.7 |
| 中度脂肪肝伴炎症 | 13 | 52.5±10.9c | 48.5±10.4a | 46.9±10.4a | 43.5±11.2a | 39.1±11.7 | 36.2±12.4 |
| 重度脂肪肝伴炎症 | 10 | 56.8±13.4c | 51.4±13.5c | 47.9±13.3c | 47.1±8.1c | 43.2±7.7a | 38.3±6.3 |
病理组织学结果显示, 轻度脂肪肝4例, 重度脂肪肝3例. 常规超声检测诊断率为71.4%(5/7), 与病理组织学诊断符合率为57.1%(4/7), IBS测定诊断率和与病理组织学符合率均为85.7%(6/7); 重度脂肪肝各声场AII均显著高于轻度脂肪肝(表4).
高营养和饮酒是目前人类流行的不良饮食方式, 由此导致的脂肪肝已严重威胁人类健康. 既往脂肪肝的研究多采用鼠类、单致病因素模型进行基础和药物干预实验[8-16]. 缺乏适于临床器械和设备检查并模拟人类饮食联合两种以上因素致病的较大动物脂肪肝模型, 因此缺乏具有病理基础的无创性量化诊断对照研究. 我们选用家兔为实验动物, 联合高营养和乙醇喂养, 模型形成快, 形成率达100%, 并可应用临床检查器械(如肝脏穿刺针)和设备(如超声诊断仪)进行肝脏病理学和超声学诊断. 动物实验和临床对比研究发现, 超声IBS脂肪肝分度和炎症病变与病理组织学的符合率分别达85.2%和85.7%, 提示超声IBS检测可作为一种无创性量化方法诊断脂肪肝.
背向散射信号产生的基础为组织中的细微结构, 包括大分子物质和胶原成分等, 病变时组织结构的微细变化, 如脂质积累、炎症细胞浸润、纤维组织增生等均可成为良好的散射源致使IBS发生改变[17-21]. 单纯轻度脂肪肝细胞内脂滴小、数量少, 组织结构变化不明显, 随着脂质的积累, 脂滴增大、增多, 肝细胞增大、形态发生改变、进一步发生变性、坏死、气球变、间质内炎细胞浸润、枯否细胞增殖、纤维组织增生等, 均可导致散射体浓度、大小、排列方式与周围组织声阻抗差发生变化, 致使IBS值增高. 赵玉华 et al[22]研究报道, 脂肪肝AII高于正常肝88.5%. Hill et al[23]对正常肝组织、脂肪肝、肝硬化等标本测量发现衰减系数和散射程度与脂肪含量正相关. 本研究结果显示: 正常家兔AII右肝低于左肝, 差异显著(P<0.01), 考虑与右侧胸壁干扰声波传播使部分声束失落有关; 同侧肝叶不同部位AII值接近, 表明IBS能客观反映家兔肝实质组织微细结构及均匀性[7]. 随脂肪肝程度加重, AII值呈现递增趋势, 正常肝脏<轻度脂肪肝<中度脂肪肝<重度脂肪肝, 同等程度脂肪肝伴发炎症者, AII进一步增高. 临床病例观察结果亦显示, IBS测定对脂肪肝的诊断率、与病理组织学符合率(85.7%)均较常规超声检测(71.4%和57.1%)明显提高, 重度脂肪肝AII较轻度脂肪肝显著增高(P<0.0001/0.05), 表明肝脏IBS可更准确的反映脂肪肝的有无、病变程度以及炎症和纤维化发生情况. 通过对正常家兔肝二维超声图像灰阶直方图分析证实, 其能分辨人眼所不能识别的图像信号细微变化、辨别组织的均匀程度. 卓忠雄 et al[24]对正常人及化疗性脂肪肝超声图像定量分析显示二者差异显著, 正常肝声像图近、远声场回声强度基本一致, 化疗性脂肪肝声像图回声强度依次为近声场最强、中声场次之、远声场最弱. 本研究结果显示, 正常家兔左肝GS高于右肝, 随脂肪变及炎性病变加重, 肝脏回声信号增强, 中、重度脂肪肝伴发炎症者GS显著高于正常肝和轻度脂肪肝(P<0.05); 同等程度脂肪变, 伴有炎症者图像信号强于单纯性脂肪肝, 提示灰阶级别的数字化分析可作为鉴别肝脂肪变和炎症有无及其程度的重要参考指标. 肝GS与AII相关性分析提示于近区二者随病变加重呈一致性增高趋势, 联合检测有助于提高诊断准确性. 由于衰减方式的不同, 于中、远区二者无明显相关性.
总之, 上述研究表明, 高营养及酒精联合喂养家兔可快速建立不同程度脂肪性肝病模型; 肝脏不同部位IBS及GS强度测定可反映脂肪肝的有无、病变程度以及炎症和纤维化发生情况. 临床凭常规超声波检测对脂肪肝诊断率仅71.5%, 与病理组织学符合率仅57.4%. 采用超声联合检测IBS与GS明显提高脂肪肝的确诊率, 与病理组织学符合率高达85.7%, 为临床无创性量化诊断脂肪肝提供了可靠依据.
脂肪肝患病率逐年上升, 发病年龄趋于年轻化, 且发病隐匿, 一旦发现, 多伴有炎症、坏死及纤维化. 目前临床沿用超声检查为主的影像学诊断方法, 缺乏量化诊断标准及病理对照研究, 往往对同一患者诊断不一.
对脂肪肝无创性量化诊断渐渐成为国内外研究热点, 但目前仍缺乏适于临床器械和设备检查并模拟人类饮食联合两种以上因素致病的较大动物脂肪肝模型, 且缺乏具有病理基础的无创性量化诊断对照研究.
正常肝左叶AII高于肝右叶, 同侧肝叶不同部位AII无显著差异, 脂肪肝AII高于正常肝88.5%. 通过对正常肝组织、脂肪肝、肝硬化等标本测量发现衰减系数和散射程度与脂肪含量正相关.
本文通过对家兔脂肪肝二维超声图像灰阶直方图分析证实, 其能分辨人眼不能识别的图像信号细微变化、辨别组织的均匀程度. IBS测定对脂肪肝的诊断率、与病理组织学诊断符合率均较常规超声明显提高. 肝GS与AII相关性分析提示于近区二者随病变加重呈一致性增高趋势, 联合检测有助于提高诊断准确性. 超声诊断结果有病理组织学研究的参照, 大大提高了结果的可靠性.
肝脏不同部位IBS与GS强度测定可反映脂肪肝的有无、病变程度及炎症和纤维化发生情况. 采用超声IBS与GS明显提高脂肪肝的确诊率, 与病理组织学符合率提高, 为临床无创性量化诊断脂肪肝提供了可靠依据.
1 IBS技术: 通过一体化的在线方法来测量、显示和分析在用户自定义的间期来触发的图像上的用户自定义的感兴趣区域内的图像的平均声学强度.
2 峰-峰强度(peak to peak intensity, PPI): 数据强度曲线的最大值和最小值的差; 平均图像强度(average image intensity, AII), 时间强度曲线的各数据的平均值.
本文通过模拟人饮食成功复制复合病因所致脂肪性肝炎并肝纤维化模型, 通过新型超声指标探讨实时超声在脂肪性肝炎肝纤维化诊断中的价值, 并进行了数例临床肝活检和影像学检查结果一致性的探讨, 对指导临床从事无创伤性诊断脂肪性肝炎的研究提供了新的希望. 选题紧密结合临床, 设计合理, 造模方法可以接受, 研究结果可靠, 具有较高的科学性.
电编: 张敏 编辑:潘伯荣
| 1. | Matteoni CA, Younossi ZM, Gramlich T, Boparai N, Liu YC, McCullough AJ. Nonalcoholic fatty liver disease: a spectrum of clinical and pathological severity. Gastroenterology. 1999;116:1413-1419. [PubMed] [DOI] |
| 2. | Reid BM, Sanyal AJ. Evaluation and management of non-alcoholic steatohepatitis. Eur J Gastroenterol Hepatol. 2004;16:1117-1122. [PubMed] [DOI] |
| 3. | Cubelic S, Misak Z, Gasparov S, Kolacek S. Nonalcoholic steatohepatitis in children. Lijec Vjesn. 2004;126:197-200. [PubMed] |
| 5. | Mendez-Sanchez N, Chavez-Tapia NC, Uribe M. Obesity and non-alcoholic steatohepatitis. Gac Med Mex. 2004;140 Suppl 2:S67-72. [PubMed] |
| 8. | Liang YQ, Kinoshita M, Muto T, Fujimaki Y, Matsuki N, Saito H, Yamanaka M, Teramoto T. Defect in an intrahepatic degradation of apolipopro-tein B in suncus: an animal model of hypobetalipo-proteinemia. J Biochem (Tokyo). 1998;123:28-32. [PubMed] [DOI] |
| 9. | Teramoto K, Bowers JL, Khettry U, Palombo JD, Clouse ME. A rat fatty liver transplant model. Transplantation. 1993;55:737-741. [PubMed] [DOI] |
| 10. | Zhang BH, Weltman M, Farrell GC. Does steatohepatitis impair liver regeneration? A study in a dietary model of non-alcoholic steatohepatitis in rats. J Gastroenterol Hepatol. 1999;14:133-137. [PubMed] [DOI] |
| 11. | Kazumi T, Odaka H, Hozumi T, Ishida Y, Amano N, Yoshino G. Effects of dietary fructose or glucose on triglyceride production and lipogenic enzyme activities in the liver of Wistar fatty rats, an animal model of NIDDM. Endocr J. 1997;44:239-245. [PubMed] [DOI] |
| 12. | Callaghan R, Desmond PV, Mashford ML. The effect of a nutritional model of chronic liver injury on the hepatic glucuronidation of morphine in rats. J Pharm Pharmacol. 1993;45:998-999. [PubMed] [DOI] |
| 13. | Rakotoamboa JL, Masson M, Palate B, Carleer J, Roba J. Fasting for 24 h reveals liver microsteatosis after continuous i.v. infusion of milacemide in the rat. Arch Toxicol. 1994;68:266-271. [PubMed] [DOI] |
| 14. | Paquet KJ, Kamphausen U. The carbon-tetrachlo-ride-hepatotoxicity as a model of liver damage. First report: Long-time biochemical changes. Acta Hepatogastroenterol (Stuttg). 1975;22:84-88. [PubMed] |
| 15. | Mikhail TH, Ibrahim KM, Awadallah R, Mona E. The effect of vitamin B12 on tetracycline-induced fatty liver. Z Ernahrungswiss. 1980;19:173-178. [PubMed] [DOI] |
| 16. | Puddu P, Caldarera CM, Marchetti M. Studies on ethionine-induced fatty liver. Biochem J. 1967;102:163-167. [PubMed] [DOI] |
| 17. | Schwarz KQ, Chen X, Steinmetz S. Methods for quantifying ultrasound backscatter and two-dimensional video intensity: implications for contrast-enhanced sonography. J Am Soc Echocardiogr. 1998;11:155-168. [PubMed] [DOI] |
| 18. | Feinberg MS, Gussak HM, Davila-Roman VG, Baumann CM, Miller JG, Perez JE. Dissociation between wall thickening of normal myocardium and cyclic variation of backscatter during inotropic stimulation. Am J Cardiol. 1996;77:515-520. [PubMed] |
| 23. | Hill CR, Rivens I, Vaughan MG, ter Haar GR. Lesion development in focused ultrasound surgery: a general model. Ultrasound Med Biol. 1994;20:259-269. [PubMed] [DOI] |