修回日期: 2006-03-01
接受日期: 2006-03-07
在线出版日期: 2006-05-08
目的: 研究特异性COX-2抑制剂NS-398和CCK-B/胃泌素受体拮抗剂AG-041R对人胃癌细胞的抑制作用机制.
方法: 以人胃癌细胞株MKN-45为研究对象, 采用MTT法、流式细胞仪(FCM)、RT-PCR观察NS-398, AG-041R及联合应用对MKN-45细胞增殖、凋亡百分率及癌基因c-Myc mRNA表达的影响.
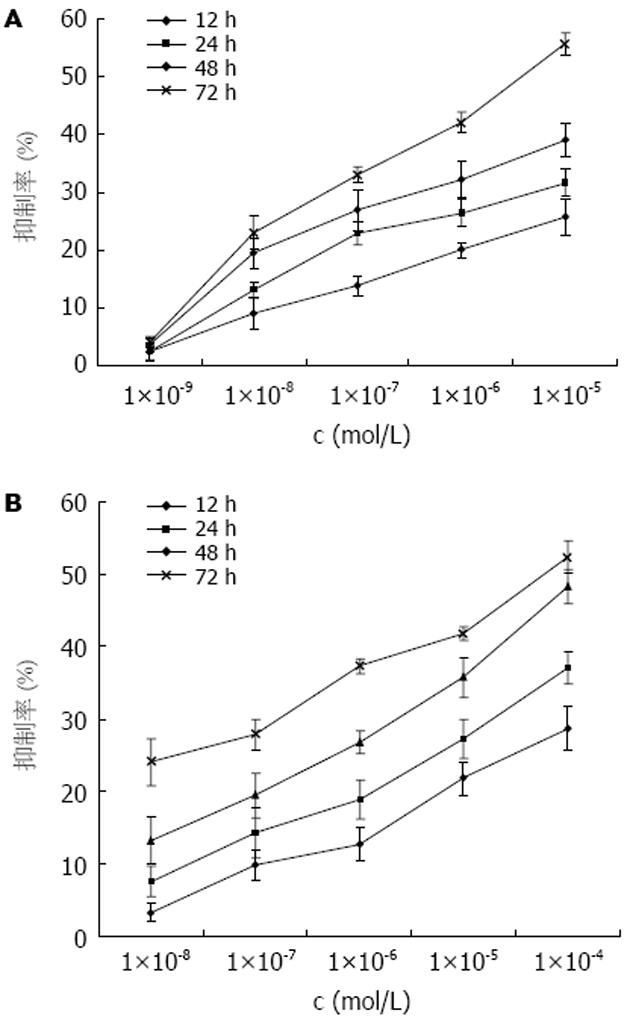
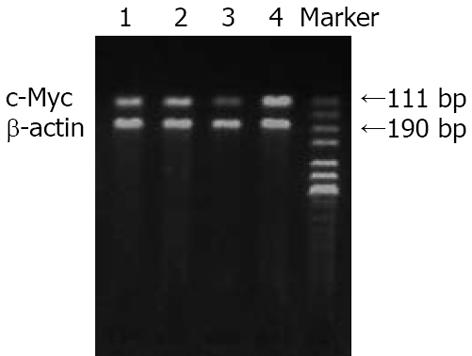
结果: NS-398和AG-041R均在一定范围(12-72 h; NS-398: 1×10-8-1×10-4 mol/L; AG-041R: 1×10-8-1×10-5 mol/L)内呈浓度和时间依赖性地抑制MKN-45细胞的增殖, AG-041R(1×10-6 mol/L)、NS-398(1×10-5 mol/L)作用72 h抑制率分别为42.1%, 41.8%, 二者联合应用有协同抑制胃癌细胞增殖效应, 且随着作用时间延长而增强. FCM显示NS-398(1×10-5 mol/L)、AG-041R(1×10-6 mol/L)和二者联合作用于MKN-45细胞72 h后, 细胞凋亡率分别为9.57%±0.60%、10.25%±0.68%和20.83%±1.90%, 与对照组(1.67%±0.76%)相比细胞凋亡率均显著增高(P<0.01), 联合用药组细胞凋亡率显著高于单一用药组(P<0.01). RT-PCR显示NS-398、AG-041R及联合应用均显著抑制MKN-45细胞c-Myc mRNA的表达, 联合用药组抑制效应显著高于单一用药组.
结论: 联合应用NS-398和AG-041R剂量、时间依赖性地抑制MKN-45细胞增殖, 促进MKN-45细胞凋亡, 抑制癌基因c-Myc mRNA的表达, 具有协同作用.
引文著录: 朱峰, 孙为豪, 李淑德, 李兆申. NS-398联用AG-041R对胃癌细胞的协同抑制作用机制. 世界华人消化杂志 2006; 14(13): 1262-1266
Revised: March 1, 2006
Accepted: March 7, 2006
Published online: May 8, 2006
AIM: To investigate the inhibitory effects and mechanisms of combined treatment of a special COX-2 inhibitor (NS-398) and a special gastric receptor antagonist (AG-041R) on gastric cancer cell line MKN-45.
METHODS: The human gastric cancer cell line MKN-45 was treated with NS398 and AG-041R, respectively, or in combination. The growth of MKN-45 cells was detected by MTT assay; the cell apoptosis was detected by flow cytometry; the expression of c-Myc mRNA was determined by reverse transcription-polymerase chain reaction (RT-PCR).
RESULTS: NS-398 and AG-041R inhibited the growth of MKN-45 cells in a time- and dose-dependent manner (12-72 h; NS-398: 1 × 10-8 - 1 × 10-4 mol/L; AG-041R: 1 × 10-8 - 1 × 10-5 mol/L). AG-041R (1×10-6 mol/L) and NS-398 (1×10-5 mol/L) inhibited the proliferation of MKN-45 cells at rates of 42.1% and 41.8%, respectively, at 72 h. NS-398 and AG-041R in combination resulted in a synergistic effect on inhibiting growth, and the inhibition effect was enhanced along with time. When NS-398 (1×10-5 mol/L) or AG-041R (1×10-6 mol/L) or their combination was used, the rate of apoptosis was 9.57% ± 0.60%, 10.25% ± 0.68% and 20.83% ± 1.90%, respectively, which was significantly higher than the rate in the controls (1.67% ± 0.76%)(all P < 0.01), and the agents in combination induced a higher apoptosis rate than either of them did (P < 0.01). NS-398 and AG-041R down-regulated the level of c-Myc mRNA, respectively, but their combination down-regulated it more significantly than either of the agents did.
CONCLUSION: Combined treatment of NS-398 and AG-041R synergistically inhibits the growth of MKN-45 cells in a time- and dose-dependent manner, induces the cell apoptosis and down-regulates c-Myc mRNA expression in MKN-45 cells.
- Citation: Zhu F, Sun WH, Li SD, Li ZS. Synergistic inhibitory effect of NS-398 combined with AG-041R on gastric cancer cells. Shijie Huaren Xiaohua Zazhi 2006; 14(13): 1262-1266
- URL: https://www.wjgnet.com/1009-3079/full/v14/i13/1262.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i13.1262
近来研究表明, COX-2表达在人胃癌组织中异常增高[1-2]. Hu et al[3]证实COX-2抑制剂塞来昔布能有效降低大鼠胃癌的发病率, 抑制胃癌的生长. 胃泌素是最常见的胃肠道肽类激素之一, 其在胃癌的发生中是一个重要的生长因子[4]. Hur et al[5]发现胃癌患者中胃癌组织的胃泌素及CCK-B受体的表达较正常胃黏膜组织异常增高. 胃泌素对胃肠道肿瘤有显著促生长作用, 胃泌素受体拮抗剂则能有效抑制实验动物大肠癌的发生[6-8].
Konturek et al[9]研究发现, 胃泌素可诱导人胃癌KATOⅢ细胞株COX-2蛋白和mRNA表达增加. Colucci et al[10]表明胃泌素通过CCK-B受体诱导COX-2表达及PGE2产生, 促进肿瘤细胞的生长; 该效应可被CCK-B受体拮抗剂L-365, 260; GV150013阻断. 表明COX-2可能为胃泌素的一下游目标. 我们研究NS-398和AG-041R对人胃腺癌细胞系MKN-45增殖、凋亡的影响, 以明确二者对胃癌有无协同抗癌作用并初步探讨其作用机制.
MKN-45人胃腺癌细胞系东南大学遗传中心实验室所赠. TRIzol试剂、RT-PCR试剂盒、RPMI 1640培养基和小牛血清购于Gibco公司. 胰蛋白酶为美国Amresco公司产品. β-actin引物: 上海申能博彩生物技术有限公司; c-Myc引物: 上海生物工程有限公司. 选择性COX-2抑制剂NS-398和胃泌素受体拮抗剂AG-041R为美国Cayman公司产品. 人胃腺癌细胞株MKN-45采用RPMI 1640细胞培养基, 含100 mL/L小牛血清, 常规培养于含50 mL/L CO2的37℃温箱中. 待其贴壁生长至70%-80%融合时, 用2.5 g/L胰酶消化传代培养. NS-398、AG-041R均用DMSO溶解(培养液中DMSO浓度不超过1 g/L), pH调节至7.2, 过滤, 4℃保存备用.
1.2.1 体外药物敏感实验: 采用MTT法. 实验设空白组(仅含培养液和等体积的DMSO), 对照组(MKN-45细胞的单细胞悬液+等体积的DMSO), 实验组为NS-398, AG-041R的不同浓度梯度组, 其中NS-398为5个浓度梯度(1×10-8-1×10-4 mol/L), AG-041R为5个浓度梯度(1×10-9-1×10-5 mol/L), 每组设6个复孔. 取对数生长期的MKN-45细胞制成单细胞悬液, 调整细胞浓度为5×107/L, 接种于96孔培养板内, 培养24 h细胞全部贴壁后, 加入不同浓度的药物分别培养12, 24, 48, 72 h, 然后每孔加入5 g/L MTT液20 μL, 继续培养4 h, 吸去上清液, 每孔加入DMSO 150 mL, 轻轻震荡10 min, 使结晶物充分溶解, 于570 nm波长酶联免疫检测仪上测定每孔吸光度(A)值, 结果以每组6孔的mean±SD表示, 实验重复3次以上. 抑制率(%) = (1-实验组吸光度值/对照组吸光度值)×100%.
1.2.2 流式细胞仪检测: 收集NS-398(1×10-5 mol/L), AG-041R(1×10-6 mol/L)及联合(其中NS-398, AG-041R浓度和单用时相同)应用72 h后的MKN-45细胞1.0×109/L, PBS洗涤, 胰蛋白酶消化后, 1000 r/min离心5 min, 去上清, 用预冷的700 mL/L乙醇固定, -20℃过夜后, 离心除去乙醇, 加入10 g/L TritonX-100摇匀后静置10 min, 离心5 min. 弃上清液后加入0.1 g/L RNA酶消化10 min后离心5 min. 弃上清液后加入0.05 g/L的碘化丙啶(PI)染色15 min, 用300目丝网过滤后上机收集分析. 资料经ModFit LT软件分析.
1.2.3 RT-PCR检测c-Myc基因表达: 取对数生长期的MKN-45细胞制成单细胞悬液, 调整细胞浓度为5×107/L, 接种于6孔培养板内, 分对照组和各药物组, 培养24 h待细胞全部贴壁后更换培养基, 药物组分别加入NS-398(1×10-5 mol/L)、AG-041R(1×10-6 mol/L)及联合应用药物100 mL, 继续培养72 h. 用TRIzol试剂提取细胞总RNA. 所提取RNA经电泳后证实28, 18, 5 s条带清晰可见, 28 s与18 s荧光强度之比为2∶1. 取RNA 5 µg, 加入引物oligo(dT)12-18及逆转录酶合成cDNA链. 取cDNA链5 µL作为模板, 分别加入c-Myc引物(s)、c-Myc引物(a)各2 µL, 加入MgCl2 3.5 µL、Taq酶0.5 µL, 总体积为50 µL的反应体系中, 经过94℃变性3 min后进入循环, 包括94℃变性30 s, 50℃退火50 s, 72℃延伸1 min, 共40个循环. 以b-actin作为内参照. 各引物序列分别为: c-Myc: 上游5'-ggtgaagtacatgaactcagggc-3', 下游5'-ggctttgaatctgctggattg-3'; β-actin: 上游5'-caattccatcatgaagtgtgac-3', 下游5'-ccacacagagtacttgcgctc-3'. 取5 µL PCR终产物及DNA Marker, 用17 g/L琼脂糖凝胶(含0.5 mg/L的溴化乙锭)电泳, 自动凝胶成像系统摄影.
统计学处理 MTT和流式细胞仪测定数据的统计处理采用统计软件SPSS 11.5, 显著性检验采用单因素方差分析. 判断均数差异显著性, P<0.05统计学有显著性差异.
一定浓度(NS-398: 1×10-8-1×10-4 mol/L; AG-041R: 1×10-8-1×10-5 mol/L)和时间范围(12-72 h)内NS-398, AG-041R对MKN-45细胞的抑制率呈浓度、时间依赖性; AG-041R(1×10-6 mol/L), NS-398(1×10-5 mol/L)作用72 h抑制率分别为42.1%, 41.8%, 接近半数抑制量, 本实验进一步选择1×10-6 mol/L AG-041R联合1×10-5 mol/L NS-398作用于MKN-45细胞, 初步观察二药的相互作用. 药物相互作用结果判断用金正均[11]方法: 在量效曲线线性区内, 用如下公式计算q值: q值 = 两药合用的抑制率/两单药预计抑制率 = EA+B/EA+(1-EA)×EB, q值>1.15时, 两药有协同作用. 结果: q 24 h = 1.18, q 48 h = 1.21, q 72 h = 1.28(图1, 表1).
流式细胞术显示: NS-398(1×10-5 mol/L), AG-041R(1×10-6 mol/L)和二者联合作用于MKN-45细胞72 h后, 细胞凋亡率分别为9.57%±0.60%, 10.25%±0.68%和20.83%±1.90%, 与对照组1.67%±0.76%相比, 细胞凋亡率均显著增高(P<0.01), 联合用药组细胞凋亡率显著高于单一用药组(P<0.01, 表2).
1×10-6 mol/L AG-041R, 1×10-5 mol/L NS-398单独及联合作用MKN-45细胞72 h后, 明显抑制癌基因c-Myc mRNA的表达, 高于对照组, 差异有显著性(P<0.01); 联合用药组高于各单独用药组, 差异有显著性(P<0.01, 图2, 表2).
环氧合酶-2(COX-2)的过度表达在消化道肿瘤中的作用日益得到重视, Sawaoka et al[12]研究发现, COX-2在胃癌细胞中高度表达并促进肿瘤细胞增殖, NS-398能有效发挥其抗肿瘤作用. Uefuji et al[13]报道, COX-2抑制剂JTE-522通过阻断胃癌细胞的细胞周期、抑制c-Myc蛋白表达从而抑制肿瘤细胞增殖.
胃泌素刺激人胃癌生长是由CCK-B受体介导的, 通过对胃癌及邻近黏膜表达胃泌素受体差异的研究显示, 胃癌较周围黏膜易于表达高含量的胃泌素受体, 其表达与肿瘤的部位和分期相关[14]. Lee et al[15]证实多数胃癌组织中高表达CCK-B受体. 而给予CCK-B/胃泌素受体拮抗剂YF476能抑制胃癌的形成[16].
最近研究进一步表明胃泌素、COX-2二者间存在关联. Yao et al[17]表明胃泌素在体内外剂量依赖性地促进肿瘤细胞的增殖, 预先给予NS-398则能逆转其促增殖作用. Slice et al[18]证实胃泌素促进CCK-B受体阳性表达的Swiss3T3细胞PGE2的释放, 且呈剂量、时间依赖性地诱导COX-2蛋白的表达; 预先给予CCK-B受体拮抗剂L-365260则能抑制胃泌素诱导的上述效应. 提示COX-2可能为胃泌素的一下游目标.
胃癌组织中高表达c-Myc是胃癌细胞高度增殖的原因之一[19]. Wang et al[20]发现胃癌细胞株IEC-6在胃泌素作用下c-Myc mRNA表达增加, 最高为正常的7.5倍. Kishimoto et al[21]研究发现: NS-398能够引起大鼠肿瘤c-Myc表达的降低.
我们利用胃泌素受体阳性且高度表达COX-2的人MKN-45胃癌细胞株作为研究对象, 采用MTT法观察NS-398, AG-041R及联合应用对MKN-45细胞增殖的影响. 结果证实: NS-398和AG-041R剂量、时间依赖性地抑制MKN-45细胞增殖; 两者联合应用具有协同作用. 为进一步探讨其机制, 我们应用RT-PCR法观察药物对人胃癌细胞MKN-45癌基因c-Myc表达的影响, 证实NS-398, AG-041R均明显抑制人胃癌细胞MKN-45癌基因c-Myc的表达, 联合用药抑制作用显著增强, 高于单一给药组. 初步提示二者联用对抑制胃癌细胞增殖的协同效应可能部分与此相关. 我们应用FCM也发现NS-398, AG-041R可明显促进MKN-45细胞凋亡, 二者联用后对MKN-45细胞凋亡的诱导作用显著高于单一给药组, 但其具体机制尚需进一步明确.
胃癌是威胁人类生命健康的最常见的恶性肿瘤之一, 近年来国内外的研究表明, COX-2及胃泌素与胃癌的增殖、凋亡有关. 最近研究进一步表明胃泌素、COX-2二者间存在内在关联. 联合应用特异性COX-2抑制剂和胃泌素受体拮抗剂有无协同抗癌作用, 值得进一步研究.
COX-2与胃癌密切相关, 特异性COX-2抑制剂有望成为胃癌防治的一类新药. 流行病学调查显示长期服用NSAIDs的人群发生大肠癌的危险性降低40%-50%, 长时间加用NSAIDs可明显降低肿瘤的发生率. 胃癌细胞表面存在胃泌素受体, 在其细胞内有胃泌素基因的表达, 胃泌素通过其受体介导细胞内一系列信号传导, 促进细胞分裂和DNA合成, 对胃癌细胞有促生长作用.
联合应用特异性COX-2抑制剂和CCK-B/胃泌素受体拮抗剂有无协同抗癌作用及其机制, 目前国内外未见报道.
化疗和放疗在杀伤胃癌细胞的同时, 也损伤正常的组织细胞, 其严重的不良反应使患者难以耐受. 化疗药物的另一个主要问题是多数肿瘤细胞具有遗传不稳定性, 易于突变而产生耐药. 非细胞毒药物可抑制肿瘤的生长甚至转移, 不良反应轻, 有一定的应用前景.
胃泌素受体拮抗剂抑制人胃癌细胞的研究较少, 用COX-2抑制剂和胃泌素受体拮抗剂联合应用抑制人胃癌细胞有较好的创新性, 联合应用有其理论依据, 设计科学, 研究方法和技术可行, 结果可靠, 有一定研究价值, 能较好地反映我国胃肠病学基础研究的先进水平.
电编: 张敏 编辑:潘伯荣
| 1. | Uefuji K, Ichikura T, Mochizuki H. Increased expression of interleukin-1alpha and cyclooxy-genase-2 in human gastric cancer: a possible role in tumor progression. Anticancer Res. 2005;25:3225-3230. [PubMed] |
| 2. | Yasuda H, Yamada M, Endo Y, Inoue K, Yoshiba M. Elevated cyclooxygenase-2 expression in patients with early gastric cancer in the gastric pylorus. J Gastroenterol. 2005;40:690-697. [PubMed] [DOI] |
| 3. | Hu PJ, Yu J, Zeng ZR, Leung WK, Lin HL, Tang BD, Bai AH, Sung JJ. Chemoprevention of gastric cancer by celecoxib in rats. Gut. 2004;53:195-200. [DOI] |
| 4. | Henwood M, Clarke PA, Smith AM, Watson SA. Expression of gastrin in developing gastric adeno-carcinoma. Br J Surg. 2001;88:564-568. [PubMed] [DOI] |
| 5. | Hur K, Kwak MK, Lee HJ, Park do J, Lee HK, Lee HS, Kim WH, Michaeli D, Yang HK. Expression of gastrin and its receptor in human gastric cancer tissues. J Cancer Res Clin Oncol. 2006;132:85-91. [PubMed] [DOI] |
| 6. | Rengifo-Cam W, Singh P. Role of progastrins and gastrins and their receptors in GI and pancreatic cancers: targets for treatment. Curr Pharm Des. 2004;10:2345-2358. [PubMed] [DOI] |
| 7. | Szabo I, Rumi G, Bodis B, Nemeth P, Mozsik G. Gastrin and pentagastrin enhance the tumour proliferation of human stable cultured gastric adenocarcinoma cells. J Physiol Paris. 2000;94:71-74. [PubMed] [DOI] |
| 8. | Fontana MG, Moneghini D, Villanacci V, Donato F, Rindi G. Effect of cholecystokinin-B gastrin receptor blockade on chemically induced colon carcinogen-esis in mice: follow-up at 52 weeks. Digestion. 2002;65:35-40. [PubMed] [DOI] |
| 9. | Konturek PC, Kania J, Kukharsky V, Ocker S, Hahn EG, Konturek SJ. Influence of gastrin on the expression of cyclooxygenase-2, hepatocyte growth factor and apoptosis-related proteins in gastric epithelial cells. J Physiol Pharmacol. 2003;54:17-32. [PubMed] |
| 10. | Colucci R, Blandizzi C, Tanini M, Vassalle C, Breschi MC, Del Tacca M. Gastrin promotes human colon cancer cell growth via CCK-2 receptor-medi-ated cyclooxygenase-2 induction and prostaglandin E2 production. Br J Pharmacol. 2005;144:338-348. [PubMed] [DOI] |
| 12. | Sawaoka H, Kawano S, Tsuji S, Tsujii M, Murata H, Hori M. Effects of NSAIDs on proliferation of gastric cancer cells in vitro: possible implication of cyclooxygenase-2 in cancer development. J Clin Gastroenterol. 1998;27 Suppl 1:S47-S52. [PubMed] [DOI] |
| 13. | Uefuji K, Ichikura T, Shinomiya N, Mochizuki H. Induction of apoptosis by JTE-522, a specific cyclooxygenase-2 inhibitor, in human gastric cancer cell lines. Anticancer Res. 2000;20:4279-4284. [PubMed] |
| 15. | Lee HK, Lee HJ, Hur K, Lee HS, Kim WH, Michaeli D, Choe KJ, Yang HK. Growth effect of gastrin on gastric cancer and its clinical implications for gastric cancer surgery. Oncol Rep. 2005;14:383-388. [PubMed] [DOI] |
| 16. | Takaishi S, Cui G, Frederick DM, Carlson JE, Houghton J, Varro A, Dockray GJ, Ge Z, Whary MT, Rogers AB. Synergistic inhibitory effects of gastrin and histamine receptor antagonists on Helicobacter-induced gastric cancer. Gastroenterology. 2005;128:1965-1983. [PubMed] [DOI] |
| 17. | Yao M, Song DH, Rana B, Wolfe MM. COX-2 selective inhibition reverses the trophic properties of gastrin in colorectal cancer. Br J Cancer. 2002;87:574-579. [PubMed] [DOI] |
| 18. | Slice LW, Hodikian R, Zhukova E. Gastrin and EGF synergistically induce cyclooxygenase-2 expression in Swiss 3T3 fibroblasts that express the CCK2 receptor. J Cell Physiol. 2003;196:454-463. [PubMed] [DOI] |
| 19. | Ishii HH, Gobe GC, Pan W, Yoneyama J, Ebihara Y. Apoptosis and cell proliferation in the development of gastric carcinomas: associations with c-myc and p53 protein expression. J Gastroenterol Hepatol. 2002;17:966-972. [PubMed] [DOI] |
| 20. | Wang JY, Wang H, Johnson LR. Gastrin stimulates expression of protooncogene c-myc through a process involving polyamines in IEC-6 cells. Am J Physiol. 1995;269:C1474-C1481. [PubMed] |
| 21. | Kishimoto Y, Yashima K, Morisawa T, Shiota G, Kawasaki H, Hasegawa J. Effects of cyclooxy-genase-2 inhibitor NS-398 on APC and c-myc expression in rat colon carcinogenesis induced by azoxymethane. J Gastroenterol. 2002;37:186-193. [PubMed] [DOI] |