修回日期: 2006-03-17
接受日期: 2006-03-24
在线出版日期: 2006-04-28
目的: 建立抗生素诱导SPF级BALB/c小鼠胃肠道白念珠菌定植模型.
方法: SPF级♀Balb/c小鼠随机饮用抗生素头孢曲松水溶液5 d(120 h)后, 单次口服灌胃107CFU(50 µL)白念珠菌以诱导其定植. 并运用平板计数和基于细菌16S rDNA的PCR-DGGE技术分析小鼠胃肠道的白色念珠菌定植与微生物区系变化.
结果: 抗生素处理5 d后, 减少了胃肠道99.99%以上的可培养厌氧菌和肠杆菌, 与处理前相比, 有极显著差异(厌氧菌: 8.53±0.31 Log10CFU/g vs 4.18±0.90 Log10CFU/g, P<0.01; 肠杆菌: 3.67±0.14 Log10CFU/g vs 0, P<0.01), 而且DGGE图谱分析显示, 抗生素处理后小鼠细菌微生物区系的多样性明显减少(条带数由27-32条减少到2-7条). 对抗生素处理小鼠单次口服灌胃107CFU白念珠菌2 d后, 在小鼠胃、小肠、盲肠和大肠检测到大量的C. albicans, 数量分别为4.44±0.02 Log10CFU/tissue, 5.05±0.19 Log10CFU/tissue, 5.62±0.06 Log10CFU/tissue, 4.95±0.14 Log10CFU/tissue, 并且单次口服灌胃白念珠菌1 wk后, 小鼠胃肠道内仍维持有4.01±0.06 Log10CFU/g的白念珠菌定植. 与正常Control组和Antibiotic only组相比, Antibiotic+Candida模型组小鼠肠杆菌增殖了10到100倍(3.65±0.16 Log10CFU/g, 3.21±0.18 Log10CFU/g vs 5.42±0.33 Log10CFU/g, P<0.05); 同时DGGE图谱分析显示, Antibiotic+Candida模型组小鼠细菌微生物区系多样性较低(条带数Antibiotic+Candida/22-24条, Control/28-34条和Antibiotic only/27-34条), 各小鼠细菌微生物区系之间的相似性为63.8%-67.0%.
结论: 抗生素处理诱导了胃肠道微生物区系紊乱, 导致了白念珠菌在SPF级Balb/c小鼠胃肠道定植成模.
引文著录: 黄雪峰, 袁静, 魏泓. 抗生素诱导SPF级BALB/c小鼠胃肠道白念珠菌定植模型. 世界华人消化杂志 2006; 14(12): 1161-1166
Revised: March 17, 2006
Accepted: March 24, 2006
Published online: April 28, 2006
AIM: To establish a specific-pathogen-free (SPF) BALB/c mouse model of Candida albicans gastrointestinal colonization following antibiotic treatment.
METHODS: Female SPF BALB/c mice were treated for 5 days (120 h) with ceftriaxone ad libitum in drinking water, followed by a single oral gavage of 107CFU (50 µL) C. albicans. The gastrointestinal microbiota of mouse model was analyzed by plate counts and 16S rDNA-based polymerase chain reaction-denaturing gradient gel electrophoresis (PCR-DGGE) technique.
RESULTS: The culturable anaerobic and enteric bacterial levels were reduced significantly by 99.99% at day 5 of antibiotic treatment (anaerobe: 8.53 ± 0.31 Log10CFU/g vs 4.18 ± 0.90 Log10CFU/g, P < 0.01; enteric bacteria: 3.67 ± 0.14 Log10CFU/g vs 0, P < 0.01). DGGE profile clearly indicated that the bacterial diversity of the gut microbiota was obviously decreased (from 27-32 bands to 2-7 bands). A single oral gavage of 107CFU C. albicans resulted in C. albicans deposition in stomach, small intestine, cecum and large intestine of antibiotic-treated mice at day 2 post-antibiotic treatment (4.44 ± 0.02 Log10CFU/tissue, 5.05 ± 0.19 Log10CFU/tissue, 5.62 ± 0.06 Log10CFU/tissue and 4.95 ± 0.14 Log10CFU/tissue, respectively), and 4.01 ± 0.06 Log10CFU/g C. albicans colonization in gastrointestinal tract of antibiotic-treated mice at day 7 post-antibiotic treatment. The enteric bacterial levels of the gut mcirobiota of mice model was 10- to 100-fold-higher as compared with those in the mice untreated and antibiotic-treated only at day 7 post-antibiotic treatment (3.65 ± 0.16 Log10CFU/g, 3.21 ± 0.18 Log10CFU/g vs 5.42 ± 0.33 Log10CFU/g, P < 0.05). The analysis of DGGE profile showed that the bacterial diversity of mice model was lower (antibiotic + Candida/22-24 bands, Control/28-34 bands and antibiotic only/27-34 bands), and similarity values of each mice ranged from 63.8% to 67.0%.
CONCLUSION: Antibiotic-induced microbiota disruption leads to persistence of gastrointestinal C. albicans colonization of SPF BALB/c mice.
- Citation: Huang XF, Yuan J, Wei H. A specific-pathogen-free BALB/c mouse model of Candida albicans gastrointestinal colonization following antibiotic treatment. Shijie Huaren Xiaohua Zazhi 2006; 14(12): 1161-1166
- URL: https://www.wjgnet.com/1009-3079/full/v14/i12/1161.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i12.1161
白念珠菌(Candida albicans, C. albicans)在临床上是一种最流行的条件致病性真菌, 易于引起免疫缺陷、癌症和HIV感染等[1-3], 患者发生系统性白色假丝酵母病. 胃肠道是C. albicans主要生理性定植位点之一, 大量研究发现C. albicans可以通过胃肠道扩散发展为系统性白色假丝酵母病[4-5]. 甚至有研究报道, C. albicans在胃肠道微生物区系紊乱的小鼠中定植, 可以诱导肺部过敏性反应[6-7]. 然而, C. albicans通过胃肠道致病的机制现在仍然不清楚. 有必要构建单纯的C. albicans胃肠道真菌定植模型, 研究C. albicans通过胃肠道致病的机制. 抗生素治疗对胃肠道细菌微生物区系有很明显的影响, 尤其是在削弱细菌定植抗性促使C. albicans在胃肠道的增殖和感染中起着关键作用[8-11]. 在此, 我们采用临床分离株C. albicans SC5314对头孢曲松处理的SPF级BALB/c小鼠进行感染, 以建立一稳定的胃肠道白念珠菌定植模型, 研究C. albicans通过胃肠道致病的机制.
SPF级♀Balb/c小鼠, 16-18 g, 4-6周龄, 购买自第三军医大学实验动物中心. 小鼠饲养于顶部有空气过滤膜的封闭小鼠笼内, 并维持于第三军医大学实验动物中心一间独立的SPF动物房内. 头孢曲松由上海信谊培菲康医药有限公司提供. C. albicans SC5314由加拿大生物技术研究所Anne Marcil博士惠赠.
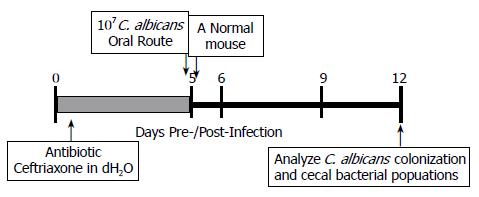
Balb/c小鼠随机口服0.5 g/L头孢曲松水溶液, 连续处理5 d(120 h)后, 接种C. albicans, 并且5 d后将饮水换成无菌水. 抗生素处理完后, 粪便活菌计数用于检测抗生素对胃肠道细菌微生物区系减少的有效性. 为了确保胃肠道细菌微生物的持续定植, 一只正常的Balb/c小鼠总是与抗生素处理的小鼠饲养在一起. C. albicans SC5314接种于Sabourand's Dextran Broth(SDB)培养基(10 g/L蛋白胨, 20 g/L无水葡萄糖)中, 在37 ℃以30 r/min振荡培养至稳定期(72 h)后收获. 为了感染, C. albicans使用生理盐水漂洗2次后, 通过细胞血球计数板计数, 并用生理盐水稀释至2×1011 CFU/L. 在灌胃C. albicans前, 小鼠禁食禁水4 h. 每只BALB/c小鼠运用1 mL注射器(接24型的小鼠灌胃针)进行口服灌胃50 µL(107CFU)菌液. 等量的溶液进行平板活菌计数以验证其接种量.
1.2.1 组织CFU检测: 无菌采取小鼠组织于装有5 mL稀释液(0.5 g/L-半胱氨酸, 0.5 g酵母粉, 9 g NaCl, 0.21 g KH2PO4, 0.726 g Na2HPO4, 1 L H2O, pH7.2)的玻璃组织匀浆管内, 称取质量, 匀浆. 口腔(包括舌和两颊)、胃、小肠、盲肠、大肠、肠系膜淋巴结、肺脏、脾脏和肾脏整体取出. 将匀浆液进行10倍稀释后, 进行平板计数. 几种培养基用于CFU检测, Sabourand's Dextran Agar(SDA)(10 g/L蛋白胨, 20 g/L无水葡萄糖, 50 mg/L氯霉素)用于C. albicans培养, Brain Heart Infusion Agar(BHI)(Difco)用于厌氧菌培养, MacConkey Agar(北京双旋微生物培养基制品厂)用于兼性厌氧肠杆菌培养. SDA平板置于37 ℃有氧条件下培养72 h后计数; MacConkey平板置于37 ℃有氧条件下培养24 h后计数; BHI平板置于37 ℃厌氧条件下(800 mL/L N2, 150 mL/L CO2, 50 mL/L H2)培养72 h后计数. C. albicans在不同组织的定植数据以CFU/tissue进行比较分析, 胃肠道细菌变化数据以CFU/g进行比较分析.
1.2.2 盲肠细菌微生物区系的PCR-DGGE分析: 小鼠处死后立即采取盲肠, 取100 mg左右的盲肠内容物于2 mL螺口管(BioSpec)中, 样品储藏在-80 ℃直到总DNA的提取. 向2 mL螺口管中加入700 µL的裂解缓冲液(500 mmol/L NaCl, 50 mmol/L Tris-HCl, pH8.0, 50 mmol/L EDTA, 40 g/L SDS), 300 µL酚/氯仿/异戊醇(25:24:1, Promega)和0.4 g锆珠(0.35 g/0.1 mm, 0.05 g/0.5 mm, BioSpec), 混匀, 并将研磨管放入Mini-BeadbeaterTM(Biospec, Bartlesville, OK, USA), 以最大转速研磨2 min. 随后进行酚氯仿提取. 提取的DNA通过10 g/L的琼脂糖凝胶电泳检测其DNA完整性, 并取1 µL溶液于NanoDrop® ND-1000核酸定量仪(Nanodrop technologies)中测定其DNA含量. 胃肠道细菌微生物区系的变化使用16S rDNA的V3可变区作为靶标进行PCR-DGGE分析. 扩增16S rDNA V3区引物[12-13]为357f (5'-CGCCCGGGGCGCGCCCCGGGCGGGGCGGGGGCACGGGGGGCCTACGGGAGGCAGCAG-3'), 519r(5'-ATTACCGCGGCTGCTGG-3'). 扩增体系(50 µL): 包括100 ng DNA模板, 1×EX Taq buffer, 200 µmol/L dNTP, 200 nmol/L各引物, 1.5 mmol/L MgCl2, 670 mg/L BSA, 1.25 U EX Taq DNA聚合酶(TaKaRa). 反应条件: 94 ℃ 5 min, 30个循环(94 ℃ 30 s, 56 ℃ 30 s, 72 ℃ 1 min), 72 ℃ 7 min. 参照Muyzer et al[14]方法, 对16S rDNA的V3可变区的扩增产物进行DGGE分析. DGGE使用80 g/L聚丙烯酰胺凝胶, 35%-65%(100%变性梯度包含400 mL/L甲酰胺和7 mol/L尿素)的变性梯度. 电泳采用DCodeTM Universal Mutation Detection System (Bio-Rad Laboratories, Hercules, CA, USA), 首先在220 V电压下预电泳10 min, 随后在85 V的固定电压下电泳16 h. 电泳结束后, 进行硝酸银染色[15]. DGGE凝胶采用Quantity One(Bio-Rad)进行相似性分析.
统计学处理 实验数据用mean±SD表示, 采用SPSS10.0软件进行统计学分析, 不同实验组之间的差异分析采用Student-t检验, P<0.05为统计学上有显著差异, P<0.01为统计学上极显著差异.
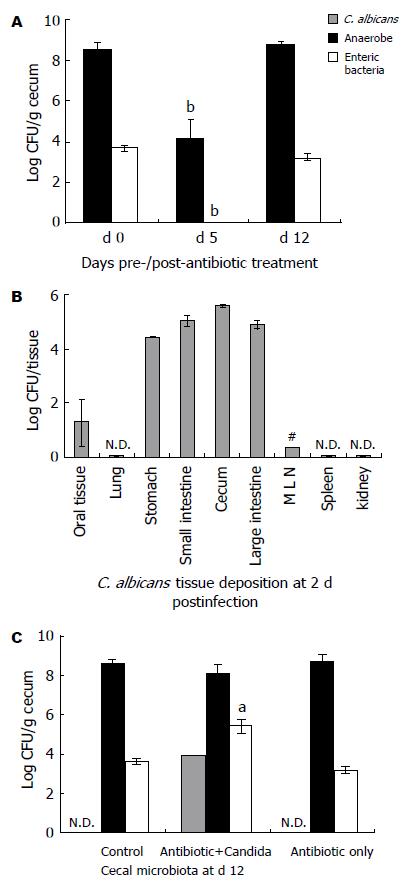
为了构建C. albicans胃肠道持续定植的小鼠模型, SPF级♀Balb/c小鼠使用广谱抗生素头孢曲松处理5 d(120 h), 以减少胃肠道总的细菌微生物, 随后单次口服灌胃107 CFU(50 µL)C. albicans, 以在胃肠道微生物区系中建立持续定植的C. albicans菌群(图1). 5 d的抗生素处理减少了胃肠道99.99%以上的可培养厌氧菌和肠杆菌, 与处理前相比, 有极显著差异(厌氧菌: 8.53±0.31 Log10CFU/g vs 4.18±0.90 Log10CFU/g, P<0.01; 肠杆菌: 3.67±0.14 Log10CFU/g vs 0, P<0.01, 图2A). 当停止抗生素的处理, 厌氧菌和肠杆菌数量恢复到处理前水平(P>0.05). 抗生素处理后接种C. albicans, 2 d后在小鼠肺脏、脾脏和肾脏中均未能检测出C. albicans, 口腔中可检测出少量C. albicans(<100 CFU/tissue), 8只小鼠中有2只小鼠的肠系膜淋巴结检测出C. albicans(<100 CFU/tissue), 胃、小肠、盲肠和大肠中均检测到大量的C. albicans, 数量分别为4.44±0.02 Log10CFU/tissue, 5.05±0.19 Log10CFU/tissue, 5.62±0.06 Log10CFU/tissue, 4.95±0.14 Log10CFU/tissue(图2B). 在C. albicans接种7 d后, 抗生素+C. albicans处理小鼠(Antibiotic+Candida组)盲肠中检测到4.01±0.06 Log10CFU/g C. albicans, 而未处理小鼠(Control组)和抗生素处理小鼠(Antibiotic only组)盲肠中均未检测到C. albicans(<50 CFU/g). 相对于Control组和Antibiotic only组, Antibiotic+Candida组小鼠肠道肠杆菌增殖了10到100倍(3.65±0.16 Log10CFU/g, 3.21±0.18 Log10CFU/g vs 5.42±0.33 Log10CFU/g, P<0.05), 厌氧菌数量变化不明显(8.56±0.29 Log10CFU/g, 8.70±0.19 Log10CFU/g vs 8.14±0.45 Log10CFU/g, P>0.05, 图2C). 此外, 该建模处理方法未引起小鼠明显的病理变化和C. albicans系统性扩散, 在肺脏、脾脏和肾脏中均未能检测出C. albicans, 但是小鼠的肠系膜淋巴结和盲肠肿大.
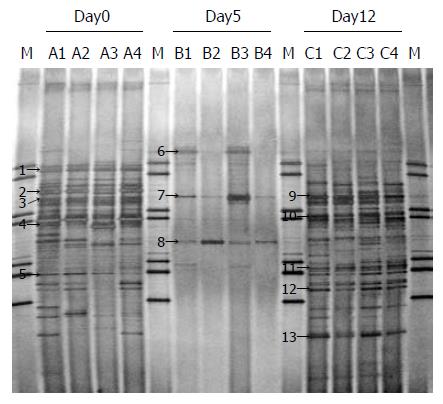
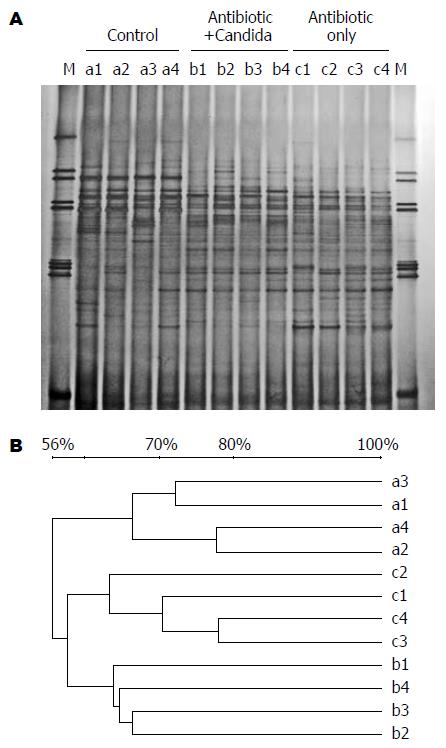
为了对建模后小鼠胃肠道细菌微生物区系变化进行分析, 我们使用了基于细菌16S rDNA的PCR-DGGE技术直观地分析小鼠胃肠道细菌多样性变化. 抗生素处理5 d后, 胃肠道细菌多样性显著减少, 只有少数细菌种类可以检测到(条带数由27-32条减少到2-7条). 停止抗生素处理7 d后, 胃肠道细菌多样性恢复到处理前的水平(条带数27-34条), 但是细菌微生物区系中的优势性细菌发生了变化(图3箭头). 此外, Antibiotic+Candida组相对于Control组和Antibiotic only组, 其优势性细菌也发生了明显的变化, 细菌多样性较低(条带数Antibiotic+Candida/22-24条, Control/28-34条和Antibiotic only/27-34条, 图4A). 聚类分析显示(图4B), Antibiotic+Candida组, Control组和Antibiotic only组的DGGE图谱各自聚为一族(相似性分别为Antibiotic+Candida: 63.8%-67.0%, Control: 66.0%-77.6%和Antibiotic only: 63.2%-78.0%), Antibiotic+Candida组与Antibiotic only组相似性更为接近(相似性为58%). 这些结果表明该模型小鼠胃肠道的微生物多样性较低(条带数22-24条), 各模型小鼠胃肠道细菌微生物多样性之间相似性较高(相似性为63.8%-67.0%).
临床上, C. albicans在人胃肠道内增殖是抗生素治疗的一种常见副效应, 并且其效应与抗生素的抗厌氧菌活性呈正相关[16-18]. 抗厌氧菌活性较强的抗生素(如替卡西林-克拉维酸、阿莫西林-克拉维酸、头孢曲松和氯霉素等)能够促进C. albicans在人或小鼠胃肠道的增殖[9-10]. 说明胃肠道微生物区系中的厌氧菌对C. albicans增殖抑制具有重要的作用. 我们的研究通过广谱抗生素头孢曲松处理和单次口服灌胃C. albicans, 建立了SPF级BALB/c小鼠胃肠道C. albicans定植模型. 该方法导致了较低水平、无生命危险的C. albicans持续定植(C. albicans接种2 wk后仍然能从小鼠粪便中检出). 这种结果存在因果关系, 首先是头孢曲松减少肠道微生物区系中厌氧菌, 一是数量降低, 二是多样性减少; 其次是C. albicans在细菌定植抗性较低的胃肠道中定植, 占据了相应的生态位, 又影响了细菌微生物区系的恢复. 从作用机制上, 该方法与Pultz et al[19]采用皮下注射抗厌氧菌活性较强的抗生素(如甲硝唑、头孢曲松和林可霉素等), 减少肠道微生物区系中厌氧菌, 促使Candida glabrata在肠道的定植是一致的.
大量研究报道, 胃肠道细菌微生物区系对C. albicans的拮抗主要表现在两个方面, 一是表现在细菌微生物区系占据有利的生态位竞争性排斥C. albicans, 阻碍其定植; 二是细菌微生物区系能够产生一些次生代谢产物(如短链脂肪酸)抑制C. albicans生长[20-23]. 更值得一提的是, 抗生素对胃肠道细菌微生物区系影响通常会持续几个月的, 导致有益的厌氧菌(如双歧杆菌、乳杆菌和拟杆菌)长期的减少和条件致病菌(如C. albicans、肠杆菌和艰难梭菌)的增殖[24-27]. 本研究获得了相似的结果, 在停止抗生素处理后, 相对于Control组和Antibiotic only组, Antibiotic+Candida组小鼠肠道肠杆菌与厌氧菌比率显著升高, 细菌微生物区系优势菌群发生变化. 相关研究还表明, 相对于Antibiotic only组而言, Antibiotic+Candida组的微生物区系中的益生菌种类(包括乳杆菌、双歧杆菌)较少, 甚至通过属特异性引物PCR在Antibiotic+Candida组检测不到双歧杆菌.
此外, 建模过程中环境的控制十分重要, 抗生素处理后小鼠胃肠道细菌定植抗性差, 容易导致交叉污染, 导致结果的一致性差. 所以在实验中我们在独立的SPF房间内仍然将小鼠饲养于顶部有空气过滤膜的封闭小鼠笼内.
感谢本教研室谢彩虹在高劳动强度平板计数过程中的协助, 感谢加拿大生物技术研究所Dr. Anne Marcil提供Candida albicans SC5314.
胃肠道是C. albicans主要生理性定植位点之一, 大量研究发现C. albicans可以通过胃肠道扩散发展为系统性白色假丝酵母病; 甚至有研究表明, C. albicans在胃肠道微生物区系紊乱的小鼠中定植, 可以诱导肺部过敏性反应, 但是C. albicans通过胃肠道致病的机制现在仍然不清楚. 有必要构建单纯的C. albicans胃肠道真菌定植模型, 以研究C. albicans通过胃肠道致病的机制.
抗生素诱导的C. albicans定植和胃肠道菌群紊乱, 除了能够导致肠道自身的变化以外, 还能够调节肠道外的免疫反应.
Pultz et al研究表明, 通过皮下注射抗厌氧菌活性较强的抗生素(如甲硝唑、头孢曲松和林可霉素等), 可以减少肠道微生物区系中厌氧菌, 促使C. glabrata在肠道的定植.
本文从实验小鼠的选择, 抗生素诱导的C. albicans定植, 以及定植后肠道微生物区系的变化等方面进行了较为细致研究, 获得了可重复性高的小鼠胃肠道C. albicans定植模型.
本文通过抗生素诱导和单次口服灌胃C. albicans获得了单纯的胃肠道C. albicans定植小鼠模型, 且成模后小鼠之间胃肠道细菌微生物区系的相似性较高,为进一步研究C. albicans通过胃肠道致病的机制提供基础.
1胃肠道微生物区系: 是指胃肠道内所有微生物的总和, 包括细菌、真菌和古菌; 其中以细菌占主导, 而细菌中97%以上的肠道细菌是严格的厌氧菌, 少数为兼性厌氧菌. 2定植: 是指胃肠道内源性或者外源性微生物在肠道内增殖和驻留的状态, 是微生物与宿主胃肠道相互作用的起始步骤.
本文对研究白念珠菌的致病机制有一定参考意义. 目的明确, 手段先进, 材料与方法正确, 动物的选择与喂养条件均符合标准, 具有一定的实用性, 能够较好地反映我国基础研究的先进水平.
编辑: 潘伯荣 电编:张敏
| 1. | Viscoli C, Girmenia C, Marinus A, Collette L, Marti-no P, Vandercam B, Doyen C, Lebeau B, Spence D, Krcmery V. Candidemia in cancer patients: a prospective, multicenter surveill-ance study by the Invasive Fungal Infection Group (IFIG) of the European Organization for Research and Treatment of Cancer (EORTC). Clin Infect Dis. 1999;28:1071-1079. [PubMed] |
| 2. | Bodey GP, Mardani M, Hanna HA, Boktour M, Abbas J, Girgawy E, Hachem RY, Kontoyiannis DP, Raad II. The epidemiology of Candida glabrata and Candida albicans fungemia in immunocom-promised patients with cancer. Am J Med. 2002;112:380-385. [PubMed] |
| 3. | Nebavi F, Ayala FJ, Renaud F, Bertout S, Eholie S, Moussa K, Mallie M, de Meeus T. Clonal population structure and genetic diversity of Candida albicans in AIDS patients from Abidjan (Cote d'Ivoire). Proc Natl Acad Sci USA. 2006;103:3663-3668. [PubMed] |
| 4. | Kennedy MJ. Regulation of Candida albicans popu-lations in the gastrointestinal tract: mechanisms and significance in GI and systemic candidiasis. Curr Top Med Mycol. 1989;3:315-402. [PubMed] |
| 5. | Cole GT, Halawa AA, Anaissie EJ. The role of the gastrointestinal tract in hematogenous candidiasis: from the laboratory to the bedside. Clin Infect Dis. 1996;22:S73-S88. [PubMed] |
| 6. | Noverr MC, Noggle RM, Toews GB, Huffnagle GB. Role of antibiotics and fungal microbiota in driving pulmonary allergic responses. Infect Immun. 2004;72:4996-5003. [PubMed] |
| 7. | Noverr MC, Falkowski NR, McDonald RA, McKen-zie AN, Huffnagle GB. Development of allergic airway disease in mice following antibiotic therapy and fungal microbiota increase: role of host gene-tics, antigen, and interleukin-13. Infect Immun. 2005;73:30-38. [PubMed] |
| 8. | Samonis G, Anaissie EJ, Bodey GP. Effects of broad-spectrum antimicrobial agents on yeast colonization of the gastrointestinal tracts of mice. Antimicrob Agents Chemother. 1990;34:2420-2422. [PubMed] |
| 9. | Samonis G, Gikas A, Anaissie EJ, Vrenzos G, Maraki S, Tselentis Y, Bodey GP. Prospective evaluation of effects of broad-spectrum antibiotics on gastrointestinal yeast colonization of humans. Antimicrob Agents Chemother. 1993;37:51-53. [PubMed] |
| 10. | Samonis G, Anastassiadou H, Dassiou M, Tselentis Y, Bodey GP. Effects of broad-spectrum antibiotics on colonization of gastrointestinal tracts of mice by Candida albicans. Antimicrob Agents Chemother. 1994;38:602-603. [PubMed] |
| 11. | Maraki S, Barbounakis E, Chatzinikolaou I, Anato-liotakis N, Plataki M, Tselentis Y, Samonis G. Effects of cefepime, cefixime and ceftibuten on murine gut colonization by Candida albicans. Chemotherapy. 1998;44:405-408. [PubMed] |
| 12. | Yu Z, Morrison M. Comparisons of different hyper-variable regions of rrs genes for use in fingerpri-nting of microbial communities by PCR-denaturing gradient gel electrophoresis. Appl Environ Microbiol. 2004;70:4800-4806. [PubMed] |
| 13. | McCracken VJ, Simpson JM, Mackie RI, Gaskins HR. Molecular ecological analysis of dietary and antibiotic-induced alterations of the mouse intes-tinal microbiota. J Nutr. 2001;131:1862-1870. [PubMed] |
| 14. | Muyzer G, de Waal EC, Uitterlinden AG. Profiling of complex microbial populations by denaturing gradient gel electrophoresis analysis of polymerase chain reaction-amplified genes coding for 16S rRNA. Appl Environ Microbiol. 1993;59:695-700. [PubMed] |
| 15. | Sanguinetti CJ, Dias Neto E, Simpson AJ. Rapid silver staining and recovery of PCR products separ-ated on polyacrylamide gels. Biotechniques. 1994;17:914-921. [PubMed] |
| 16. | Sullivan A, Edlund C, Nord CE. Effect of antimicro-bial agents on the ecological balance of human microflora. Lancet Infect Dis. 2001;1:101-114. [PubMed] |
| 17. | Huang MY, Wang JH. Impact of antibiotic use on fungus colonization in patients hospitalized due to fever. J Microbiol Immunol Infect. 2003;36:123-128. [PubMed] |
| 18. | Maraki S, Margioris AN, Orfanoudaki E, Tselentis Y, Koumantakis E, Kontoyiannis DP, Rovithi M, Samonis G. Effects of doxycycline, metronidazole and their combination on Candida species coloniza-tion of the human oropharynx, intestinal lumen and vagina. J Chemother. 2003;15:369-373. [PubMed] |
| 19. | Pultz NJ, Stiefel U, Ghannoum M, Helfand MS, Donskey CJ. Effect of parenteral antibiotic adminis-tration on establishment of intestinal colonization by Candida glabrata in adult mice. Antimicrob Agents Chemother. 2005;49:438-440. [PubMed] |
| 20. | Noverr MC, Huffnagle GB. Regulation of Candida albicans morphogenesis by fatty acid metabolites. Infect Immun. 2004;72:6206-6210. [PubMed] |
| 21. | Sjogren J, Magnusson J, Broberg A, Schnurer J, Kenne L. Antifungal 3-hydroxy fatty acids from Lactobacillus plantarum MiLAB 14. Appl Environ Microbiol. 2003;69:7554-7557. [PubMed] |
| 22. | Magnusson J, Strom K, Roos S, Sjogren J, Schnurer J. Broad and complex antifungal activity among environmental isolates of lactic acid bacteria. FEMS Microbiol Lett. 2003;219:129-135. [PubMed] |
| 23. | Hogan DA, Vik A, Kolter R. A Pseudomonas aeruginosa quorum-sensing molecule influences Candida albicans morphology. Mol Microbiol. 2004;54:1212-1223. [PubMed] |
| 24. | Orrhage K, Nord CE. Bifidobacteria and lactobacilli in human health. Drugs Exp Clin Res. 2000;26:95-111. [PubMed] |
| 25. | van der Waaij D. The ecology of the human intestine and its consequences for overgrowth by pathogens such as Clostridium difficile. Annu Rev Microbiol. 1989;43:69-87. [PubMed] |
| 26. | Payne S, Gibson G, Wynne A, Hudspith B, Brostoff J, Tuohy K. In vitro studies on colonization resistance of the human gut microbiota to Candida albicans and the effects of tetracycline and Lactobacillus plantarum LPK. Curr Issues Intest Microbiol. 2003;4:1-8. [PubMed] |
| 27. | Tannock GW. Analysis of the intestinal microflora using molecular methods. Eur J Clin Nutr. 2002;56:S44-S49. [PubMed] |