修回日期: 2005-12-01
接受日期: 2005-12-24
在线出版日期: 2006-04-18
目的: 用SEREX方法鉴定HCC表达的肿瘤抗原, 检测hcct-19的表达谱.
方法: 将HCC表达文库铺板, IPTG诱导蛋白质表达, BSA封闭. 同1:1000稀释的预吸收HCC患者血清反应后, 与1:5000稀释的羊抗人抗体反应, 在BCIP/NBT的作用下显色, 挑取阳性克隆噬菌斑块, 重复筛选和铺板3次, 直至得到一致的单克隆免疫阳性重组噬菌体. 挑取阳性克隆噬菌斑, 用载体克隆位点两端的通用引物进行PCR扩增, PCR产物纯化测序, 序列结果用BLAST软件同GenBank中的已知基因进行对比分析. 检测阳性克隆抗原基因hcct-19在部分正常组织、肿瘤组织及肿瘤细胞株中的表达, 半定量RT-PCR方法检测阳性克隆抗原基因在肝癌及癌旁组织中的表达.
结果: 共得到31个阳性克隆, 代表14个不同的cDNA序列, 其中10个为已知功能的基因, 4个为未知功能的基因. 在已知功能的基因中, RFC2、NDUFA4及MCART1首次被发现与HCC有关. hcct-19在部分正常组织、肿瘤组织及肿瘤细胞株中表达, 在肝癌组织中的表达强度明显高于癌旁组织(13.2±2.7 vs 2.9±0.3, P < 0.05).
结论: 本实验筛选出的HCC抗原有助于进一步阐明HCC的形成过程. hcct-19可能作为一个过量表达的基因参与了HCC的发病过程.
引文著录: 陈晓红, 陈智, 陈峰, 姚航平, 夏琦, 焦婧婧. 用SEREX方法筛选HCC抗原及hcct-19表达谱的检测. 世界华人消化杂志 2006; 14(11): 1064-1070
Revised: December 1, 2005
Accepted: December 24, 2005
Published online: April 18, 2006
AIM: To identify hepatocellular carcinoma (HCC) antigens by serological analysis of recombinant cDNA expression library (SEREX) and observe the expression of hcct-19 in human tissues and cell lines.
METHODS: Firstly, a high-quality cDNA library from human HCC tissue was constructed successfully. E. coli transfected with recombinant λTripleX2 phages were plated onto LB-agar plates. The expression of recombinant proteins was induced with isopropyl-beta-D-thiogalactopyranoside (IPTG). The membranes were blocked with BSA and incubated with a 1:1000 dilution of patient's serum, which had been preabsorbed with transfected E. coli phage lysate. Then they were incubated with a 1:5000 dilution of the alkaline phosphatase-conjugated antibody specific for human IgG. Reactive clones were visualized by staining with BCIP/NBT, and these clones were subcloned three times to obtain monoclonality. Secondly, positive clone plaques were randomly picked and tested using polymerase chain reaction (PCR) with universal primers derived from the sequence flanking the vector. PCR products were purified and sequenced, and the results were analyzed with BLAST software in comparison with the known genes in GenBank. Thirdly, the positive clone of hcct-19 gene expression was detected by PCR in normal human tissues of stomach, colon, liver, pancreas, kidney, uterus, testicle and bladder, human tumor tissues of colon carcinoma, renal carcinoma, pancreatic cancer, gastric carcinoma, prostatic carcinoma, HCC, ovarian cancer and lung cancer, and tumor cell lines of HepG2, Hela, MGC-803, PANC-1, PC3, W-549 and SW-480, and semi-quantitative reverse transcription PCR was used to detect hcct-19 expression in HCC and cancer-adjacent tissues.
RESULTS: Firstly, thirty-one positive clones were obtained, representing fourteen different cDNA sequences (lengths from 324 to 805 bp). Ten cDNAs were genes with known functions, of which replication factor C 2, NADH dehydrogenase 1 alpha subcomplex 4 and mitochondrial carrier triple repeat 1 were found to be associated with HCC for the first time. Secondly, the cloned hcct-19 was expressed in normal human tissues of stomach, large intestine, liver, pancreas, kidney, uterus, testicle and bladder, human tumor tissues of colon carcinoma, renal carcinoma, pancreatic cancer, gastric carcinoma, prostatic carcinoma, hepatocellular carcinoma, ovarian cancer and lung cancer, and tumor cell lines of HepG2, Hela, MGC-803, PANC-1, PC3, W-549 and SW-480. The level of hcct-19 expression in HCC tissues was significantly higher than that in cancer-adjacent tissues (13.2 ± 2.7 vs 2.9 ± 0.3, P < 0.05).
CONCLUSION: HCC antigens identified from this study contribute to clarify the pathogenesis of HCC, during which hcct-19 may serves as an overexpressed gene.
- Citation: Chen XH, Chen Z, Chen F, Yao HP, Xia Q, Jiao JJ. Identification of hepatocellular carcinoma antigens by serological analysis of recombinant cDNA expression library and detection of hcct-19 expression in human tissues and cell lines. Shijie Huaren Xiaohua Zazhi 2006; 14(11): 1064-1070
- URL: https://www.wjgnet.com/1009-3079/full/v14/i11/1064.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i11.1064
原发性肝癌(hepatocellular carcinoma, HCC)早期不易发现, 然而肿瘤细胞的改变可以被免疫细胞识别并被免疫系统排斥. 用分子生物学和免疫的方法鉴定出这些改变的基因(肿瘤特异性/相关性抗原基因)和蛋白, 可为早期诊断及免疫治疗提供潜在的靶位. 筛选肿瘤抗原的方法SEREX(serological analysis of recombinant cDNA expression library), 即重组克隆表达抗原的血清学鉴定技术, 最方便和高效. 该方法是用癌症患者的抗体库来鉴别抗原分子[1], 他的主要特点是适用于各种肿瘤及能迅速找到抗原的分子特征.
HCC发生、发展的分子基础之一是多基因表达的特点[2]. 总体上, 对HCC的抗原研究及以其作为疫苗行免疫治疗尚处于不成熟阶段, HCC的抗原及编码的基因还远不清楚, 急需寻找新的抗原分子及鉴定其表位. 因此, 我们采用SEREX方法, 从高度分化的HCC组织中提取总RNA, 构建cDNA表达文库, 以HCC患者自体和异体的混合血清筛选文库, 鉴定HCC表达的肿瘤抗原. 期望为HCC的早期诊断和预后提供新的标记物, 为HCC疫苗的研制及免疫效果监测打下基础, 并且为探讨肿瘤发生、发展的分子机制提供依据.
正常人胃、大肠、肝脏、胰腺、肾脏、子宫、睾丸及膀胱组织标本, 人大肠癌、肾癌、胰腺癌、胃癌、前列腺癌、HCC、卵巢癌及肺癌组织标本, 人HCC组织及癌旁组织(癌组织5 cm以外)标本, 由浙江大学病理教研室、浙江大学附属二院外科及病理科提供, 并经病理证实. 肝癌HepG2细胞株、子宫颈癌Hela细胞株、胃癌MGC-803细胞株及胰腺癌PANC-1细胞株由浙江大学传染病研究所保存, 肺癌W549细胞株由浙江大学附属一院呼吸病研究所惠赠, 前列腺癌PC3细胞株由浙江大学免疫研究所惠赠, 大肠癌SW-480细胞株由浙江大学病理教研室惠赠. SMARTTM cDNA Library Construction Kit为美国Clontech公司产品, E. coli XL1-Blue为美国Clontech公司产品, Escherichia coli phage lysate为美国Stratagene公司产品, 碱性磷酸酶连接的Fc片段的特异性羊抗人抗体为美国SouthernBiotechnology Associates公司产品, RevertAidTMM-MuLV逆转录酶为立陶宛Fermentas公司产品, Pyrobest DNA Polymerase为日本Takara公司产品, IPTG为美国Promega公司产品, BCIP/NBT为美国Roche公司产品. 寡核苷酸引物合成由上海生工公司及上海博亚生物技术有限公司完成, DNA测序由上海博亚生物技术有限公司及上海华大基因公司完成.
1.2.1 HCC患者组织cDNA表达文库的构建和筛选: 用Trizol方法提取人原发性肝癌组织总RNA并进行mRNA纯化; 反转录合成单链cDNA, 长距离PCR方法合成双链cDNA; PCR产物经蛋白酶K水解、纯化后, 用SfiⅠ酶切; 将酶切产物进行分级分离, 回收0.4 kb以上的cDNA组分, 并与λTripEx2载体连接; 连接产物经体外蛋白包装, 产生未扩增文库; 鉴定文库的滴度和重组效率(中华传染病杂志 2005; 23: 289-292). 用大肠杆菌噬菌体裂解液预吸收一抗(HCC患者自体和异体混合血清): 在TBST(含5 g/L Tween-20的TBS)缓冲液中按1:10(V/V)稀释大肠杆菌噬菌体裂解液, 将4张硝酸纤维膜依次浸入其中, 在室温下孵育30 min, 30 g/L的BSA封闭, 洗膜; 按1:5在TBST中稀释一抗, 依次硝酸纤维膜放到一抗溶液中, 37 ℃震摇10 min, 取出硝酸纤维膜, 收集一抗溶液, 加入0.5 g/L NaN3放在4 ℃保存. 将噬菌体重组子转染大肠杆菌XL1-Blue, 在150 mm LB/MgSO4琼脂上铺板, 用0.01 mol/L IPTG处理过的硝酸纤维膜诱导蛋白质表达; TBS洗膜后先与1:5000稀释的二抗(碱性磷酸酶-偶联羊抗人抗体)共孵育, 洗膜后与BCIP/NBT进行显色反应, 阳性克隆处用针孔标记; 将滤膜与1:1000稀释的预吸收一抗共孵育, 洗膜后再与二抗共孵育, 显色, 没有针孔标记的阳性噬菌斑为对患者血清反应的阳性克隆; 挑取阳性噬菌斑块, 放置在1×Lambda稀释缓冲液中, 4 ℃过夜洗脱; 确定洗脱液中噬菌体的滴度, 重复筛选和铺板3次, 直至得到一致的单克隆免疫阳性重组噬菌斑. 挑取阳性噬菌斑, 用载体克隆位点两端的通用引物进行PCR扩增, 反应参数为95 ℃ 3 min; 94 ℃ 30 s, 55 ℃ 30 s, 72 ℃ 2 min, 30个循环; 72 ℃ 7 min. PCR产物纯化后送上海博亚生物技术有限公司及华大基因公司测序, 测序结果在NCBI所提供的网站上(http://www.nici.nlm.nih.gov), 用BLAST软件同Genbank中的已知基因进行同源性分析.
1.2.2 阳性克隆基因的表达谱检测: 为了解我们感兴趣的阳性克隆hcct-19在正常组织和肿瘤组织中的表达情况, 设计hcct-19的特异性引物, 以β-actin为内参照, 分别从100 mg正常人胃、大肠、肝脏、胰腺、肾脏、子宫、睾丸及膀胱组织, 100 mg人大肠癌、肾癌、胰腺癌、胃癌、前列腺癌、肝癌、卵巢癌及肺癌组织, 1×106个人肝癌HepG2细胞、子宫颈癌Hela细胞、胃癌MGC-803细胞、胰腺癌PANC-1细胞、前列腺癌PC3细胞、肺癌W-549细胞及大肠癌SW-480细胞中提取总RNA, RT-PCR法检测hcct-19的表达. hcct-19的上游引物为: 5'-CTATTGGGTGCCATGTTG-3', 下游引物为: 5'-TTCACTAACCCTCTGACCT-3', 长度为390 bp. β-actin的上游引物为: 5'-CGCCGCGCTCGTCGTCGACA-3', 下游引物为: 5'-GTCACGCACGATTTCCCGCT-3', 长度为619 bp. PCR参数为: 95 ℃ 3 min; 94 ℃ 30 s, 55 ℃ 30 s, 72 ℃ 1 min, β-actin和hcct-19基因扩增的扩增循环数分别为25个和28个; 72 ℃ 10 min. 取等量hcct-19基因和β-actin基因PCR产物在10 g/L琼脂糖凝胶中电泳, 100 V约30 min, 经数码凝胶成像系统成像, 用Gel Pro analyzer 4.0软件进行条带灰度分析, 以β-actin作为内参照, 测定hcct-19基因的相对表达量. 为了解hcct-19在肝癌组织和癌旁组织中的表达是否存在差异, 采用半定量RT-PCR方法, 以β-actin为内参照, 分别检测了20对肝组织和癌旁组织中hcct-19的表达.
统计学处理 数据采用统计软件SPSS10.0进行t检验.
我们采用SMART方法构建了HCC的cDNA表达文库, 初始文库容量为1.37×109 pfu/L, 重组克隆百分比为97.46%, cDNA插入片段的平均长度为0.96 kb. 选用自体和异体HCC患者的混合血清筛选文库, 经过3轮筛选, 得到31个阳性克隆. 用载体克隆位点两端的通用引物进行PCR扩增, 产物纯化测序, 所得基因片段的长度324-805 bp不等. 测序后的结果经与Genbank进行同源性比较, 得到14个cDNA片段, 其中10个为已知功能基因, 4个为未知功能基因(表1), 这些基因从功能上可分为4类(表2). 在已知功能的基因中, RFC2、NDUFA4及MCART1首次被发现与HCC有关.
| Clone | Gene | Identity(%) | Accession number | Location | Function |
| hcct-1, 14 | Homo. EIF3S2 | 99% | U39067 | 1p34.1 | translation initiation factor activity |
| hcct-3, 6 | Homo. RAB4B | 98% | NM016154 | 19q13.2 | GTP binding, GTPase activity |
| hcct-4, 21 | Homo. HSPCA | 99% | NM005348 | 14q32.33 | Molecule champerone |
| hcct-5, 8 | Homo. IGFBP2 | 99% | NM000597 | 2q33-q34 | insulin-like growth factor binding |
| hcct-7 | Homo. HSP70 | 99% | NM004134 | 5q31.1 | Molecule champerone |
| hcct-9 | Homo. MAGE-3 | 97% | BC005963 | Xq28 | Unknown |
| hcct-11, 15 | Homo. LDH-A | 99% | NM010699 | 7q | Metabolic enzyme |
| hcct-12, 16 | Homo. MAGE-1 | 98% | BC017555 | Xq28 | Unknown |
| hcct-13 | Homo. RFC2 | 98% | NM181471 | 7q11.23 | nucleotide binding |
| hcct-18 | Homo. hypothetical protein FLJ25976 | 97% | NM174943 | 14q24.3 | unknown |
| hcct-19 | Homo. MCART1 | 99% | NM03342 | 9p13.3-p12 | binding |
| hcct-22 | RNA Arabidopsis thaliana ubiquitin activating enzyme | 100%(21 bp) | NM121923 | 5 | ubiquitin-like activating enzyme activity, NEDD8 activating enzyme activity |
| hcct-26 | Mus musculus RIKEN cDNA E130307A14 gene | 96%(25 bp) | XM211291 | 10 | unknown |
| hcct-29 | Homo. NDUFA4 | 98% | NM002489 | 7p21.3 | NADH dehydrogenase activity |
| 功能分类 | 代表基因 |
| 结构基因 | HSPCA, HSP70 |
| 调节基因 | EIF3S2, RAB4B, IGFBP2, RFC2, NM121923 |
| 能量代谢基因 | LDH-A, NDUFA4, MCART1 |
| 未知功能基因 | hypothetical protein FLJ25976, XM211291, MAGE-1, MAGE-3 |
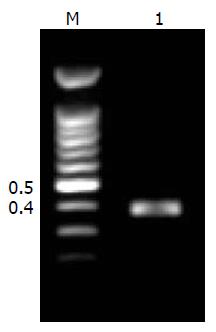
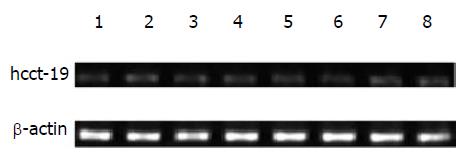
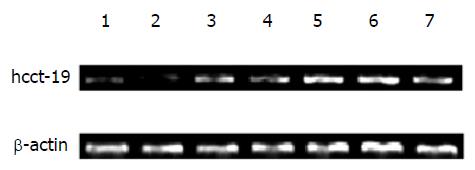
以β-actin为内参照(图1), hcct-19目的片段长度为390 bp(图2), PCR产物测序结果和预期相符. hcct-19在部分正常组织(图3)、肿瘤组织(图4)及肿瘤细胞株(图5)中均表达, 但强度较弱.
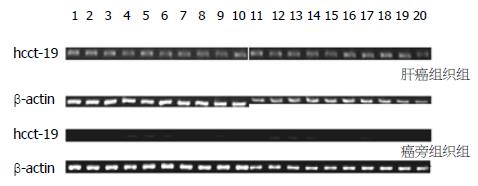
hcct-19在20例肝癌组织及癌旁组织中均表达, 但在肝癌组织中的表达强度高于癌旁组织(图6). PCR产物电泳条带灰度值分析显示, 肝癌组hcct-19的相对表达量明显高于癌旁组(13.2±2.7 vs 2.9±0.3, P<0.05).
热休克蛋白(heat shock protein, HSP)是一组具有高度保守性质的、与细胞耐受应激损伤关系密切的蛋白质[3], 并已经被多个实验证实具有良好的"分子伴侣"和免疫佐剂的效应[4-6]. 在肿瘤的发生过程中, HSP可作为肿瘤抗原多肽的靶载体, 参与抗原的递呈和加工, 可在体内诱导特异性主动免疫. HSPCA(heat shock 90 kDa protein 1 alpha, HSP90α)在HCC中的表达率明显高于正常肝脏和癌旁组织[7]. 对乳腺癌及子宫内膜癌等肿瘤的研究也证实了HSP90α呈高表达且与恶性程度相关[8-10]. 肿瘤细胞中突变或异常蛋白质的存在刺激HSP70的合成, 使其呈现持续的高诱导表达. HSP70在肝癌组织中表达, 并呈现胞质、胞膜和胞核的表达差异[11]. 他在肿瘤细胞中异于正常细胞的定位分布, 在某种程度上反映了细胞生物学行为的异常, 这与肿瘤自身不断增生和无限生长的特性相适应, 这种异常的表达分布可能在诱导抗肿瘤免疫中起到作用. 真核翻译起始因子3S2(eukaryotic translation initiation factor 3 p36 subunit, EIF3S2)在蛋白质的生物合成中调节翻译的起始. EIF3S2在62%的HCC组织中过表达, 其同家族EIF3S3和EIF3S10被报道过在不同的肿瘤中过表达[12-14]. RAB4B(member RAS oncogene family)在GTP酶介导的信号传导过程及囊泡介导的转运过程中, 具有GTP酶的活性. 有学者报道RAB4B在HCC中表达上调[15]. 胰岛素样生长因子结合蛋白2(insulin-like growth factor binding protein 2.36 kDa, IGFBP2)能抑制细胞的凋亡、起始了整合素介导的黏附信号, 肿瘤组织由于产生增多的IGFBP2可以促进肿瘤细胞的增生和侵袭[16]. 在HCC患者血清中, IGFBP2的水平明显高于正常, 甚至部分AFP阴性病例IGFBP2的水平也升高[17]. 复制因子C2 (replication factor C2, RFC2)在依赖ATP能量反应的条件下使DNA聚合酶捆绑在模板上向前延长DNA合成链. 目前, 还认为他与PCNA一起参与细胞DNA损伤后的错配修复和切除修复机制[18]. 因此, 他可以对抗细胞凋亡.
肿瘤细胞繁殖过快, 能量消耗剧增, 糖酵解增加的结果导致产生过多的乳酸, 因此, 乳酸脱氢酶-A(lactate dehydrogenase 1, A chain, LDH-A)水平明显升高. 最近发现, LDH-A是一个直接的c-Myc反应基因, c-Myc在持续的转化过程中激活LDH-A来保证能量供应[19]. 在原发性肝癌, 有报道说血清乳酸脱氢酶(serum lactate dehydrogenase, S-LDH)的水平与S-AFP相比, 与临床关系更紧密[20]. NDUFA4 (NADH dehydrogenase 1 alpha subcomplex 4)具有NADH脱氢酶和氧化还原酶活性. 将电子从NADH转移至呼吸链, 参与能量代谢. MCART1(mitochondrial carrier triple repeat1)是一个线粒体基因, 在转运的过程中作为载体具有结合作用, 参与能量代谢.
黑色素瘤抗原3(melanoma antigen family, MAGE-3)在多种肿瘤中都有较高程度的表达, 可与人类白细胞抗原HLA-A1等结合, 被CTL特异识别, 产生效应CTL特异杀伤肿瘤细胞[21-22]. 国外已有人将MAGE-3制备成疫苗, 试用于一些肿瘤的临床治疗, 取得较好效果[23-24]. MAGE-3在HCC中阳性率达68%[25]. 黑色素瘤抗原1(melanoma antigen family, MAGE-1)在HCC中阳性率达67%[26], 但黑色素瘤抗原在肿瘤形成中的具体功能不清. Hypothetical protein FLJ25976为一假想蛋白, 功能不明.
本实验所筛选出的14个基因片段中, RFC2、NDUFA4、MCART1、Hypothetical protein FLJ25976、hcct-22及hcct-26首次被发现与HCC有关. hcct-22的长度为520 bp, 其中20 bp与RNA arabidopsis thaliana ubiquitin activating enzyme有86%的同源性. hcct-26的长度为366 bp, 其中25 bp与Mus musculus RIKEN cDNA E130307A14 gene有96%的同源性. 在GenBank人的基因中未找到这2个基因片段的同源基因, 在人的染色体上未找到相对应的位点, 可能是新基因. 未知基因功能尚不清楚, 部分与肿瘤的关系也不明确. 可以推测这些基因与肿瘤的结构、代谢或调控有关, 值得深入研究.
肿瘤的抗原库和他们编码的基因还远不清楚, 既往有学者用SEREX方法从HCC表达文库中筛选出许多核糖体基因、信号转导分子MIF、细胞黏附相关分子Galectin、线粒体基因、分子伴侣及假想蛋白等[27-29]. 多数是过度表达的结果, 这些基因表达的变化改变了肿瘤细胞的免疫原性, 使其成为B细胞识别的靶抗原. HCC细胞过快的增殖增加了抗原递呈的机会, 从而增加在HCC患者产生针对这些基因的抗体的机会, 免疫系统对之起反应.
hcct-19在HCC组织中的表达强度明显高于癌旁组织. 推测他是一个过量表达的基因. 本实验初步分析了hcct-19在部分组织中的表达谱及在肝癌和癌旁组织中的表达, SEREX方法鉴定的HCC肿瘤抗原正在迅速的累积. 总的说来, 我们的实验结果有助于更好的理解HCC形成过程中的分子特征, 为研究HCC发生、发展的机制提供分子信息, 并为HCC的诊断提供了候选标记物.
SEREX法是鉴定肿瘤抗原最方便和高效的一种方法, 他的主要特点是适用于各种肿瘤及能迅速找到抗原的分子特征. 目前急需寻找新的HCC抗原分子及鉴定其表位.
本文采用SEREX方法, 从高度分化的HCC组织中提取总RNA, 构建cDNA表达文库, 以HCC患者自体和异体的混合血清筛选文库, 鉴定HCC表达的肿瘤抗原.
本实验所筛选出的14个基因片段中, RFC2, NDUFA4, MCART1, Hypothetical proteinFLJ25976, hcct-22及hcct-26首次被发现与HCC有关.
本文的实验结果有助于更好的理解HCC形成过程中的分子特征, 为研究HCC发生、发展的机制提供分子信息, 并为HCC的诊断提供了候选标记物.
该研究科学性较强, 有一定创新性对该领域研究具有理论参考价值.
编辑: 潘伯荣 电编:李琪
| 1. | Sahin U, Tureci O, Schmitt H, Cochlovius B, Johannes T, Schmits R, Stenner F, Luo G, Schobert I, Pfreundschuh M. Human neoplasms elicit multiple specific immune responses in the autologous host. Proc Natl Acad Sci USA. 1995;92:11810-11813. [PubMed] |
| 2. | Aznavoorian S, Murphy AN, Stetler-Stevenson WG, Liotta LA. Molecular aspects of tumor cell invasion and metastasis. Cancer. 1993;71:1368-1383. [PubMed] |
| 3. | Mizushima Y, Wang P, Jarrar D, Cioffi WG, Bland KI, Chaudry IH. Preinduction of heat shock proteins protects cardiac and hepatic functions following trauma and hemorrhage. Am J Physiol Regul Integr Comp Physiol. 2000;278:R352-R359. [PubMed] |
| 4. | Manjili MH, Wang XY, Park J, Facciponte JG, Repasky EA, Subjeck JR. Immunotherapy of cancer using heat shock proteins. Front Biosci. 2002;7:d43-52. [PubMed] |
| 5. | Ciupitu AM, Petersson M, Kono K, Charo J, Kiessling R. Immunization with heat shock protein 70 from methylcholanthrene-induced sarcomas induces tumor protection correlating with in vitro T cell responses. Cancer Immunol Immunother. 2002;51:163-170. [PubMed] |
| 6. | Ponomarev ED, Tarasenko TN, Sapozhnikov AM. Splenic cytotoxic cells recognize surface HSP70 on culture-adapted EL-4 mouse lymphoma cells. Immunol Lett. 2000;74:133-139. [PubMed] |
| 8. | Jameel A, Skilton RA, Campbell TA, Chander SK, Coombes RC, Luqmani YA. Clinical and biological significance of HSP89 alpha in human breast cancer. Int J Cancer. 1992;50:409-415. [PubMed] |
| 9. | Mileo AM, Fanuele M, Battaglia F, Scambia G, Benedetti-Panici P, Mancuso S, Ferrini U. Selective over-expression of mRNA coding for 90 KDa stress-protein in human ovarian cancer. Anticancer Res. 1990;10:903-906. [PubMed] |
| 10. | Nanbu K, Konishi I, Komatsu T, Mandai M, Yamamoto S, Kuroda H, Koshiyama M, Mori T. Expression of heat shock proteins HSP70 and HSP90 in endometrial carcinomas. Correlation with clinicopathology, sex steroid receptor status, and p53 protein expression. Cancer. 1996;77:330-338. [PubMed] |
| 12. | Huang JS, Chao CC, Su TL, Yeh SH, Chen DS, Chen CT, Chen PJ, Jou YS. Diverse cellular transformation capability of overexpressed genes in human hepatocellular carcinoma. Biochem Biophys Res Commun. 2004;315:950-958. [PubMed] |
| 13. | Nupponen NN, Porkka K, Kakkola L, Tanner M, Persson K, Borg A, Isola J, Visakorpi T. Amplification and overexpression of p40 subunit of eukaryotic translation initiation factor 3 in breast and prostate cancer. Am J Pathol. 1999;154:1777-1783. [PubMed] |
| 14. | Pincheira R, Chen Q, Zhang JT. Identification of a 170-kDa protein over-expressed in lung cancers. Br. J Cancer. 2001;84:1520-1527. [PubMed] |
| 15. | He H, Dai F, Yu L, She X, Zhao Y, Jiang J, Chen X, Zhao S. Identification and characterization of nine novel human small GTPases showing variable expressions in liver cancer tissues. Gene Expr. 2002;10:231-242. [PubMed] |
| 16. | 张 巍. IGFBP 2和Lip45对胶质瘤侵袭性的调节. 中国微侵袭神经外科杂志. 2004;9:478-482. |
| 17. | Ranke MB, Maier KP, Schweizer R, Stadler B, Schleicher S, Elmlinger MW, Flehmig B. Pilot study of elevated levels of insulin-like growth factor-binding protein-2 as indicators of hepatocellular carcinoma. Horm Res. 2003;60:174-180. [PubMed] |
| 18. | Matsumoto Y. Molecular mechanism of PCNA-dependent base excision repair. Prog Nucleic Acid Res Mol Biol. 2001;68:129-138. [PubMed] |
| 19. | Shim H, Dolde C, Lewis BC, Wu CS, Dang G, Jungmann RA, Dalla-Favera R, Dang CV. c-Myc transactivation of LDH-A: implications for tumor metabolism and growth. Proc Natl Acad Sci USA. 1997;94:6658-6663. [PubMed] |
| 20. | Fujiwara Y, Takenaka K, Kajiyama K, Maeda T, Gion T, Shirabe K, Shimada M, Sugimachi K. The characteristics of hepatocellular carcinoma with a high level of serum lactic dehydrogenase: a case report. Hepatogastroenterology. 1997;44:820-823. [PubMed] |
| 21. | Kirkin AF, Dzhandzhugazyan K, Zeuthen J. The immunogenic properties of melanoma-associated antigens recognized by cytotoxic T lymphocytes. Exp Clin Immunogenet. 1998;15:19-32. [PubMed] |
| 22. | Gaugler B, Van den Eynde B, van der Bruggen P, Romero P, Gaforio JJ, De Plaen E, Lethe B, Brasseur F, Boon T. Human gene MAGE-3 codes for an antigen recognized on a melanoma by autologous cytolytic T lymphocytes. J Exp Med. 1994;179:921-930. [PubMed] |
| 23. | Thurner B, Haendle I, Roder C, Dieckmann D, Keikavoussi P, Jonuleit H, Bender A, Maczek C, Schreiner D, von den Driesch P. Vaccination with mage-3A1 peptide-pulsed mature, monocyte-derived dendritic cells expands specific cytotoxic T cells and induces regression of some metastases in advanced stage IV melanoma. J Exp Med. 1999;190:1669-1678. [PubMed] |
| 24. | Marchand M, van Baren N, Weynants P, Brichard V, Dreno B, Tessier MH, Rankin E, Parmiani G, Arienti F, Humblet Y. Tumor regressions observed in patients with metastatic melanoma treated with an antigenic peptide encoded by gene MAGE-3 and presented by HLA-A1. Int J Cancer. 1999;80:219-230. [PubMed] |
| 25. | Tahara K, Mori M, Sadanaga N, Sakamoto Y, Kitano S, Makuuchi M. Expression of the MAGE gene family in human hepatocellular carcinoma. Cancer. 1999;85:1234-1240. [PubMed] |
| 26. | Kobayashi Y, Higashi T, Nouso K, Nakatsukasa H, Ishizaki M, Kaneyoshi T, Toshikuni N, Kariyama K, Nakayama E, Tsuji T. Expression of MAGE, GAGE and BAGE genes in human liver diseases: utility as molecular markers for hepatocellular carcinoma. J Hepatol. 2000;32:612-617. [PubMed] |
| 27. | Stenner-Liewen F, Luo G, Sahin U, Tureci O, Koslovski M, Kautz I, Liewen H, Pfreundschuh M. Definition of tumor-associated antigens in hepatocellular carcinoma. Cancer Epidemiol Biomarkers Prev. 2000;9:285-290. [PubMed] |