修回日期: 2006-01-22
接受日期: 2006-02-08
在线出版日期: 2006-04-08
目的: 探讨表皮生长因子(EGF)诱导胆管癌细胞侵袭力的相关机制.
方法: 检测胆管癌细胞株HuCCT1在EGF不同浓度下的细胞侵袭力及细胞增殖情况; 采用RT-PCR及Western blot分析方法, 检测基质金属蛋白酶(MMPs)、尿激酶型纤溶酶原激活剂(uPA)、纤溶酶原激活物抑制剂(PAI-1)在不同EGF浓度下的基因和蛋白表达; 采用凝胶电泳迁移率试验(EMSA)检测核转录因子(nuclear factor kappa B, NF-κB)在不同EGF浓度下的活性; 并用NF-κB的抑制剂PDTC和布洛芬(ibuprofen)预先处理HuCCT1胆管癌细胞后, 检测其对HuCCT1胆管癌细胞侵袭力的影响.
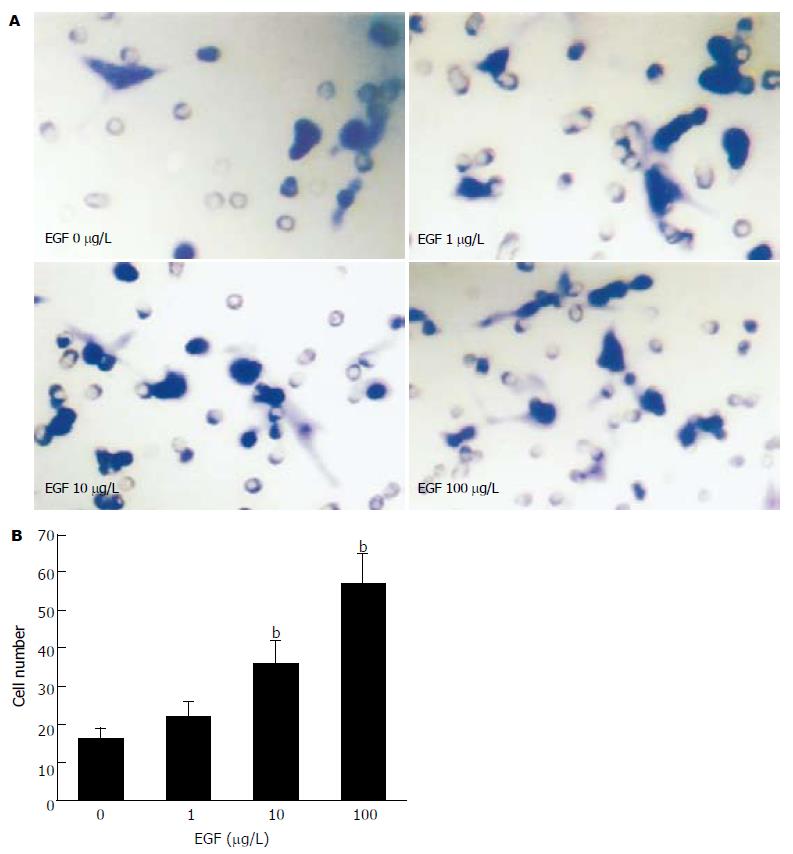
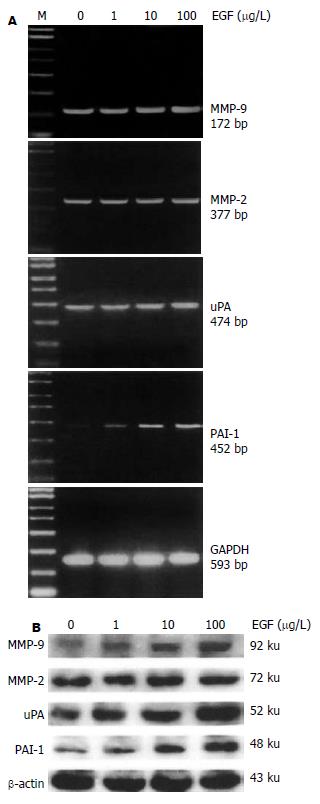
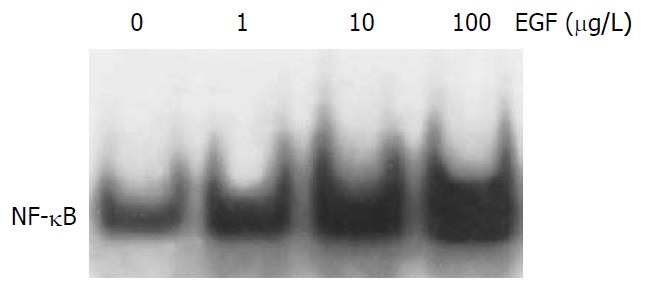
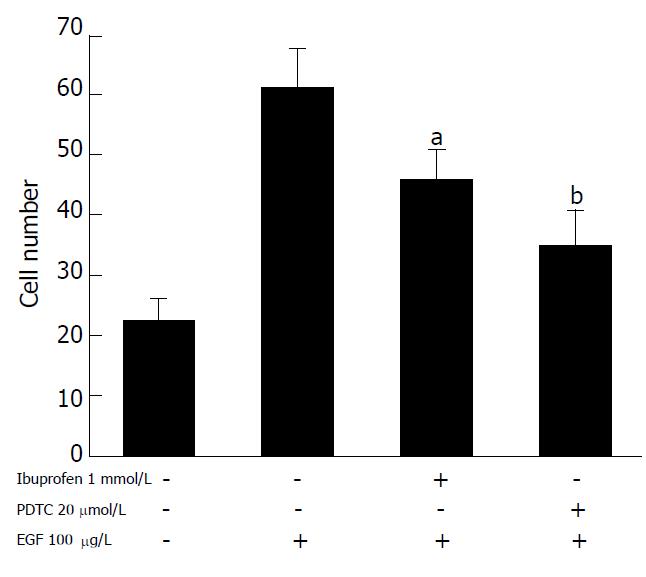
结果: 随着EGF浓度的增加, 胆管癌细胞株HuCCT1侵袭细胞数也随之增加, 具有明显的浓度依赖性(EGF 10, 100 mg/L vs 0 mg/L: 35.4±6.2 vs 16.3±3.1, t = 4.77,P = 0.009; 57.2±7.6 vs 16.3±3.1, t = 8.63, P = 0.001), 而EGF浓度的变化对HuCCT1细胞的增殖无明显影响. EGF明显上调HuCCT1细胞中MMP-9、uPA和PAI-1的mRNA和蛋白表达水平, MMP-2不受影响. 随着EGF浓度的增加, NF-κB的活化明显增强; PDTC和布洛芬明显抑制EGF诱导的HuCCT1细胞侵袭力(46.6±4.6 vs 62.3±5.2, t = 3.168, P = 0.037; 35.3±5.4 vs 62.3±5.2, t = 6.30, P = 0.003).
结论: EGF能够增强胆管癌细胞的侵袭力, 其增强的侵袭力可能是通过NF-κB信号传导路径, 激活MMP-9, uPA和PAI-1等蛋白水解酶而实现的.
引文著录: 孔凡民, 刘小方, 李航宇, 隋春阳, 李昱骥, 张浩, 郭仁宣. EGF中介的 NF-κB 及细胞外基质降解酶与胆管癌细胞侵袭相关性. 世界华人消化杂志 2006; 14(10): 947-952
Revised: January 22, 2006
Accepted: February 8, 2006
Published online: April 8, 2006
AIM: To explore the mechanism of epidermal growth factor (EGF) in the promotion of human cholangiocarcinoma cell invasion.
METHODS: Invasion assay and cell proliferation assay were performed in human cholangiocarcinoma cell line HuCCT1 treated with different concentrations of EGF. Reverse transcription polymerase chain reaction (RT-PCR) and Western blot were used to detect the expression of matrix metalloproteinases (MMPs), urokinase type plasminogen activator (uPA) and plasminogen activator inhibitor (PAI-1) in HuCCT1 cells. The activity of nuclear factor-kappa B (NF-κB) was determined by electrophoretic mobility shift assay (EMSA). After pretreatment with pyrrolidine dithiocarbamate or ibuprofen, the invasion of HuCCT1 cells was observed.
RESULTS: EGF treatment resulted in increased invasions of HuCCT1 cells in a dose-dependent manner (cell number as EGF at 10, 100 μg/L vs 0 μg/L: 35.4 ± 6.2, 57.2 ± 7.6 vs 16.3 ± 3.1; t = 4.77, P = 0.009; t = 8.63, P = 0.001, respectively). However, EGF did not affect the proliferation in HuCCT1 cells. RT-PCR and Western blot showed that EGF dramatically increased the expression of MMP-9, uPA and PAI-1 mRNA and protein in HuCCT1 cells, but it did not change the expression of MMP-2. The activity of NF-κB was significantly increased after EGF treatment, while EGF-induced invasion of HuCCT1 cells was markedly inhibited by pretreatment with PDTC or ibuprofen (cell number: 46.6 ± 4.6 vs 62.3 ± 5.2, t = 3.168, P = 0.037; 35.3 ± 5.4 vs62.3 ± 5.2, t = 6.30, P = 0.003).
CONCLUSION: EGF promotes the invasion of human cholangiocarcinoma cells, and the up-regulation of MMP-9, uPA , PAI-1 and NF-κB activity is involved in this process.
- Citation: Kong FM, Liu XF, Li HY, Sui CY, Li YJ, Zhang H, Guo RX. Correlations of epidermal growth factor-mediated nuclear factor-kappa B and matrix proteinase activity with invasions of cholangiocarcinoma cells. Shijie Huaren Xiaohua Zazhi 2006; 14(10): 947-952
- URL: https://www.wjgnet.com/1009-3079/full/v14/i10/947.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i10.947
胆管癌是以浸润性生长为其病理学特征, 其早期向邻近组织侵袭和转移是导致手术难以切除、预后差的主要原因. 表皮生长因子(epidermal growth factor, EGF)和EGF受体(EGF receptor)在胆管癌组织中高表达, 并且与胆管癌发展相关[1-3], 暗示EGF可能刺激胆管癌细胞的侵袭, 促进其发展. 但是, EGF促进胆管癌细胞侵袭的分子机制还不十分清楚. 基质金属蛋白酶(matrix metalloproteinases, MMPs)、尿激酶型纤溶酶原激活剂(urokinase type plas-minogenactivator, uPA)和纤溶酶原激活物抑制剂(plasminogen activator inhibitor, PAI-1)能够降解基底膜及细胞外基质(ECM), 而使肿瘤细胞穿过基底膜保护, 侵入周边组织, 其在肿瘤细胞侵袭过程中起决定作用. 核转录因子-κB( nuclear factor kappa B, NF-κB)是转录调节蛋白质家族的一员, 能够激活、调节MMPs、uPA和PAI-1的转录, 促进细胞侵袭和转移[4-7]. 我们在人胆管癌HuCCT1细胞株中, 研究EGF对HuCCT1细胞侵袭力、NF-κB活性、MMP-2、MMP-9、uPA及PAI-1蛋白表达的调节, 探讨EGF促进胆管癌细胞侵袭增强的相关机制.
HuCCT1细胞株由日本佐贺大学医学部外科教研室惠赠. 细胞用含100 mL/L胎牛血清的RPMI 1640培养基, 置于50 mL/L CO2, 37 ℃条件下培养传代. 血清与RPMI 1640培养基均为美国GIBCO公司产品. EGF购于Biomedical Technologies Inc. (Stonghton, MA).
体外侵袭力检测在细胞培养器中进行, 培养器中含有过滤器, 孔径大小为8.0 mm, 其表面覆盖一层基膜, 浓度为250 mg/cm2, 室温下过夜干燥. HuCCT1细胞经不同浓度EGF处理24 h后, 用PBS溶液冲洗2次, 加到培养器的上层, 细胞数为1×1010/L. DMEM作为诱导剂加入下层. 经过16 h孵育后, 取出过滤器, 用甲醛固定, 然后用棉签把上层细胞完全擦掉, Gimza染色. 最后, 在光镜下计数从上层移到下层的肿瘤细胞数. 将5个视野的平均细胞数定义为肿瘤细胞的侵袭力. HuCCT1细胞在EGF作用下的生长由WST-1增殖检测试剂盒测定(Takara, Kyoto, Japan), 方法参照说明书. 另用组织裂解液(Pierce公司)裂解细胞, 然后用蛋白分析试剂盒(Bio-Rad, Hercules, CA)进行蛋白定量. SDS-PAGE胶分离蛋白质, 于4 ℃转移到硝酸纤维膜上. 经TBS浸泡10 min后, 用50 g/L脱脂奶粉TBS封闭1 h; TBS漂洗, 加入一抗室温孵育1 h后TBS 5 min漂洗3次, 加入二抗室温孵育1 h后TBS洗膜后ECL显色压片. 细胞总RNA的提取采用Trizol总RNA提取试剂盒(invitrogen公司). 电泳鉴定RNA质量并在260 nm测其吸光度值. 所有引物均经GenBank查询为目前已知基因特异性引物序列. MMP-2: Sense 5'-ATGGCAAGGAGTACAACAGC-3', Antisense 5'-GCTGGTGCAGCTCTCATATT-3', 377 bp; MMP-9: Sense 5'-TGGGCTACGTGACCTATGACAT-3', Antisense 5'-GCC CAGCCCACCTCCACTCCTC-3', 172 bp; uPA: Sense 5'-AGAATTCACCACCATCGAGA-3', Antisense 5'-ATCAGCTTCACAACAGTCAT-3', 474 bp; PAI-1: Sense 5'-ATGGGATTCAAGATTGATGA-3', Antisense 5'-TCAGTATAGTTGAACTTGTT-3', 452 bp; GAPDH: Sense 5'-CCACCCATGGCAAATTCCATGGCA-3', Antisense 5'-TCTAGACGGCAGGTCAGGTCCACC-3', 593 bp. 按第1链合成试剂盒说明进行逆转录. PCR扩增条件: 变性95 ℃ 1 min, 退火55 ℃ 1 min, 延伸72 ℃ 1 min, 循环25-30次. PCR产物以20 g/L琼脂糖凝胶电泳检测, 长波紫外灯下观测照相.
凝胶电泳迁移率试验(electrophoretic mobility shift assay, EMSA): 细胞核蛋白的提取参照Deryckere的方法[8]. 进行蛋白定量后, 取其10 mg与g-32P-ATP标记的电泳约2-3 h, 电泳结束后取出凝胶, 在干胶机上80 ℃真空干燥30 min, 置于-70 ℃冰箱中进行放射自显影, 5-6 h后洗片, 记录结果.
统计学处理 所有实验数据以均数±标准差表示, 组间比较采用t检验.
随着EGF浓度的增加, HuCCT1侵袭细胞数也随之增加, 具有明显的浓度依赖性(图1). 然而, EGF浓度的变化对HuCCT1细胞的增殖无明显影响, 表明EGF能够促进HuCCT1细胞的侵袭能力. EGF明显上调MMP-9、uPA和PAI-1 mRNA和蛋白表达水平(图2), 而MMP-2未见受影响. 随着EGF浓度的增加, NF-κB的活化明显增强(图3), 表明NF-κB的活化很可能参与EGF诱导的HuCCT1细胞侵袭. 我们预先用NF-κB抑制物PDTC(pyrrolidine dithiocarbamate)和ibuprofen分别处理HuCCT1细胞2 h.结果显示, PDTC和ibuprofen明显抑制EGF诱导的HuCCT1细胞侵袭力(图4), 表明NF-κB与EGF诱导HuCCT1细胞侵袭密切相关.
肿瘤侵袭是一个多阶段过程, 包括细胞增殖、吸附、运动及不同阶段酶的分泌[9]. 在这个侵袭过程中, 细胞外基质酶解起关键作用. 许多蛋白水解酶, 包括基质金属蛋白酶MMPs, uPA、纤溶酶原激活物抑制剂(plasminogen activator inhibitor, PAI-1), 参与这个过程. MMP家族, 特别是MMP-2和MMP-9, 不仅能降解基底膜, 并且也能降解细胞外基质, 而使肿瘤细胞穿过基底膜保护, 侵入周边组织, 其在肿瘤细胞侵袭过程中起重要作用[10-14]. uPA催化纤维蛋白溶酶原转化为纤维蛋白溶酶, 直接降解细胞外基质蛋白, 同时激活MMP-2和MMP-9, 促进肿瘤细胞的侵袭和转移[15]. PAI-1是uPA的一种抑制剂, 一方面他与uPA/uPAR形成复合物, 从而抑制纤溶酶系统的活性. 另一方面, 细胞对这种复合物产生内吞效应, 使uPA在溶酶体内降解, uPAR再循环到细胞表面, 这不但调节uPA的活性, 而且也调节uPAR在细胞表面位置的变化, 适应细胞移出过程中细胞表面uPA介导的蛋白溶解活动浓度集中和活性区域变化的需要, 从而促进肿瘤细胞的侵袭和转移[16-21]. 我们的结果显示, 随着EGF浓度的增加, HuCCT1的侵袭细胞数逐渐增加, 而增殖情况无明显改变. 可见, EGF能够增强HuCCT1细胞的侵袭力, 并且EGF促进胆管癌细胞侵袭不是由细胞增殖引起的. 而单独肿瘤细胞运动的改变不能引起有效的邻近组织侵袭, 所以, EGF促进胆管癌细胞侵袭一定存在其他机制, 其可能是由细胞外基质酶解引起的. 我们将不同浓度的EGF加入HuCCT1细胞培养基中, 从mRNA和蛋白两个水平检测EGF不同浓度下HuCCT1细胞中MMP2, MMP-9, uPA和PAI-1的表达情况, 发现EGF显著提高HuCCT1细胞中MMP-9, uPA和PAI-1的表达, 而MMP2未受影响. 表明EGF增强HuCCT1细胞的侵袭力是通过提高MMP-9、uPA和PAI-1的表达实现的.
NF-κB是调节转录因子. 正常情况下, NF-κB存在于细胞质中, 与抑制蛋白单体ⅠκB结合而无活性. 当受到细胞外刺激作用, NF-κB与ⅠκB分离, NF-κB复合体进入细胞核,与特定包含κB的靶基因结合, 调节与细胞应答相关的基因表达, 包括肿瘤细胞侵袭和转移, 如MMP-9, MMP-2, uPA和PAI-1[22-23]. 许多研究表明, NF-κB信号传导通路在肿瘤的浸润转移过程中发挥重要的作用, 特别是他能够调控MMP-9, uPA和PAI-1蛋白的表达[24-27]. 本结果显示, EGF可以提高NF-κB的活性. 提示EGF激活MMP-9, uPA和PAI-1, 增强HuCCT1细胞的侵袭力可能是通过NF-κB信号传导通路实现的. 为了进一步证实由EGF引起的肿瘤侵袭上调可能是通过增加NF-κB的活性实现的, 我们用NF-κB抑制剂做细胞侵袭力检测, 发现用NF-κB的抑制物PDTC和ibuprofen预处理HuCCT1细胞后, EGF导致的细胞侵袭力明显受到抑制, 但EGF导致的细胞侵袭力没有完全被抑制. 这说明EGF对细胞侵袭的刺激效应与NF-κB活性有关, EGF激活MMP-9, uPA和PAI-1, 增强HuCCT1细胞的侵袭力可能一部分是通过NF-κB信号传导通路实现的. 通过本实验研究, 明确了EGF促进胆管癌细胞侵袭的分子机制, 为胆管癌侵袭、转移的预防、治疗提供理论依据.
EGF诱导胆管癌细胞侵袭力的机制不明, 相关报道甚少. 本文首次证明EGF能够通过促进NF-κB活性信号传导路径, 激活MMP-9, uPA和PAI-1等蛋白水解酶而增强胆管癌细胞的侵袭力.
本文结果表明NF-κB抑制剂能够抑制EGF所诱导的胆管癌细胞侵袭力, 具有临床应用价值.
本研究为胆管癌细胞株体外侵袭力及机制的探讨性研究, 显示了EGF浓度增加与HuCCT1侵袭力增强相关, 但细胞增殖情况无改变, 而EGF能显著提高胆管癌细胞中MMPa, MMP-9, uPA和PAI-1的表达, 并提高NF-κB的活性, 在用NF-κB抑制物预处理后, EGF导致的细胞侵袭力未被完全抑制, 从而得出EGF可增强胆管癌细胞的侵袭力, 其部分可能是通过NF-κB信号传导途径激活MMP-9, uPA和PAI等蛋白水解酶实现的结论. 本研究内容与结论有新意, 为深入研究提供了依据.
电编: 李琪 编辑:潘伯荣
| 1. | Han C, Wu T. Cyclooxygenase-2-derived prost-aglandin E2 promotes human cholangiocarcinoma cell growth and invasion through EP1 receptor-mediated activation of the epidermal growth factor receptor and Akt. J Biol Chem. 2005;280:24053-24063. [PubMed] [DOI] |
| 2. | Yoon JH, Gwak GY, Lee HS, Bronk SF, Werneburg NW, Gores GJ. Enhanced epidermal growth factor receptor activation in human cholangiocarcinoma cells. J Hepatol. 2004;41:808-814. [PubMed] [DOI] |
| 3. | Werneburg NW, Yoon JH, Higuchi H, Gores GJ. Bile acids activate EGF receptor via a TGF-alpha-dependent mechanism in human cholangiocyte cell lines. Am J Physiol Gastrointest Liver Physiol. 2003;285:G31-G36. [PubMed] [DOI] |
| 4. | Sato H, Seiki M. Regulatory mechanism of 92 kDa type IV collagenase gene expression which is associated with invasiveness of tumor cells. Oncogene. 1993;8:395-405. [PubMed] |
| 5. | Reuning U, Wilhelm O, Nishiguchi T, Guerrini L, Blasi F, Graeff H, Schmitt M. Inhibition of NF-kappa B-Rel A expression by antisense oligodeoxynucleotides suppresses synthesis of urokinase-type plasminogen activator (uPA) but not its inhibitor PAI-1. Nucleic Acids Res. 1995;23:3887-3893. [PubMed] [DOI] |
| 6. | Huang S, Robinson JB, Deguzman A, Bucana CD, Fidler IJ. Blockade of nuclear factor-kappaB signaling inhibits angiogenesis and tumorigenicity of human ovarian cancer cells by suppressing expression of vascular endothelial growth factor and interleukin 8. Cancer Res. 2000;60:5334-5339. [PubMed] |
| 8. | Slomiany BA, Kelly MM, Kurtz DT. Extraction of nuclear proteins with increased DNA binding activity. Biotechniques. 2000;28:938-942. [PubMed] |
| 9. | Price JT, Bonovich MT, Kohn EC. The biochemistry of cancer dissemination. Crit Rev Biochem Mol Biol. 1997;32:175-253. [PubMed] [DOI] |
| 10. | Westermarck J, Kahari VM. Regulation of matrix metalloproteinase expression in tumor invasion. FASEB J. 1999;13:781-792. [PubMed] |
| 11. | Leeman MF, Curran S, Murray GI. New insights into the roles of matrix metalloproteinases in colorectal cancer development and progression. J Pathol. 2003;201:528-534. [PubMed] [DOI] |
| 12. | Zeng ZS, Cohen AM, Guillem JG. Loss of basement membrane type IV collagen is associated with increased expression of metalloproteinases 2 and 9 (MMP-2 and MMP-9) during human colorectal tumorigenesis. Carcinogenesis. 1999;20:749-755. [PubMed] [DOI] |
| 13. | Mysliwiec AG, Ornstein DL. Matrix metallopro-teinases in colorectal cancer. Clin Colorectal Cancer. 2002;1:208-219. [PubMed] [DOI] |
| 14. | Jo Chae K, Rha SY, Oh BK, Koo JS, Kim YJ, Choi J, Park C, Park YN. Expression of matrix meta-lloproteinase-2 and -9 and tissue inhibitor of metalloproteinase-1 and -2 in intraductal and nonintraductal growth type of cholangiocarcinoma. Am J Gastroenterol. 2004;99:68-75. [PubMed] [DOI] |
| 15. | 张 诚. uPA/uPAR研究进展. 国外医学· 生理、病理科学与临床分册. 2004;24:352-354. |
| 16. | Czekay RP, Loskutoff DJ. Unexpected role of plasminogen activator inhibitor 1 in cell adhesion and detachment. Exp Biol Med(Maywood). 2004;229:1090-1096. [PubMed] |
| 17. | Andreasen PA, Egelund R, Petersen HH. The plasminogen activation system in tumor growth, invasion, and metastasis. Cell Mol Life Sci. 2000;57:25-40. [PubMed] [DOI] |
| 20. | Li P, Gao Y, Ji Z, Zhang X, Xu Q, Li G, Guo Z, Zheng B, Guo X. Role of urokinase plasminogen activator and its receptor in metastasis and invasion of neuroblastoma. J Pediatr Surg. 2004;39:1512-1519. [PubMed] [DOI] |
| 21. | Konno H, Abe J, Kaneko T, Baba M, Shoji A, Sunayama K, Kamiya K, Tanaka T, Suzuki S, Nakamura S. Urokinase receptor and vascular endothelial growth factor are synergistica-lly associated with the liver metastasis of colorectal cancer. Jpn J Cancer Res. 2001;92:516-523. [PubMed] [DOI] |
| 22. | Ghosh S, Karin M. Missing pieces in the NF-kappaB puzzle. Cell. 2002;109:S81-S96. [PubMed] [DOI] |
| 23. | Zandi E, Karin M. Bridging the gap: composition, regulation, and physiological function of the IkappaB kinase complex. Mol Cell Biol. 1999;19:4547-4551. [PubMed] [DOI] |
| 24. | Yoo HG, Shin BA, Park JS, Lee KH, Chay KO, Yang SY, Ahn BW, Jung YD. IL-1beta induces MMP-9 via reactive oxygen species and NF-kappaB in murine macrophage RAW 264.7 cells. Biochem Biophys Res Commun. 2002;298:251-256. [PubMed] [DOI] |
| 25. | Okamoto T, Valacchi G, Gohil K, Akaike T, van der Vliet A. S-nitrosothiols inhibit cytokine-mediated induction of matrix metalloproteinase-9 in airway epithelial cells. Am J Respir Cell Mol Biol. 2002;27:463-473. [PubMed] [DOI] |
| 26. | Sanceau J, Boyd DD, Seiki M, Bauvois B. Interferons inhibit tumor necrosis factor-alpha-mediated matrix metalloproteinase-9 activation via interferon regulatory factor-1 binding competition with NF-kappa B. J Biol Chem. 2002;277:35766-35775. [PubMed] [DOI] |
| 27. | Hozumi A, Nishimura Y, Nishiuma T, Kotani Y, Yokoyama M. Induction of MMP-9 in normal human bronchial epithelial cells by TNF-alpha via NF-kappa B-mediated pathway. Am J Physiol Lung Cell Mol Physiol. 2001;281:L1444-L1452. [PubMed] |