修回日期: 2005-09-03
接受日期: 2005-09-27
在线出版日期: 2006-01-08
目的: 探讨苦参碱对大鼠原位肝移植供肝冷保存再灌注损伤中肝细胞凋亡及调控基因表达的影响.
方法: 应用延长保存的大鼠原位肝移植模型, 大鼠84只随机分为对照组、低剂量苦参碱治疗组(40 mg/kg)、高剂量苦参碱治疗组(80 mg/kg)和假手术组, 将供肝在4 ℃林格液中保存5 h后植入受体, 各组大鼠于再灌注后4和24 h后取样. 采用TUNEL法分别检测移植术后肝细胞凋亡, 流式细胞仪检测凋亡相关基因Bcl-2, FasL蛋白的表达, 光镜下观察移植肝脏病理形态学的改变.
结果: 与对照组比较, 苦参碱低、高剂量治疗组术后肝脏细胞凋亡指数显著降低(6.07±1.68, 6.17±0.83 vs 14.87±2.10,P<0.01), 肝组织Bcl-2表达增加(59.32±14.09, 58.90±16.70 vs 17.00±8.01, P<0.01), 但FasL表达量无显著差异(P>0.05), 肝细胞凋亡指数、Bcl-2和FasL表达在苦参碱低、高剂量组间也无显著差异. 对照组肝细胞损伤的病理表现相当严重, 而治疗组的病理表现显著改善.
结论: 苦参碱通过促进抑制凋亡基因Bcl-2的表达来抑制冷保存再灌注导致的肝细胞凋亡.
引文著录: 朱新华, 仇毓东, 史敏科, 丁义涛. 苦参碱对大鼠供肝冷保存再灌注损伤中肝细胞凋亡及调控基因表达的影响. 世界华人消化杂志 2006; 14(1): 25-28
Revised: September 3, 2005
Accepted: September 27, 2005
Published online: January 8, 2006
AIM: To investigate the effect of Matrine on the apoptosis of hepatocytes and expression of regulating gene during cold preservation and reperfusion injury in rat orthotopic liver trans-plantation (OLT).
METHODS: Eighty-four syngeneic SD rats were randomly divided into control, Matrine, and pseudo-treatment group. The rats in Matrine group were treated with low (40 mg/kg) and high dose (80 mg/kg) of Matrine, respectively. After the donor liver was preserved in Ringer's (LR) solution for 5 h, the orthotopic implantation was performed. Four and 24 h after reperfusion of the portal vein, the serum and tissue samples were collected for analysis. The cell apoptosis was detected by TUNEL, and the expression of Fas-L and Bcl-2 protein were determined by flow cytometry. The histopathological changes were observed under light and electron microscope.
RESULTS: In comparison with that in the control group, the apoptosis index was significantly de-creased in low and high dose Matrine treatment group (6.07 ± 1.68, 6.17 ± 0.83 vs 14.87 ± 2.10, P < 0.01), while the level of Bcl-2 expression was markedly elevated (59.32 ± 14.09, 58.90 ± 16.70 vs 17.00 ± 8.01, P < 0.01). The expression of FasL was not notably different between the control and Matrine group. The apoptosis index, Bcl-2 and FasL expression had no distinct difference between low and high dose treatment group either. The pathological changes of liver cells were severe in the control group, but they were obviously ameliorated in Matrine group.
CONCLUSION: Matrine can protect hepatocyts against apoptosis by inhibiting the Bcl-2 express-ion during cold preservation and reperfusion injury.
- Citation: Zhu XH, Qiu YD, Shi MK, Ding YT. Effects of matrine on apoptosis of hepatocytes and expression of regulating gene during cold preservation and reperfusion injury in rat donor liver. Shijie Huaren Xiaohua Zazhi 2006; 14(1): 25-28
- URL: https://www.wjgnet.com/1009-3079/full/v14/i1/25.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i1.25
在原位肝移植过程中, 供肝冷保存和门静脉阻断是两个不可避免的操作, 故研究减轻移植肝脏的再灌注损伤具有重要意义. 供肝冷保存再灌注损伤是一个由多因素参与的复杂的病理过程, 其中肝细胞凋亡发挥着重要作用. 苦参碱为中药苦参提取的有效成分, 其基本结构为苦参次碱-15酮, 具有抗炎抗氧化、免疫抑制、保肝等药理作用[1,2], 且无明显的毒副作用[3]. 苦参碱能显著抑制库氏细胞激活, 降低血中肿瘤坏死因子和白介素-6水平[4], 这就表明苦参碱有可能对移植肝脏再灌注损伤有保护作用. 我们采用大鼠原位肝移植模型, 研究苦参碱对供肝冷保存再灌注中肝细胞凋亡的影响.
♂健康SD大鼠84只(购自南京军区总医院动物实验中心), 体质量200-220 g, 随机分为对照组、小剂量治疗组、大剂量治疗组和假手术组. 各组有大鼠12对. 大鼠原位肝移植模型参照改良Kamada法[5]进行. 各组供肝取出后均置于4 ℃林格液中保存5 h再植入受体. 受体门静脉阻断时间16-18 min. 小剂量治疗组受体术前0.5 h ip苦参碱(购自广州明兴制药厂)40 mg/kg; 大剂量治疗组术前0.5 hip苦参碱80 mg/kg; 对照组同法注入生理盐水1 mL; 假手术组方法同肝移植受体的肝脏游离, 只是不作肝切除, 目的是进行正常对照, 以排除手术因素或肝动脉结扎对实验的影响. 各组大鼠于再灌注后4和24 h分别取6只经下腔静脉取血4 mL, 离心(4 ℃, 3 000 r/min)10 min后, 取上清置于-70 ℃冰箱保存, 采用全自动生化分析仪测定谷丙转氨酶(ALT). 同时于再灌注后4 h分别取肝中叶组织适量快速置于液氮及40 g/L中性甲醛中保存待测.
1.2.1 TUNEL法检测肝细胞凋亡: 肝组织石蜡切片厚4 μm, 采用末端脱氧核苷酸转移酶介导的dUTP缺口末端标记法(TUNEL)检测. 按细胞凋亡检测试剂盒(购自北京中山生物制剂有限公司)操作说明进行操作. 阳性细胞表现为细胞核呈棕黄色着色. 每张切片光镜(20×15倍)观察10×500个细胞, 计算每100个细胞中平均阳性细胞数, 即凋亡指数(apoptosis index, AI).
1.2.2 流式细胞仪检测Fas L蛋白表达: 分别于再灌注后4 h取各组大鼠肝组织约0.5 g在平面皿上剪成碎块, 置100目及260目铜/尼龙网上, 以镊子夹持摩擦, 同时用PBS洗下搓下的细胞, 放入10 mL试管内, 离心1 500 r/min, 5 min. 去上清, PBS洗2次. 调整细胞密度为1012/L, 分2管, 每管加细胞悬液20 μL, 其中一管加Fas L-FITC标记抗体(鼠抗人), 一管加IgG1-FITC(羊抗鼠)阴性对照. 室温避光30 min. 上机前用标准荧光微球调整仪器, 使变异系数在2.0%以内. 上FAC Scan流式细胞仪后收集1 000个细胞, 荧光强度以对数放大. 光散射数据存入软盘. 测试完后在计算机上用Cell Quest Plot软件(美国BD公司产)分析数据, 由HP1200c/ps打印机打印结果. 另一管加Bcl-2-FITC标记抗体(鼠抗人), 一管加IgG -FITC(羊抗鼠)阴性对照. 室温避光30 min, 待检. FAC Scan流式细胞仪检测同上.
1.2.3 肝脏病理检查: 再灌注后4 h处死大鼠, 各取前叶肝组织石蜡切片厚4 μm, HE染色, 光镜下观察肝脏组织的病理形态学变化. 另取前叶1-2 mm见方肝组织放入4 ℃ 20 g/L戊二醛液中固定, 经锇酸后固定, 乙醇脱水, 环氧树脂Epon 618包埋, 用AO-E型超薄切片机超薄切片, 铅铀双染, 在JEM-1200EX型透射电镜下观察.
统计学处理 所有数据以mean±SD表示, 采用SAS软件方差分析Student-Newman-Keuls法进行统计分析.
与假手术组比较, 治疗组和对照组移植术后ALT值均升高. 两治疗组术后4 h和24 h的ALT值均显著低于对照组(P<0.01), 且两治疗组间术后4 h和24 h的ALT值也有显著差异(分别为P<0.05和P<0.01, 表1).
假手术组凋亡细胞极少, 而对照组再灌注后2 h可见较多散在的肝实质细胞凋亡, 亦可见少量染色阳性的肝窦内皮细胞. 两治疗组凋亡的肝细胞明显减少, 其AI均显著降低(P<0.01),而两治疗组AI相比无显著差异(表1).
与假手术组比较, 对照组移植术后Bcl-2表达减少, 而两治疗组表达增加. 两治疗组术后Bcl-2表达较对照组显著增加(P<0.01, 表2),而两治疗组间比较无显著差异. 与对照组比较, 两治疗组移植术后FasL表达减少, 但统计学分析无显著差异(P>0.05), 两治疗组间比较也无显著差异.
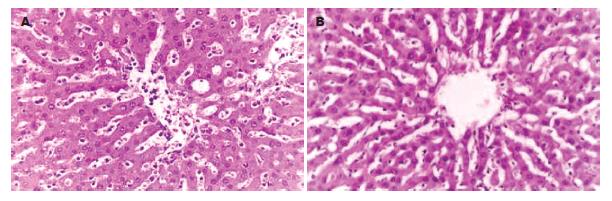
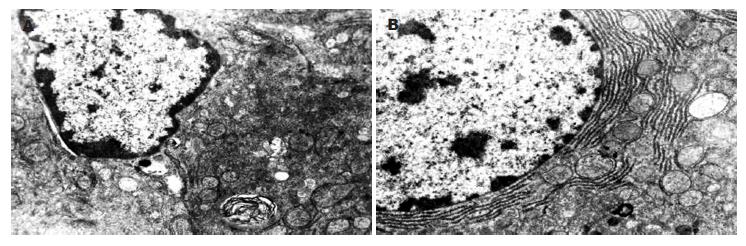
光镜下假手术组肝组织结构基本正常, 对照组可见肝细胞灶性坏死, 伴大量中性粒细胞及单核细胞浸润, 肝窦内皮细胞受损, 与Disse间隙脱离, 库氏细胞增生明显(图1A). 小剂量治疗组可见少数肝细胞呈空泡变性, 无肝细胞坏死, 炎性细胞浸润明显减少, 库氏细胞大致正常(图1B). 大剂量治疗组形态学改变与小剂量治疗组相似. 电镜下, 与假手术组相比较, 对照组肝细胞核皱缩, 染色质浓集, 线粒体肿胀, 嵴结构不清, 粗面内质网扩大成指状(图2A), Kupffer细胞明显活跃, 肝窦内皮细胞不连续, 高度肿胀; 治疗组肝细胞核圆居中, 线粒体和粗面内质网结构清晰(图2B), 肝窦内皮细胞基本完整, 未见明显肿胀.
现在认为肝细胞凋亡是供肝缺血再灌注损伤的一种表现形式[6-8]. 凋亡细胞呈胞核皱缩, 核染色质广泛浓缩、边集, 胞质浓缩但细胞器仍保持结构完整, 细胞膜形成多个芽突, 随后分裂为一个或多个有生物膜包被的特征性凋亡小体[9]. 各种损伤因素可以通过上调凋亡基因蛋白如Fas/FasL、Bax等的表达, 进而激活细胞内水解酶系引起钙离子大量内流, 引发线粒体膜通透性增加和功能丧失, 使其释放细胞色素C而最终导致细胞凋亡[10]. 细胞凋亡是肝细胞的死亡方式之一, 过度凋亡可引起肝功能损害. 我们采用TUNEL方法对各组大鼠移植术后的肝组织细胞凋亡情况进行研究. 结果显示对照组移植术后肝组织内散在分布着核染色阳性细胞. 电镜观察也进一步证实了供肝再灌注后存在核固缩、染色质聚集于细胞核边缘呈环状的凋亡肝细胞, 个别细胞内可见凋亡特征性形态改变-凋亡小体. 这就表明供肝冷保存再灌注后确实存在着明显的肝细胞凋亡情况. 两苦参碱治疗组移植术后供肝凋亡细胞明显减少, 凋亡指数AI显著降低, 其肝脏形态学检测也发生相应的改善, 表明苦参碱能有效减轻肝细胞凋亡.
Bilbao et al[11]研究发现在缺血期通过腺病毒载体将bcl-2基因转染给供肝可明显减轻再灌注后肝细胞的凋亡和坏死, 并可减少移植术后原发性移植肝无功能的发生率. 我们发现Bcl-2基因蛋白在两苦参碱治疗组表达明显高于对照组, 而两治疗组间表达无明显差异. 这就表明苦参碱能促进Bcl-2蛋白的表达, 从而抑制和减轻供肝冷保存再灌注所诱发的细胞凋亡. Fas/FasL是介导凋亡的细胞表面分子, 其机制可能是Fas与其配体FasL结合从而转导凋亡信号进入靶细胞并激活caspase级联反应, 诱导细胞凋亡. 我们发现苦参碱治疗组并不能显著降低FasL蛋白的表达, 这就提示苦参碱抑制肝细胞凋亡与FasL蛋白表达无明显关系. Huet et al[10]认为Fas/Fas L基因主要参与免疫排斥反应中的肝细胞凋亡.
总之, 苦参碱可以通过促进抑制凋亡基因蛋白Bcl-2的表达等机制来抑制冷保存再灌注导致的肝细胞凋亡,从而减轻供肝细胞的再灌注损伤. 苦参碱作为药物的单体成分, 其化学结构及药理作用机制明确, 副作用很小, 并已制备出多种剂型供临床选用, 临床应用前景较广泛.
临床广泛应用的苦参碱药理学结构明确, 在前期研究中已明确其对供肝冷保存再灌注损伤具有保护作用, 本文进一步探讨苦参碱对供肝冷保存再灌注中肝细胞凋亡的影响.
供肝冷保存再灌注损伤及防治一直是肝移植领域的研究难点, 其中肝细胞凋亡机制正成为研究热点. 苦参碱免疫抑制、抗炎抗氧化等药理学作用在移植领域的应用越来越广泛.
本文作者已在前期研究中发现苦参碱对供肝肝窦内皮细胞及枯否氏细胞的保护作用, 详见正文.
本研究在国内首次将苦参碱应用于防治供肝冷保存再灌注损伤的基础研究, 并且对作用机制进行深入探讨.
苦参碱作为药物的单体成分, 其化学结构及药理作用机制明确, 副作用很小, 并已制备出多种剂型供临床选用, 临床应用前景较广泛.
电编: 张敏 编辑:潘伯荣 审读:张海宁
| 1. | Zhang JP, Zhang M, Zhou JP, Liu FT, Zhou B, Xie WF, Guo C. Antifibrotic effects of matrine on in vitro and in vivo models of liver fibrosis in rats. Acta Pharmacol Sin. 2001;22:183-186. [PubMed] |
| 2. | Zhu X, Qiu Y, Shi M, Ding Y. Matrine protects sinu-soidal endothelial cells from cold ischemia and reperfusion injury in rat orthotopic liver transplan-tation. Ann Clin Lab Sci. 2003;33:216-225. [PubMed] |
| 4. | Zhu XH, Qiu YD, Shen H, Shi MK, Ding YT. Effect of matrine on Kupffer cell activation in cold ischemia reperfusion injury of rat liver. World J Gastroenterol. 2002;8:1112-1116. [PubMed] |
| 6. | Carlucci F, Marinello E, Gerunda G, Neri D, Rosi F, Floccari F, Tabucchi A. Liver transplant: adenosine metabolism and apoptosis. Nucleosides Nucleotides Nucleic Acids. 2004;23:1295-1299. [PubMed] |
| 7. | Mueller TH, Kienle K, Beham A, Geissler EK, Jauch KW, Rentsch M. Caspase 3 inhibition improves survival and reduces early graft injury after ische-mia and reperfusion in rat liver transplantation. Transplantation. 2004;78:1267-1273. [PubMed] |
| 8. | Baskin-Bey ES, Canbay A, Bronk SF, Werneburg N, Guicciardi ME, Nyberg SL, Gores GJ. Cathepsin B inactivation attenuates hepatocyte apoptosis and liver damage in steatotic livers after cold ischemia-warm reperfusion injury. Am J Physiol Gastrointest Liver Physiol. 2005;288:G396-402. [PubMed] |
| 9. | Teoh NC, Farrell GC. Hepatic ischemia reperfusion injury: Pathogenic mechanisms and basis for hepat-oprotection. J Gastroenterol Hepatol. 2003;18:891-902. [PubMed] |
| 10. | Huet PM, Nagaoka MR, Desbiens G, Tarrab E, Brault A, Bralet MP, Bilodeau M. Sinusoidal endothelial cell and hepatocyte death following cold ischemia-warm reperfusion of the rat liver. Hepatology. 2004;39:1110-1119. [PubMed] |