修回日期: 2004-10-11
接受日期: 2004-10-20
在线出版日期: 2005-04-15
目的: 利用HIV-Tat蛋白转导域(protein transduction domain, PTD)高效的跨膜转导特性, 探索将乙肝病毒靶向核糖核酸酶(targeted ribonuclease, TR)导入肝细胞的新途径.
方法: 将TR基因克隆入含TatPTD的pTAT原核表达载体, 在大肠杆菌BL21(DE3)LysS 内诱导融合蛋白表达并进行纯化. 将纯化的Tat-TR加入培养的HepG2细胞, 间接免疫荧光法检测其导入HepG2细胞的效率, MTT法检测其对细胞生长代谢的影响. 将Tat-TR加入培养的HepG2.2.15细胞, 定量PCR法检测HBV DNA水平并以SPSS软件进行统计分析. 将Tat-TR经尾静脉注入小鼠体内2 h后, 对小鼠肝组织进行免疫组化染色, 检测TatPTD能否在体内介导TR进入肝细胞.
结果: 成功地制备了Tat-TR融合蛋白, 其纯度为90%. 间接免疫荧光及MTT的检测结果证实Tat-TR可以跨膜导入HepG2细胞且对细胞生长没有影响. SPSS统计分析显示Tat-TR可以抑制HBV的复制. 免疫组化染色结果显示, TatPTD在体内也可以介导TR进入肝细胞.
结论: Tat-HBV靶向核糖核酸酶的制备及活性鉴定, 为应用靶向核糖核酸酶治疗乙肝病毒感染的研究奠定了良好的基础.
引文著录: 丁劲, 刘军, 薛采芳, 李英辉, 赵亚, 陈俊, 黄豫晓, 刘忠湘. TatPTD介导HBV靶向核糖核酸酶进入肝细胞的研究. 世界华人消化杂志 2005; 13(8): 958-962
Revised: October 11, 2004
Accepted: October 20, 2004
Published online: April 15, 2005
AIM: To introduce hepatitis B virus(HBV)targeted ribonuclease into hepatocytes by using human immunodeficiency virus Tat protein transduction domain (HIV-TatPTD).
METHODS: The gene encoding HBV targeted ribonuclease was cloned into prokaryotic expression vector pTAT-HA. Recombinant plasmid was transduced into E. coli BL21 (DE3) LysS, and then induced with IPTG. The expression of the fusion protein was analyzed by SDS-PAGE. Tat-TR fusion protein was purified and added to the HepG2 cell culture. The transduction efficiency was evaluated by IFA. MTT assay was performed to investigate the cytotoxicity of Tat-TR. Tat-TR was added into the cultured HepG2.2.15 cells, and the HBV DNA concentration was measured using quantitative PCR. Immunohistochemical staining was performed to identify whether TatPTD could introduce TR into the hepatocytes in vivo.
RESULTS: Tat-TR fusion protein was successfully expressed and purified. IFA visualization showed that Tat-TR was introduced into hepatocytes. MTT assay suggested that Tat-TR did not affect the cell growth and had no cytotoxity. Quantitative PCR result indicated that Tat-TR inhibited the replication of HBV. Immunohistochemical staining result showed that TatPTD delivered TR into hepatocytes in vivo.
CONCLUSION: The Tat-TR fusion protein may be valuable for the therapy of HBV infection.
- Citation: Ding J, Liu J, Xue CF, Li YH, Zhao Y, Chen J, Huang YX, Liu ZX. TatPTD can introduce HBV targeted ribonuclease into hepatocytes. Shijie Huaren Xiaohua Zazhi 2005; 13(8): 958-962
- URL: https://www.wjgnet.com/1009-3079/full/v13/i8/958.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i8.958
乙型肝炎是危害人类健康的重要疾病, 治疗乙型肝炎的研究也一直是医学领域的热点问题[1-3]. 由于HBV的复制过程类似于逆转录病毒, 我室依据核衣壳导向的病毒灭活(capsid-targeted viral inactivation, CATI)原理[4], 构建了HBV靶向核糖核酸酶融合基因[5], 靶向分子HBV核心蛋白是HBV包装过程中必需的成分, 效应分子人嗜酸性粒细胞来源的神经毒素是一种人源性的核糖核酸酶. 在HBV复制的过程中, 理论上HBVc可将与之融合的hEDN引入核心区, hEDN则可在核心区内与HBV的前基因组RNA(pgRNA)相结合并对其进行酶解. 在体外研究中, 我们利用TR基因的真核表达载体转染HepG2.2.15细胞, 结果显示TR的确可以抑制HBV的复制[6]. 但是转染的方法存在着效率低下、效果不稳定和难以体内应用的缺点, 这也极大地阻碍了靶向核糖核酸酶作用的发挥. 近年来蛋白质传导结构域(PTD)的发现和功能研究为解决这一问题带来了曙光. PTD是一类在蛋白转导过程中, 能高效穿过生物膜的结构域, 当其与蛋白质、多肽或DNA等分子共价连接时, 可将这些分子高效地转移到细胞内[7]. 迄今发现的高效PTD有HIV的Tat[8], HSV的VP22[9], 以及果蝇的ANTP[10], 其中Tat蛋白是研究较为深入的一种[11-12]. 实验证明, 纯化的Tat融合蛋白无需复性即可导入小鼠体内的几乎所有细胞和组织中, 甚至还可以穿过血脑屏障[13]. Tat融合蛋白系统已被公认是一种很有前途的运载工具, 无论对于基础研究, 还是临床治疗, 都有着非常广泛的应用前景[14]. 因此, 利用Tat高效的蛋白转导特性, 将与Tat融合的TR导入肝细胞可能成为治疗HBV感染更为有效的途径. 我们将TR基因克隆入含Tat的pTAT原核表达载体, 在大肠杆菌内诱导表达后, 纯化了Tat-TR融合蛋白并对TatPTD 介导HBV-TR转入肝细胞的效率和效果进行了检测.
PCR试剂盒、限制性内切酶及连接酶为Takara公司产品. 核酸电泳分子量标准, 低分子量标准蛋白质和IPTG均为华美公司产品. 质粒小量提取试剂盒、BCA蛋白定量试剂盒均购自碧云天生物技术研究所. Ni-NTA-agrose购自基因公司. PD-10 desalting columns购自Amersham Pharmacia生物技术有限公司. SABC免疫组化检测试剂盒购自博士德公司. pTAT-HA质粒由美国Doudy教授惠赠. 质粒pcDNA3.1(-)/TR、pUC18及大肠杆菌JM109、BL21(DE3)LysS由本室保存. HepG2.2.15细胞由北京解放军302医院程云教授惠赠.
PCR引物由北京奥科生物技术有限公司合成. Forward: GCGCATGGCCATGGAGGAGC CGCAGTCAGAT(划线处为Nco I 酶切位点). Backward: GCGCGAATTCTCAGTCTGAATCAGGCCCTT(划线处为EcoR I酶切位点). 在50 μL体系中, 以pcDNA3.1(-)/TR为模板进行PCR. 将PCR产物和pTAT-HA质粒分别用Nco I和EcoR I双酶切, 回收酶切产物, 用T4DNA连接酶于16℃水浴连接16 h, 转化JM109感受态细胞. 以含Amp的固体培养基(LB)筛选阳性克隆, 小量提取质粒后用Nco I和EcoR I酶切鉴定. 测序由上海基康公司完成. 以pTAT-HA/TR原核表达载体转化大肠杆菌BL21(DE3)LysS, IPTG诱导融合蛋白表达并利用融合蛋白携有的(His)6标签, 以Ni-NTA-agrose柱进行纯化(具体步骤参见操作手册). 用PD-10 Desalting columns除去蛋白洗脱液中咪唑等小分子杂质. 纯化的Tat-TR融合蛋白经SDS-PAGE分析后, 采用凝胶扫描的方法测定蛋白样品的纯度, BCA法测定融和蛋白的浓度. HepG2细胞是人肝癌细胞株, 常规培养于37℃、50 mL/L CO2、含100 mL/L胎牛血清的DMEM培养液中, 加入青、链霉素至终浓度均为100 mg/L. 每2 d 换液一次, 4 d传代.
1.2.1 Tat-TR跨膜转导效率的鉴定: 将HepG2细胞以2×108/L的密度接种于内置爬片的24孔培养板. 待细胞贴壁后(24 h), 在第1组的2个复孔中加入DMEM 20 μL作为阴性对照.2-16组(每组2个复孔)均加入Tat-TR融合蛋白至终浓度为200 μmol/L, 分别在15 min, 30 min, 1 h, 2 h 和4 h时, 于冰上吸去培养液, 4 ℃的PBS(pH8.0)洗涤各孔贴壁细胞10 min, 每孔加入含20 g/L多聚甲醛、1 g/L TritonX-100的PBS溶液1 mL, 置冰上30 min. 再以4℃ PBS洗涤10 min, 加入10 g/L的BSA于42℃放置10 min, 4℃的PBS洗涤10 min, 每孔加入鼠抗His抗体 (1: 1 000)1 mL, 42℃放置30 min后, 4℃ PBS洗涤15 min, 加入FITC标记的兔抗鼠IgG (1: 1 000), 42℃孵育10 min, PBS震洗1 h后以500 mL/L的甘油封片, 荧光显微镜下观察并照相.
1.2.2 MTT试验: 将HepG2细胞以2×108/L的密度接种于96孔培养板, 培养24 h后将其分成2组, 每组4个复孔. 实验组加入Tat-TR融合蛋白至终浓度为200 μmol/L, 对照组加入DMEM, 继续培养72 h. 相差显微镜下观察细胞形态后, 每孔加入MTT溶液20 μL(5 g/L), 继续孵育4 h. 每孔加入DMSO150 μL, 振荡10 min, 使结晶物充分溶解. 选择490 nm波长, 在酶联免疫检测仪上测定各孔的吸光度. 以SPSS软件对结果进行统计学分析.
1.2.3 HepG2.2.15细胞的培养: HepG2.2.15细胞是在HepG2细胞的基因组中整合了完整的HBV基因组, 能持续转录和翻译HBV基因, 产生HBsAg, HBeAg和Dane颗粒, HepG2.2.15细胞在含150 mL/L胎牛血清的DMEM培养液中, 于37℃, 50 mL/L CO2条件下进行培养, 加入G418至终浓度为200 mg/L. 每3 d换液1次, 6 d传代.
1.2.4 Tat-TR抗病毒效果的检测: 将长势良好的HepG2.2.15细胞以2×108/L的密度接种于12孔板, 培养24 h换液1次. 将培养细胞分为2组(每组4个复孔): 实验组加入Tat-TR融合蛋白至终浓度100 nmol/L, 对照组加入DMEM20 μL. 继续培养48 h后, 每孔吸出上清200 μL, 由第四军医大学临床分子生物学中心测定HBV DNA浓度. 将实验组和各对照组浓度均数按α = 0.05的水平, 以SPSS软件进行统计学分析.
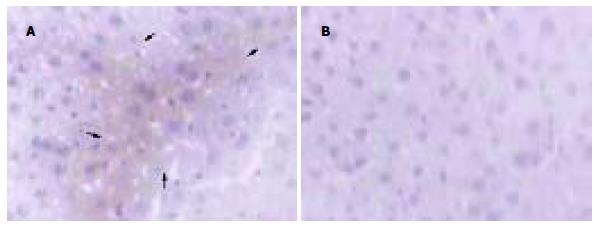
1.2.5 肝组织切片的免疫组化染色: 取4-6 wk 的Balb/c小鼠, 经尾静脉注射Tat-TR融合蛋白200 μg, 另取小鼠尾静脉注射生理盐水作为对照, 4 h后均摘眼球放血处死. 取小鼠肝组织于100 mg/L甲醛溶液固定, 制作石蜡切片(5 μm厚). 将石蜡切片脱蜡水化后, 室温下以300 mL/L H2O2封闭内源性过氧化物酶, 加入正常小鼠血清封闭非特异结合位点, 再依次加入鼠抗his单抗、正常山羊血清封闭液、HRP标记的羊抗鼠IgG后, 以DAB进行显色. 苏木素轻度复染, 脱水、透明后中性树胶封固, 置显微镜下观察、摄像.
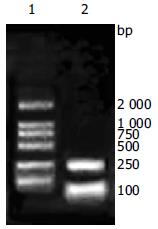
PCR产物的琼脂糖凝胶电泳结果如图1所示, 目的片段大小约1 000 bp, 与TR大小相当. 将构建的pTAT-HA/TR质粒用Nco I和EcoR I双酶切鉴定, 酶切产物的小片段约1 000 bp(图1). 测序报告显示核苷酸序列无误, 表明pTAT-HA/TR原核表达质粒构建正确.
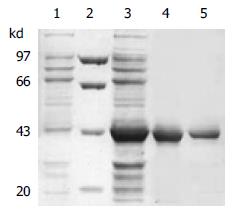
用重组原核表达载体pTAT-HA/TR转化大肠杆菌BL21(DE3)LysS, 经IPTG诱导后与pTAT-HA转化相同菌株的表达产物相比较, 在120 g/L的SDS-PAGE图谱上出现了新的条带, Mr 43 000, 与TR的预计分子量大小相当(图2). Tat-TR融合蛋白纯化产物的SDS-PAGE分析显示, Tat-TR纯化成功(图2). 凝胶扫描测定融合蛋白的纯度为90%. 经定量Tat-TR融合蛋白的浓度为0.8 g/L.
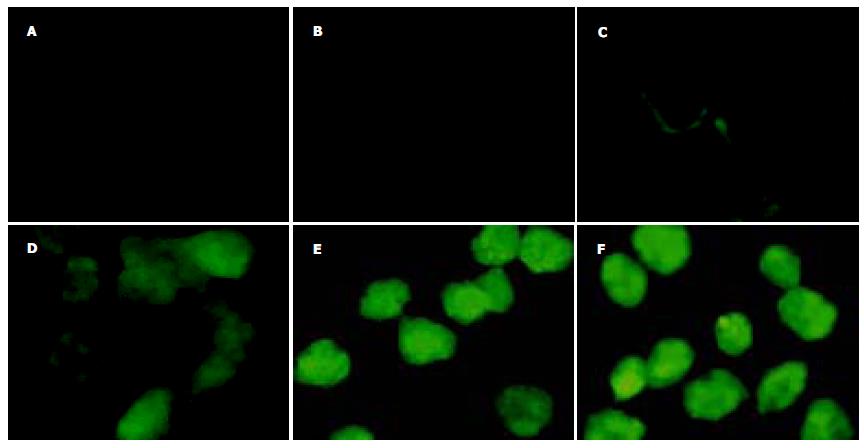
加入Tat-TR融合蛋白15 min时荧光显微镜下观察未见荧光, 30 min时可检测到较弱荧光并主要集中在胞膜, 1 h时胞内出现明显的荧光, 2 h时荧光强度达峰值, 4 h时没有增强. 而对照组均没有荧光出现, 这一结果说明Tat PTD可在短时间内将TR高效地导入HepG2细胞(图3).
加入Tat-TR融合蛋白72 h后, 倒置显微镜下观察细胞形态和生长状况发现, 各组细胞生长状况良好. MTT比色测得A490(mean±SD, n = 4)分别为0.4 875+0.018和0.4 852+0.050. SPSS统计软件分析结果显示: 实验组与对照组之间没有显著性差异(P>0.05), 说明Tat-TR融合蛋白对细胞没有毒性, 也不影响细胞的生长代谢
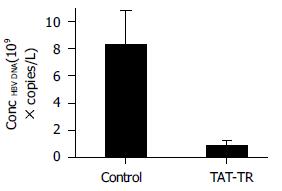
Tat-TR融合蛋白加入HepG2.2.15细胞48 h后, 检测上清中HBV DNA浓度(图4). SPSS软件进行方差分析发现, 实验组HBV DNA浓度均数与对照组相比有统计学差异, 并且实验组上清中HBV DNA浓度比对照组平均下降了90.1%.
为了探明Tat PTD在体内能否将TR引入肝细胞, 试验中将Tat-TR融合蛋白及其对照生理盐水, 分别经尾静脉注入小鼠体内, 4 h后取肝组织制备石蜡切片. 免疫组化染色, 注射Tat-TR融合蛋白的小鼠, 肝组织切片免疫组化染色呈阳性(图5), 而注射生理盐水的小鼠, 肝组织切片染色呈阴性. 这一结果说明Tat PTD在体内可以将TR引入肝细胞.
近些年来, 人们发现了一类蛋白质功能结构域, 他们可将与其共价连接的分子高效地导入细胞内, 故名蛋白转导域. 研究发现, 这类分子均由富含碱性氨基酸残基的短肽构成, 也称为细胞穿膜肽(cell penetrate peptide, CPP). 目前, 蛋白转导的机制并不清楚, 推测他是一个不依赖于受体和转运蛋白的过程, 可能直接作用于脂质双层, 这一特点使得所有细胞都可成为被转导的对象. 蛋白质和药物向细胞的导入受制于本身的理化性质, 被动扩散的药物的摄入与其脂溶性直接相关, 极性或带电荷的分子只能被有限摄入. 通过与PTD的共价连接, 为化合物、蛋白质、多肽等向靶细胞的传递提供一个崭新途径. 目前已有数十种分子质量在15-120 kD的Tat融合蛋白已被成功导入细胞. 最近的一些研究结果显示, 将荧光素标记的Tat PTD多肽通过会阴注射入小鼠体内, 然后在共聚焦显微镜下检测, 发现荧光素可被导入所有组织中[14]. 从一些体外转导实验结果来看, 利用蛋白转导的策略将治疗所需的化合物输入患者体内的前景良好.
为了探索应用PTD将TR引入肝细胞治疗乙型肝炎的可行性. 我们构建了Tat-HBV靶向核糖核酸酶融合蛋白原核表达载体, 转化大肠杆菌BL21 (DEIII)后以IPTG诱导表达, 与本室先前的研究相比, 融合蛋白的表达效率显著提高, 这可能是由于在表达载体上目的基因更接近起始密码子引起的. 利用间接免疫荧光法检测Tat-TR融合蛋白导入肝细胞的效率发现: 在加入Tat-TR融合蛋白30 min时细胞出现荧光, 此时荧光物质主要集中在胞膜, 这可能是由于TatPTD富含碱性氨基酸, 在溶液中带有较强的正电荷, 可与带负电荷的细胞脂膜结合造成的, 这时Tat融合蛋白还没有进入到细胞内部, 故胞质没有荧光. 到加入融合蛋白1 h时检测, 胞内已经有较强荧光出现, 并且细胞核也着色, 这可能是融合蛋白进入细胞后, 在较短时间内即进入到胞核造成的. 大约2 h胞内荧光强度达峰值, 4 h时没有明显变化, 这就提示蛋白转导可能是以一个浓度依赖的方式进行的, 在2 h左右细胞内外蛋白浓度相当, 维持一个动态平衡, 故荧光强度不再变化. MTT检测结果显示, Tat-TR融合蛋白对细胞的生长代谢没有影响, 转导过程对靶细胞也没有损害. 与目前常规的脂质体转染相比较发现, Tat PTD介导的蛋白转导具有明显的优势: (1)导入细胞的效率大大提高, 融合蛋白几乎可以进入100%的培养细胞. (2)转导过程迅速, 数分钟到几小时内, 就可以看到了融合蛋白进入细胞并在胞内积累. (3)由于Tat融合蛋白以浓度依赖的方式进入细胞, 故每个细胞内的蛋白浓度基本相同, 所以可以相对精确的控制胞内蛋白的浓度. (4) PTD还具有温度适应性广、携带分子多样及可导入常规方法难以转染的原代细胞等. 本研究采用乙型肝炎体外模型HepG2.2.15细胞, 进行了Tat-TR抗病毒效果的鉴定. 检测指标选用了能客观反映HBV负荷及复制情况的HBV DNA水平, 检测结果显示Tat-TR融合蛋白可以显著抑制乙肝病毒的复制, 抑制率约90.1%. 小鼠肝组织的免疫组化染色结果证明, TatPTD可以在体内将TR导入肝细胞, 这就为我们下一步利用HBV靶向核糖核酸酶, 抑制乙肝病毒复制的体内试验奠定了良好的基础.
编辑: 张海宁 电编: 潘伯荣
| 1. | Guo SP, Wang WL, Zhai YQ, Zhao YL. Expression of nuclear factor-kappa B in hepatocellular carcinoma and its relation with the X protein of hepatitis B virus. World J Gastroenterol. 2001;7:340-344. [PubMed] |
| 2. | Zhuang L, You J, Tang BZ, Ding SY, Yan KH, Peng D, Zhang YM, Zhang L. Preliminary results of Thymosin-a1 versus interferon-alpha-treatment in patient with HBeAg negative and serum HBV DNA positive chronic hepatitis B. World J Gastroenterol. 2001;7:407-410. [PubMed] |
| 3. | Song YH, Lin JS, Liu NZ, Kong XJ, Xie N, Wang NX, Jin YX, Liang KH. Anti-HBV hairpin ribozyme-mediated cleavage of target RNA in vitro. World J Gastroenterol. 2002;8:91-94. [PubMed] |
| 4. | Natsoulis G, Boeke JD. New antiviral strategy using capsid-nuclease fusion proteins. Nature. 1991;352:632-635. [PubMed] |
| 5. | 丁 劲, 刘 军, 薛 采芳, 李 英辉, 宫 卫东. TAT-乙肝病毒靶向核糖核酸酶融合蛋白原核载体的构建及表达. 细胞与分子免疫学杂志. 2003;19:49-51. |
| 6. | 李 英辉, 刘 军, 薛 采芳, 丁 劲, 宫 卫东, 赵 亚. 靶向核糖核酸酶在体外抑制乙肝病毒复制的研究. 中华微生物学与免疫学杂志. 2003;23:484-488. |
| 7. | Schwarze SR, Dowdy SF. In vivo protein transduction: intracellular delivery of biologically active proteins, compounds and DNA. Trends Pharmacol Sci. 2000;21:45-48. [PubMed] |
| 8. | Fawell S, Seery J, Daikh Y, Moore C, Chen LL, Pepinsky B, Barsoum J. Tat-mediated delivery of heterologous proteins into cells. Proc Natl Acad Sci USA. 1994;91:664-668. [PubMed] |
| 9. | Elliott G, O'Hare P. Intercellular trafficking and protein delivery by a herpesvirus structural protein. Cell. 1997;88:223-233. [PubMed] |
| 10. | Derossi D, Joliot AH, Chassaing G, Prochiantz A. The third helix of the Antennapedia homeodomain translocates through biological membranes. J Biol Chem. 1994;269:10444-10450. [PubMed] |
| 11. | Ezhevsky SA, Nagahara H, Vocero-Akbani AM, Gius DR, Wei MC, Dowdy SF. Hypo-phosphorylation of the retinoblastoma protein(pRb)by byclin D: Cdk4/6 complexes results in active pRb. Proc Natl Acda Sci USA. 1997;94:10699-10704. [PubMed] |
| 12. | Vives E, Brodin P, Lebleu B. A truncated HIV-1 Tat protein basic domain rapidly translocates through the plasma membrane and accumulates in the cell nucleus. J Biol Chem. 1997;272:16010-16017. [PubMed] |
| 13. | Chellaiah MA, Soga N, Swanson S, McAllister S, Alvarez U, Wang D, Dowdy SF, Hruska KA. Rho-A is critical for osteoclast podosome organization, motility and bone resorption. J Biol Chem. 2000;275:11993-12002. [PubMed] |