修回日期: 2005-01-21
接受日期: 2005-01-26
在线出版日期: 2005-04-01
目的: 探讨缺血预处理对大鼠移植胰缺血再灌注损伤的早期保护作用及其与细胞凋亡的相关性.
方法: 正常大鼠6只为对照组, 糖尿病SD大鼠24只随机分为缺血再灌注组(I/R组, n = 6)和缺血预处理组(IPC组, n = 18), IPC组又根据不同方法分为3个亚组: IPC1组(缺血5 min再灌注5 min 1次, n = 6)、IPC2组(缺血5 min再灌注5 min 2次, n = 6)和IPC3组(缺血5 min再灌注5 min 3次, n = 6), I/R组和IPC组均行单纯胰腺移植, 24只SD大鼠为供体; 检测各组再灌注前、后血糖; 再灌注后2 h血清中TNF-α和NO的含量、移植胰组织中SOD, MPO和MDA含量; 用TUNEL法观察移植胰组织细胞凋亡情况, Western Blot法检测移植胰组织Bax和Bcl-2蛋白表达情况.
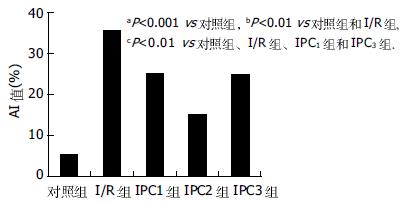
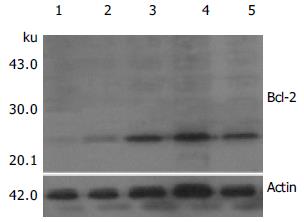
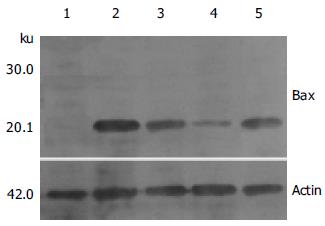
结果: 再灌注后IPC1(14.3±1.1 vs 12.1±0.9 mmol/L, P<0.05)组、IPC2(12.1±0.9 vs 16.5±1.4 mmol/L, P<0.01)和IPC3组(14.7±1.3 vs 12.1±0.9 mmol/L, P<0.05)相对于I/R组血糖低; IPC2组较IPC1组(12.1±0.9 vs 14.3±1.1 mmol/L, P<0.05)和IPC3组(12.1±0.9 vs 14.7±1.3 mmol/L, P<0.05)血糖低. 再灌注后IPC1(1.41±0.17 vs 1.79±0.25 kU/L, P<0.05)组、IPC2(1.05±0.16 vs 1.79±0.25kU/L, P<0.01)和IPC3组(1.43±0.20 vs 1.79±0.25 kU/L, P<0.05)较I/R组血清中TNF-α含量低; IPC2组较IPC1组(1.05±0.16 vs 1.41±0.17 kU/L, P<0.05)和IPC3组(1.05±0.16 vs 1.43±0.20kU/L, P<0.05)TNF-α含量低. 再灌注后IPC1(13.13±2.87 vs 8.91±1.23 μg/L, P<0.05)组、IPC2(18.79±2.39 vs 8.91±1.23 μg/L, P<0.01)和IPC3组(14.36±1.78 vs 8.91±1.23 μg/L, P<0.05)较I/R组血清中NO含量高; IPC2组较IPC1组(18.79±2.39 vs 13.13±1.87 μg/L, P<0.05)和IPC3组(18.79±2.39 vs 14.36±1.78 μg/L, P<0.05)NO含量高. 再灌注后IPC1(179.82±19.54 vs 153.47±17.67 mU/g, P<0.05)组、IPC2(213.64±22.97 vs 153.47±17.67 mU/g, P<0.01)和IPC3组(181.68±20.32 vs 153.47±17.67 mU/g, P<0.05)较I/R组移植胰组织中SOD活性高; IPC2组较IPC1组(213.64±22.97 vs 179.82±19.54 mU/g, P<0.05)和 IPC3组(213.64±22.97 vs 181.68±20.32 mU/g, P<0.05)SOD活性高. 再灌注后IPC1(0.70±0.26 vs 0.87±0.31 mmol/g, P<0.05)组、IPC2(0.46±0.18 vs 0.87±0.31 mmol/g, P<0.01)和IPC3组(0.67±0.15 vs 0.87±0.31 mmol/g, P<0.05)较I/R组移植胰组织中MDA含量低; IPC2组较IPC1组(0.46±0.18 vs 0.70±0.26 mmol/g, P<0.05)和 IPC3组(0.46±0.18 vs 10.67±0.15 mmol/g, P<0.05)MDA含量低. 再灌注后IPC1(0.81±0.23 vs 0.96±0.34 A/g, P<0.05)组、IPC2(0.51±0.16 vs 0.96±0.34 A/g, P<0.01)和IPC3组(0.78±0.22 vs 0.96±0.34 A/g, P<0.05)较I/R组移植胰组织中MPO活性低; IPC2组较IPC1组(0.51±0.16 vs 0.81±0.23 A/g, P<0.05)和IPC3组(0.51±0.16 vs 0.78±0.22 A/g, P<0.05)MPO活性低. 再灌注后IPC1(25.21±3.47 vs 35.65±4.78%, P<0.01)组、IPC2(15.47±2.09 vs 35.65±4.78%, P<0.01)和IPC3组(24.89±3.56 vs 35.65±3.78%, P<0.01)较I/R组移植胰组织中AI值低; IPC2组较IPC1组(15.47±2.09 vs 25.21±3.47%, P<0.05)和 IPC3组(15.47±2.09 vs 24.89±3.56%, P<0.05)AI值低. 再灌注后I/R组胰组织Bax蛋白高表达, Bcl-2蛋白低表达, IPC各组再灌注后移植胰组织Bax蛋白低表达, Bcl-2蛋白高表达, 而IPC2组Bcl-2蛋白表达最高Bax蛋白表达最低.
结论: 缺血预处理对大鼠移植胰的缺血再灌注损伤具有早期保护作用, 可能于提高SOD的活性、增加内源性NO的合成、下调TNF-α和减轻PMNs黏附与聚集有关; 缺血预处理可以减少移植胰缺血再灌注后的细胞凋亡, 可能于减轻PMNs黏附与聚集、减少氧自由基、上调Bcl-2蛋白和下调Bax蛋白有关; 缺血5 min再灌注5 min 2次是最佳的大鼠移植胰缺血预处理诱导办法.
引文著录: 刘小南, 霍婷婷, 王为忠, 陈彩平, 管文贤, 陈冬利. 缺血预处理对大鼠移植胰缺血再灌注损伤的保护作用及其与细胞凋亡的相关性. 世界华人消化杂志 2005; 13(7): 871-876
Revised: January 21, 2005
Accepted: January 26, 2005
Published online: April 1, 2005
AIM: To investigate the effect of ischemic preconditioning on ischemia reperfusion injury of the pancreas graft in rat, and to analyze the possible mechanism.
METHODS: Six normal SD rats in the control group received sham operation. Twenty-four SD rats with steptozozin-induced diabetes were randomly assigned to 2 groups: Group I/R consisted of 6 diabetic rats which received pancreas transplantation; Group IPC consisted of 18 diabetic rats which received pancreas transplantation and were exposed to 5 min ischemia and 5 min reperfusion once (IPC1, n = 6), twice (IPC2, n = 6) or thrice (IPC3, n = 6) before ablating donors. Blood glucose, serum NO and TNF-α, MDA, SOD, MPO, TUNEL cells, and the expression of Bcl-2 and Bax pretien (Western Blot) in graft were monitored.
RESULTS: The mean blood glucose levels in Group IPC1 (14.3 ± 1.1 vs 12.1 ± 0.9 mmol/L, P<0.05), Group IPC2 (12.1 ± 0.9 vs 16.5 ± 1.4 mmol/L, P<0.01) and Group IPC3(14.7 ± 1.3 vs 12.1 ± 0.9 mmol/L, P<0.05) were lower than that in Group I/R, and the glucose level in Group IPC2 was lower than those in IPC1(12.1 ± 0.9 vs 14.3 ± 1.1 mmol/L, P<0.05)and IPC3 (12.1 ± 0.9 vs 14.7 ± 1.3 mmol/L, P<0.05) 2 hours after reperfusion. The mean NO (13.13 ± 2.87 vs 8.91 ± 1.23 μg/L, P<0.05, 18.79 ± 2.39 vs 8.91 ± 1.23 μg/L, P<0.01, 14.36 ± 1.78 vs 8.91 ± 1.23 μg/L, P<0.05) and SOD (179.82 ± 19.54 vs 153.47 ± 17.67 mU/g, P<0.05, 213.64 ± 22.97 vs 153.47 ± 17.67 mU/g, P<0.01, 181.68 ± 20.32 vs 153.47 ± 17.67 mU/g, P<0.05) levels in Group IPC1, IPC2 and IPC3 were higher than that in Group I/R, and the levels in Group IPC2 were higher than those in Group IPC1 and Group IPC3 2 hours after reperfusion (18.79 ± 2.39 vs 13.13 ± 2.87 μg/L, 18.79 ± 2.39 vs 14.36 ± 1.78 μg/L, 213.64 ± 22.97 vs 179.82 ± 19.54 mU/g, 213.64 ± 22.97 vs 181.68 ± 20.32 mU/g, P<0.05). The mean levels of TNF-α (1.41 ± 0.17 vs 1.79 ± 0.25 kU/L, P<0.05, 1.05 ± 0.16 vs 1.79 ± 0.25 kU/L, P<0.01, 1.43 ± 0.20 vs 1.79 ± 0.25 kU/L, P<0.05, MDA (0.70 ± 0.26 vs 0.87 ± 0.31 mmol/g, P<0.05, 0.46 ± 0.18 vs 0.87 ± 0.31 mmol/g, P<0.01; 0.67 ± 0.15 vs 0.87 ± 0.31 mmol/g, P<0.05) and MPO (0.81 ± 0.23 vs 0.96 ± 0.34 A/g, P<0.05, 0.51 ± 0.16 vs 0.96 ± 0.34 A/g, P<0.01, 0.78 ± 0.22 vs 0.96 ± 0.34 A/g, P<0.05) in Group IPC1, IPC2 and IPC3 were lower than those in Group I/R, and those in Group IPC2 were lower than in IPC1 and IPC3 2 hours after reperfusion (1.05 ± 0.16 vs 1.41 ± 0.17 kU/L, 1.05 ± 0.16 vs 1.43 ± 0.20 kU/L, 0.46 ± 0.18 vs 0.70 ± 0.26 mmol/g, 0.46 ± 0.18 vs 10.67 ± 0.15 mmol/g, 0.51 ± 0.16 vs 0.81 ± 0.23 A/g, 0.51 ± 0.16 vs 0.78 ± 0.22 A/g, P<0.05). The apoptotic indexes in IPC1 (25.21 ± 3.47 vs 35.65 ± 4.78%, P<0.01), IPC2 (15.47 ± 2.09 vs 35.65 ± 4.78%, P<0.01) and IPC3 (24.89 ± 3.56 vs 35.65 ± 4.78%, P<0.01) were lower than Group I/R, and that in Group IPC2 was lower than IPC1 (15.47 ± 2.09 vs 25.21 ± 3.47%, P<0.01) and IPC3 (15.47 ± 2.09 vs 24.89 ± 3.56%, P<0.01) 2 hours after reperfusion. The expression of the Bax protein in Group I/R was higher than that in Group IPC, while that in Group IPC2 was the lowest. The expression of Bcl-2 protein in Group IPC was higher than in Group I/R, and that in Group IPC2 was the highest. The expression of the Bax protein in Group IPC was lower than Group I/R, and that in Group IPC2 was the lowest.
CONCLUSION: Ischemic preconditioning can protect pancreas graft from I/R injury. The possible mechanism may be related to the increased production of serum NO and tissue SOD, reduced conglutination and aggregation of PMNs in pancreas and diminished synthesis TNF-α. Ischemic preconditioning can reduce apopotosis of the graft, which may be resulted from alleviated conglutination and aggregation of PMNs, increased oxygen radical, increased Bcl-2 protein and reduced P53 protein expression. Five min ischemia and five min reperfusion twice is the best way to induce ischemic preconditioning in rat pancreas transplantation.
- Citation: Liu XN, Huo TT, Wang WZ, Chen CP, Guan WX, Chen DL. Effect of ischemic preconditioning on ischemia reperfusion injury of graft after pancreas transplantation and correlations with apoptosis in rat. Shijie Huaren Xiaohua Zazhi 2005; 13(7): 871-876
- URL: https://www.wjgnet.com/1009-3079/full/v13/i7/871.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i7.871
胰腺移植过程中, 缺血再灌注(Ischemic reperfusion, I/R)损伤会导致许多并发症, 直接威胁着供胰和受体本身的存活, 严重时可导致移植失败. 缺血预处理(Ischemic preconditioning, IPC)可使心肌在随后的缺血中得到保护, 即IPC的早期保护作用. 近来体内体外的试验表明早期IPC还可以减少细胞凋亡[1], 这种现象在心脏[2]、肝脏[3]和脑[4]的实验中得到了证实, 但在胰腺移植方面的研究很少, 我们应用大鼠胰腺移植模型, 研究IPC对大鼠移植胰缺血再灌注损伤的早期保护作用, 以及其与凋亡相关蛋白的相关性.
SD雄性大鼠70只(250-320 g), 标准实验室饲养, 由第四军医大学动物实验中心提供. 血糖监测仪购自美国强生公司; 超氧化物歧化酶(superoxide dismutase, SOD)、一氧化氮(nitric oxic, NO)、丙二醛(malondialdehyde, MDA)和细胞凋亡检测试剂盒购自南京建成生物工程研究所; 肿瘤坏死因子(tumur necrosis factor, TNF)-α测试盒购自北京东亚免疫技术研究; 兔抗鼠Bax、 Bcl-2和actin多克隆抗体、Western bloting luninol reagent购自德国Santa Cruz公司; Tri釲S Reagent购自美国GibcoBRL公司.
正常大鼠6只为对照组, 大鼠46只自阴茎静脉注射STZ(65 mg/kg)后, 30只空腹血糖持续2 wk超过17.4 mmol/L为糖尿病大鼠模型成功, 糖尿病大鼠随机分为缺血再灌注组(I/R组, n = 6)缺血预处理组(IPC组, n = 18), IPC组又根据不同方法分为3个亚组: IPC1、IPC2和IPC3组. 对照组仅行开腹术. 余两组大鼠PTA动物模型根据文献[5], I/R组于获取供胰前以4℃肝素冰平衡盐液(150 kU/L)灌洗20 min; IPC1组于获取供胰前阻断脾血管5 min再灌注5 min 1次; IPC2于获取供胰前阻断脾血管5 min再灌注5 min 2次; IPC3于获取供胰前阻断脾血管5 min再灌注5 min 3次, 以4℃肝素冰平衡盐液(150 kU/L)灌洗10 min, 供胰均置入4℃肝素冰平衡盐液(150 kU/Ll)保存, 各组控制冷缺血时间为180 min, 热缺血时间为15 min. 术前禁食不禁水24 h, 并im氨苄青霉素100 mg/kg. 氯氨胴100 mg/kg ip麻醉. 术后im氨苄青霉素200 mg/kg, 24 h后正常饮食. 各组大鼠于移植前2 d经尾静脉取血, 再灌注2 h后经下腔静脉取血, 用血糖监测仪测血糖; 部分血样离心(4℃, 4 000 r/min, 10 min), 上清置于-70℃冰箱保存, 用相应的试剂盒测定TNF-α(放免法, 具体操作步骤参照说明书)及NO(采用硝酸盐还原法, 具体操作步骤参照说明书). 各组大鼠于胰腺再灌注2 h后取胰组织, 部分保存于-70℃冰箱用相应试剂盒测定MPO(操作步骤见后)和SOD活性(采用黄嘌呤氧化酶法测定, 具体操作步骤参照说明书)及MDA含量(采用改良八木国夫法, 具体操作步骤参照说明书); 部分组织切成1 mm×1 mm×0.5 mm大小组织块, 用25 g/L戊二醛固定备行电镜检查; 部分组织保存于含40 g/L中性甲醛中用于HE和TUNEL染色, 光镜检查; 部分组织置入-70℃冰箱备行凋亡相关蛋白的测定.
1.2.1 胰腺组织MPO活性测定: 取胰腺组织块(0.1 g)在冰生理盐水中漂洗, 除去血液, 滤纸拭干, 称质量, 放入小烧杯内; 用普通滴管取预冷的2 mL匀浆递质(pH7.4, 0.01 mol/L蔗糖, 0.01 mol/L Tris-HCl, 0.001 mol/L EDTA2Na-溶液)置入烧杯中, 用眼科小剪尽快剪碎组织块; 将剪碎的组织倒入玻璃匀浆管中进行匀浆, 捣杆垂直插入套管中上下转动研磨数十次(6-8 min), 充分研碎, 使组织匀浆化, 将匀浆以3 000-4 000 r/min离心15 min, 取上清液0.1 mL加0.167 g/L邻联茴香胺二盐酸化物以及0.5 mL/L过氧化氢混合液2.9 mL; 恒温紫外分光光度计在460 nm处每隔15 s连续记录A值1 min, MPO活性定义为27℃平均每克胰腺组织单位时间(min)内A值的变化, 即用每分钟A/g表达MPO的活性.
1.2.2 胰腺细胞凋亡检测: 采用TUNEL法检测, 每例石蜡切片均取一张常规脱蜡入水, 用新鲜配制的体积分数为30 mL/L H2O2处理, 蒸馏水洗涤; 加以Tris缓冲盐水(TBS)1: 100新鲜稀释的蛋白酶K, 37℃10 min, 蒸馏水洗; 加含TdT和DIG-dUTP的标记缓冲液20 μL, 37℃, 2 h, TBS洗涤; 加封闭液50 μL, 室温30 min, 甩干; 加以封闭液1: 100稀释的Anti-DIG-biotin 50 μL, 37℃, 30 min, TBS洗; 加以TBS1: 100稀释的链酶亲合素-生物素-过氧化物酶复合物(SABC), 37℃, 30 min, TBS洗; 然后用3, 3-二氨基联苯胺盐酸盐(DAB)显色20 min, 蒸馏水洗; 苏木素复染, TBS洗; 脱水, 透明, 封片. 将切片置显微镜下观察, 细胞核中有棕黄色颗粒者为凋亡细胞. 每张切片光镜(20×10倍)观察10×500个细胞, 计算平均阳性细胞率, 即凋亡指数(apoptosis index, AI).
1.2.3 移植胰组织Western杂交: 取100 mg胰腺组织, 与Trizol regent 0.75 mL在匀浆器中匀浆, 匀浆后在15-30℃环境下放置5 min; 将匀浆物移入新的Eppendrof管中, 加入氯仿0.2 mL, 剧烈振摇15 s, 15-30℃环境下放置10 min, 4℃下12 000 g离心15 min, 液体分为3层, 取下层有机相, 移入新的eppendrof管中, 并加入1.5 mL异丙醇, 混匀后室温放置10 min, 4 ℃下12 000 g离心15 min; 弃去上清, 加入950 mL/L乙醇2 mL溶解的0.3 mol/L盐酸胍, 室温放置20 min, 4 ℃下7 500 g离心5 min后弃上清, 重复洗3次, 然后加入无水乙醇2 mL, Vortex混匀, 室温放置20 min, 4 ℃下7 500 g离心5 min后弃上清; 蛋白沉淀用真空干燥, 然后溶于SDS溶液30 mL. 每管蛋白样品中加入2×loading buffer 30 μL, 经120 g/LSDS聚丙烯酰凝胶电泳, 凝胶上的蛋白用100 V转移3 h至硝酸纤维膜上, 50 g/L脱脂奶粉室温封闭2 h; 依次加入相应的1: 1 000稀释的兔抗鼠一抗, Western杂交4℃孵育过夜; 1: 2 000稀释的HRP标记的羊抗兔二抗作用2 h, 加入luninol试剂, 并以X-光片捕捉HRP催化luninol试剂所产生的激发光.
1.2.4 组织切片并镜检: 将用25 g/L戊二醛液固定的胰组织取出, 用PBS液洗10 min 3次, 锇酸后固定1 h, 再次PBS洗10 min 3次, 丙酮梯度脱水, 每级10 min, 环氧树酯丙酮混合液浸泡4 h, 再用纯环氧树脂包埋液浸泡4 h, 环氧树脂包埋液包埋成块, 超薄切片(厚500-700 nm), 铅铀双重染色透射电镜观察、照片.
统计学处理 数据资料以均数北曜疾(mean±SD)表示. 组间显著性差异用方差分析. P<0.05为有统计学显著差异.
I/R组(19.6±1.8 vs 16.5±1.4 mmol/L, P<0.05)、IPC1组(20.2±2.2 vs 14.3±1.1 mmol/L, P<0.01)、IPC2组(19.4±1.6 vs 12.1±0.9 mmol/L, P<0.01)和 IPC3组(20.1±2.0 vs 14.7±1.3 mmol/L, P<0.01)较再灌注前血糖即下降. 再灌注后IPC1组(14.3±1.1 vs 12.1±0.9 mmol/L, P<0.05)和 IPC3组(14.7±1.3 vs 12.1±0.9 mmol/L, P<0.05)较I/R组血糖低; IPC2组较I/R组(12.1±0.9 vs 16.5±1.4 mmol/L, P<0.01)、IPC1组(12.1±0.9 vs 14.3±1.1 mmol/L, P<0.05)和IPC3组(12.1±0.9 vs 14.7±1.3 mmol/L, P<0.05)血糖低, IPC1组和IPC3组血糖变化无明显差异. 对照组腺组织结构正常, 无中性粒细胞浸润. IPC2组腺组织结构尚正常, 但小叶间质水肿, 可见少量中性粒细胞浸润. I/R组胰小叶间隙增宽, 间质血管扩张充血, 大量中性粒细胞浸润, 小叶结构有部分破坏. IPC1组和IPC3组腺组织结构差别不大, 其损伤程度介于I/R组和IPC1组之间. 在透射电镜下I/R组、IPC1组、IPC2组和IPC3组均可见细胞固缩; 染色质浓聚, 裂解, 边集; 胞浆内"小泡"及"凋亡小体"形成.
I/R组、IPC1组、IPC2组和IPC3组较对照组再灌注后2 h血清中TNF-α含量升高、NO含量下降; 再灌注后IPC1组、IPC2组和 IPC3组较I/R组血清中TNF-α含量高、NO含量低; IPC2组再灌注后血清中TNF-α含量低于、NO含量高于IPC1组和 IPC3组; IPC1组和 IPC3组TNF-α和NO含量变化无明显差异(表1).
| 分组 | TNF-α(kU/L) | NO(mg/L) | MPO(A/g) | SOD(mU/g) | MDA(mmol/g) |
| 对照组 | 0.62±0.12 | 21.45±3.43 | 0.31±0.12 | 241.43±23.45 | 0.37±0.14 |
| I/R组 | 1.79±0.25b | 8.91±1.23b | 0.96±0.34b | 153.47±17.67b | 0.87±0.31b |
| IPC1组 | 1.41±0.17d | 13.13±2.87d | 0.81±0.23d | 179.82±19.54d | 0.70±0.26d |
| IPC2组 | 1.05±0.16af | 18.79±2.39af | 0.51±0.16af | 213.64±22.97af | 0.46±0.18af |
| IPC3组 | 1.43±0.20d | 14.36±1.78d | 0.78±0.22d | 181.68±20.32d | 0.67±0.15d |
I/R组、IPC1 组、IPC2组和IPC3组较对照组再灌注后2 h胰腺组织中SOD活性低, MDA活性和MPO含量高再灌注后IPC1组IPC2组和IPC3组较I/R组胰腺组织中SOD活性高、MPO活性和MDA含量低; IPC2组再灌注后胰腺组织中SOD活性低于、MDA活性和MPO含量高于I/R组、IPC1组和IPC3组; IPC1组和IPC3组SOD活性、MPO活性和MDA含量无明显差异(表1).
I/R组、IPC1组、IPC2组和IPC3组相对于对照组再灌注后2 h胰腺组织中AI值升高. IPC2组再灌注后胰腺组织中AI值相对于I/R组、IPC1组和IPC3组低; IPC1组和IPC3组再灌注后胰腺组织中AI值相对于I/R组高; IPC1组和IPC3组AI值无明显差异(图1).
取各组供胰组织100 mg提取蛋白后, 经120 g/LSDS聚丙烯酰凝胶电泳, 然后电转移至硝酸纤维膜上, 分别用兔抗鼠Bcl-2和Bax多抗进行Western blot (以actin为内对照). 结果显示, I/R组再灌注后移植胰组织P53蛋白表达, Bcl-2蛋白低表达; IPC各组再灌注后移植胰组织Bax蛋白低表达, Bcl-2蛋白高表达; 而IPC2组Bcl-2蛋白表达最高, Bax蛋白表达最低(图2, 3).
正常细胞内每天能产生大量的氧自由基, 虽然其在细胞代谢过程中连续不断地产生, 但由于机体内存在防御系统, 氧自由基可被SOD、过氧化氢酶及过氧化物酶等所破坏而清除. I/R后, 炎性细胞、内皮细胞和肌细胞释放的氧自由基可以触发细胞坏死与凋亡[6]. 我们发现IPC可有效的减少移植胰脂质过氧化物MDA的产生, 同时内源性氧自由基清除剂SOD的活性增加, 说明IPC通过提高SOD的活性清除I/R过程中产生的氧自由基, 减轻其对移植胰的损伤, 从而达到保护移植胰功能的作用. 内源性NO具有调节血管张力、血压、器官血流量、血小板功能及改善微循环等作用, 应用NO前体可以减轻I/R损伤[7], 反之应用NOS阻滞剂则可以阻断IPC的保护作用[8], 在经典的IPC中NO可能是通过清除氧自由基、抑制PMNs黏附与聚集、减轻TNF-α对内皮细胞的损害和激活PKC来发挥其保护作用的. 我们发现移植后I/R组和IPC组血清中NO的含量均减少, 但IPC组NO的含量明显高于I/R组, 说明IPC可能通过增加内源性NO的合成来发挥其对移植胰I/R损伤的保护作用. TNF-α具有多种促炎症作用, 可增强促凝活动和纤维蛋白沉积[9], 从而增加PMNs向病变部位黏附、聚集和活化[10], 引起移植胰的损伤. 本实验发现移植后I/R组和IPC组血清中TNF-α的含量均增加, 但IPC组TNF-α的含量明显低于I/R组, 说明IPC可能通过下调TNF-α减轻移植胰I/R介导的损伤. I/R后PMNs在胰腺组织的黏附、聚集和激活可引起微循环障碍[11], 同时释放IL-1β、IL-2和TNF-α等细胞因子介导器官损伤[12], MPO是PMNs内含量相对恒定的酶, 其活性的高低可以反映PMNs在组织中的聚集程度, 我们发现移植后I/R组和IPC组移植胰组织中MPO活性均增加, 但IPC组MPO活性显著低于I/R组, 说明IPC能减轻移植胰I/R引起的PMNs黏附与聚集及活化对胰细胞的损害. 综上所述, 在胰腺移植时, IPC可能是通过提高SOD的活性、增加内源性NO的合成、下调TNF-α和减轻PMNs黏附、聚集及活化来减轻移植胰I/R损伤.
研究表明I/R损伤可导致细胞凋亡[13], I/R后随着PMNs聚集的增加凋亡细胞也不断地增加[14], 在犬的I/R损伤模型中, PMNs聚集与凋亡细胞的发生率成线性关系[15], 此时, 前炎性递质、氧自由基及PNMs释放的各种细胞因子被认为诱导了凋亡[16], 我们发现IPC可以显著降低移植胰组织的MPO活性, SOD的活性增加, 同时细胞凋亡现象显著减少, 表明: IPC可以减少移植胰I/R后的细胞凋亡, 其机制之一可能与减少PMNs聚集和氧自由基有关. Bcl-2家族蛋白是在细胞凋亡过程中起关键性作用的一类蛋白质. 在线粒体上, Bcl-2家族蛋白通过与其他凋亡蛋白的协同作用, 调控线粒体结构与功能的稳定性, 发挥着细胞凋亡"主开关"的作用, Bcl-2家族包括两类蛋白质: 一类是抗凋亡蛋白, 另一类是促凋亡蛋白. 在细胞凋亡时, Bcl-2家族中的促凋亡蛋白成员发生蛋白质的加工修饰, 易位到线粒体的外膜上, 引起细胞色素C、凋亡诱导因子等其他促凋亡因子的释放, 导致细胞凋亡; 而平时被隔离在线粒体等细胞器内的该家族的抗凋亡蛋白成员则抑制细胞色素C和凋亡诱导因子等促凋亡因子的释放, 具有抑制细胞凋亡的功能, 一旦这类抗凋亡蛋白成员与激活的促凋亡蛋白发生相互作用后, 便丧失了对细胞凋亡的抑制作用, 造成线粒体等细胞器的功能丧失和细胞器内促凋亡因子的释放, 导致细胞凋亡. Maulik et al[17-18]发现IPC可通过上调Bcl-2和下调P53的表达来显著地减少细胞凋亡, 而这些效应与炎性反应无关. Baghelai et al[19]认为, 早期的IPC不能改变以后Bcl-2的表达, 但是能显著地下调Bax蛋白表达, Bcl-2和Bax蛋白表达比率的增高可减少细胞凋亡. Bcl-2和bax蛋白的比率增加可以抑制线粒体释放细胞色素C[20]是IPC减少细胞凋亡的重要机制. 本实验发现: I/R组再灌注后移植胰组织P53蛋白高表达, Bcl-2蛋白低表达, IPC各组再灌注后移植胰组织虽P53蛋白低表达, Bcl-2蛋白高表达, 而IPC2组Bcl-2蛋白表达最高, P53蛋白表达最低, 提示IPC可能通过上调Bcl-2和下调P53蛋白来减少移植胰细胞凋亡, 从而起到保护移植胰的作用. 我们通过对大鼠胰腺不同方法的IPC研究发现, 缺血5 min再灌注5 min 1, 2和3次都可以对移植胰起到保护作用, 但缺血5 min再灌注5 min 2次的保护作用更为强烈, 表现在组织学、内分泌功能的恢复、细胞凋亡和脂质过氧化程度的减轻等方面.
编辑: 张海宁 电编: 潘伯荣
| 1. | Gross GJ, Fryer RM. Sarcolemmal versus mitochondrial ATP-sensitive K+ channels and myocardial preconditioning. Circ Res. 1999;84:973-979. [PubMed] |
| 2. | Zhao M, Chen Y, Li Y. Changes of apoptosis and Fas gene expression in cardiomyocytes of rats with myocardial reperfusion and the effects of ischemic preconditioning. Zhonghua Neike Zazhi. 1999;38:753-756. [PubMed] |
| 3. | Rudiger HA, Kang KJ, Sindram D, Riehle HM, Clavien PA. Comparison of ischemic preconditioning and intermittent and continuous inflow occlusion in the murine liver. Ann Surg. 2002;235:400-407. [PubMed] |
| 4. | Shake JG, Peck EA, Marban E, Gott VL, Johnston MV, Troncoso JC, Redmond JM, Baumgartner WA. Pharmacologically induced preconditioning with diazoxide: a novel approach to brain protection. Ann Thorac Surg. 2001;72:1849-1854. [PubMed] |
| 6. | Thourani VH, Nakamura M, Duarte IG, Bufkin BL, Zhao ZQ, Jordan JE, Shearer ST, Guyton RA, Vinten-Johansen J. Ischemic preconditioning attenuates postischemic coronary artery endothelial dysfunction in a model of minimally invasive direct coronary artery bypass. J Thorac Cardiovasc Surg. 1999;117:383-389. [PubMed] |
| 7. | Brunner F, Maier R, Andrew P, Wolkart G, Zechner R, Mayer B. Attenuation of myocardial ischemia/reperfusion injury in mice withmyocyte-specific overexpression of endothelial nitric oxide synthase. Cardiovasc Res. 2003;57:5562. [PubMed] |
| 8. | Loucks EB, Godin DV, Walley KR, McManus BM, Rahimian R, Granville DJ, Hong JM, Aktary FM, Qayumi AK. Role of platelet activating factor in cardiac dysfunction, apoptosis and nitric oxide synthase mRNA expression in the ischemic-reperfused rabbit heart. Can J Cardiol. 2003;19:267-274. [PubMed] |
| 9. | Lichtman SN, Lemasters JJ. Role of cytokines and cytokine producing cells in reperfusion injury to the livers. Semin Liver Dis. 1999;19:171-187. [PubMed] |
| 10. | Shibuya H, Ohkohchi N, Tsukamota S, Satomi S. Tumor necrosis factor induced superoxide-mediated neutrophil accmul-ation in cold ischemic/reperfused rat liver. Hepatology. 1997;26:113-120. [PubMed] |
| 11. | Obermaier R, Benz S, Von Dobschuetz E, Drognitz O, Schareck W, Jonas L, Messmer K, Hopt UT. Characterization of microcirculatory disturbance in a novel model of pancreatic ischemia-reperfusion using intravital fluorescence-microscopy. Pancreas. 2002;25:142-148. [PubMed] |
| 12. | Fink GW, Norman JG. Intrapancreatic interleukin-1beta gene expression by specific leukocyte populations during acute pancreatitis. J Surg Res. 1996;63:369-373. [PubMed] |
| 13. | Gottlieb RA, Burleson KO, Kloner RA, Babior BM, Engler RL. Reperfusion injury induces apoptosis in rabbit cardiomyocytes. J Clin Invest. 1994;94:1621-1628. [PubMed] |
| 14. | Nakamura M, Wang NP, Zhao ZQ, Wilcox JN, Thourani V, Guyton RA, Vinten-Johansen J. Preconditioning decreases Bax expression, PMN accumulation and apoptosis in reperfused rat heart. Cardiovasc Res. 2000;45:661-670. [PubMed] |
| 15. | Zhao ZQ, Velez DA, Wang NP, Hewan-Lowe KO, Nakamura M, Guyton RA, Vinten-Johansen J. Progressively developed myocardial apoptotic cell death during late phase of reperfusion. Apoptosis. 2001;6:279-290. [PubMed] |
| 16. | Yang JJ, Kettritz R, Falk RJ, Jennette JC, Gaido ML. Apoptosis of endothelial cells induced by the neutrophil serine proteases proteinase 3 and elastase. Am J Pathol. 1996;149:1617-1626. [PubMed] |
| 17. | Maulik N, Sasaki H, Addya S, Das DK. Regulation of cardiomyocyte apoptosis by redox-sensitive transcription factors. FEBS Lett. 2000;485:7-12. [PubMed] |
| 18. | Maulik N, Engelman RM, Rousou JA, Flack JE 3rd, Deaton D, Das DK. Ischemic preconditioning reduces apoptosis by upregulating anti-death gene Bcl-2. Circulation. 1999;100:II369-375. [PubMed] |
| 19. | Baghelai K, Graham LJ, Wechsler AS, Jakoi ER. Delayed myocardial preconditioning by a1-adrenoceptors involves inhibition of apoptosis. J Thorac Cardiovasc Surg. 1999;117:980-986. [PubMed] |