修回日期: 2005-02-21
接受日期: 2005-03-03
在线出版日期: 2005-04-01
目的: 简化富含RNA酶组织RNA的抽提方法.
方法: 健康SD大鼠10只, 随机分成液氮组及改良组, 每组5只, 用乙醚麻醉后, 分别取胰腺组织约50 mg, 液氮组组织迅速放入液氮中, 改良组组织放入一预装RNAguard 100 μL的1.5 mL EP管中, 放入-70℃冰箱保存. 液氮组将胰腺组织从液氮中取出, 立即放入预装适量液氮的研钵中迅速研磨至粉末(研磨过程中始终保持研钵内有适量液氮), 移入另一1.5 mL EP管中, 加入1 mL Trizol, 按Trizol法提取总RNA; 改良组取眼科剪在酒精灯上消毒后冷却, 从-70℃冰箱中取出冻存的组织, 在冰盒上, 加入1 mL Trizol, 用眼科剪迅速剪切3 min(剪切过程组织不解冻), 剧烈振荡混匀30 s, 以后步骤按Trizol法.
结果: 改良法抽提RNA的效果与液氮研磨法无显著差异(P>0.05), 但方法简单方便.
结论: 改良法提取RNA简单方便, 结果稳定, 值得推广应用.
引文著录: 张传仓, 刘卫鹏, 朱德新, 杜江, 封志纯. 富含RNA酶组织总RNA提取方法的改良. 世界华人消化杂志 2005; 13(6): 797-799
Revised: February 21, 2005
Accepted: March 3, 2005
Published online: April 1, 2005
N/A
- Citation: N/A. N/A. Shijie Huaren Xiaohua Zazhi 2005; 13(6): 797-799
- URL: https://www.wjgnet.com/1009-3079/full/v13/i6/797.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i6.797
RNA的提取是分子生物学中最常用到的基础操作之一, 但由于mRNA分子的结构特点, 容易受RNA酶的攻击反应而降解, 加上RNA酶极为稳定且广泛存在, 因此, 如何抑制RNA酶的活性, 成为RNA提取过程中的关键. 常规的组织或细胞RNA提取方法, 对提取RNA的环境、使用的物品等提出了较高的要求, 以避免外源性的RNA酶的污染, 但是在肝脏、胰腺、心肌等内脏组织中, 由于含有大量内源性的RNA酶, 常规的方法根本无法完全抑制其活性, 常常在组织匀浆的过程中, RNA即完全降解. 液氮研磨法的出现, 使这一问题得以解决. 但是, 该法操作非常复杂, 我们对该方法进行了改良, 大大简化了操作程序. 现介绍如下:
健康SD大鼠10只, 雌雄不拘, 体重150-200 g, 购自南方医科大学实验动物中心, Trizol(申能博彩生物科技有限公司), 氯仿/异丙醇(24/1)(申能博彩生物科技有限公司), 焦碳酸二乙酯(DEPC, Sigma), 75%酒精(DEPC处理), RNAguard(上海华舜生物工程有限公司), β-actin引物(北京赛百盛公司合成), DNA Marker(Promega), RT-PCR试剂盒(GIBCO), 液氮, 3-(N-玛琳代)丙磺酸(Sigma), 琼脂糖, UV-9100紫外分光光度仪、电热干燥箱、低温离心机、-70℃冰箱、电泳仪、电子天平、研钵、冰盒(300 mL/L的乙醇溶液放入-70℃冰箱).
SD大鼠10只随机分成两组(液氮组及改良组), 每组5只, 用乙醚麻醉后, 于胰腺的同一部位(胰头)分别取组织约50 mg, 液氮组组织迅速放入液氮中, 改良组组织放入一预装RNAguard 100 μL的1.5 mL EP管中, 放入-70℃冰箱保存.
1.2.1 液氮法RNA提取程序: 将胰腺标本从液氮中取出, 立即放入预装适量液氮的研钵中迅速研磨至粉末(研磨过程中始终保持研钵内有适量液氮), 移入一1.5 mL EP管中, 加入1 mL Trizol, 剧烈振荡混匀30 s; 加入200 μL氯仿/异戊醇(24/1), 剧烈振荡混匀15 s; 12 000 g室温离心15 min; 上清转入另一1.5 mL EP管中, 加入等体积异丙醇, 颠倒混匀, 室温下放置5 min, 12 000 g离心5 min; 小心倒去上清, 防止沉淀丢失, 加入700 μL 750 mL/L的乙醇, 颠倒混匀, 7 500 g离心5 min, 弃上清; 重复洗涤一次; 在滤纸上沾干残留部分, 室温晾干10 min, 加100 μL无RNA酶水溶解. 取10 μL用无RNA水稀释后测A260及A280, 做RNA琼脂糖变性胶电泳及β-actin RT-PCR.
1.2.2 改良法RNA提取程序: 眼科剪在酒精灯上消毒后冷却, 从-70℃冰箱中取出冻存的组织, 放在冰盒中, 加入1 mL Trizol, 用眼科剪迅速剪切3 min(剪切过程组织不解冻), 剧烈振荡混匀30 s; 加入200 μL氯仿/异戊醇(24/1), 以后步骤同液氮法.
1.2.3 RT-PCR
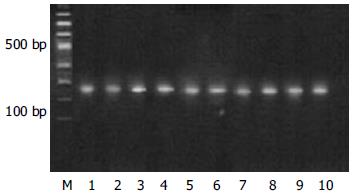
1.2.3.1 大鼠β-actin引物序列[1] (上游: 5'-CAC GAT GGA GGG GCC GGA CTC ATC-3'; 下游: 5'-TAA AGA CCT CTA TGC CAA CAC AGT-3'; PCR产物长度为 240 bp).
1.2.3.2 cDNA第一链的合成 取一0.5 mL EP管, 依次加入下列组分: 总RNA 1ng-5 μg、下游引物(10 μmol/L)0.5 μL、10 mmol/L dNTP 1 μL、无菌双蒸水补至12 μL, 加热到65℃ 5 min, 冰浴1 min, 短暂离心; 加入下列组分: 5×First-Strand Buffer 4 μL、0.1 mmol/L DTT 2 μL、RNA inhibitor(40 kU/L)1 μL, 轻轻混合以上组分, 37℃孵育2 min. 加入M-MLV RT 1 μL, 用移液管轻轻吹打混匀, 达总体积20 μL, 37℃孵育50 min, 继加热到70℃ 15 min终止反应.
1.2.3.3 PCR反应 取一0.5 mL EP管, 依次加入下列组分: 10×PCR Buffer 2 μL、10 mmol/L dNTP 0.5 μL、上下游引物(10 μmol/L)各0.5 μL、cDNA 1 μL、无菌双蒸水15 μL、Pfu DNA Polymerase 0.5 μL, 总体积20 μL, 混匀后短暂离心. 反应条件: 95℃ 3 min, 95℃ 30 s, 57℃ 30 s, 72℃ 30 s, 30个循环; 最后 72℃延伸10 min. 取PCR产物5 μL在14 g/L的琼脂糖凝胶(含溴化乙锭1 mg/L)上电泳.
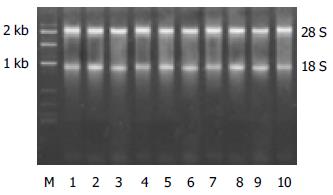
统计学处理 两种方法提取的RNA量(μg)、A260/A280比值及RNA琼脂糖变性胶电泳28S/18S比值的比较采用SPSS11.5统计软件进行t检验.
| 样品 | RNA量(mg) | A260/A280比值 | 28S/18S | |||
| 液氮组 | 改良组 | 液氮组 | 改良组 | 液氮组 | 改良组 | |
| 1 | 76.5 | 87.6 | 1.85 | 1.76 | 1.84 | 1.96 |
| 2 | 121.0 | 134.5 | 1.79 | 1.97 | 1.98 | 1.89 |
| 3 | 154.3 | 127.2 | 1.96 | 1.88 | 1.56 | 1.75 |
| 4 | 106.7 | 94.0 | 2.04 | 1.82 | 1.66 | 1.69 |
| 5 | 95.5 | 62.1 | 1.89 | 1.95 | 1.89 | 1.88 |
| 均数 | 110.8 | 101.1 | 1.91 | 1.88 | 1.79 | 1.83 |
| t值 | 0.521 | 0.512 | 0.525 | |||
| P值 | 0.617 | 0.622 | 0.614 | |||
改良法提取的RNA量略少于液氮法, 但未见统计学差异(P = 0.617), A260/A280(P = 0.622)及28S/18S(P = 0.614)比值亦未见显著差异.
两种方法提取的总RNA变性胶电泳时, 均可见清晰的28S及18S条带; 大鼠β-actin RT-PCR产物电泳结果, 均有清晰的β-actin(约240 bp)条带, 未见非特异性产物.
对大部分研究者来说, RNA抽提比基因组DNA抽提要困难得多. 事实上, 现有的RNA抽提方法, 如果用于从培养细胞中抽提RNA, 比抽提基因组DNA更方便, 成功率也更高. 但用于组织RNA的抽提, 困难就比较大.
组织RNA抽提失败最常见的原因有两个: RNA降解和组织内杂质的残留, 而前者则是重中之重. 现有的RNA抽提试剂, 都含有快速抑制RNA酶的成分. 在培养细胞中加入裂解液, 简单的振荡, 即可使所有的细胞与裂解液充分混匀, 细胞被彻底裂解. 细胞被裂解后, 裂解液中的有效成分立即抑制住细胞内的RNA酶, 所以RNA得以保持完整[2-4]. 而组织中的细胞不容易迅速与裂解液充分接触, RNA酶的活性也就无法得到迅速充分的抑制. 因此, 如果在抑制RNA活性的同时使组织充分裂解, 降解问题也就可以彻底解决了. 液氮碾磨法[5]的出现, 从根本上解决了这一问题. 组织在液氮中研磨的过程中, RNA酶在低温环境中被完全抑制. 但是, 液氮碾磨方法非常麻烦, 特别是碰到样品数比较多的时候更是如此. 研究者不仅要把庞大的研钵进行高温处理, 以灭活RNA酶, 还要不厌其烦地取用液氮, 一不小心就可能面临被液氮冻伤的危险, 而且, 一旦液氮添加不及时, 组织就会化冻, 导致RNA提取失败. 有人采用电动匀浆器的方法[6-7], 期望利用其破碎组织的速度将组织在RNA被大量降解前被匀浆, 但匀浆器方法并不能杜绝降解现象, 而且, 很重要的一点, 必须有电动匀浆器.
面对以上问题, 我们在实验过程中, 对富含RNA酶组织总RNA抽提的方法进行了改良.首先, 我们找到了一种保存组织的有效试剂-RNAguard. RNAguard是一种组织内源核酸酶的抑制剂, 能快速抑制样品中的内源核酸酶活性, 确保动物组织/细胞中的RNA在 37℃ 1 d不降解, 25℃ 1 wk不降解, 4℃ 1 mo不降解, -20℃ 1 a以上不降解. RNAguard适用的样品包括: 动物组织, 培养细胞, 昆虫, 及部分植物组织. 经过RNAguard处理的样品可以用几乎所有常用的RNA方法/试剂抽提RNA, 所有的操作与用新鲜组织没有什么不同(见RNAguard试剂说明书). 我们将组织取出后, 浸泡在适量RNAguard中, 并迅速在-70℃冰箱中冻存, 基本上保证了组织内RNA不被降解, 以后随便什么时候做都可以, 非常方便. 而且, RNAguard非常便宜. 对于每个样品, RNAguard的用量不能太多(本实验中用100 μL), 多了会影响裂解液的效果. 但这个用量, 在常温下无法保证RNA酶被完全抑制, 必须将样品放入-70℃冰箱中冻存才能达到理想的效果.
组织的匀浆过程, 是RNA提取成功与否的关键步骤, 而彻底匀浆是提高获得率和降低降解的关键. 我们采取了以下措施: (1)在-70℃冰箱中制作含有300 mL/L乙醇溶液的冰盒: 因为在普通冰箱中制作的冰盒, 温度不够低, 无法保证组织在加入裂解液后不溶化; 冰盒中含有300 mL/L的乙醇一方面可以使冰松软, EP管可以插入, 以达到更好的冷冻效果, 另一方面, 乙醇可以有效抑制局部环境中的RNA酶, 防止操作过程中的外源性污染. (2)用于组织剪切的眼科剪在使用前, 必须放在酒精灯上充分灼烧, 并完全冷却后使用. (3)剪切要迅速、充分, 时间约需3-5 min, 直至组织成均一的混悬液. (4)通过控制EP管插入冰中的时间, 保持组织既不溶解, 裂解液也不被冻结. 当然, 如果有条件, 用电动匀浆器会比手工剪切效果更好.
总之, 改良法在很大程度上简化了组织RNA抽提的过程, 而且非常稳定, 即使是从富含RNA酶的组织中提取RNA, 其提取效率及RNA的完整性也可以达到理想的效果, 值得推广应用.
编辑: 张海宁
| 2. | 王 晓谦. 大鼠心肌总RNA的提取. 河南科技大学学报(医学版). 2004;22:85-86. |
| 3. | Chirgwin JM, Przybyla AE, MacDonald RJ, Rutter WJ. Isolation of biologically active ribonucleic acid from sources enriched in ribonuclease. Biochemistry. 1979;18:5294-5299. [PubMed] |
| 4. | Samuelson LC, Keller PR, Darlington GJ, Meisler MH. Glucocorticoid and developmental regulation of amylase mRNAs in mouse liver cells. Mol Cell Biol. 1988;8:3857-3863. [PubMed] |
| 5. | Gadbois DM, Salo WL, Ann DK, Downing SW, Carlson DM. The preparation of poly(A)+ mRNA from the hagfish slime gland. Prep Biochem. 1988;18:67-76. [PubMed] |