修回日期: 2005-01-15
接受日期: 2005-01-20
在线出版日期: 2005-03-15
目的: 构建表达抗乙型肝炎病毒核心蛋白单链抗体(抗HBc ScFv)的复制缺陷型腺病毒载体, 并检测其能否在真核细胞中有效表达目的基因.
方法: 采用DNA重组技术将特异性人源性抗HBc单链抗体基因克隆于腺病毒穿梭质粒pAdTrack-CMV, 与5型腺病毒骨架质粒pAdeasy-1共转染BJ5183细菌, 经细菌内同源重组产生携带抗HBc ScFv基因的重组腺病毒载体pAd-ScFv, 经脂质体法转染293细胞, 包装产生携带抗HBc ScFv基因的重组腺病毒Ad-ScFv, 体外转染HepG2细胞, PCR和ELISA法检测目的基因及其表达.
结果: 构建了表达抗HBc ScFv基因的复制缺陷型腺病毒, 病毒滴度达4×1015PFU/L, 并能在真核细胞中有效表达目的基因.
结论: 成功构建表达抗HBc ScFv的复制缺陷型腺病毒载体, 为进一步开展抗HBc ScFv在抗HBV基因治疗中的作用研究提供实验基础.
引文著录: 汤正好, 马会慧, 臧国庆, 余永胜, 李刚, 姚集鲁. 抗HBc-ScFv基因复制缺陷型腺病毒载体的构建及其体外表达. 世界华人消化杂志 2005; 13(6): 734-738
Revised: January 15, 2005
Accepted: January 20, 2005
Published online: March 15, 2005
AIM: To construct recombinant adenoviral vector carrying anti-HBc ScFv gene and to express the gene efficiently in eukaryotic cells.
METHODS: The gene of human variable region of single chain antibody against hepatitis B virus core antigen (anti-HBc ScFv) was amplified by polymerase chain reaction(PCR)and was cloned into adenoviral shuttle vector pAdTrack-CMV. Then, the recombinant vector pAdTrack-CMV-ScFv was linearized by digesting with restriction endonuclease Pme I, and co-transformed into E. coli BJ5183 cells with adenoviral backbone plasmid pAdeasy-1. The recombinant adenoviral plasmid pAd-ScFv was obtained by homologous recombination in bacteria and then transfected into 293 cells for packaging of recombinant adenovirus Ad-ScFv. Finally, HepG2 cells were infected with the adenoviruses and anti-HBc ScFv was detected by PCR and ELISA in vitro.
RESULTS: The titer of recombinant adenovirus Ad-ScFv was up to 4×1015 PFU/L in infected 293 cells. Anti-HBc ScFv was expressed efficiently in HepG2 cells after infection.
CONCLUSION: The recombinant adenovirus Ad-ScFv expressing anti-HBc ScFv has been constructed successfully, which can be used in study of gene therapy for HBV.
- Citation: Tang ZH, Ma HH, Zang GQ, Yu YS, Li G, Yao JL. Construction and expression of replication-deficient recombinant adenoviral vector carrying anti-HBc ScFv gene. Shijie Huaren Xiaohua Zazhi 2005; 13(6): 734-738
- URL: https://www.wjgnet.com/1009-3079/full/v13/i6/734.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i6.734
重组复制缺陷型腺病毒作为基因治疗和蛋白表达载体, 已经成为基因治疗研究中应用最为广泛的载体之一[1-4]. 我们采用一种新的细菌内同源重组系统[5], 构建携带增强型绿色荧光蛋白(enhanced green fluorescent protein, EGFP)基因和抗乙型肝炎病毒核心蛋白单链抗体(抗HBc ScFv)基因的重组复制缺陷型腺病毒, 并检测他在真核细胞中的表达, 旨在为抗HBc ScFv的进一步研究及开展慢性乙型肝炎的抗病毒基因免疫治疗提供实验基础.
携带EGFP基因的腺病毒穿梭质粒pAdTrack-CMV, E1区和E3区缺失的复制缺陷5型腺病毒骨架质粒pAdeasy-1, 大肠杆菌BJ5183, 293细胞和HepG2细胞株由深圳宝安中心血站黄呈辉博士惠赠. 重组质粒pHEN1-ScFv[6-7], 大肠杆菌XL1Blue和大肠杆菌DH10B由中山大学附属第三医院传染科实验室保留. pfu DNA聚合酶、限制性内切酶Hind III、Xba I为Promega公司产品; Pme I和Pac I为New England Labs公司产品; Taq DNA聚合酶、dNTP、T4 DNA连接酶为Takara公司产品. 胶回收试剂盒为Gibco公司产品; 质粒抽提试剂盒为Omega公司产品; 高纯度质粒抽提试剂盒购自Roche公司; 抗myc抗体(9E10)购自博士德公司. 辣根过氧化物酶标记的羊抗鼠抗体、羊抗人抗体IgG购自华美生物工程公司; 丙稀酰胺、甲叉双丙稀酰胺和TEMED为Promega公司产品; 过硫酸铵为Gibco公司产品. DMEM培养基、胎牛血清购自Hyclone公司; 真核细胞转染试剂jetPEI为法国PolyPlus公司产品.
1.2.1 腺病毒穿梭载体pAdTrack-CMV-ScFv的构建: 设计并合成带有Hind III和Xba I酶切位点的引物: P1: G ATT AAG CTT ATG GCC GAG GTG CAG CTG, P2: GTG TCT AGA CTA TGC GGC CCC ATT CAG . 重组质粒pHEN1-ScFv 100倍稀释, 以此为模板扩增带有Hind III和Xba I酶切位点的抗-HBc ScFv基因. PCR反应条件: 94℃ 5 min, 94℃ 30 s, 58℃ 1 min, 72℃ 1 min, 共32个循环. 胶回收试剂盒回收PCR产物. 将获得的抗-HBc ScFv基因的PCR纯化产物和穿梭质粒pAd-Track-CMV分别以Hind III和Xba I进行双酶切并纯化. 纯化后进行连接反应. pAd-Track-ScFv连接产物化学法转化感受态大肠杆菌XLI Blue. pAd-Track-ScFv转化菌涂LBK平板(含卡那霉素50 mg/L).37℃培养过夜. 培养克隆经提取质粒, 筛选阳性重组质粒, 并进行PCR和酶切鉴定.
1.2.2 腺病毒穿梭质粒pAdTrack-CMV-ScFv和骨架质粒pAd-Easy-1在大肠杆菌BJ5183内同源重组构建pAd-ScFv腺病毒载体: 阳性克隆经37℃ 250 r/min过夜培养后, 提取重组质粒pAd-Track-ScFv, 取0.1-0.5 μg的pAdTrack-CMV-ScFv质粒, PmeⅠ酶切线性化后溶解于6 μL无菌水中, 与1 μL(0.1 μg)pAdEasy-1质粒一起加入到20 μL电穿孔感受态大肠杆菌BJ5183中, 混匀后加入预冷的2.0 mm电转化杯中, 冰浴5 min, 在2.5 kV/200Ω/25 μf条件下电转化, 菌液在SOC培养液1 mL中37℃孵育10-20 min, 涂4个含25 mg/L卡那霉素的LB平板, 37℃过夜培养16-20 h, 挑选10-24个小菌落, 碱裂解法小提质粒, 7 g/L琼脂糖凝胶电泳, 挑选质粒大小大于pAdEasy-1的质粒, 并用PacⅠ酶切鉴定, 取阳性质粒1 μL化学法转化DH10B菌, 用Roche提取试剂盒进行质粒的提取和纯化.
1.2.3 重组腺病毒Ad-ScFv的包装: 转染前1 d, 在T-25培养瓶中接种2×106 293细胞, 至转染时细胞约为50%-70%汇合度. 取质粒pAd-ScFv 4 μg, 用PacⅠ酶切, 酚/氯仿抽提, 乙醇沉淀, 溶于无菌去离子水溶于40 μL无菌去离子水中, 加入150 mmol/L的NaCL210 μL. 同时将转染试剂jetPEI 10 μL加入240 μL 150 mmol/L NaCL中; 混匀后, 将jetPEI/NaCL溶液250 μL加入DNA/NaCL溶液250 μL中, 立即混匀混合物并瞬时离心; 室温放置15-30 min; 将jetPEI/DNA混合液500 μL以点滴的方式加于细胞培养液, 轻轻旋动细胞瓶使加入的混合物均匀分布于培养液中.24 h后通过荧光倒置显微镜观察绿色荧光蛋白EGFP的表达情况. 转染后每天观察EGFP的表达和细胞生长情况, 待细胞出现病变时(7-10 d)收集细胞, 细胞悬液800 r/min离心5 min, 吸弃上清, 以PBS 2 mL重悬细胞沉淀, -80℃/37℃反复冻溶4次, 10 000 g离心5 min, 保留上清(含重组腺病毒). 取病毒上清1 mL再感染T-25瓶 50%-70%汇合的293细胞, 感染后3-5 d, 约50%的293细胞脱落时, 收集细胞, 按上述方法收集病毒, 再重复感染扩增1次, 收集第3代病毒进行滴度(pfu/L)测定[3].
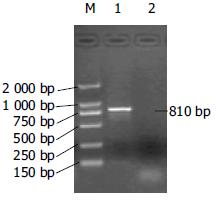
1.2.4 重组Ad-ScFv腺病毒中目的基因的PCR鉴定: 取病毒液100 μL加5 μL 25 mmol/L MgCL2, 99℃加热15 min, 12 000 g离心10 min, 取5 μL作模板进行PCR反应. 引物、PCR反应混合物及反应条件同重组质粒pAdTrack-CMV-ScFv的PCR鉴定. 扩增产物在15 g/L琼脂糖凝胶上电泳, 观察有无810 bp大小的目的片段.
1.2.5 抗HBc-ScFv目的基因在真核细胞中的表达: 取病毒上清, 按MOI为10转染HepG2细胞, 荧光显微镜下观察EGFP的表达, 转染3-5 d, 95%以上细胞出现EGFP的表达, 收集培养上清和细胞裂解物上清进行ELISA测定: 以HBcAg(10 mg/L)常规包被酶标板和封闭; 依次加入细胞培养上清或裂解物上清、抗myc抗体(1: 500稀释)、羊抗鼠IgG-HRP(1: 5 000稀释), 最后以底物TMB 显色, 450 nm波长测定光吸收(A450)值.
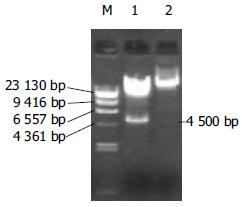
PCR扩增抗HBc-ScFv基因片段约810 bp. 双酶切后定向亚克隆到pAdTrack-CMV质粒上, 产生重组腺病毒穿梭质粒pAdTrack-CMV-ScFv, 与0.1 μg pAdEasy-1 共转化BJ5183菌, 获得数百个克隆, 挑选50-100个克隆经碱裂解法提质粒, 7 g/L琼脂糖凝胶电泳, 片段大小大于pAdEasy-1的质粒为阳性重组质粒; 用PacⅠ酶切, 阳性重组腺病毒质粒pAd-ScFv出现一条大的片段(约35 kb)和一条小的片段(4.5 kb, 图1).
取PacⅠ酶切后的质粒pAd-ScFv, 用脂质体法转染293细胞, 24 h后荧光显微镜下可见293细胞内有EGFP的表达, 其后EGFP表达逐日增多, 于转染后5 d达高峰, 7-10 d后收获病毒; 取1/3-1/2病毒上清再转染T-25瓶 50%-70%汇合的293细胞, 转染24 h后, 1/3以上细胞可见EGFP的表达, 3-5 d出现明显细胞病变(CPE). 取第3代病毒进行滴度(pfu/L)测定, 病毒滴度达4×1015pfu/L. 病毒液经PCR检测, 扩增出810 bp预计大小的片段(图2), 表明重组腺病毒基因中整合有ScFv基因.
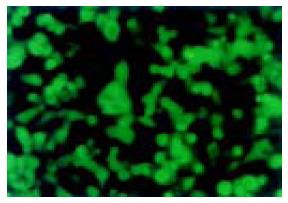
重组腺病毒Ad-ScFv感染HepG2细胞18 h后, 在荧光显微镜下观察到HepG2细胞中EGFP荧光, 可间接反映目的基因的表达(图3). 感染72 h, ELISA检测细胞培养上清和细胞裂解液中抗HBc-ScFv A值分别为0.610和1.030(C. O = 0.255).
细胞内抗体(Intracellular antibody)[8-11]是利用基因工程技术在非淋巴细胞内表达具有生物学活性的抗体, 他可通过特异性干扰或阻碍细胞内某些生物大分子的活性或功能, 改变细胞的一系列生物过程. 根据细胞内抗体所针对的靶分子在细胞内存在的位置, 还可在抗体的N端或C端连接一个信号肽, 将抗体定向滞留于细胞的不同部位如内质网或细胞核等[12]. ScFv是一种小分子抗体, 由于其分子质量小, 结构简单, 易于基因工程改造, 且具有和天然抗体相似的亲和力等多种特点, 因而成为胞内抗体技术最常用的抗体形式[13-16]. 利用细胞内表达的ScFv作为一种基因治疗的手段已在肿瘤和病毒性疾病的治疗研究中显示出广阔的应用前景[17-19]. ScFv在病毒性肝炎方面的研究目前还处于萌芽阶段, 其确切的临床应用价值尚未得到充分证明与肯定, 针对HBV相关抗原的ScFv究竟能否用于乙型肝炎的诊断、治疗或预防仍需要进一步研究和证实[13,20-22]. 用于基因真核表达的载体有逆转录病毒载体、腺病毒载体、腺伴随病毒载体、单纯疱疹病毒载体等, 其中, 以逆转录病毒载体及腺病毒载体最常用[23-28]. 腺病毒载体作为外源性DNA转入真核细胞的工具, 具有很多优点[29]. 腺病毒载体包装容量大, 可以插入7.5 kb的外源性基因片段; 对宿主细胞毒性小, 不与宿主细胞的染色体整合, 不存在激活致癌基因或插入突变等危险; 宿主范围广, 不仅可感染增生期细胞, 也可感染静止期细胞; 融合了巨细胞病毒启动子CMV, 提高了目的基因在细胞中的表达效率, 病毒经繁殖、纯化, 可达到很高滴度, 并达100%的感染率; 腺病毒载体感染宿主细胞表达的目的抗原, 较质粒载体更近似病原体感染, 易获得更强的免疫应答[30-31]. 因此, 腺病毒成为继逆转录病毒之后被广泛应用于基因免疫和基因治疗研究的病毒载体[23-27]. 我们选用复制缺陷型腺病毒AdEasy系统中的穿梭质粒pAdTrack与骨架质粒pAdEasy-1, 通过基因重组技术构建pAd-ScFv. 该系统的特点是, 穿梭质粒pAdTrack带有CMV启动子, 并含有表达绿色荧光蛋白的EGFP基团, 骨架质粒pAdEasy-1缺失了腺病毒的E1区和E3区. E1区基因是腺病毒复制所必需的基因, 腺病毒完整复制必须在E1区基因转染的细胞中进行.293细胞是转化了E1区基因的包装细胞, 可以提供腺病毒缺失的基因编码产物, 这决定了复制缺陷型腺病毒在靶细胞中只有一次感染机会而无复制能力, 在完成腺病毒载体的功能时, 避免腺病毒本身对靶细胞的损害, 达到基因转移的目的. 在构建pAd-ScFv时, 将ScFv正向连接于pAdTrack的CMV启动子之下是实验的关键, 我们在构建pAdTrack-ScFv后用HindIII和XbaI酶切得到了810 bp的ScFv基因片段和9 200 bp片段, 证实了ScFv插入到pAdTrack的启动子之下. 由于pAdTrack具有卡那霉素抗性, 而pAdEasy-1是氨苄青霉素抗性. 因此只有通过两个质粒上的同源序列在BJ5183菌内产生的重组体或穿梭质粒本身才具有卡那霉素抗性, LBK平板上生长的克隆不是携带穿梭质粒即是重组腺病毒质粒. 此外, E. coli BJ5183为RecA+菌株, 利于线性的穿梭质粒和环化的腺病毒骨架分子之间进行同源重组, 但在E. coli BJ5183中质粒拷贝数较低[38], 难以获得高拷贝质粒进行细胞转染, 国外学者采用电穿孔法将重组腺病毒的质粒转化至E. coli DHl0B中以获得高拷贝质粒. 我们以化学转化法取代电穿孔法, 也获得了理想的结果. 重组腺病毒在293细胞中的产生和大量扩增时, 要在空斑或细胞病变出现之前早期了解和证实腺病毒的产生, 是腺病毒载体必须解决的问题. 我们选用的腺病毒系统则可以利用在同源重组时整合腺病毒穿梭载体中的EGFP直接观察转染与感染的效率, 可在转染后24 h通过EGFP的表达直接了解腺病毒的产生, 省去了烦琐的空斑纯化过程. 本研究中, 我们利用这种新的腺病毒载体系统, 在293细胞中成功包装出重组腺病毒Ad-ScFv, 滴度达4×1015 pfu/L. 为了解携带抗-HBc ScFv基因的重组腺病毒感染哺乳动物细胞后能否表达抗-HBc ScFv, 本研究将包装的病毒感染HepG2细胞后, 通过荧光倒置显微镜观察到绿色荧光蛋白的表达. 以病毒裂解液为膜板进行的PCR反应也证实病毒基因组中含有ScFv的基因片段. 此外, 以HBcAg包被酶标板, ELISA法检测细胞培养上清和细胞裂解物中的ScFv, 结果显示出阳性反应, 表明表达的ScFv具有HBcAg特异性结合活性. 上述结果表明, HepG2细胞感染重组腺病毒后抗-HBc ScFv在细胞内获得表达. 我们成功制备表达抗-HBc ScFv基因的重组腺病毒载体, 并能够在真核细胞中获得高效稳定的表达, 这一初步结果为进一步研究抗-HBc ScFv在慢性乙型肝炎抗病毒基因治疗中的作用提供了一定的实验基础.
编辑: 张海宁 电编: 潘伯荣
| 1. | Xiang ZQ, Yang Y, Wilson JM, Ertl HC. A replication-defective human adenovirus recombinant serves as a highly efficacious vaccine carrier. Virology. 1996;219:220-227. [PubMed] |
| 2. | Magovern CJ, Mack CA, Zhang J, Rosengart TK, Isom OW, Crystal RG. Regional Angiogenesis induced in nonischemic tissure by an adenoviral vector expressing vascular endothelial growth factor. Hum Gene Ther. 1997;8:215-227. [PubMed] |
| 3. | 郝 春秋, 周 永兴, 冯 志华, 李 谨革, 贾 战生, 王 平忠. HCV C基因腺病毒表达载体骨架质粒pAd. HCV-C的构建、鉴定及表达. 世界华人消化杂志. 2001;9:635-639. [DOI] |
| 4. | 黄 呈辉, 欧阳 玲, 马 会慧, 汤 正好, 李 刚, 姚 集鲁. 细菌内同源重组法构建HBV S区和C区基因非复制型腺病毒载体及其体外表达. 世界华人消化杂志. 2003;11:438-441. [DOI] |
| 5. | He TC, Zhou S, da Costa LT, Yu J, Kinzler KW, Vogelstein B. A simplified system for generating recombinant adenoviruses. Proc Natl Acad Sci USA. 1998;95:25092514. [PubMed] |
| 8. | Bilbao G, Contreras JL, Curiel DT. Genetically engineered intracellular single- chain antibodies in gene therapy. Mol Biotechnol. 2002;22:191-211. [PubMed] |
| 9. | Cohen PA. Intrabodies. Targeting scFv expression to eukaryotic intracellular compartments. Methods Mol Biol. 2002;178:367-378. [PubMed] |
| 10. | Zhou C, Emadi S, Sierks MR, Messer A. A human single-chain Fv intrabody blocks aberrant cellular effects of overexpressed alpha-synuclein. Mol Ther. 2004;10:1023-1031. [PubMed] |
| 11. | Cohen PA, Mani JC, Lane DP. Characterization of a new intrabody directed against the N-terminal region of human p53. Oncogene. 1998;17:2445-2456. [PubMed] |
| 12. | Persic L, Righi M, Roberts A, Hoogenboom HR, Cattaneo A, Bradbury A. Targeting vectors for intracellular immunisation. Gene. 1997;187:1-8. [PubMed] |
| 13. | 汤 正好, 姚 集鲁. 基因工程单链抗体在传染病中的应用研究进展. 国外医学·流行病学与传染病学分册. 2002;29:137-139. |
| 14. | Bonnin E, Gruel N, Moutel S, Mantegazza AR, Barrio MM, Mordoh J, Teillaud JL. Generation of functional scFv intrabodies for triggering anti-tumor immunity. Methods. 2004;34:225-232. [PubMed] |
| 15. | Auf der Maur A, Tissot K, Barberis A. Antigen-independent selection of intracellular stable antibody frameworks. Methods. 2004;34:215-224. [PubMed] |
| 16. | Cardinale A, Filesi I, Mattei S, Biocca S. Intracellular targeting and functional analysis of single-chain Fv fragments in mammalian cells. Methods. 2004;34:171-178. [PubMed] |
| 17. | Marasco WA, LaVecchio J, Winkler A. Human anti-HIV-1 tat sFv intrabodies for gene therapy of advanced HIV-1-infection and AIDS. J Immunol Methods. 1999;231:223-238. [PubMed] |
| 18. | Steinberger P, Andris-Widhopf J, Buhler B, Torbett BE, Barbas CF 3rd. Functional deletion of the CCR5 receptor by intracellular immunization produces cells that are refractory to CCR5-dependent HIV-1 infection and cell fusion. Proc Natl Acad Sci USA. 2000;97:805-810. [PubMed] |
| 19. | Alvarez RD, Barnes MN, Gomez-Navarro J, Wang M, Strong TV, Arafat W, Arani RB, Johnson MR, Roberts BL, Siegal GP. A cancer gene therapy approach utilizing an anti-erbB-2 single-chain antibody-encoding adenovirus(AD21): a phase I trial. Clin Cancer Res. 2000;6:3081-3087. [PubMed] |
| 20. | Ramirez N, Ayala M, Lorenzo D, Palenzuela D, Herrera L, Doreste V, Perez M, Gavilond JV, Oramas P. Expression of a single-chain Fv antibody fragment specific for the hepatitis B surface antigen in transgenic tobacco plants. Transgenic Res. 2002;11:61-64. [PubMed] |
| 21. | Bose B, Chugh DA, Kala M, Acharya SK, Khanna N, Sinha S. Characterization and molecular modeling of a highly stable anti-Hepatitis B surface antigen scFv. Mol Immunol. 2003;40:617-631. [PubMed] |
| 22. | Lee MS, Kwon MH, Kim KH, Shin HJ, Park S, Kim HI. Selection of scFvs specific for HBV DNA polymerase using ribosome display. J Immunol Methods. 2004;284:147-157. [PubMed] |
| 23. | Wikstrom K, Blomberg P, Islam KB. Clinical grade vector production: analysis of yield, stability, and storage of gmp-produced retroviral vectors for gene therapy. Biotechnol Prog. 2004;20:1198-1203. [PubMed] |
| 24. | Woodley DT, Keene DR, Atha T, Huang Y, Ram R, Kasahara N, Chen M. Intradermal injection of lentiviral vectors corrects regenerated human dystrophic epidermolysis bullosa skin tissue in vivo. Mol Ther. 2004;10:318-326. [PubMed] |
| 25. | Goncalves MA, van der Velde I, Knaan-Shanzer S, Valerio D, de Vries AA. Stable transduction of large DNA by high-capacity adeno-associated virus/adenovirus hybrid vectors. Virology. 2004;321:287-296. [PubMed] |
| 26. | Chuah MK, Collen D, VandenDriessche T. Biosafety of adenoviral vectors. Curr Gene Ther. 2003;3:527-543. [PubMed] |
| 27. | Glover CP, Bienemann AS, Hopton M, Harding TC, Kew JN, Uney JB. Long-term transgene expression can be mediated in the brain by adenoviral vectors when powerful neuron-specific promoters are used. J Gene Med. 2003;5:554-559. [PubMed] |
| 28. | Mizuguchi H, Hayakawa T. Targeted adenovirus vectors. Hum Gene Ther. 2004;15:1034-1044. [PubMed] |
| 29. | Mitani K, Kubo S. Adenovirus as an integrating vector. Curr Gene Ther. 2002;2:135-144. [PubMed] |
| 30. | Mitani K, Graham FL, Caskey CT, Kochanek S. Rescue, propagation, and partial purification of a helper virus-dependent adenovirus vector. Proc Natl Acad Sci USA. 1995;92:3854-3858. [PubMed] |
| 31. | Fisher KJ, Choi H, Burda J, Chen SJ, Wilson JM. Recombinant adenovirus deleted of all viral genes for gene therapy of cystic fibrosis. Virology. 1996;217:11-22. [PubMed] |
| 32. | Wang L, Qi X, Sun Y, Liang L, Ju D. Adenovirus-mediated combined P16 gene and GM-CSF gene therapy for the treatment of established tumor and induction of antitumor immunity. Cancer Gene Ther. 2002;9:819-824. [PubMed] |
| 33. | 林 涛, 丁 杰, 孟 繁平, 韩 全利, 喻 召才, 郭 长存, 刘 志国, 樊 代明. 利用细菌内重组腺病毒系统构建胃癌MG7-Ag模拟表位疫苗. 世界华人消化杂志. 2003;11:14-17. [DOI] |
| 34. | 李 喆, 潘 欣, 潘 卫, 曹 贵松, 闻 兆章, 方 国恩, 戚 中田, 毕 建威, 华 积德. 内皮抑素-可溶性血管内皮细胞生长抑制因子融合基因重组腺病毒的包装与鉴定. 世界华人消化杂志. 2003;11:741-744. [DOI] |
| 37. | Bain JR, Schisler JC, Takeuchi K, Newgard CB, Becker TC. An adenovirus vector for efficient RNA interference-mediated suppression of target genes in insulinoma cells and pancreatic islets of langerhans. Diabetes. 2004;53:2190-2194. [PubMed] |
| 38. | Kusano K, Nakayama K, Nakayama H. Plasmid-mediated lethality and plasmid multimer formation in an Escherichia coli recBC sbcBC mutant. Involvement of RecF recombination pathway genes. J Mol Biol. 1989;209:623-634. [PubMed] |